2. 浙江科技学院浙江省废弃生物质循环利用与生态处理技术重点实验室, 杭州 310023
2. Key Laboratory of Recycling and Eco-treatment of Waste Biomass of Zhejiang Province, Zhejiang University of Science and Technology, Hangzhou 310023
温室效应对全球气候的影响日益显现, 由此导致了全球性气候变暖, 已经成为公众最为关注的焦点之一.温室气体CO2的大量排放是造成温室效应的主要原因, 约有60%的温室效应是由CO2产生的, 随着我国经济的高速发展, 能源利用的快速增长, 二氧化碳的排放量也迅速增长.因此如何有效地捕集排放的CO2, 同时高效地利用CO2资源已经成为环境及经济领域的当务之急.
因为吸收速率快、吸收容量高等优点, 化学吸收法是目前捕集CO2的主要方法, 占据主导地位, 典型的化学吸收法有:热钾碱法、有机醇胺法、氨基酸盐法和氨水洗涤法等.其中, 热钾碱法具有净化度较高、高CO2回收率等优点, 是当前国内外使用最多的净化CO2技术, 参见闫平科等(2011)、姜宁等(2011)、王祥云(2016)、SHAW等(2001)、MacDowell等(2010)、潘良等(2015)、Scholz等(2013).
当前, 对热钾碱吸收CO2过程的基础研究主要集中在如下几个方面:化学反应性质研究、热力学性质研究、动力学性质研究.
实验室规模化学性质研究, 多集中于新型吸收剂性能的考察, 如Brennecke等(2001), 国内杨洁等(2013)、周灵杰等(2014)等;CO2吸收过程热力学研究热点领域主要是基于基团贡献法的原理进行吸收剂的筛选, 参见石会龙等(2016)、Hagewiesche等(1995)、吴家全等(2007)、魏静等(2008)、盛卫心等(2007).
对于CO2吸收过程动力学研究, 张成芳等(1985)从工程应用出发, 采用了接近工业生产的温度和碱液浓度的试验条件, 在搅拌反应器和圆盘塔中测定了热碱和二乙醇胺催化热碱溶液吸收CO2的速率.张仁伟等(1988)采用搅拌反应器测定了纯热钾碱液(K2CO3 30%)吸收纯CO2的速率.对吸收速率系数随温度和转化度的变化进行了讨论, 并用数学表达式进行关联.Sun等(2005)以哌嗪为活化剂, 研究了CO2吸收反应动力学, 并获得了指前因子和反应活化能.Guo等(2011)、李伟斌等(2011)则分别以H3BO3、DEA为促进剂研究了CO2吸收过程动力学, 获得了相应的动力学模型参数.申淑锋等(2013)在湿壁柱装置中, 研究了碳酸钾溶液体系在不同浓度和不同温度下吸收CO2的速率, 同时讨论了不同活化碳酸钾溶液对吸收CO2的归一化传质通量的影响.但由于测试所用反应装置、操作条件的不同, 及研究者对吸收过程理解的差异, 实验回归所得的动力学方程形式及模型参数也存在不同.
在此背景下, 由于热钾碱吸收CO2反应主要是在液相中发生, 本文首先对液相中的反应作出机理设定, 据此推导出本征动力学方程;再根据双膜理论建立宏观动力学模型, 同时考虑到溶液的非理想性质, 对宏观动力学方程中的浓度效应进行修正;应用双驱动搅拌器装置, 针对不同温度、不同浓度、不同反应时间等操作状态进行反应动力学实验, 测定相应的实验数据, 最后获得宏观动力学模型参数;结合由实验测定的液膜传质系数, 进而获得吸收反应的本征动力学方程;根据膜内转化系数, 提出了吸收过程机理, 为工业规模反应器的设计提供了坚实的基础.
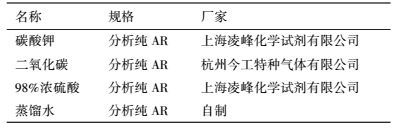
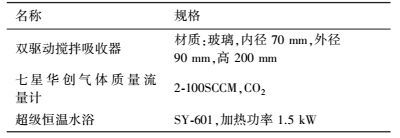
2 实验原理及方法(Experimental principle and methods) 2.1 实验药品与仪器实验采用的药品试剂和所需的仪器设备分别如表 1和表 2所示.
| 表 1 实验药品 Table 1 Experimental drugs |
| 表 2 实验仪器 Table 2 Experimental instrument |
实验测定动力学工艺流程如图 1所示.双驱动搅拌吸收器是一个气液接触界面已知的设备, 气相搅拌桨、液相搅拌桨的转速分别通过数显调速器调节.吸收器中液面的位置应控制在液相搅拌桨上桨的下缘1 mm左右, 以保证桨叶转动时正好刮在液面上, 以达到更新表面的目的.吸收液从吸收剂瓶一次准确加入.
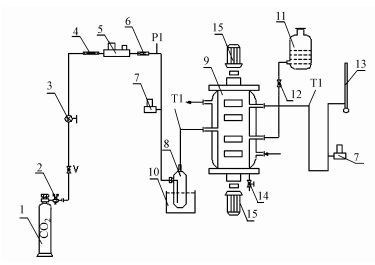 |
| 图 1 二氧化碳气体吸收测定工艺流程图(1.气体钢瓶; 2.减压阀; 3.调节阀; 4.过滤器; 5.质量流量计; 6.止逆阀; 7.压力变送器; 8.玻璃增湿器; 9.双驱动搅拌吸收器; 10.恒温水浴; 11.吸收剂瓶; 12.截止阀; 13.皂膜流量计; 14.吸收液取样瓶; 15.交流电机) Fig. 1 Diagram of process flow for CO2 absorption(1. gas cylinder; 2. reducing valve; 3. control valve; 4. filtrator; 5. mass flowmeter; 6. check valve; 7. pressure transmitter; 8. humidifier; 9. double drive reactor; 10. constant temperature bath; 11. absorption bottle; 12. shut. off valve; 13. soap. film flowmeter; 14. sampling valve; 15. AC motor) |
① 碳酸钾吸收二氧化碳反应机理碳酸钾吸收CO2总反应式为:
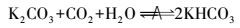
|
(1) |
反应机理:
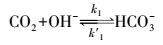
|
(2) |
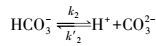
|
(3) |
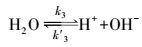
|
(4) |
反应速率:
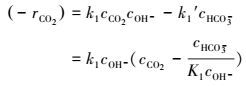
|
(5) |
令:
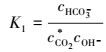
|
(6) |
则:
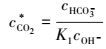
|
(7) |
故:
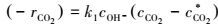
|
(8) |
当pH>10时, 即cOH-较多, CO2浓度低, 则cOH-在液膜内可认为是常数, 则上式:
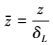
|
(9) |
式中, k=k1cOH-, cOH-的确定, 可根据反应机理(4) 达到平衡可得.
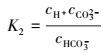
|
(10) |
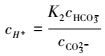
|
(11) |
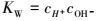
|
(12) |
故:
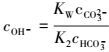
|
(13) |
② 宏观反应速率方程的建立
因为:
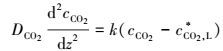
|
(14) |
无因次化得:
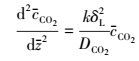
|
(15) |
若反应为快反应, 则边界条件如下:
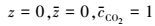
|
(16) |
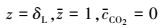
|
(17) |
令
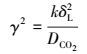
|
(18) |
即膜内转化系数, 则方程化为:
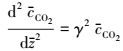
|
(19) |
求解该方程得CO2在膜内的浓度分布为:
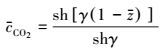
|
(20) |
宏观反应速率:
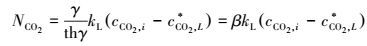
|
(21) |
式中, β=γ/thγ(22), 若γ>3, thγ≈1, 则β≈γ (23), 则宏观反应速率如下:
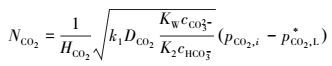
|
(24) |
转化度f的定义为:溶液中转化掉的CO32-与溶液中总的CO32-之比.
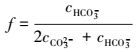
|
(25) |
即:
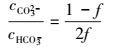
|
(26) |
最后:
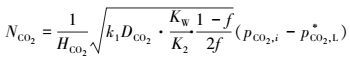
|
(27) |
③ 宏观动力学方程的修正
由于溶液为非理想溶液, 故需对宏观动力学方程进行修正, 设:
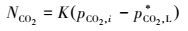
|
(28) |

|
(29) |
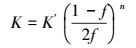
|
(30) |
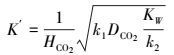
|
(31) |
式中, K′仅是温度的函数, DCO2指的是CO2在水中的扩散系数, 与碳酸钾浓度无关.对宏观动力学方程的修正, 其实质是将所有与碳酸钾浓度有关的非理想因素都纳入到指数n当中.
令:
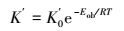
|
(32) |
则:
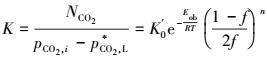
|
(33) |
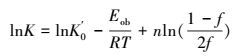
|
(34) |
式中, K0′为宏观动力学指前因子, Eob为表观活化能, n为反应级数.
2.3.2 液相传质分系数kL的测定由因次分析法可得液相传质分系数与搅拌转速之间的关系.
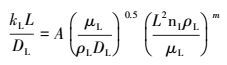
|
(35) |
式中, A为系数, 无因次, L为搅拌桨叶的长度(m), DL为CO2在水溶液中的扩散系数(m2·s-1), nL为搅拌器转速(r·min-1), ρL为溶液密度(kg·m-3), μL为CO2水溶液黏度(Pa·s), 表示物性的Sc准数在整个吸收过程中可认为变化不大, 故其幂指数取定值0.5.
在实验获得不同nL时的kL值后, 为求解A、m值, 将上式进行如下处理:
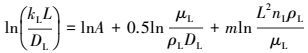
|
(36) |
根据实验数据, 应用线性回归法可求得A、m值.
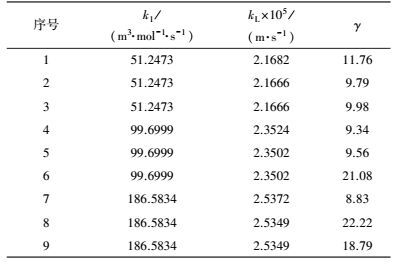
3 结果与讨论(Results and discussions) 3.1 气相搅拌速度nG的确定研究为研究气相搅拌速度与反应吸收速率之间的关系, 以确定最佳的气相搅拌速率, 本文应用CO2-H2O体系进行实验, 体系温度为17 ℃, 压力为0.1 MPa, 气相流量为80 mL·min-1、液相搅拌桨转速为100 r·min-1条件下进行的, 吸收一定的气相体积, 记录下相应的时间, 根据NCO2=nco2/St即可计算吸收速率.实验数据如表 3所示.
| 表 3 气相搅拌速率nG与吸收速率NCO2之间的关系 Table 3 Relationship between gas stirring speed nG and absorption rate NCO2 |
由表中数据可知, 在20~80 r·min-1之间吸收速率变化较快, 大于80 r·min-1之后, 吸收速率变化趋向稳定, 根据双膜论可知, 此时气膜传质阻力已经消除.由此可得, 在后续的动力学实验测试过程中, 气相转速可确定为大于80 r·min-1.
3.2 液相搅拌速率nL与液相传质系数kL的关系研究为研究液相传质系数kL所遵循的规律, 本文采取CO2-H2O体系进行实验, 体系温度为17 ℃, 压力为0.1 MPa, 气相流量80 mL·min-1、气相搅拌速度为100 r·min-1条件下, 测定了液相搅拌速度与反应吸收速率之间的关系, 根据实验数据应用线性回归法求出模型参数, 实验数据如表 4所示.
| 表 4 液相搅拌速率nL与吸收速率NCO2之间的关系 Table 4 Relationship between liquid mixing speed nL and absorption rate NCO2 |
由表中数据可知, 吸收速率NA随液相搅拌转速nL的增大, 呈上升趋势.为获得液相传质系数kL的关联式, 关键是要求出kL与液相搅拌转速nL之间的关系, 根据:
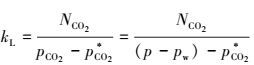
|
(37) |
式中, NCO2为吸收速率, pCO2*为二氧化碳的平衡分压, pw为水的饱和蒸气压.由此可获得kL随液相搅拌转速nL之间的关系:
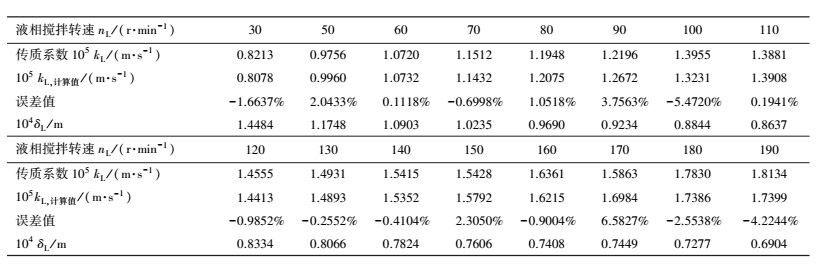
| 表 5 液相搅拌转速nL与传质系数kL、液膜厚度δL之间的关系 Table 5 Relationship between liquid mixing speed nL and the mass transfer coefficient kL, the liquid film thickness δL |
根据液相传质系数kL与液相转速nL之间的关系数据, 应用线性回归法, 获得关联式如下:
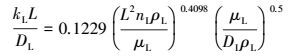
|
(38) |
比较kL的计算值与实验值, 可得误差值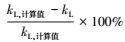
根据δL=DL/kL可以计算液膜厚度, 其值见表 5.
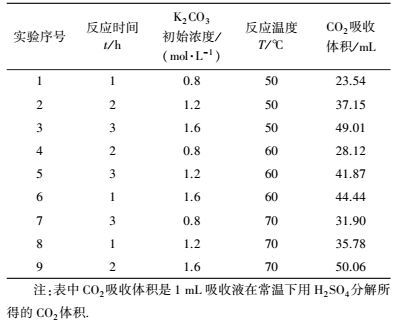
3.3 宏观动力学的实验研究 3.3.1 正交实验设计及原始实验数据为获得宏观动力学模型中各参数值, 本实验采取正交实验设计, 实验因素取3个, 分别为反应温度、碳酸钾的初始浓度及反应时间, 各因素水平为3个, 反应温度为50、60、70 ℃;碳酸钾初始浓度分别取0.8、1.2、1.6 mol·L-1;反应时间分别取1、2、3 h;气相为纯CO2气体组成.正交表表头设计为L9(34)形式.
实验原始数据如下:
| 表 6 原始实验数据一览表 Table 6 Data list for the original experiment |
根据:
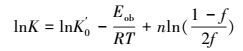
|
(39) |
转化度f的获得:溶液转化度f可按下式计算:
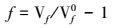
|
(40) |
式中,f为吸收液的转化度.Vf、Vf0分别为吸收后和吸收前1 mL吸收液酸解后放出的CO2校正后体积数(mL).
吸收速率NCO2的获取:由于反应是半连续的, 气相连续, 液相间歇, 同时由于液相体积很大, cCO2浓度变化不是很大, 故可近似认为NCO2在气体吸收反应过程中为常数.反应吸收速率:
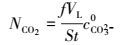
|
(41) |
式中, VL为液相体积(m3), S为反应器截面积(m2), t为反应时间(s), cCO32-0为热钾碱初始浓度(mol·L-1).由上式可知, 为获得NCO2值, 必须知道是S, t, VL, f, cCO32-0各物理量值.
吸收系数K值的获得:由于K=
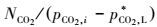
|
(42) |
由上式可知, 为获得pCO2, i, 必须要消除气膜阻力, 这时:
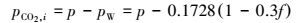
|
(43) |
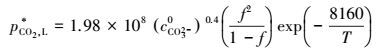
|
(44) |
宏观动力学方程:实验数据如表 7所示.
| 表 7 各物理量数据一览表 Table 7 Data list for each physical quantity |
根据实验数据, 应用线性回归法可以求出模型参数K0′、Eob和n, 其值如下:
K′0=1.1908×10-4 mol·m-2·s-1·Pa, Eob=21.9308 kJ·mol-1, n=0.1399.
故吸收系数:
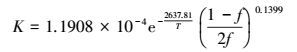
|
(45) |
误差定义为:(K实-K计)/K计, 其值见表 7, 由表中数据可知, 最大误差为9.17%, 说明方程能较好的拟合实验数据, 最后吸收反应宏观动力学方程为:
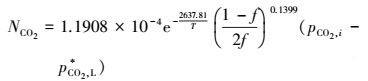
|
(46) |
模型适应性验证:为验证该模型的适应性, 本文在气相流量为80 mL·min-1, 气、液搅拌速度为100 r·min-1, 热钾碱浓度为1.2 mol·L-1, 温度为60 ℃, 改变反应时间分别为1.5、2.5 h进行验证实验, 计算数据如表 8所示.
| 表 8 宏观动力学方程适应性验证 Table 8 Adaptive authentication of the macro kinetic equation |
由表中数据可知, 模型误差较小, 说明该模型具有良好的适应性.
3.4 本征动力学方程的获得因为:
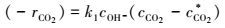
|
(47) |
而:
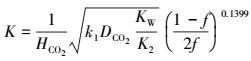
|
(48) |
故:
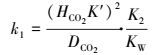
|
(49) |
由于KW、K2随温度变化不大, KW/K2几乎不随温度而改变, 故可认为是常数.
KW/K2=2.2638×10-1 mol·m-3
CO2在水中的扩散系数及亨利系数由下列公式计算得到:
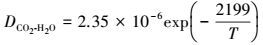
|
(50) |
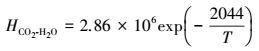
|
(51) |
最后得:
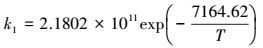
|
(52) |
本征动力学方程为:
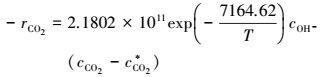
|
(53) |
活化能E=59.57 kJ·mol-1, 指前因子k0=2.1802×1011 m3·mol-1·s-1.
3.5 CO2吸收反应机理判断根据:
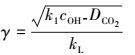
|
(54) |
可见γ的计算最关键的是DCO2的计算, 即CO2在碳酸钾溶液中的扩散系数, 如下所示:
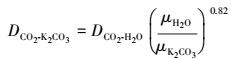
|
(55) |
式中:
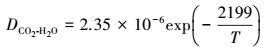
|
(56) |
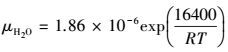
|
(57) |
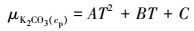
|
(58) |
式中:
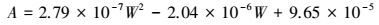
|
(59) |
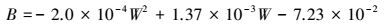
|
(60) |
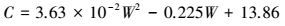
|
(61) |
式中, W为碳酸钾质量百分含量.
现对上述9组正交实验数据分别计算γ值, 如表 9所示.
| 表 9 本征反应速率常数和膜内转化系数γ值一览 Table 9 List of intrinsic reaction rate constant and the liquid film conversion coefficient γ |
由表中数据可见, 序号为7的膜内转化系数γ=8.83, 为所有实验点中最小值, 该序号对应的操作条件为反应温度为70 ℃, 碳酸钾初始浓度为0.8 mol·L-1, 反应时间为3 h.
由于γ值远远大于2, 可见CO2吸收为快速反应过程, 反应主要在膜内进行.该特点为后续的工业规模反应器选型提供了重要的依据, 即反应器应具备较大的相界面积, 所以通常采取填料塔.
4 结论(Conclusions)1) 通过改变气相搅拌转速与吸收速率之间的关系可知, 当气相搅拌转速大于80 r·min-1时, 气膜阻力即被消除;通过改变液相搅拌速率, 研究了搅拌速率与液相传质系数kL之间的关系, 获得了kL的关联式:
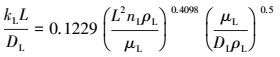
|
2) 建立了CO2吸收反应的宏观动力学方程, 本文通过对反应级数的校正, 考虑了溶液非理想性对动力学方程的影响, 通过正交实验求解出表观活化能Eob=21.9308 kJ·mol-1, 表观反应级数n=0.1399, 指前因子K′0=1.1908×10-4 mol·m-2·s-1·Pa-1, 获得了宏观动力学方程:
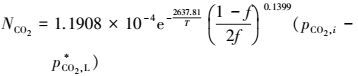
|
通过两组随机实验验证了该模型的适应性, 其最大误差为2.85%, 说明该模型具有良好的拟合实验数据的能力和准确的预测性.该宏观动力学模型的建立是本文突出的创新之处.
3) 在宏观动力学模型建立的基础上, 获得了吸收反应本征动力学方程:
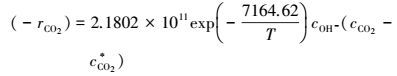
|
本征反应活化能E=59.57 kJ·mol-1, 指前因子k0=2.1802×1011 m3·mol-1·s-1.
4) 计算了膜内转化系数γ, 该值远大于2, 可知CO2吸收反应为快速反应, 反应主要集中在膜内完成;同时为工业反应器的选型提供了重要的依据, 工业反应器应采用比相界面积较大的填料塔.
| [${referVo.labelOrder}] | Blanchard L A, Gu Z, Brennecke J F. 2001. High-pressure phase behavior of ionic liquid/CO2 systems[J]. The Journal of Physical Chemistry B, 105(12): 2437–2444. DOI:10.1021/jp003309d |
| [${referVo.labelOrder}] | Guo D F, Thee H, Silva, et al. 2011. Borate-catalyzed carbon dioxide hydration via the carbonic anhydrase mechanism[J]. Environmental Science and Technology, 45(11): 4802–4807. DOI:10.1021/es200590m |
| [${referVo.labelOrder}] | Hagewiesche D P, Ashour S S, Al Ghawas H A. 1995. Absorption of carbon dioxide into aqueous blends of monoethanolamine and N-methyldiethanolamine[J]. Chemical Engineering Science, 50(7): 1071–1079. DOI:10.1016/0009-2509(94)00489-E |
| [${referVo.labelOrder}] | 姜宁, 李春福, 王远江, 等. 2011. 天然气脱二氧化碳工艺方法综述[J]. 化学工程与装备, 2011(7): 147–150. |
| [${referVo.labelOrder}] | 李伟斌, 董立户, 陈健. 2011. 仲胺和叔胺水溶液吸收CO2的动力学[J]. 过程工程学报, 2011, 11(3): 422–428. |
| [${referVo.labelOrder}] | MacDowell N, Florin N, Buchard A, et al. 2010. An overview of CO2 capture technologies[J]. Energy & Environmental Science, 3(11): 1645–1669. |
| [${referVo.labelOrder}] | 潘良, 徐晓秋, 高德玉, 等. 2015. 沼气脱碳提纯技术研究进展[J]. 黑龙江科学, 2015, 6(18): 18–20. DOI:10.3969/j.issn.1674-8646.2015.18.008 |
| [${referVo.labelOrder}] | Scholz M, Melin T, Wessling M. 2013. Transforming biogas into biomethane using membrane technology[J]. Renewable and Sustainable Energy Reviews, 17(1): 199–212. |
| [${referVo.labelOrder}] | Shaw T P, Hughes P W. 2001. Optimize CO2 removal[J]. Hydrocarbon Processing, 80(5): 53–56, 58. |
| [${referVo.labelOrder}] | 申淑锋, 冯晓霞, 赵瑞红. 2013. 活化碳酸钾溶液吸收CO2的动力学研究[J]. 高校化学工程学报, 2013, 27(5): 903–909. |
| [${referVo.labelOrder}] | 盛卫心, 戎宗明, 英徐根. 2007. 基团贡献法分子设计研究的进展[J]. 化学工业与工程, 2007, 24(5): 457–465. |
| [${referVo.labelOrder}] | 石会龙, 李春虎, 张祥坤. 2016. 基于基团贡献法的CO2复合吸收溶剂实验研究[J]. 化工进展, 2016, 35(3): 787–791. |
| [${referVo.labelOrder}] | Sun W C, Yong C B, Li M H. 2005. Kinetics of the absorption of carbon dioxide into mixed aqueous solutions of 2-amino-2-methyl-l-propanol and piperazine[J]. Chemical Engineering Science, 60(2): 503–516. DOI:10.1016/j.ces.2004.08.012 |
| [${referVo.labelOrder}] | 王祥云. 2016. 化工反应循环气脱碳技术的开发应用[J]. 能源化工, 2016, 37(2): 52–56. |
| [${referVo.labelOrder}] | 魏静, 解新安, 丁年平, 等. 2008. UNIFAC基团贡献法研究及应用进展[J]. 当代化工, 2008, 37(6): 659–665. |
| [${referVo.labelOrder}] | 吴家全, 李海华, 衣守志. 2007. 对应态基团贡献法的应用现状[J]. 天津科技大学学报, 2007, 22(1): 83–86. |
| [${referVo.labelOrder}] | 闫平科, 王来贵. 2011. 二氧化碳的捕集及资源化研究进展[J]. 中国非金属矿工业导刊, 2011, 93(6): 4–6. |
| [${referVo.labelOrder}] | 杨洁, 严晋跃, 于新海, 等. 2013. 基于醇胺+[bmin][BF4]+H2O溶液的CO2捕捉工艺[J]. 华东理工大学学报(自然科学版), 2013, 39(6): 641–647. |
| [${referVo.labelOrder}] | 张仁伟, 涂晋林, 施亚钧. 1988. 氨基乙酸活化热钾碱吸收二氧化碳动力学研究[J]. 化肥工业, 1988(1): 5–10. |
| [${referVo.labelOrder}] | 周灵杰. 2014. 高效二氧化碳复合吸收剂的应用研究[J]. 广州化工, 2014, 42(4): 80–82. |
| [${referVo.labelOrder}] | 庄永定, 张成芳. 1983. 加压下热钾碱溶液吸收二氧化碳的研究[J]. 华东理工大学学报, 1983(3): 50–59. |
 2017, Vol. 37
2017, Vol. 37