2. 中国环境科学研究院, 北京 100012
2. Chinese Research Academy of Environmental Sciences, Beijing 100012
氯代芳香族化合物广泛用作生产有机氯杀虫剂、除菌剂,主要用于化学工业,具有长期残留性、生物蓄积性、致癌性和致突变性.《关于持久性有机污染物的斯德哥尔摩公约》中首批控制的12种持久性有机污染物均为氯代有机化合物.由于历史上的大量生产和使用,以及在农药生产、各类燃烧和热处理过程中的无意产生,致使这类物质在环境中广泛存在.Bailey等(2009)根据已有的数据统计显示,全球每年五氯苯的排放量为121000 kg,其中,主要的排放源有固体废物焚烧、生物质燃烧、农业杀虫剂及原料的降解这3类,排放量分别为32000、45000和26000 kg·a-1.杨淑伟(2010)参考日本的排放因子,估算了我国2008年非故意产生的六氯苯(Hexachlorobenzene,HCB)和多氯联苯的排放清单,结果显示,我国废弃物焚烧、水泥生产、化工生产和金属冶炼等主要行业非故意产生的HCB和多氯联苯排放总量分别为529、7763 kg.全球生产、积累的含氯代有机污染物已成为生态环境的重大隐患,亟待处理.
目前,处理氯代有机污染物的方法包括封存法、高温处理法、化学脱除法和生物降解法等.其中,封存法仍存在环境泄露的情况,并不能从根本上解决污染问题;高温分解法去除效果较好,但会造成二次污染,需要进一步的无害化处理,且处理成本高;生物降解法处理速度较慢,处于研究阶段尚未有重大进展;化学脱除法是将氯代有机物脱氯生成其他无毒或低毒物质,可彻底处理废物,研究较多的处置技术包括吸附/解吸法(Huang et al., 2003)、氧化/还原脱氯法(Xu et al., 2000)、光降解法、热催化法、机械球磨法(Tanaka et al., 2003)、微波消解法(Chen et al., 2016)等.Tong等(2012)对各类处置和修复氯代有机污染物的技术进行比较,发现机械球磨、光降解、微波消解等技术具有很高的去除率,但处理成本较高,成为主流技术的难度很大.相比之下,低温热降解技术因反应条件温和(200~400 ℃),处理量较大,具有高效、经济等优点,在《关于持久性有机污染物的斯德哥尔摩公约》附件中列为降解飞灰中二英的最佳可行技术.
由于金属氧化物催化剂成本较低,且具有较高的脱氯活性,近几年已成为研究的热点之一.根据催化反应原理,主要分为氧化反应和还原反应.Su等(2014)对Fe3O4降解八氯萘进行了研究,在产物中检测到甲酸和乙酸;Krishnamoorthy等(2000)利用多种过渡金属氧化物(Cr2O3、V2O5、MoO3、Fe2O3和Co3O4)降解1, 2-二氯苯,发现产物中存在甲酸盐、醋酸盐、马来酸盐和酚盐,而且最终会转化为CO、CO2和H2O,表明在催化降解过程中发生了氧化开环反应.还原反应是利用催化剂实现对氯代有机物的加氢脱氯反应,研究表明,多种过渡金属都表现出较好的加氢脱氯活性,如Ni、Fe等(吴文海,2006; Ma et al., 2005).Huang等(2013)研究了一系列铁基尖晶石材料降解十氯联苯的途径,表明主要降解途径为脱氯加氢.Gullett等(1997)采用Ca化合物(CaO、Ca(OH)2)降解1, 2, 3, 4-四氯代二英,结果发现,可能是Ca化合物促进了脱氯中间产物发生了缩聚,但产物形态未确定.通过研究发现,金属氧化物在特定条件下都表现出较好的催化脱氯活性,但对于Fe2O3催化降解氯代有机物存在氧化开环和脱氯加氢2种不同的解释途径(Krishnamoorthy et al., 2000;赵彦辉等,2015);且Misaka等(2006)研究发现,在650 K温度下利用飞灰低温热降解OCDD,反应前后物料不守恒,反应后OCDD的降解率达到了99%,但气相中低氯代苯产物仅为初始OCDD的17%,表明飞灰降解二英过程中还存在其他降解途径.
基于各种氯代芳香族有机物结构上的相似性和降解反应过程中的相似性,本研究选取结构最简单的HCB作为模型污染物,以氧化铝(α-Al2O3、γ-Al2O3)、氧化钙(CaO)、过渡金属氧化物(MnO2、α-Fe2O3、γ-Fe2O3、Ni2O3、CuO)为催化剂,在相同的反应条件下对HCB进行低温热处理,探究能够促进脱氯的主要活性物质及活性物质添加比例对HCB降解率的影响,考察可能存在的降解途径,为实现氯代有机物的去除奠定理论基础.
2 材料与方法(Materials and methods) 2.1 实验材料实验中用到的目标污染物六氯苯固体标样购自美国安捷伦公司,GC/MS分析纯试剂(>99.5%);12组分氯苯混标(100 μg·mL-1,Methanol)购自美国AccuStandard, Inc公司;正己烷(色谱纯,>98.8%)购自美国JT-Baker公司;无水硫酸钠(优级纯,99.0%)购自北京化工厂;CaO(分析纯,>99.0%)购自天津市汉沽区海中化工厂,使用前于马弗炉中900 ℃高温煅烧2 h,以去除吸潮生成的Ca(OH)2和CaCO3,密封包装备用;γ-Fe2O3(分析纯,>99.2%)和α-Fe2O3(分析纯,>99.2%)购自美国Sigma-aldrich公司;MnO2(分析纯)、CuO(分析纯)、Ni2O3(光谱纯)、α-Al2O3(色谱纯)、γ-Al2O3(色谱纯)均为美国Alfa试剂公司生产;实验过程用水均采用超纯水.
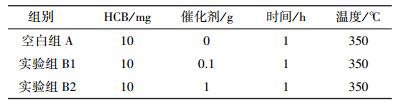
2.2 实验设计本实验分为空白组A、实验组B1(m催化剂:mHCB=10:1) 和B2(m催化剂:mHCB=100:1),分别进行8种催化剂的单组分催化降解实验,筛选高活性的催化剂并考察添加比例对反应的影响.根据文献调研可知,提高反应温度、延长反应时间可有效提高降解效果,HCB的沸点为309~310 ℃,且气-固异相反应比液-固异相反应效果好(肖叶,2013;尹可清,2014),因此,选择高于310 ℃的反应温度;另外,由于γ-Fe2O3在空气气氛中受热温度超过400 ℃时会转化为α-Fe2O3,影响实验分析,所以温度必须低于400 ℃.本研究的目的是筛选出高活性催化剂,故反应时间取1 h,温度取350 ℃,不做梯度实验.各组实验具体条件如表 1所示.
| 表 1 HCB低温热降解实验条件 Table 1 Reaction conditions of HCB dechlorination |
精确称取10 mg HCB和相应质量的催化剂装入5 mL的玻璃安瓿瓶中,熔封并翻转振荡均匀.盐浴锅以质量比为1:1的硝酸钾和硝酸钠为介质,预先加热到350 ℃,将安瓿瓶放入盐浴锅中反应1 h,取出后自然冷却至室温,用超纯水清洗安瓿瓶表面,各反应条件均设立3个平行样.对有机、无机降解产物进行不同的提取操作和分析.
2.3.1 氯离子的提取与分析将处理后的安瓿瓶沿切口掰开置于烧杯中,加20~30 mL超纯水,在磁力加热搅拌器上加热至80 ℃,恒温在80 ℃下搅拌20 min,再超声提取20 min,过滤出上清液,以上步骤重复3次,将提取所得上清液定容至100 mL待测.采用离子色谱仪测定氯离子浓度,IonPacAS4A-SC阴离子交换柱,19.13 mol·L-1 NaOH溶液淋洗液,淋洗液流速为1.2 mL·min-1.每次测样均设置平行实验及空白实验,以提高测定的精密度和准确度.
2.3.2 有机产物的提取与分析参考《危险废物鉴别标准浸出毒性鉴别》(GB 5085.3—2007) 中的“附录R固体废物含氯烃类化合物的测定”,以及相关文献(Ma et al., 2005),具体操作步骤如下:将相应处理后的安瓿瓶掰断置于离心管中,加入20 mL正己烷超声提取20 min,3000 r·min-1离心5 min,收集提取液,重复3次;将3次所得提取液合并转移至分液漏斗中,加入20 mL超纯水,振荡5 min静止分层,将下层水溶液去除,重复洗涤2次,去除无机氯离子;上层提取液经装有无水硫酸钠的漏斗脱水处理,装入100 mL容量瓶中并定容,再取0.1 mL定容至10 mL,装入GC/MS进样瓶中待测.采用Agilent 7890A GC-5975C MS气相色谱质谱联用仪测定氯苯类有机产物,气相色谱柱为HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气.对GC/MS谱图中出现的峰,采用NIST 05标准谱库进行定性.
2.4 数据分析HCB的脱氯率和降解率是了解低温热脱氯机制的关键因素,脱氯率可以通过游离氯离子实测值(脱氯率表示为D1)和产物中氯代苯中去除的有机氯(脱氯率表示为D2)进行表征,降解率DHCB通过剩余HCB表征.计算公式见式(1)~ (3).
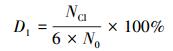
|
(1) |
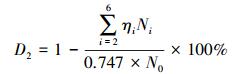
|
(2) |
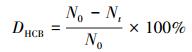
|
(3) |
式中,NCl表示实测的反应体系中水溶性的游离氯离子,No和Nt分别表示初始和剩余HCB的量,Ni表示i个氯离子取代的氯苯的量,ηi为i个氯离子取代的氯苯中氯元素的质量分数.
3 结果与讨论(Results and discussion) 3.1 金属氧化物脱氯活性分析对反应后的产物进行提取分析,实验结果显示,空白组A条件下,HCB没有发生降解反应.相同反应条件下加入不同质量比例、不同种类催化剂后的实验结果如图 1所示.由图可知,当m催化剂:mHCB= 10:1时(实验组B1),HCB的脱氯率较低,当m催化剂:mHCB= 100:1时(实验组B2),8种催化剂对HCB的脱氯率提高了1~11倍,以α-Al2O3为例,脱氯率D1由2.6%提高到了31.4%.游离氯离子来自于HCB中的有机氯元素,实验结果表明,随着催化剂添加比例的增加,脱氯效果显著提高,且随着反应条件的变化,D1与D2体现出相同的变化规律.
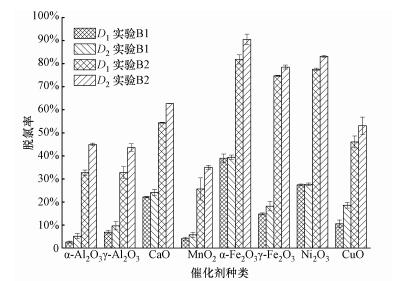 |
| 图 1 催化剂种类及添加比例对HCB脱氯率的影响 Fig. 1 Dechlorination efficiencies (D1 and D2) on different metallic oxides and mixed ratios |
在实验组B2条件下,对比催化剂种类对脱氯率的影响,碱土催化剂CaO比两性催化剂Al2O3的脱氯效果好.从晶体类型来分析,Al2O3是离子-共价晶体,是最强和最硬的晶体(Vainshtein et al., 1995),而CaO是离子晶体,性质较活泼,可以提供较多的活性位点.相比于氧化铝和氧化钙,过渡金属的价电子轨道拥有d层电子,性质较活泼,因此,5种过渡金属氧化物在降解过程中表现出较高脱氯活性,其中,α-Fe2O3的降解效果最好,脱氯率D1可达到81.9%.MnO2与HCB反应后,脱氯率D1为25.7%,降解活性相对较低,可能与反应气氛等有关系.Wang等(2011)对比了臭氧气氛与无臭氧气氛下MnOx对氯苯的催化效果,结果显示,无臭氧气氛下,200 ℃时氯苯转化率不到10%,加入1200 mg·L-1的臭氧后MnOx在90 ℃时的氯苯转化率可达到81.5%.本实验是密封空气气氛.
另外,从图 1中还可以看出,在α-Fe2O3和Ni2O3的催化作用下,当催化剂添加比例为10:1时,脱氯率D1和D2基本相等;当催化剂添加比例为100:1时,根据游离氯离子计算出的脱氯率D1低于D2.其余6种催化剂在两种反应条件下D1始终低于D2,表明反应过程中存在氯元素失恒现象,这种反应前后物料失衡现象在其他研究中也存在(Gao et al., 2016).
3.2 HCB降解产物分析催化剂添加比例为100:1,在350 ℃温度下HCB与催化剂反应1 h后,分析有机产物,各产物占初始HCB的百分比如图 2所示.随着催化剂添加量的提高,活性位点增加,在CaO、MnO2的催化作用下,有少量四氯苯生成,分别占初始六氯苯的1.0%和3.2%.在α-Fe2O3、Ni2O3的催化作用下五氯苯与六氯苯完全降解,二氯至四氯代苯均有检出,低氯代苯总量分别为初始六氯苯的13.9%和21.1%,HCB发生了明显的逐级脱氯加氢反应,且α-Fe2O3和Ni2O3比其他几种催化剂具有更强的催化脱氯加氢的反应能力.价键理论认为,过渡金属原子以杂化轨道相结合,杂化轨道通常为s、p、d等原子轨道的线性组合,称之为spd或dsp杂化,杂化轨道中d原子轨道所占的百分数称为d特性百分数,用符号d%表示,是价键理论用以关联金属催化活性和其他物性的一个特性参数,d%越大相应的d能带中的电子填充越多, 则d空穴越少,一般认为d轨道百分数为40%~50%的过渡金属及其前后的金属的加氢脱氯催化活性较好(吴越,2009).Mn、Fe、Ni、Cu属于过渡金属,d%分别为40.1%、39.7%、40.0%、36.0%,随着d%的增加,加氢活性会增加(辛勤,2009).本实验中α-Fe2O3与Ni2O3脱氯加氢效果较好,CuO的降解效果较低,符合这一规律.类似的脱氯加氢反应在其它氯代芳香烃降解中也有报道,汪嘉利等(2014)利用CaO降解受多氯联苯污染的土壤,研究发现,在350 ℃下反应4 h后,原有的五氯联苯和四氯联苯消失,有联苯和一氯联苯生成;赵彦辉等(2015)研究了α-Fe2O3微纳米材料降解八氯萘的情况,发现产物中七氯至二氯萘均存在,说明发生了逐级加氢脱氯反应.γ-Fe2O3的催化效果也比较好,但除了生成微量的五氯苯外,没有其他低氯代苯生成,说明脱氯加氢并不是γ-Fe2O3降解HCB的主要途径.Su等(2013)研究了碱土催化剂(MO:M=Mg、Ca、Sr、Ba)与不同晶型氧化铁(FexOy:Fe2O3和Fe3O4)在300 ℃下协同降解HCB的情况,结果表明,碱土催化剂和氧化铁协同降解HCB效果显著,在降解过程中存在脱氯加氢和氧化降解2种途径.因此,2种晶型的Fe2O3对HCB催化降解方式的差异可能与二者晶型有关,α-Fe2O3属刚玉型三角晶系结构,这种结构化学稳定性较高;γ-Fe2O3结构与Fe3O4非常相近,属于反尖晶石结构,处于亚稳定状态.同时,图中剩余HCB含量反映了降解率情况,随着催化剂添加比例的提高,HCB的降解率均提高,α-Fe2O3和Ni2O3对HCB的降解效率可达到100.0%.
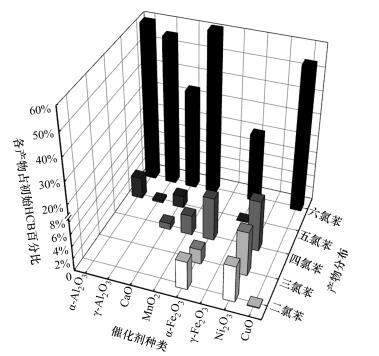 |
| 图 2 HCB在催化剂表面进行脱氯降解的产物分布 Fig. 2 Distribution of dechlorination products following degradation of HCB over metallic oxide |
根据金属氧化物催化降解HCB反应的脱氯率和降解率可知,8种氧化物中催化活性较高的为碱土金属氧化物CaO和过渡金属氧化物中的α-Fe2O3,对这2种氧化物与HCB的反应途径进行分析.金属氧化物低温催化降解HCB的反应是气固异相表面接触反应,HCB分子进入催化剂孔隙内部,需吸附于活性位点上发生化学反应.Chen等(2016)采用新型的纳米级的铁氧体(MgFe2O4)微波降解土壤中的六氯苯,利用电子自旋共振分析发现,微波加热会诱发氧化物表面生成活性电子,活性电子与氧分子或水分子反应会生成·O2-和·OH,而不是氧铁体结构中的晶格氧与羟基生成了·O2-和·OH.在本实验条件下,反应温度较高,氧化物表面的金属原子会被激发,导致表面的金属阳离子或O2-离子不饱和造成电荷缺陷(晶体缺陷的一种),也会产生空穴或活性电子,与吸附在氧化物表面的水、氧气分子作用产生·OH和·O2-,对HCB产生吸附作用.在高温条件下,活泼的·OH可进攻氯原子,氯是吸电基团,电荷由介质向HCB转移,C—Cl键键长增长键能下降,最终断裂完成脱氯反应,生成五氯苯自由基.研究表明,空气气氛中有低浓度的·H+,大约为106个·cm-3(Ingrosso,2002),以及少量水分子,可以提供H元素,并且通过自由基反应生成五氯苯,完成脱氯/加氢反应.依次类推,会逐步生成各种低氯代苯,直至完成脱氯反应(Ma et al., 2005).
不同物质具有不同的特征光谱,利用拉曼光谱出峰位置可以对物质进行定性分析,目前该技术广泛应用于纳米材料的研究.本研究对HCB样品及与催化剂反应后的产物进行拉曼光谱测试,谱图如图 3所示,其中,图 3a为HCB的拉曼谱图,图 3b为未加催化剂的HCB样品在350 ℃反应8 h后的谱图.分析图 3b可知,在未加催化剂的情况下,HCB的拉曼特征谱线未发生变化,峰位置略有偏移,与空白组A的实验结果相同,也没有发生碳化.
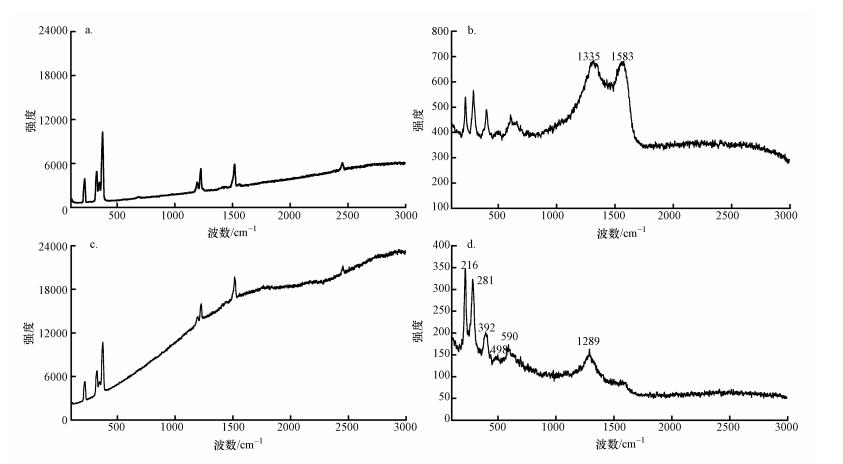 |
| 图 3 反应物和反应后样品的拉曼光谱(a.HCB, b.HCB 350 ℃反应8 h, C.HCB与CaO 350 ℃反应8 h, d.HCB与Fe2O3350 ℃反应8 h) Fig. 3 Raman spectra of reactant and reaction product |
HCB与CaO反应8 h后样品颜色会加深,对反应产物黑色区域进行检测,Raman谱线如图 3c所示,在1335 cm-1处和1583 cm-1处出现Raman峰,根据文献调研可知,这两处的峰属于典型的无序碳特征峰(程光旭,2001;Wakayama et al., 2008).由图 2可知,CaO与HCB的反应产物中剩余HCB为初始HCB的34.5%,有少量五氯苯和四氯苯生成,约占初始HCB的3%,其余低氯代苯未检出,所以反应完后产物为初始HCB的37.5%,其余62.5%的C元素未检测到.尹可清(2014)对HCB与CaO的反应产物进行红外光谱检测,发现随时间与反应温度的增加,苯环C=C双键的特征吸收峰基本保持不变,说明苯环结构没有破坏.综合推断,HCB与CaO的反应过程中低氯苯自由基会发生缩合反应,脱氯/缩合生成了具有无序碳结构的含氯高分子聚合产物.由于含氯高聚产物无法定量检测,所以导致氯元素前后失衡;同时,苯基母体的最终归趋应为分子量很大的缩聚产物,这也解释了HCB中的C元素归趋问题.
α-Fe2O3为红棕色,HCB与α-Fe2O3反应8 h后样品颜色无变化,对α-Fe2O3与HCB反应后的Raman谱图(图 3d)进行分析,图中在216、281、392、498、590和1289 cm-1处出现Raman峰,与标准峰形相同,位置略有差异,均为α-Fe2O3的特征峰(Srivastava et al., 2010;王莹,2012).说明α-Fe2O3在反应中没有发生结构变化,也没有产生无序碳特征峰.结合图 1和2可知,在B1实验条件下,不存在Cl元素失衡现象,单独对该反应条件下的有机产物进行分析,可知只有四氯苯和五氯苯生成;当催化剂添加比例提高为100:1时,在α-Fe2O3的催化作用下,2~4氯代低氯苯均有检出,由于一氯苯沸点低挥发性极强,没有检出,所以Cl元素失衡可能是由于反应产物中一氯苯的损失造成的.同时,2~4氯代低氯苯的检出及Raman光谱分析表明,α-Fe2O3催化HCB以脱氯加氢反应为主.
4 结论(Conclusions)1) 在反应温度350 ℃,反应时间1 h的条件下,对比10:1和100:1两种催化剂添加比例下的HCB脱氯率可知,随着催化剂添加比例的提高,活性位点增加,HCB的降解效果显著提高.
2) 对比相同反应条件下8种金属氧化物催化降解HCB的效果可知,碱土金属氧化物CaO和过渡金属氧化物中的α-Fe2O3和Ni2O3对HCB脱氯的促进作用较强;当催化剂添加比例为100:1时,α-Fe2O3的催化效果最好,降解率和脱氯率(D1)分别达到100.0%和81.9%;
3) 当添加比例为100:1时,在α-Fe2O3和Ni2O3的催化作用下有2~4氯代低氯苯检出,五氯苯与六氯苯完全降解,说明存在明显的逐级脱氯加氢反应;其余6种金属氧化物的脱氯产物中低氯苯含量较少或未检出,但脱氯率有明显提高,说明脱氯/加氢不是唯一的反应途径.
4) 利用Raman光谱对HCB与CaO反应产物进行分析,发现有无序碳的特征峰,说明在反应中生成了无序碳等高分子聚合物,且反应后样品颜色的加深说明C极有可能是HCB中碳元素的最终归趋,反应过程中存在脱氯/缩合途径,为解释物质归趋和氯元素失衡现象奠定了研究基础.
| [${referVo.labelOrder}] | Bailey R E, van Wijk D, Thomas P C. 2009. Sources and prevalence of pentachlorobenzene in the environment[J]. Chemosphere, 75(5): 555–564. DOI:10.1016/j.chemosphere.2009.01.038 |
| [${referVo.labelOrder}] | Chen J, Zhong D, Hou H, et al. 2016. Ferrite as an effective catalyst for HCB removal in soil: Characterization and catalytic performance[J]. Chemical Engineering Journal, 294: 246–253. DOI:10.1016/j.cej.2016.02.020 |
| [${referVo.labelOrder}] | 程光煦. 2001. 拉曼布里渊散射:原理及应用[M]. . |
| [${referVo.labelOrder}] | Gao X, Ji B, Huang Q. 2016. Thermal dechlorination of heavily PCB-contaminated soils from a sealed site of PCB-containing electrical equipment[J]. Environmental Science and Pollution Research, 23(15): 15544–15550. DOI:10.1007/s11356-016-6680-7 |
| [${referVo.labelOrder}] | Gao X, Wang W, Liu X. 2008. Low-temperature dechlorination of hexachlorobenzene on solid supports and the pathway hypothesis[J]. Chemosphere, 71(6): 1093–1099. DOI:10.1016/j.chemosphere.2007.10.041 |
| [${referVo.labelOrder}] | Gullett B K, Natschke D F, Bruce K R. 1997. Thermal Treatment of 1, 2, 3, 4-Tetrachlorodibenzo-p-dioxin by reaction with Ca-based sorbents at 23-300 ℃[J]. Environmental Science & Technology, 31(7): 1855–1862. |
| [${referVo.labelOrder}] | Huang L, Su G, Zhang A, et al. 2013. Degradation of polychlorinated biphenyls using mesoporous iron-based spinels[J]. Journal of Hazardous Materials, 261: 451–462. DOI:10.1016/j.jhazmat.2013.07.064 |
| [${referVo.labelOrder}] | Huang W, Peng P, Yu Z, et al. 2003. Effects of organic matter heterogeneity on sorption and desorption of organic contaminants by soils and sediments[J]. Applied Geochemistry, 18(7): 955–972. DOI:10.1016/S0883-2927(02)00205-6 |
| [${referVo.labelOrder}] | Ingrosso G. 2002. Free radical chemistry and its concern with indoor air quality:an open problem[J]. Microchemical Journal, 73(1): 221–236. |
| [${referVo.labelOrder}] | Krishnamoorthy S, Rivas J A, Amiridis M D. 2000. Catalytic oxidation of 1, 2-dichlorobenzene over supported transition metal oxides[J]. Journal of Catalysis, 193(2): 264–272. DOI:10.1006/jcat.2000.2895 |
| [${referVo.labelOrder}] | Ma X, Zheng M, Liu W, et al. 2005. Synergic effect of calcium oxide and iron(III) oxide on the dechlorination of hexachlorobenzene[J]. Chemosphere, 60(6): 796–801. DOI:10.1016/j.chemosphere.2005.04.021 |
| [${referVo.labelOrder}] | Misaka Y, Abe T, Takeuchi K, et al. 2006. Dechlorination/hydrogenation and destruction reactions of PCDDs in OCDD-added fly ash heated under vacuum[J]. Chemosphere, 65(3): 419–426. DOI:10.1016/j.chemosphere.2006.01.079 |
| [${referVo.labelOrder}] | Su G, Liu Y, Huang L, et al. 2013. Synergetic effect of alkaline earth metal oxides and iron oxides on the degradation of hexachlorobenzene and its degradation pathway[J]. Chemosphere, 90(1): 103–111. DOI:10.1016/j.chemosphere.2012.08.009 |
| [${referVo.labelOrder}] | Su G, Lu H, Zhang L, et al. 2014. Thermal degradation of octachloronaphthalene over as-prepared Fe3O4 micro/nanomaterial and its hypothesized mechanism[J]. Environmental Science & Technology, 48(12): 6899–6908. |
| [${referVo.labelOrder}] | Srivastava M, Ojha A K, Chaubey S, et al. 2010. Investigation on magnetic properties of α-Fe2O3 nanoparticles synthesized under surfactant-free condition by hydrothermal process[J]. Journal of Alloys and Compounds, 500(2): 206–210. DOI:10.1016/j.jallcom.2010.03.245 |
| [${referVo.labelOrder}] | Tanaka Y, Zhang Q, Saito F. 2003. Mechanochemical dechlorination of trichlorobenzene on oxide surfaces[J]. The Journal of Physical Chemistry B, 107(40): 11091–11097. DOI:10.1021/jp0276808 |
| [${referVo.labelOrder}] | Tong M, Yuan S. 2012. Physiochemical technologies for HCB remediation and disposal:A review[J]. Journal of Hazardous Materials, 229-230: 1–14. DOI:10.1016/j.jhazmat.2012.05.092 |
| [${referVo.labelOrder}] | Vainshtein B K, Friedkin V M, Indenbom V L. 2013. Structure of Crystals[M]. Berlin Heidelberg: Springer Science & Business Media. |
| [${referVo.labelOrder}] | 王莹. 2012. 三氧化二铁及其复合物的合成与应用研究[D]. 扬州: 扬州大学 |
| [${referVo.labelOrder}] | 汪嘉利, 高兴保, 杨志敏, 等. 2014. PCBs污染土壤的CaO诱导低温热处理脱氯研究[J]. 环境工程学报, 2014, 8(11): 4902–4906. |
| [${referVo.labelOrder}] | 吴文海. 2006. 镍基催化剂上氯代芳香族化合物加氢脱氯降解研究[D]. 大连: 中国科学院大连化学物理研究所 |
| [${referVo.labelOrder}] | 吴越. 2009. 应用催化基础[M]. 北京: 化学工业出版社. |
| [${referVo.labelOrder}] | 肖叶. 2013. 六氯苯碱催化分解影响因素及降解机理研究[D]. 北京: 清华大学 |
| [${referVo.labelOrder}] | 辛勤. 2009. 现代催化研究方法[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | 杨淑伟. 2010. 生活垃圾焚烧UP-POPs排放特征与催化降解装置[D]. 北京: 清华大学 |
| [${referVo.labelOrder}] | 尹可清. 2014. 焚烧飞灰中UPOPs低温脱氯反应途经研究[D]. 北京: 清华大学 |
| [${referVo.labelOrder}] | 赵彦辉, 芦会杰, 徐文, 等. 2015. Fe2O3微纳米材料对八氯萘的热催化降解及其机制研究[J]. 环境化学, 2015, 34(12): 2204–2212. DOI:10.7524/j.issn.0254-6108.2015.12.2015070903 |
| [${referVo.labelOrder}] | Wakayama H, Mizuno J, Fukushima Y, et al. 1999. Structural defects in mechanically ground graphite[J]. Carbon, 37: 947–952. DOI:10.1016/S0008-6223(98)00249-8 |
| [${referVo.labelOrder}] | Wang H C, Liang H S, Chang M B. 2011. Chlorobenzene oxidation using ozone over iron oxide and manganese oxide catalysts[J]. Journal of Hazardous Materials, 186(2/3): 1781–1787. |
| [${referVo.labelOrder}] | Xu Y, Zhang W. 2002. Subcolloidal Fe/Ag particles for reductive dehalogenation of chlorinated benzenes[J]. Industrial & engineering Chemistry Research, 39(7): 2238–2244. |
| [${referVo.labelOrder}] | Zhang L, Zheng M, Liu W, et al. 2008. A method for decomposition of hexachlorobenzene by γ-alumina[J]. Journal of Hazardous Materials, 150(3): 831–834. DOI:10.1016/j.jhazmat.2007.10.037 |
 2017, Vol. 37
2017, Vol. 37