我国是烟草种植、生产和消费大国, 种植面积和产量均居世界首位.烟草行业是我国纳税大户, 在“十二五”期间烟草行业五年上缴财政总额4.13万亿元, 年均增长17.5%, 比同期全国财政收入年均增长率高4.7%, 在国民经济中发挥着重要作用.然而在烟草制品生产过程中会产生大量废水, 国家统计局2013年报道我国烟草制品业废水排放量为2362×104 t.烟草工业废水排放量大且颜色深、成分复杂, 烟叶中的尼古丁、有机酸、氨基联苯、萘胺等成分造成废水毒性大, 污染严重, 被欧盟法规认定为“有毒危险性废物”(Novotny et al., 1999), 若不妥善处理, 极易对环境造成严重的污染和潜在的危害(Wang et al., 2012) .尼古丁是烟草废水中一种关键的污染物, 溶于水和多种有机溶剂, 甚至可穿过复杂的生物膜, 包括血-脑屏障, 具有致癌、致畸、致突变性, 对人体造成危害(Tega et al., 2013) .因而有效处理该类废水, 使处理后污水无毒排放或中水回用, 对烟草工业绿色健康发展具有重要的意义.
目前已有多种方法应用于烟草废水处理领域, 工程常采用物理-化学-生物方法联合处理工艺, 其中生物法由于其经济高效的特性成为目前该类废水处理的主流技术, 并作为主体工艺技术应用于生产实践中.然而由于尼古丁及多环芳烃等污染物的难降解性和生物毒性(Yuan et al., 2006; Qu et al., 2006), 导致活性污泥的处理体系出现出水水质差、系统运行不稳定等问题, 使传统生物处理技术面临巨大挑战(郭静波等, 2011) .而生物强化技术被认为是最直接有效改善活性污泥性能, 提高系统运行效率的技术(Limbergen et al., 1998) .目前生物强化局限于单一菌株对活性污泥的强化处理(Wang et al., 2013), 并主要关注对单一污染物尼古丁的降解效能和机理分析, 如筛选获得以节细菌(Arthrobacter sp.)(Ruan et al., 2006; Hochstein et al., 1959), 假单胞菌(Pseudomonas sp.)(Chen et al., 2008; Ruan et al., 2005) 为主的尼古丁降解菌类群.然而作为生物强化的菌种只有能够长期稳定适应处理环境才能发挥较好的作用(Fantroussi et al., 2005) .烟草废水处理运行过程受产能、生产周期和烟草质量影响, 水质波动较大且成分复杂, 除了含有高浓度的尼古丁外, 还含有其他多种有毒有害污染物.单一菌株的处理往往不能达到预期效果.与之相比, 菌群的环境耐受能力强, 处理效果稳定, 在环境治理研究中取得较好的处理效果(Seib et al., 2015; Zhao et al., 2016) .
目前鲜有利用菌群进行烟草废水处理或生物强化的应用研究, 本研究旨在通过筛选驯化的方式获得高效活性降解菌群, 并分析处理前后烟草废水理化参数和有机成分的变化, 利用克隆文库技术分析菌群构成及多样性指数, 解析菌群处理过程中烟草废水污染成分的变化及降解过程.本研究获得的菌群由于其构成的稳定性和代谢途径的多样性, 能够适应不同浓度的废水环境, 去除尼古丁的同时有效降解其他多种杂环化合物、芳香烃及酯类等污染物, 拓展了降解范围, 为菌群在烟草制品废水处理中的应用提供了理论指导.
2 材料和方法(Materials and methods) 2.1 水质分析废水来自于某烟草公司, 该公司产生的废水黄褐色, 浑浊并伴有典型烟草气味.废水基本理化参数检测按照《水和废水监测分析方法》规定进行(国家环保局, 1997) .其中COD、色度、悬浮物(SS)采用便携式水质分析仪(DR1900, 美国Hach公司)进行测定;生化需氧量(BOD5)采用BOD测试仪(美国Hach公司)进行测定;pH值采用pH电极法测定, pH计(FE20, Mettler Toledo);盐度采用折光率法进行测定, 盐度计(手持式盐度仪, 南京山特公司);氨氮含量采用纳式试剂分光光度法(GB 7497-87) 测定;可溶性磷酸盐采用钼酸铵分光光度法(GB 11893-89) 测定.
2.2 有机污染物分析利用固相萃取和气相色谱-质谱联用法(Gas Chromatography-Mass Spectra, GC-MS)分析有机污染物.
水样预处理:取3份水样各500 mL, 分别用H2SO4和NaOH调节至pH小于2、自然pH和pH大于11, 用0.45 μm滤膜过滤后分别用固相萃取柱(Agela Cleanert C-18) 萃取(Yang et al., 2013) .固相萃取柱活化后, 水样以5.0 mL·min-1的流速渗透过固相萃取柱, 使污染物吸附于萃取柱中.预富集后抽真空10 min使小柱干燥, 依次加入乙酸乙酯、正己烷和甲醇, 每种有机溶剂自然流下后收集洗脱的样品, 将同一个样品的淋洗液合并, 加入无水硫酸钠脱水, 最后氮吹仪吹干浓缩过滤后用于定性定量分析微生物降解前后水样中的污染物类别和含量.实验中用到的所有有机溶剂均为色谱纯.
GC-MS/MS联用仪(Agilent 7890A GC/7200 Q-TOF MS)分析污染物种类和含量.方法参照文献进行并略有调整(Yang et al., 2013), 仪器设置参数如下:①进样口温度:250 ℃;分流比:100:1(V/V);色谱柱:30 m×250 μm×0.25 μm (J&W HP-5, 320 ℃);载气:氦气;流速:1.2 mL·min-1;升温程序:平衡时间0.5 min, 50 ℃ 维持1 min, 之后10 ℃·min-1升温至130 ℃, 30 ℃·min-1 升温至280 ℃ 维持6 min, 整个分析流程20 min.② Q-TOF质谱条件:接口温度:280 ℃;离子源:EI, 70 eV;离子源温度:200 ℃;四极杆温度:150 ℃.分析流程开始阶段, 设置溶剂延迟3 min.
2.3 功能菌群的筛选驯化和多样性分析根据废水的性质和污染类型, 选取污水处理厂污泥样品, 以逐步提高污染物负荷的方式筛选驯化具有高效降解功能的菌群(Gong et al., 2009), 在操作过程中通过调整废水的稀释倍数实现污染物浓度梯度逐步提高、增加驯化压力的目的.10 g污泥样品加入到稀释4倍的100 mL废水中, 180 r·min-1、30 ℃培养4 d后转接到稀释倍数为2的废水中, 逐步提高浓度至不稀释废水培养基中, 不断驯化菌群活性和环境耐受能力, 测定处理污水过程中COD浓度变化, 筛选降解效率最高的功能菌群.
采用细菌总DNA提取试剂盒(MO BIO PowerSoil®)提取菌群样品DNA, 利用细菌通用引物27F和1492R扩增细菌16S rRNA 基因(Li et al., 2011), 并构建克隆文库分析群落构成(刘开朗等, 2009) .克隆菌株送至诺和致源公司进行测序分析, 测序结果采用Blast方法在GenBank数据库(http://www.ncbi.nlm.nih.gov)中进行相似性搜索比对, 根据基因测序比对结果分析群落多样性和微生物群落结构组成.
3 结果与讨论 (Results and discussion) 3.1 废水样品的基本理化参数检测废水基本理化参数列于表 1.在烟草制品生产过程中一般会有较多烟草成分溶解于水中, 从表中结果可以看出, 菌群处理前废水的悬浮物和化学需氧量都很高, 分别达到735 mg·L-1和2169 mg·L-1.结果显示处理前的废水色度为1250, BOD5也高达971 mg·L-1.废水的B/C为0.45.B/C即BOD5/COD, 是衡量污水可生化性的重要指标, 即污染物中可生化降解组分占总污染物的比例, 当比值大于0.45, 生物降解性高;在0.45~0.30之间, 生物降解性一般;在0.30~0.20之间, 较难生物降解;比值小于0.20, 极难生物降解(陈壁波, 2006) .测定结果表明废水水质可生化性较好, 适用于生物处理, 这同文献报道中的烟草制品废水属性一致(侯轶等, 2008) .
| 表 1 废水样品的基本理化参数 Table 1 Physicochemical parameters of wastewater sample |
以COD为指标, 筛选获得3个具有降解效果的菌群, 分别命名为菌群A、B和C, 对烟草废水COD的降解效果如表 2所示.3组功能菌群经过梯度驯化后对废水COD的降解率均有提高, 且对COD为848、1692、2169 mg·L-1的废水均有较好的处理效果, 适用浓度范围大.其中菌群C在不同的COD下均展现出最优的处理水平, 第4代处理废水36 h后, COD由初始2169 mg·L-1降至366 mg·L-1, 去除率为83.1 %, 在3个菌群中降解效果最好.基于此, 后续以菌群C作为重点菌群, 深入研究处理烟草废水降解效果、污染物组成变化及其微生物群落结构.
| 表 2 驯化菌群对烟草废水的处理效果 Table 2 Treatment of tobacco wastewater by microbiota |
菌群C对废水样品污染指标的降解过程如图 1所示.相比于不加菌的空白组, 菌群C对废水COD的降解效果明显.在以往的研究报道中, 絮凝法(Wang et al., 2014, Pi et al., 2014) 、芬顿氧化法(何玉洁等, 2012)等物理和化学法对烟草废水COD的降解率未达到80%, 生物强化法虽取得较好的处理效果, 然而多针对单一的尼古丁类有害底物并以配制废水进行实验(Wang et al., 2013, Ruan et al., 2005, Gong et al., 2009), 本研究首次利用菌群处理烟草生产废水, 显示了高效的处理能力.从结果中还可以看出废水的色度也有较明显的下降, 处理后为790, 去除率为36.8%.菌群处理后氨氮和可溶性磷酸盐等参数均有所下降, 氨氮浓度从46.87 mg·L-1降低至22.78 mg·L-1, 去除率为51.4%;磷酸盐浓度从5.7 mg·L-1降低至1.04 mg·L-1, 去除率为81.8%, 显示了菌群较好的处理效果.另外废水的BOD5降低至169 mg·L-1, 盐度也有所下降, 处理后为0.4%.菌群处理后, 废水pH由6.95上升至7.94.
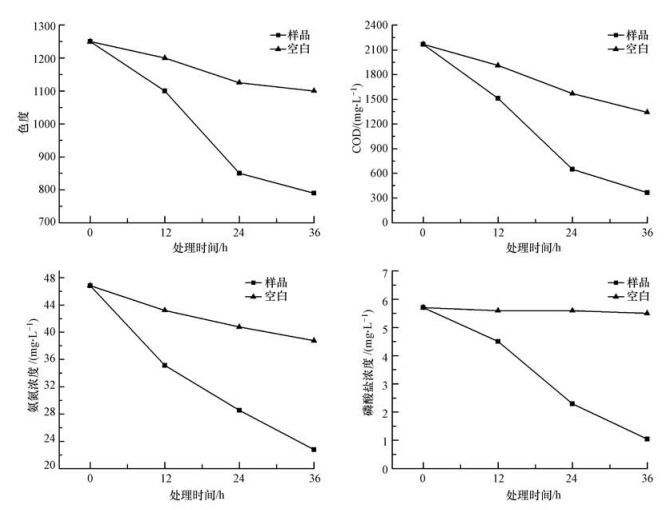 |
| 图 1 菌群C对废水样品主要污染指标的降解曲线 Fig. 1 Degradation curve of main pollutants of wastewater sample treatment by microbiota C |
准确分析废水中有机物组成及变化, 了解污染物代谢过程并为后续处理的方向和工艺调整提供指导.污染物分析检测的总离子流图如图 2所示, 其中每个离子流峰代表一种污染物, 每个峰积分面积代表污染物相对含量, 从下图比较可以看出, 经过菌群C作用后, 有机物种类大幅减少, 含量明显降低.
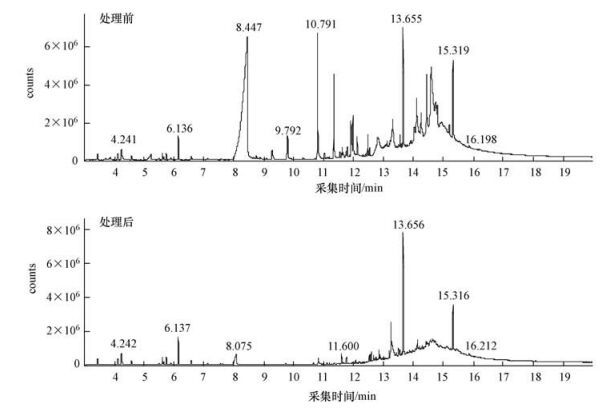 |
| 图 2 菌群处理前后污染物GC-MS总离子流图比较 Fig. 2 Comparison of total ion chromatogram of pollutants detected by GC-MS before and after treated by microbiota |
去除空白样品中有机物后, 将处理前后废水有机物组成和含量列于表 3中.整体上分析处理后废水中污染物含量是处理前10%~15%, 显著下降, 降解率接近90 %, 这与COD的降解率基本相符, 说明污染物种类含量和COD指标正相关.污染物种类也从降解前的49种变为降解后的37种.从结果可以看出, 处理后有机酸的种类由10种降至6种且相对含量由1235×104降至67×104, 有机酸被有效降解, 与处理后pH有所上升对应, 并且有机酸是烟叶组成中重要的香气化合物(王利杰等, 2007), 这也是经菌群处理后废水的气味减弱的原因之一.此外, 处理后废水中的含氧杂环和磺基类物质被完全降解;在处理后的废水中酯类和芳香烃的种类和相对含量均有所下降, 酯类化合物的种类由4种减少到1种, 相对含量由43.8×104降低为2.2×104;芳香烃的种类由6种减少到4种, 相对含量由58.1×104降至12.1×104.处理后酮醛类物质含量丰富, 并出现醚、烯烃和苯酚.
| 表 3 废水处理前后物质组成分析 Table 3 Analysis of material composition before and after wastewater treatment |
尼古丁是烟叶的重要有机成分, 也是生产废水中主要污染物之一, 它是一种含氮杂环类物质, 因而分析中重点关注了含氮杂环有机物的变化情况.结果表明, 尼古丁在经过处理后的水样中未检出, 说明菌群C对尼古丁具有很好的降解能力, 对尼古丁的去除率达到100%, 含氮杂环类物质整体的种类和含量也均降低.新出现的两种物质分别为二氮环甲烷和哌啶酮, 为结构相对简单的含氮杂环物质.另外联吡啶、3-(3, 4-二氢-2H-吡咯-5-)吡啶两种物质虽仍有残留, 但含量明显降低, 去除率超过90%.在含氮杂环类物质中, 仅有噻唑含量没有明显变化, 可能因为在该物质结构中含有硫元素, 其结构的特殊性和含硫杂环的高键能成为生物降解的障碍, 导致未被有效降解.
总体看来, 经过菌群C处理后, 废水中对COD贡献率较高的如尼古丁、吲哚、喹啉、酯及芳香烃等物质含量显著降低, 转变为COD贡献率较低小分子物质, 不仅极大减轻了出水指标的压力, 且去除了尼古丁为代表的毒性物质.未来研究可针对性的强化对噻唑、酮类及烃类物质的降解能力, 进一步降低废水COD, 使其能够稳定达到排放标准.
3.4 高效活性菌群构成的测定将高效菌群C文库中的78个阳性克隆进行测序, 分析后共得到47个OTU.样品微生物多样性分析结果显示:其香农-威纳指数(Shannon-Wiener Index)、辛普森多样性指数(Simpson Index)和菌群丰富度指数(ACE)分别为3.645、0.978、106.其中香农-威纳指数高, 说明群落结构复杂;辛普森多样性指数达到了0.978, 说明群落中细菌种类多, 且个体分布均匀;污泥样品中的菌群丰度指数(ACE)表明样品具有较高的微生物种群丰度.总之, 微生物多样性分析结果表明, 菌群中的微生物的群落结构复杂, 物种丰富度高, 且分布均匀, 适合使用于实际废水处理中.
菌群的克隆文库中的克隆主要属于细菌域的7个主要类群, 如图 3所示, 变形菌门(Proteobacteria)占有最大比例为48.75%, 其次为放线菌门 (Actinobacteria)占到总数的11.51%.另外还包含硝化螺旋菌门 (Nitrospira), 拟杆菌门 (Bacteriodetes), 绿弯菌门 (Chlorobacteria)等.
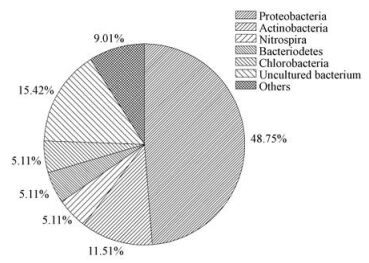 |
| 图 3 高效菌群C结构组成 Fig. 3 Microbial composition of highly effective microbiota C |
在克隆文库中比例最高的变形菌门是细菌中最大的一门, 比例为48.75%, 而这与一般处理污水的活性污泥的构成类似(Zak et al., 1994), 即活性污泥的优势类群也是变形菌门.变形菌门细菌的细胞形态极为多样, 参与了大多数化合物的降解代谢, 具有多种代谢方式.变形菌门检测到Brevundimonas aveniformis、Thiobacillus sp.、Desulfomicrobium sp.、Xanthobacter sp.及Burkholderiales sp.等微生物, 比例分别为1.3%、11.5%、1.3%、1.3%和1.3%, 具有降解多环芳烃(Xiao et al., 2010) 、脱氮除硫(范立民等., 2013) 、脱硫解毒重金属离子(徐卫华等, 2009) 、降解含氧杂环化合物(金小君等, 2012) 及降解酚类(Elsayed et al., 2003)等功能.
在克隆文库中比例排第二位的为放线菌门(Actinobacteria), 比例为11.51%, 这也是污水处理系统中常见的微生物类群(Wagner et al., 2002) .在克隆文库中检测到了Nocardioides sp.、Microbacterium sp.等微生物种类, 两者比例均为1.3%, 这些微生物在降解杂环芳香化合物(Rhee et al., 2011)和芳香烃(李丽等, 2001)等多种复杂有机物中均有报道.另外拟杆菌门的Flavobacterium sp. 比例为2.6%具有降解石油烃的功能(李丽等, 2001) .
正是微生物群落的结构多样性和代谢活性复杂性, 使其在降解过程中的形成“共代谢机制”, 高效降解了废水中的有毒有害有机物, 并保障了降解的稳定性和彻底性.目前尼古丁的细菌降解途径有两种, 一种是放线菌门节杆菌属为代表的吡啶途径(Brandsch, 2006), 另一种是变形菌门假单胞菌为代表的吡咯途径(Wang et al., 2005) .在克隆文库中发现Nocardioides sp., 该菌也被报道有降解尼古丁的能力(Ganas et al., 2008), 并遵循吡啶途径, 然而在菌群处理废水过程中, 并没有发现该途径常出现的蓝色物质, 是否由于菌群自身的复杂性, 使其并未按照单菌的代谢途径降解废水中的污染物, 有待进一步深入研究.
4 结论(Conclusions)1) 从环境样品中获得一组高效降解菌群C, 该菌群能够适应实际废水的环境, 对废水的COD和色度具有较好的去除效果, 降解率分别为83.1%和36.8%, 且处理后的废水其他指标包括氨氮和磷酸盐等均有所下降.
2) 经过GC-MS分析可知, 菌群对总有机物的去除率近90%, 且能够完全去除废水中的尼古丁, 并对其他含氮杂环物质有很好的降解效果, 能够将废水中的有毒大分子物质转化为COD贡献率较低的小分子物质.
3) 菌群的多样性分析表明, 微生物的群落结构复杂, 物种丰富度高, 且分布均匀.分析菌群构成可知, 变形菌门在菌群构成中所占比例最高为48.75%, 其次为放线菌门, 比例为11.51%.在菌群组成中发现能够降解尼古丁的菌株Nocardioides sp., 然而该菌降解尼古丁的吡啶途径并没有在菌群C处理废水过程中完整的体现, 因而由多种物种构成的微生物菌群对尼古丁的代谢机制有待进一步研究.
4) 菌群C群落组成丰富, 分布均匀, 包含多种不同功能的微生物菌株, 不仅能够针对性的去除尼古丁等有毒有害化合物, 并且有效降低其他各项污染物含量.由于其稳定的微生物群落结构能够适应不同浓度的废水, 未来可以用于强化活性污泥功能、减少剩余污泥、改善出水水质, 具有巨大的工业生产应用潜力.
| [${referVo.labelOrder}] | Brandsch R. 2006. Microbiology and biochemistry of nicotine degradation[J]. Applied Microbiology & Biotechnology, 69(5): 493–498. |
| [${referVo.labelOrder}] | 陈壁波. 2006. 废水可生化性评价方法及中段废水可生化性的评价[J]. 轻工科技, 2006, 22(5): 65–67. |
| [${referVo.labelOrder}] | Chen C, Li X, Yang J, et al. 2008. Isolation of nicotine-degrading bacterium Pseudomonas sp. Nic22, and its potential application in tobacco processing[J]. International Biodeterioration & Biodegradation, 62(3): 226–231. |
| [${referVo.labelOrder}] | Elsayed W S, Ibrahim M K, Abushady M, et al. 2003. Isolation and characterization of phenol-catabolizing bacteria from a coking plant[J]. Bioscience Biotechnology & Biochemistry, 67(9): 2026–2029. |
| [${referVo.labelOrder}] | 范立民, 裘丽萍, 陈家长, 等. 2013. 养殖池塘系统脱氮硫杆菌(Thiobacillus denitrificans)的分离、生长特性及脱氮特征研究[J]. 农业环境科学学报, 2013, 32(1): 153–159. DOI:10.11654/jaes.2013.01.022 |
| [${referVo.labelOrder}] | Ganas P, Sachelaru P, Mihasan M, et al. 2008. Two closely related pathways of nicotine catabolism in Arthrobacter nicotinovorans and Nocardioides sp. strain JS614[J]. Archives of Microbiology, 189(5): 511–517. DOI:10.1007/s00203-007-0340-8 |
| [${referVo.labelOrder}] | Gong X W, Yang J K, Duan Y Q, et al. 2009. Isolation and characterization of Rhodococcus sp. Y22 and its potential application to tobacco processing[J]. Research in Microbiology, 160(3): 200–204. DOI:10.1016/j.resmic.2009.02.004 |
| [${referVo.labelOrder}] | 郭静波, 崔凤国, 杨世东, 等. 2011. 生物强化技术在污水处理中的应用研究现状及发展展望[J]. 东北电力大学学报, 2011, 31(5): 1–8. |
| [${referVo.labelOrder}] | 国家环保局. 1997. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社. |
| [${referVo.labelOrder}] | 何玉洁, 陈卫, 郑晓英, 等. 2012. 芬顿氧化PAM助凝法预处理高浓度烟草香料废水试验[J]. 河海大学学报(自然科学版), 2012, 40(5): 525–529. |
| [${referVo.labelOrder}] | Hochstein L I, Rittenberg S C. 1959. The bacterial oxidation of nicotine. I. Nicotine oxidation by cell-free preparations[J]. Journal of Biological Chemistry, 234(1): 151–155. |
| [${referVo.labelOrder}] | 侯轶, 李友明, 郑振山. 2008. 造纸法烟草薄片废水中污染物的分析[J]. 华南理工大学学报:自然科学版, 2008, 36(3): 95–98. |
| [${referVo.labelOrder}] | 金小君, 陈东之, 朱润晔, 等. 2012. Xanthobacter flavus DT8降解二噁烷的特性研究[J]. 环境科学, 2012, 33(5): 1657–1662. |
| [${referVo.labelOrder}] | Limbergen H V, Top E M, Verstraete W. 1998. Bioaugmentation in activated sludge: current features and future perspectives[J]. Applied Microbiology & Biotechnology, 50(50): 16–23. |
| [${referVo.labelOrder}] | Li J, Li B, Zhou Y, et al. 2011. A rapid DNA extraction method for PCR amplification from wetland soils[J]. Letters in Applied Microbiology, 52(6): 626–633. DOI:10.1111/lam.2011.52.issue-6 |
| [${referVo.labelOrder}] | 李丽, 张利平, 张元亮. 2001. 石油烃类化合物降解菌的研究概况[J]. 微生物学通报, 2001, 28(5): 89–92. |
| [${referVo.labelOrder}] | 刘开朗, 卜登攀, 王加启, 等. 2009. 六个不同品种牛的瘤胃微生物群落的比较分析[J]. 中国农业大学学报, 2009, 14(1): 13–18. |
| [${referVo.labelOrder}] | Novotny T E, Zhao F. 1999. Consumption and production waste: another externality of tobacco use[J]. Tobacco Control, 8(1): 75–80. DOI:10.1136/tc.8.1.75 |
| [${referVo.labelOrder}] | Pi K, Xia M, Yang X, et al. 2014. Optimization of COD decrease from tobacco wastewater by Ca/Mg/Al coagulant using RSM[J]. Journal of Water Process Engineering, 5: 166–171. |
| [${referVo.labelOrder}] | Qu Y Y, Zhou J T, Wang J, et al. 2006. Bioaugmentation of bromoamine acid degradation with Sphingomonas xenophaga QYY and DNA fingerprint analysis of augmented systems[J]. Biodegradation, 17(1): 83–91. DOI:10.1007/s10532-005-3544-0 |
| [${referVo.labelOrder}] | Rhee S K, Lee S T, Lee K Y, et al. 2011. Degradation of pyridine by Nocardioides sp. strain OS4 isolated from the oxic zone of a spent shale column[J]. Canadian Journal of Microbiology, 43(2): 205–209. |
| [${referVo.labelOrder}] | Ruan A, Min H, Zhu W. 2006. Studies on biodegradation of nicotine by Arthrobacter sp. strain HF-2[J]. Journal of Environmental Science & Health. Part b. Pesticides, Food Contaminants & Agricultural Wastes, 41(7): 1159–1170. |
| [${referVo.labelOrder}] | Ruan A, Hang M, Peng X, et al. 2005. Isolation and characterization of Pseudomonas sp. strain HF-1, capable of degrading nicotine[J]. Research in Microbiology, 156(5/6): 700–706. |
| [${referVo.labelOrder}] | Seib M D, Berg K J, Zitomer D H. 2015. Reduced energy demand for municipal wastewater recovery using an anaerobic floating filter membrane bioreactor[J]. Environmental Science Water Research & Technology, 2(2): 290–297. |
| [${referVo.labelOrder}] | Tega Y, Akanuma S I, Kubo Y, et al. 2013. Blood-to-brain influx transport of nicotine at the rat blood-brain barrier: Involvement of a pyrilamine-sensitive organic cation transport process[J]. Neurochemistry International, 62(2): 173–181. DOI:10.1016/j.neuint.2012.11.014 |
| [${referVo.labelOrder}] | 王利杰, 卢红. 2007. 烟草有机酸研究进展[J]. 贵州农业科学, 2007, 35(3): 142–144. |
| [${referVo.labelOrder}] | Wang J H, He H Z, Wang M Z, et al. 2013. Bioaugmentation of activated sludge with Acinetobacter sp. TW enhances nicotine degradation in a synthetic tobacco wastewater treatment system[J]. Bioresource Technology, 142(8): 445–453. |
| [${referVo.labelOrder}] | Wang X, Tang L, Yao Y, et al. 2012. Bioremediation of the tobacco waste-contaminated soil by Pseudomonas sp. HF-1: nicotine degradation and microbial community analysis[J]. Applied Microbiology & Biotechnology, 97(13): 6077–6088. |
| [${referVo.labelOrder}] | Wang Y, Chen K, Mo L, et al. 2014. Optimization of coagulation-flocculation process for papermaking-reconstituted tobacco slice wastewater treatment using response surface methodology[J]. Journal of Industrial & Engineering Chemistry, 20(2): 391–396. |
| [${referVo.labelOrder}] | Wagner M, Loy A. 2002. Bacterial community composition and function in sewage treatment systems[J]. Current Opinion in Biotechnology, 13(3): 218–227. DOI:10.1016/S0958-1669(02)00315-4 |
| [${referVo.labelOrder}] | Wang S N, Xu P, Tang H Z, et al. 2005. "Green" route to 6-hydroxy-3-succinoyl-pyridine from (S)-nicotine of tobacco waste by whole cells of a Pseudomonas sp.[J]. Environmental Science & Technology, 39(17): 6877–6880. |
| [${referVo.labelOrder}] | Xiao J, Guo L, Wang S, et al. 2010. Comparative impact of cadmium on two phenanthrene-degrading bacteria isolated from cadmium and phenanthrene co-contaminated soil in China[J]. Journal of Hazardous Materials, 88(174): 818–823. |
| [${referVo.labelOrder}] | 徐卫华, 刘云国, 曾光明, 等. 2009. 硫酸盐还原菌及其还原解毒Cr(Ⅵ)的研究进展[J]. 微生物学通报, 2009, 36(7): 1040–1045. |
| [${referVo.labelOrder}] | Yang X, Liu M, Wang Z, et al. 2013. Determination of 4-tert-octylphenol in surface water samples of Jinan in China by solid phase extraction coupled with GC-MS[J]. Journal of Environmental Sciences, 25(8): 1712–1717. DOI:10.1016/S1001-0742(12)60209-5 |
| [${referVo.labelOrder}] | Yuan Y J, Lu Z X, Huang L J, et al. 2006. Optimization of a medium for enhancing nicotine biodegradation by Ochrobactrum intermedium DN2[J]. Journal of Applied Microbiology, 101(3): 691–697. DOI:10.1111/jam.2006.101.issue-3 |
| [${referVo.labelOrder}] | Zak J C, Willig M R, Moorhead D L, et al. 1994. Functional diversity of microbial communities: A quantitative approach[J]. Soil Biology & Biochemistry, 26(9): 1101–1108. |
| [${referVo.labelOrder}] | Zhao Y G, Yu Z, Tian W, et al. 2016. Enrichment and immobilization of sulfide removal microbiota applied for environmental biological remediation of aquaculture area[J]. Environmental Pollution, 214: 307–313. DOI:10.1016/j.envpol.2016.03.028 |
 2017, Vol. 37
2017, Vol. 37