2. 黄河文明与可持续发展研究中心, 开封 475004;
3. 中南大学冶金与环境学院, 长沙 410083
2. Key Research Institute of Yellow River Civilization and Sustainable Development & Collaborative Innovation Center on Yellow River Civilization of Henan Province, Henan University, Kaifeng 475004;
3. School of Metallurgical & Environment, Central South University, Changsha 410083
邻苯二甲酸酯(Phthalic Acid Esters, 简称PAEs)是一类难降解的有机污染物, 在塑料添加剂和增塑剂中都有非常广泛的应用(Blount et al., 2000) .由于PAEs与塑料间并非通过共价键连接(Talsness et al., 2009), 极易从塑料中脱离出来进入周边环境, 使红树林(Yuan et al., 2010) 、土壤(Zeng et al., 2008a)、水体(Penalver et al., 2000) 、大气(Pei et al., 2013) 、沉积物(Liu et al., 2014)等受到严重污染.其中, 邻苯二甲酸二丁酯(DBP)作为应用最为广泛的一种, 已经从各种环境介质中检测到它的存在.Wang等对南京郊区蔬菜土壤中6种被列为优先控制污染的PAEs调查发现, 土壤中总PAEs浓度为0.15~9.68 μg·g-1, 其中DBP、DEHP和DOP的含量最高(Wang et al., 2013) .Zeng等研究了广州市城市湖泊中16种PAEs的含量, 发现水体和沉积物中16种PAEs的浓度分别为1.69~4.72 μg·L-1和0.130~1.364 μg·g-1 (干重), 且水体中的DBP含量较大, 占53.0%~81.2%(Zeng et al., 2008b).
近年来, 国内外许多学者对DBP的生物降解进行了大量研究, 已发现多种可以降解DBP的菌株, 其中可以降解DBP的细菌有Enterobacter sp. (Fang et al., 2010) 、Gordonia sp. (Jin et al., 2012) 、Arthrobacter sp. (吴学玲等, 2009) 、Agrobacterium sp. (Wu et al., 2011) 、Variovorax sp. (Prasad et al., 2012) 、Bacillus sp. (Yuan et al., 2010)等.但是, 关于细菌降解DBP的报道大多数都是利用纯种菌株对DBP的降解能力研究, 而利用细菌菌群降解DBP的研究并不多见.研究表明细菌菌群的多样性能够增强其在不同环境中的生存能力, 且在多种污染物共存的环境中, 细菌菌群与纯菌株相比有更加稳定的群落结构和抗冲击能力, 可以有效提高对有机污染物的降解效率(Saratale et al., 2009; He et al., 2013) .因此, 利用细菌菌群降解DBP的相关研究具有重要的理论意义.
本研究从开封市垃圾焚烧发电厂废水处理系统的活性污泥中富集得到DBP高效降解菌群, 利用高通量测序技术分析该菌群的群落组成, 研究该菌群对DBP的降解特性以及降解途径, 以期为邻苯二甲酸酯类污染物的生物修复提供一定的理论支撑.
2 材料与方法(Materials and methods) 2.1 试验材料污泥样品采自开封市中节能垃圾焚烧发电厂好氧处理工艺池活性污泥.无机盐培养基(MSM) (g·L-1):K2HPO4 5.8, (NH4)2SO4 2.0, KH2PO4 4.5, MgCl2 0.16, CaCl2 0.02, FeCl2 0.0018, Na2MoO4·2H2O 0.0024, MnCl2·2H2O 0.0015.
主要试剂:DBP购自上海阿拉丁试剂有限公司, 纯度99%;分析纯乙酸乙酯购自上海国药集团化学试剂有限公司;色谱纯甲醇、正己烷购自默克化工技术(上海)有限公司;实验用水为实验室自制双蒸水.
2.2 DBP高效降解菌群的富集及群落分析取垃圾焚烧发电厂污水处理系统中活性污泥5 g, 加入到含100 mL (50 mg·L-1 DBP) 的无机盐培养基, 于30℃、175 r·min-1的摇床中避光振荡培养.采用梯度驯化法, 每隔一周按1%的接种量逐步转接至DBP浓度为100、200、300, 400、500、1000 mg·L-1的无机盐培养基中继续培养, 最终得到DBP高效降解菌群并命名为LV-1.
利用Ezup柱式基因组DNA抽提试剂盒(Bio Basic Inc., Markham, Ontario, Canada)对LV-1的总基因组进行提取.PCR扩增、测序及数据处理由中南大学资源加工与生物工程学院完成(Xiao et al., 2015) .通过设计引物扩增16S rRNA基因的V4高变区, 正向引物515F (5′ -GTGCCAGCMGCCGCG GTAA-3′)和反向引物806R (5′ - GGACTACHVGG GTWTCTAAT-3′), 反向引物还包含了Illumina adapter sequences和barcodes.样品文库是由纯化的PCR产物构建, 用MiSeq 500 cycles kit (2×250bp paired-ends)在Illumina MiSeq平台完成测序.测序结果在Galaxy pipeline (http://zhoulab5.rccc.ou.edu/) developed by Qin et al. (unpublished)上经过BTRIM的选择与分析后, 超过10 bp 重叠的结果被FLASH进行再选择, 240~260 bp的结果将被嵌入.OTU的测序结果随后被UPARSE在97%的相似度上分析, RDP软件则被用来进行OTU的分类, 测序结果上传到NCBI数据库(SRR5115354) .
2.3 LV-1对DBP的降解条件优化将LV-1接种于500 mg·L-1 DBP的无机盐培养基中, 在30 ℃、175 r·min-1的摇床中培养48 h后收集菌体, 在无菌条件下利用pH 7.5的0.05 mol·L-1磷酸盐缓冲液冲洗3次, 并用磷酸盐缓冲液将菌液调至OD600=1.0作为种子液备用.将种子液按5%(V/V)的接种量加入含20 mL无机盐培养基的50 mL锥形瓶中, 考察初始浓度为500 mg·L-1、转速为175 r·min-1的条件下, 不同pH值、不同温度以及不同接种量对LV-1降解DBP的影响.
2.4 LV-1对DBP的降解动力学研究向灭菌的50 mL三角瓶中加入不同量的10 g·L-1 DBP的甲醇溶液, 并置于通风橱中挥发其中甲醇, 然后按5%(V/V)接种量添加种子液和无机盐培养基配置成20 mL溶液, 使DBP最终浓度分别为100、200、300、400、500和1000 mg·L-1, 在最佳降解条件下于摇床中培养72 h, 每隔12 h取1次样.
2.5 LV-1降解底物广谱性测试按5%(V/V)的添加量将种子液分别接种于浓度为200 mg·L-1的邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异辛脂(DEHP)、邻苯二甲酸(PA)、双酚a (BPA)、蒽、萘、芴、荧蒽和菲的培养基中, 于最佳温度的摇床中175 r·min-1振荡培养, 48 h后用紫外分光光度计检测菌液的吸光度(OD600).
2.6 DBP生物降解产物分析按5%(V/V)的接种量将种子液接种于20 mL DBP培养基中(pH为6.0, DBP含量为500 mg·L-1), 于最佳温度的摇床中175 r·min-1振荡培养48 h, 每隔8 h取1次样并保存在4℃冰箱中, 48 h后将所有样品用乙酸乙酯萃取, 挥发干乙酸乙酯后用正己烷溶解过滤(0.22 μm有机相滤头)并盛于样品瓶中, 利用GC-MS进行检测.
2.7 分析方法样品处理方法:将50 mL锥形瓶中的样品转入分液漏斗, 并用10 mL乙酸乙酯洗涤锥形瓶, 将洗液转入分液漏斗中, 摇动漏斗30 s后静置5~10 min使其完全分层, 萃取过程重复3次, 收集上层有机相, 于通风橱中挥发至干;用甲醇将挥发后剩余物质(DBP)定容于25 mL容量瓶中, 利用0.22 μm有机相过滤器对样品进行过滤, 用UPLC测定样品中DBP剩余量.
UPLC条件:色谱柱, ACQUITY UPLC BEH C18(2.1 mm×50 mm, 1.7 μm);流速, 0.5 mL·min-1;流动相, 甲醇:水(90:10, V/V);UV检测器波长, 254 nm;进样量2 μL.
GC-MS条件:毛细管色谱柱:HP-5MS 5% Phenyl Methyl Silox (30 m×250 μm×0.25 μm);升温程序:初始温度60 ℃下保持3 min, 15 min内升至280 ℃, 最后在短时间内迅速降低至60 ℃;载气为He, 流速1 mL·min-1, 进样量为1 μL;采用EI离子源, 离子源温度为250 ℃, 电离电压70 eV, 全扫描模式, 范围为40~500 amu, 速度为500 amu·s-1.
3 结果与讨论(Results and discussion) 3.1 LV-1的群落分析采用高通量测序技术对LV-1进行分析, 在科的水平上, LV-1由33个科的细菌组成(图 1a), 其中优势科为Brucellaceae(62.78%)和Sinobacteraceae(14.83%), 两者的相对丰度共占77%.此外, LV-1中还有Rhizobiaceae, Comamonadaceae, Chitinophagaceae, Pseudomonadaceae, Micrococcaceae, Flavobacteriaceae和Rhodocyclaceae, 它们的相对丰度分别为4.42%、2.28%、3.37%、2.15%、2.32%、2.26%和1.36%.在属的水平上, LV-1由48个属的细菌组成(图 1b), 其中优势菌属为Brucella sp. (62.78%)和Sinobacter sp. (14.83%), 此外, 相对丰度较高的还有Terrimonas sp.(2.93%)、Arthrobacter sp.(2.32%)、Flavobacterium sp.(2.26%)、Pseudomonas sp.(1.95%)、Delftia sp.(1.95%)以及Thauera sp.(1.36%).
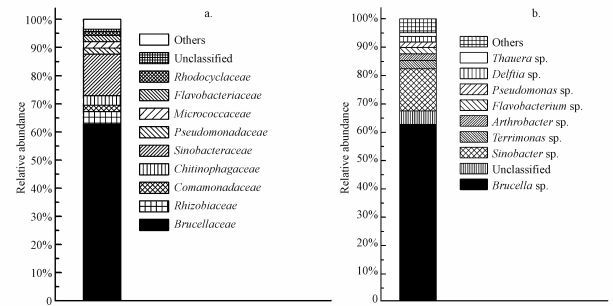 |
| 图 1 LV-1的微生物群落结构 (a.科, b.属) Fig. 1 Bacterium consortium structure of LV-1. (a. at family level.b. at genus level) |
前期研究几乎没有关于Sinobacter sp.和Terrimonas sp.降解有机污染物的报道, 关于Brucella sp.降解有机污染物的研究也非常少, Muthukumar等在研究石油的生物降解过程中发现Brucella sp.是芳烃的主要降解菌(Muthukumar et al., 2003), 除了这3个属的细菌之外, 其他菌属都较为常见, 且在有机污染物的生物降解方面被多次报道(Patil et al., 2004;段星春等, 2009;Wang et al., 2012;Liang et al., 2008;Shinoda et al., 2004), 只是它们在LV-1中的相对丰度较低, 不是该菌群中的优势菌.目前利用细菌菌群降解PAES的研究相对较少, He等发现了能够高效降解DBP的细菌菌群HD-1, 主要由Gordonia sp. 、Achromobacter sp.和Burkholderia sp. 组成, HD-1在48 h内可将1200 mg·L-1 DBP降解90%左右(He et al., 2013) ;Chang等发现菌株Sphingomonas sp. DK4和Corynebacterium sp. O18同时作用时能够降解多种PAEs (Chang et al., 2004) ;Wu等在对邻苯二甲酸二辛脂(DOP)的降解中指出, JDC-2和JDC-32协同作用时才可将其完全矿化(Wu et al., 2010) .可以看出与纯种菌株相比, 细菌菌群或菌株组合对有机污染物的降解效果更佳, 因此, 利用细菌菌群对有机物的生物处理具有很大的应用潜力.
3.2 LV-1降解条件优化 3.2.1 pH值对LV-1降解DBP的影响pH值对LV-1降解DBP的影响如图 2a所示.由图可知, LV-1对DBP的降解率随初始pH值的升高先上升, 并在pH值为6.0时降解率达到最高(约93%);随着pH值的继续升高, DBP降解率逐渐下降, 在pH为7.0和8.0时降解率在85%左右, 但高于8.0时, DBP降解率快速下降, 在pH为10.0时DBP的降解率降至64%左右.总的来说, pH值为6.0~8.0时, LV-1对DBP可以保持较高的降解率, 在pH值为6.0时降解效果最佳.
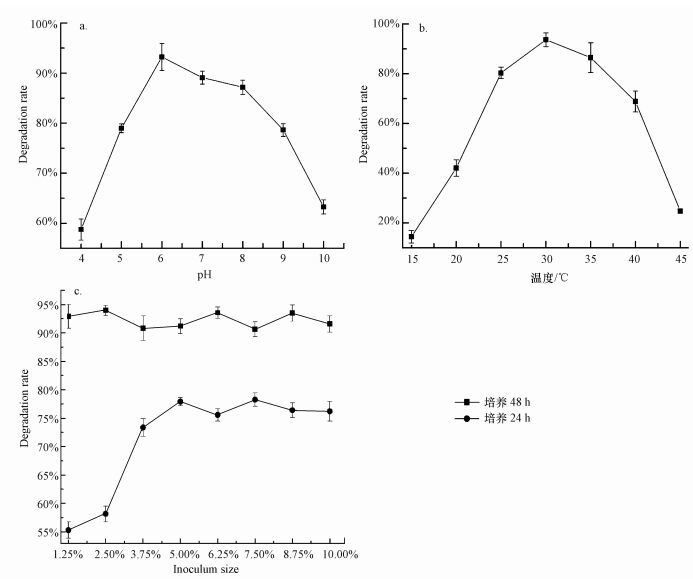 |
| 图 2 pH (a)、温度(b)和接种量(V/V)(c)对LV-1降解DBP的影响 Fig. 2 Effect of pH (a), temperature (b) and inoculum size (V/V) (c) on biodegradation of DBP by LV-1 |
温度对LV-1降解DBP的影响如图 2b所示.由图可知, 15 ℃时LV-1仅能降解10%左右的DBP;随着温度的升高其降解率逐渐上升, 且在15~25 ℃内降解速率较快, 25 ℃时降解率可达到80%左右, 25 ℃后降解速率增加变缓, 在30 ℃时降解率达到最高, 为93%左右.随着温度继续上升, DBP的降解速率呈现一个由慢到快的降低趋势, 45 ℃时仅能降解27%左右.温度过低或者过高对LV-1的降解能力都有很大程度的限制, 在25~35 ℃的范围内降解效果较好, 降解率可达到80%以上, 30 ℃时LV-1对DBP的降解效果最佳.
3.2.3 接种量对LV-1降解DBP的影响不同接种量对LV-1降解DBP的影响见图 2c.培养时间为24 h时, 接种量对DBP的降解效率影响较大, 接种量为1.25%时DBP降解率仅为55%左右, 增加接种量后DBP降解率迅速提高, 当接种量增至5%时DBP降解率可以达到73%左右;但接种量继续增加则对DBP的降解效率影响较小, 降解率都稳定在77%左右.当培养时间延长至48 h时, 接种量对DBP的降解几乎没有影响, LV-1对DBP的降解率都稳定在93%左右.
3.3 LV-1对DBP的降解动力学研究LV-1对不同初始浓度DBP的降解能力如图 3a所示.由图可知, 当DBP浓度在300 mg·L-1以下时, LV-1能够将其迅速降解, 延滞期较短, 随着DBP浓度的上升, 延滞期明显延长, 浓度为1000 mg·L-1时最为明显, 12 h内仅降解了15%左右.在DBP降解率方面, LV-1在48 h内可将500 mg·L-1DBP降解93%左右, 72 h内将1000 mg·L-1DBP降解95%左右.与纯种菌株相比, LV-1对DBP的降解效果更佳.Wu等研究了戈登氏菌JDC-33对DBP的降解效果, JDC-33在48 h内仅能降解78%左右的400 mg·L-1DBP (Wu et al., 2011) ;高俊贤等在利用变形假单胞菌对DBP的降解实验中发现, 72h内变形假单胞菌对400 mg·L-1DBP的降解率为88%左右(高俊贤等, 2016) .
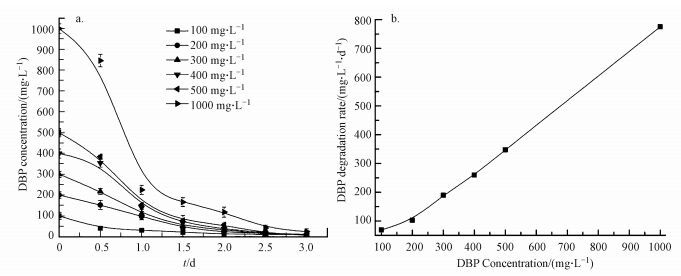 |
| 图 3 LV-1对DBP的降解曲线 (a. DBP降解曲线;b.第一天内DBP降解速率) Fig. 3 Degradation curve of DBP by LV-1 (a. DBP degradation curve; b. DBP degradation rate within first day) |
利用一级动力学方程对DBP降解曲线进行拟合, 结果如表 1所示.初始DBP浓度在100~500 mg·L-1时, LV-1对DBP的降解符合一级动力学方程, 而初始浓度为1000 mg·L-1时不符合一级动力学方程;当初始浓度为100 mg·L-1时, 其半衰期为13.44 h, 随着浓度的升高, 半衰期整体上呈上升趋势, 在14.64~19.20 h之间浮动, 可见LV-1对DBP的降解能力较为稳定, 具有良好的应用潜力.图 3b为第一天内LV-1对DBP的降解速率, 随着DBP浓度的升高, 其降解速率逐渐加快, 表明即使较高浓度的DBP也不会对LV-1的降解显示出明显的抑制.
| 表 1 LV-1对DBP的降解动力学方程 Table 1 Kinetics of DBP degradation by LV-1 |
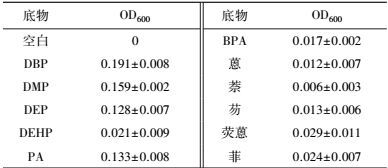
LV-1对不同有机物的降解效果如表 2所示.可以看出PAEs侧链的长短对LV-1的降解能力影响较大, LV-1对侧链较短的DMP、DEP以及PAEs代谢物PA的降解效果较好, 但对侧链较长的DEHP降解能力较差, 而其他6种非PAEs有机物BPA、荧蒽、菲、蒽、萘和芴等芳香族化合物几乎不能被其降解.
| 表 2 LV-1在不同有机物中的生长情况 Table 2 Growth Profile of LV-1 on various organic matters |
利用GC-MS对LV-1降解DBP的中间产物进行分析, 在降解过程中检测到DBP、邻苯二甲酸单丁酯(MBP)、邻苯二甲酸单乙酯(MEP)以及邻苯二甲酸(PA)的存在.根据检测结果、生化反应特点以及前期文献报道, 我们提出一个新的DBP生物降解途径(图 4) :LV-1经过β氧化作用脱掉DBP一条侧链上的一个乙基, 生成邻苯二甲酸-1乙基-6丁基酯(BEP), 再经脱酯作用将该侧链彻底水解生成MBP, MBP再经β氧化作用生成MEP, MEP再脱酯生成PA, 然后在酶作用下开环并最终完全矿化为CO2和H2O.虚框中的BEP为推测降解过程中应该生成的中间产物, 但是在本次试验中没有检测出来, 可能是因为LV-1对其降解能力较强, 形成之后在短时间内就被完全降解, 造成其含量低于GC-MS的最低检测限, 因此很难检出, 但根据以前的研究结果及本试验结果, 我们推断在LV-1对DBP降解过程中应该有BEP的存在.
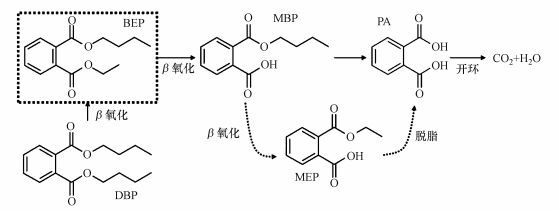 |
| 图 4 LV-1降解DBP的可能途径 Fig. 4 Possible biochemical degradation Pathway for DBP by LV-1 |
MEP的存在意味着LV-1对DBP生物降解过程中存在β氧化过程, Amir等曾经报道在PAEs生物降解过程中可能存在β氧化过程, 通过β氧化脱掉PAEs侧链上的一个乙基(Amir et al., 2005) ;Wu等在利用Gordonia sp. JDC-2和Arthrobacter sp. JDC-32对DOP的降解途径中指出, JDC-2通过β氧化作用将DOP的侧链逐步分解形成PA, PA的进一步降解再由JDC-32完成(Wu et al., 2010) ;Cartwright等在DEP的降解途径中报道, DEP可通过两条途径降解为PA, 一条途径是DEP的两条侧链相继脱去一个乙基, 被逐步水解最后生成PA;另一条途径是DEP侧链上的乙基被甲基替代, 以去甲基化的形式被逐步降解最后脱脂生成PA (Cartwright et al., 2000), 与本实验中推测的降解途径有着较好的一致性.
4 结论(Conclusions)1) 从开封市垃圾焚烧发电厂活性污泥中富集得到以DBP为唯一碳源和能源的细菌菌群LV-1, LV-1主要菌属为布鲁氏杆菌(Brucella sp.)和中华杆菌(Sinobacter sp.), 其相对丰度分别为62.78%和14.83%, 相对丰度超过1%的细菌属有8个.
2) LV-1降解DBP的最佳条件为:温度30 ℃, pH 6.0;在此条件下, LV-1可在48 h内将500 mg·L-1 DBP降解93%左右, 72 h内将1000 mg·L-1 DBP降解95%以上;底物初始浓度对LV-1的降解能力影响较大, 但是高浓度的DBP不会对LV-1显示出明显的抑制作用.
3) 本文提出一条新的DBP生物降解途径, LV-1通过β氧化和脱酯作用共同完成DBP支链的水解并生成PA, 然后再进一步代谢为CO2和H2O.
| [${referVo.labelOrder}] | Amir S, Hafidi M, Merlina G, et al. 2005. Fate of phthalic acid esters during composting of both lagooning and activated sludges[J]. Process Biochemitry, 40: 2183–2190. DOI:10.1016/j.procbio.2004.08.012 |
| [${referVo.labelOrder}] | Blount B C, Milgram K E, Silva M J, et al. 2000. Quantitative detection of eight phthalate metabolites in human urine using HPLC-APCI-MS/MS[J]. Analytical Chemistry, 72(17): 4127–4134. DOI:10.1021/ac000422r |
| [${referVo.labelOrder}] | Cartwright C D, Owen S A, Thompson I P, et al. 2000. Biodegradation of diethyl phthalate in soil by a novel pathway[J]. FEMS Microbiology Letters, 186(1): 27–34. DOI:10.1111/fml.2000.186.issue-1 |
| [${referVo.labelOrder}] | Chang B V, Yang C M, Cheng C H, et al. 2004. Biodegradation of phthalate esters by two bacteria strains[J]. Chemosphere, 55(4): 533–538. DOI:10.1016/j.chemosphere.2003.11.057 |
| [${referVo.labelOrder}] | 段星春, 易筱筠, 杨晓为, 等. 2007. 两株邻苯二甲酸二丁酯降解菌的分离鉴定及降解特性的研究[J]. 农业环境科学学报, 2007, 26(5): 1937–1941. |
| [${referVo.labelOrder}] | Fang C R, Yao J, Zheng Y G, et al. 2010. Dibutyl phthalate degradation by Enterobacter sp. T5 isolated from municipal solid waste in landfill bioreactor[J]. International Biodeterioration & Biodegradation, 64(6): 442–446. |
| [${referVo.labelOrder}] | 高俊贤, 刘琦, 连梓竹, 等. 2016. 一株 DBP 高效降解菌的分离、鉴定与降解性能[J]. 环境工程学报, 2016, 10(3): 1521–1526. DOI:10.12030/j.cjee.20160382 |
| [${referVo.labelOrder}] | He Z, Xiao H, Tang L, et al. 2013. Biodegradation of di-n-butyl phthalate by a stable bacterial consortium, HD-1, enriched from activated sludge[J]. Bioresource Technology, 128: 526–532. DOI:10.1016/j.biortech.2012.10.107 |
| [${referVo.labelOrder}] | Jin D, Bai Z, Chang D, et al. 2012. Biodegradation of di-n-butyl phthalate by an isolated Gordonia sp. strain QH-11: Genetic identification and degradation kinetics[J]. Journal of Hazardous Materials, 221: 80–85. |
| [${referVo.labelOrder}] | Liu H, Cui K, Zeng F, et al. 2014. Occurrence and distribution of phthalate esters in riverine sediments from the Pearl River Delta region, South China[J]. Marine Pollution Bulletin, 83(1): 358–365. DOI:10.1016/j.marpolbul.2014.03.038 |
| [${referVo.labelOrder}] | Liang D W, Zhang T, Fang H H, et al. 2008. Phthalates biodegradation in the environment[J]. Applied Microbiology and Biotechnology, 80(2): 183–198. DOI:10.1007/s00253-008-1548-5 |
| [${referVo.labelOrder}] | Muthukumar N, Mohanan S, Maruthamuthu S, et al. 2003. Role of Brucella sp. and Gallionella sp. in oil degradation and corrosion[J]. Electrochemistry Communications, 5(5): 421–425. DOI:10.1016/S1388-2481(03)00093-6 |
| [${referVo.labelOrder}] | Patil N K, Kundapur R, Shouche Y S, et al. 2006. Degradation of plasticizer di-n-butylphthalate by Delftia sp. TBKNP-05[J]. Current Microbiology, 52(5): 369–374. DOI:10.1007/s00284-005-5258-2 |
| [${referVo.labelOrder}] | Pei X Q, Song M, Guo M, et al. 2013. Concentration and risk assessment of phthalates present in indoor air from newly decorated apartments[J]. Atmospheric Environment, 68: 17–23. DOI:10.1016/j.atmosenv.2012.11.039 |
| [${referVo.labelOrder}] | Penalver A, Pocurull E, Borrull F, et al. 2000. Determination of phthalate esters in water samples by solid-phase microextraction and gas chromatography with mass spectrometric detection[J]. Journal of Chromatography A, 872(1): 191–201. |
| [${referVo.labelOrder}] | Prasad B, Suresh S. 2012. Biodegradation of phthalate esters by Variovorax sp[J]. Apcbee Procedia, 1: 16–21. DOI:10.1016/j.apcbee.2012.03.004 |
| [${referVo.labelOrder}] | Saratale R, Saratale G, Kalyani D, et al. 2009. Enhanced decolorization and biodegradation of textile azo dye Scarlet R by using developed microbial consortium-GR[J]. Bioresource Technology, 100: 2493–2500. DOI:10.1016/j.biortech.2008.12.013 |
| [${referVo.labelOrder}] | Shinoda Y, Sakai Y, Uenishi H, et al. 2004. Aerobic and anaerobic toluene degradation by a newly isolated denitrifying bacterium, Thauera sp. strain DNT-1[J]. Applied and Environmental Microbiology, 70(3): 1385–1392. DOI:10.1128/AEM.70.3.1385-1392.2004 |
| [${referVo.labelOrder}] | Talsness C E, Andrade A J M, Kuriyama S N, et al. 2009. Components of plastic: experimental studies in animals and relevance for human health[J]. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 364(1526): 2079–2096. DOI:10.1098/rstb.2008.0281 |
| [${referVo.labelOrder}] | Wang Y, Miao B, Hou D, et al. 2012. Biodegradation of di-n-butyl phthalate and expression of the 3, 4-phthalate dioxygenase gene in Arthrobacter sp. ZH2 strain[J]. Process Biochemistry, 47(6): 936–940. DOI:10.1016/j.procbio.2012.02.027 |
| [${referVo.labelOrder}] | Wang J, Luo Y, Teng Y, et al. 2013. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution, 180: 265–273. DOI:10.1016/j.envpol.2013.05.036 |
| [${referVo.labelOrder}] | 吴学玲, 金德才, 赵维良, 等. 2009. 4株邻苯二甲酸二丁酯降解菌的分离鉴定及其相关降解基因的克隆[J]. 环境科学, 2009, 30(9): 2722–2727. |
| [${referVo.labelOrder}] | Wu X, Liang R, Dai Q, et al. 2010. Complete degradation of di-n-octyl phthalate by biochemical cooperation between Gordonia sp. strain JDC-2 and Arthrobacter sp. strain JDC-32 isolated from activated sludge[J]. Journal of Hazardous Materials, 176(1): 262–268. |
| [${referVo.labelOrder}] | Wu X, Wang Y, Liang R, et al. 2011. Biodegradation of an endocrine-disrupting chemical di-n-butyl phthalate by newly isolated Agrobacterium sp. and the biochemical pathway[J]. Process Biochemistry, 46(5): 1090–1094. DOI:10.1016/j.procbio.2011.01.031 |
| [${referVo.labelOrder}] | Wu X, Wang Y, Dai Q, et al. 2011. Isolation and characterization of four di-n-butyl phthalate (DBP)-degrading Gordonia sp. strains and cloning the 3,4-phthalate dioxygenase gene[J]. World Journal of Microbiology and Biotechnology, 27(11): 2611–2617. DOI:10.1007/s11274-011-0734-2 |
| [${referVo.labelOrder}] | Xiao Y H, Xu Y D, Dong W L, et al. 2015. The complicated substrates enhance the microbial diversity and zinc leaching efficiency in sphalerite bioleaching system[J]. Applied Microbiology and Biotechnology, 99: 10311–10322. DOI:10.1007/s00253-015-6881-x |
| [${referVo.labelOrder}] | Yuan S Y, Huang I C, Chang B V. 2010. Biodegradation of dibutyl phthalate and di-(2-ethylhexyl) phthalate and microbial community changes in mangrove sediment[J]. Journal of Hazardous Materials, 184(1): 826–831. |
| [${referVo.labelOrder}] | Zeng F, Cui K, Xie Z, et al. 2008a. Phthalate esters (PAEs): emerging organic contaminants in agricultural soils in peri-urban areas around Guangzhou, China[J]. Environmental Pollution, 156(2): 425–434. DOI:10.1016/j.envpol.2008.01.045 |
| [${referVo.labelOrder}] | Zeng F, Cui K, Xie Z, et al. 2008b. Occurrence of phthalate esters in water and sediment of urban lakes in a subtropical city, Guangzhou, South China[J]. Environment International, 34(3): 372–380. DOI:10.1016/j.envint.2007.09.002 |
 2017, Vol. 37
2017, Vol. 37