2. 清华-伯克利深圳学院, 环境与新能源技术工程实验室, 深圳 518055;
3. 天津大学环境科学与工程学院, 天津 300072
2. Shenzhen Environmental Science and New Energy Technology Engineering Laboratory, Tsinghua-Berkeley Shenzhen Institute, Shenzhen 518055;
3. School of Environmental Science and Engineering, Tianjin University, Tianjin 300072
目前, 我国的水资源现状不容乐观, 供需矛盾日益加剧(钱易, 1996) .污水再生利用成本低, 见效快, 亦可减轻水体污染, 是缓解我国水资源短缺问题的有效途径(Sun et al., 2016) .再生水的输送和储存是再生水利用过程的必要环节, 也是影响用户端再生水水质的重要环节.与传统水源相比, 再生水中所含微生物的种类和数量均较多, 对再生水进行氯消毒是保障再生水水质安全的重要手段(胡洪营等, 2011) .
然而, 有研究表明, 再生水经消毒后, 杀灭了大多数的微生物, 但并不能杜绝微生物的再次生长(Jjemba et al., 2010) .有机物是再生水中微生物生长的重要条件.研究者们引入生物稳定性的概念, 用以评价水中的营养物质所能支持异养微生物(主要是异养细菌)生长的最大可能性, 即水中异养细菌的最大生长潜力(王占生等, 1999) .近年来, 氯消毒对饮用水生物稳定性的影响研究受到了较多关注(Liu et al., 2002), 而氯消毒对再生水生物稳定性的影响研究还有待开展.
本研究以可同化有机碳(AOC)作为生物稳定性的评价指标, 系统研究再生水在氯消毒过程中AOC的变化规律及其影响因素, 揭示AOC变化与氯消耗、水质变化的关系, 为优化污水再生工艺、保障再生水供水水质生物安全提供依据.
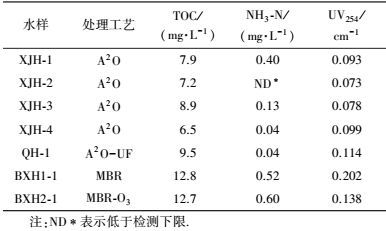
2 材料与方法(Materials and methods) 2.1 水样及水质测定方法实验用水样分别取自北京XJH污水处理厂二级处理工艺(缺氧-厌氧-好氧生物处理, anaerobic-anoxic-oxic, A2O)出水, QH污水处理厂深度处理工艺(超滤)出水, BXH污水处理厂二级处理工艺(膜生物反应器, membrane bioreactor, MBR)出水和BXH污水处理厂深度处理工艺(臭氧)出水.
水样储存在4 ℃冰箱并于24 h内测定水质指标, 随后进行消毒实验.本研究中考察的水样水质情况见表 1.
| 表 1 实验用水样的水质 Table 1 Water quality of experimental water samples |
氯消毒剂采用分析纯次氯酸钠(质量浓度不少于5%)溶液.测定有效氯含量后装在锡箔纸包裹的棕色容量瓶中4 ℃下储存待用.脱氯剂采用亚硫酸钠溶液.将水样置于500 mL锡箔纸包裹避光的蓝盖丝口试剂瓶中, 加氯后按事先确定的取样时间取样, 并立即测定总氯(胡洪营等, 2015) .
测定完总氯后, 取出100 mL消毒后水样用配置好的亚硫酸钠溶液中和余氯, 置于100 mL蓝盖丝口试剂瓶中, 放入4 ℃冰箱保存.经0.22 μm亲水性尼龙微滤孔膜过滤后消毒的水样脱氯后可直接用于AOC及其他水质指标的测定, 未经过滤直接进行消毒实验的水样, 需在脱氯后再用0.22 μm亲水性尼龙微滤孔膜过滤, 然后进行AOC及其他水质指标的测定.
2.3 水质常规指标测定方法TOC由燃烧氧化非色散红外线吸收法测定, 采用仪器为TOC-VCPH型总有机碳分析仪, 日本岛津公司出品.
NH3-N浓度测定采用纳氏试剂比色法, 仪器为HI96715型氨氮浓度测定仪, 哈纳公司出品.
UV254测定采用紫外分光光度法, 仪器为UV-2401PC型紫外-可见分光光度计, 日本岛津公司出品.
氯浓度测定采用 EPA 330.5 DPD试剂法, 所用仪器为HI93711游离氯-总氯浓度测定仪, 哈纳公司出品.
2.4 生物稳定性评价方法及AOC的测定选用AOC 作为再生水生物稳定性的评价指标.AOC指的是水中容易被异养细菌利用于合成细胞体, 形成自身繁殖生长的有机物, 其本质上是水中所有影响微生物生长与代谢的因素的综合评价指标.
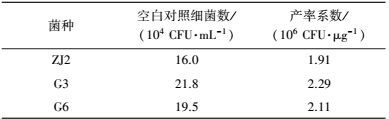
本研究采用Zhao等建立的再生水AOC测定方法(Zhao et al., 2013) 进行测定.AOC测试菌种为(Stenotrophomonas sp. ZJ2, Pseudomonas sp. G3, Enterobacter sp. G6), 采取混合接种的方法, 设置2个平行样品, 置于25 ℃条件下恒温培养3 d.
| 表 2 AOC测定中各测试菌种的空白对照细菌浓度及产率系数 Table 2 Concentration and yield coefficient of the test bacteria of AOC in the blank control |
测定5种水样在消毒过程(30 min)中的余氯衰减曲线, 初始投加量为15 mg·L-1, 具体如图 1所示.可以发现, 5 min时余氯衰减均较为显著.但不同水样余氯衰减速率有所不同, 对照已测定的水质指标可以发现, 除O3出水外, 其他水样呈现出TOC越高, 余氯衰减速率越大的趋势.
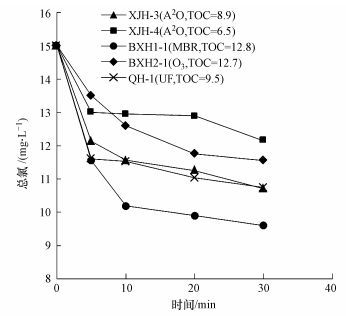 |
| 图 1 不同水样在氯消毒过程中的余氯衰减曲线 Fig. 1 Residual chlorine decay curves of different water samples |
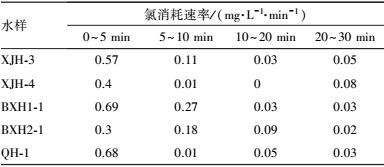
对上述水样在氯消毒过程中0~5 min、5~10 min、10~20 min、20~30 min氯的消耗速率进行定量分析, 如表 3所示.可以发现5 min为氯消耗最快的阶段, 因此定义5 min为快速氯消耗阶段.该阶段内消耗的氯浓度可能与消毒后水质的变化有着较大的关系, 将在本文后续章节中进一步探讨.
| 表 3 不同水样在氯消毒过程不同阶段中的氯消耗速率 Table 3 Chlorine consumption rates of different water samples in different stages |
水样XJH-1经3、5 mg·L-1氯消毒, 水样中的TOC含量随时间变化如图 2所示.考虑到仪器测量误差, 可认为水样的TOC浓度随消毒时间几乎没有任何变化.因此, 氯消毒对再生水总有机物的含量基本没有影响, 说明氯氧化只是改变了有机物的化学性质.
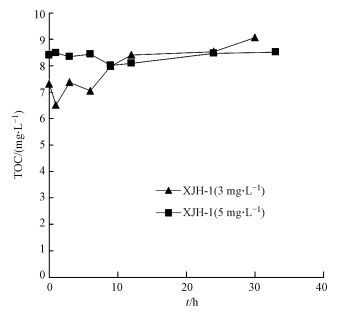 |
| 图 2 氯消毒后水样TOC浓度随时间的变化(水样XJH-1) Fig. 2 TOC concentration after chlorine disinfection (XJH-1) |
UV254反映了水样中含有双键及苯环等结构的有机物含量(Musikavong et al., 2007) .不同再生水水样在同一氯投加量下(15 mg·L-1)氯消毒过程中UV254随消毒时间的变化趋势如图 3所示.由图可以发现, 虽然各水样消毒前的初始UV254不同, 但具有类似的变化趋势, 即加氯后5 min, 紫外吸光度变化最明显, 5 min以后, 紫外吸光度没有显著变化.
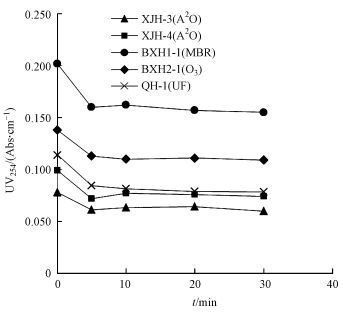 |
| 图 3 不同水样氯消毒过程中UV254的变化 Fig. 3 UV254 of different water samples during chlorine disinfection |
为了进一步考察消毒过程中再生水物质组成的变化, 本研究还考察了消毒对再生水三维荧光光谱特性的影响.三维荧光光谱是测定不同激发波长(Ex)和发射波长(Em)下水样的荧光强度(FI), 也称作激发-发射矩阵, 根据Chen等(2003) 的区域荧光强度积分理论, 三维荧光光谱可分为5个区(I~V), 分别代表酪氨酸类蛋白质、色氨酸类蛋白质、富里酸类腐殖质、芳香族蛋白质和腐殖酸类腐殖质.
以水样XJH-1在消毒过程中的三维荧光图谱(图 4) 为例, 可以发现经过氯消毒处理后, 荧光光谱上各区域的荧光强度都有所降低, 表明氯氧化对含苯环的结构有机物有普遍的去除作用.对比原水、加氯5 min、加氯10 min、加氯30 min的荧光光谱, 发现加氯后5 min, 荧光强度变化最明显.5 min以后, 荧光强度逐渐减弱, 但减弱幅度很小.
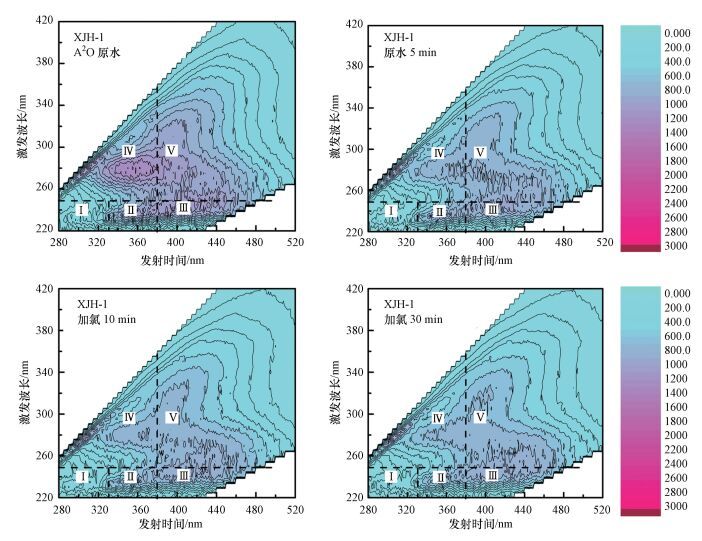 |
| 图 4 水样XJH-1氯消毒后三维荧光图谱的变化 Fig. 4 The 3DEEM before and after chlorination of XJH-1 |
在此基础上, 计算加氯后各区域积分强度的降低占总降低强度的百分比, 如图 5所示.发现, 消毒后荧光强度降低最大的部分是Ⅱ、Ⅳ区, 说明Ⅱ、Ⅳ区可能有较多的氯反应活性物质.因此, 这两类物质也是在再生水消毒过程中需要关注的部分.
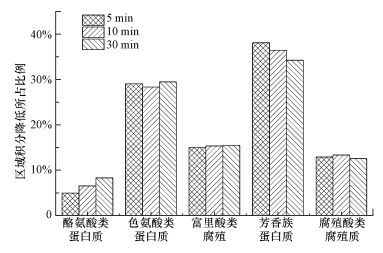 |
| 图 5 水样XJH-1氯消毒后三维荧光图谱各区域的变化 Fig. 5 Changes of different regions of 3DEEM of XJH-1 |
不同再生水水样(XJH-4、BXH1-1、BXH2-1、QH1) 在同一氯投加量下(15 mg·L-1)氯消毒过程中三维荧光图谱的变化如图 6所示.
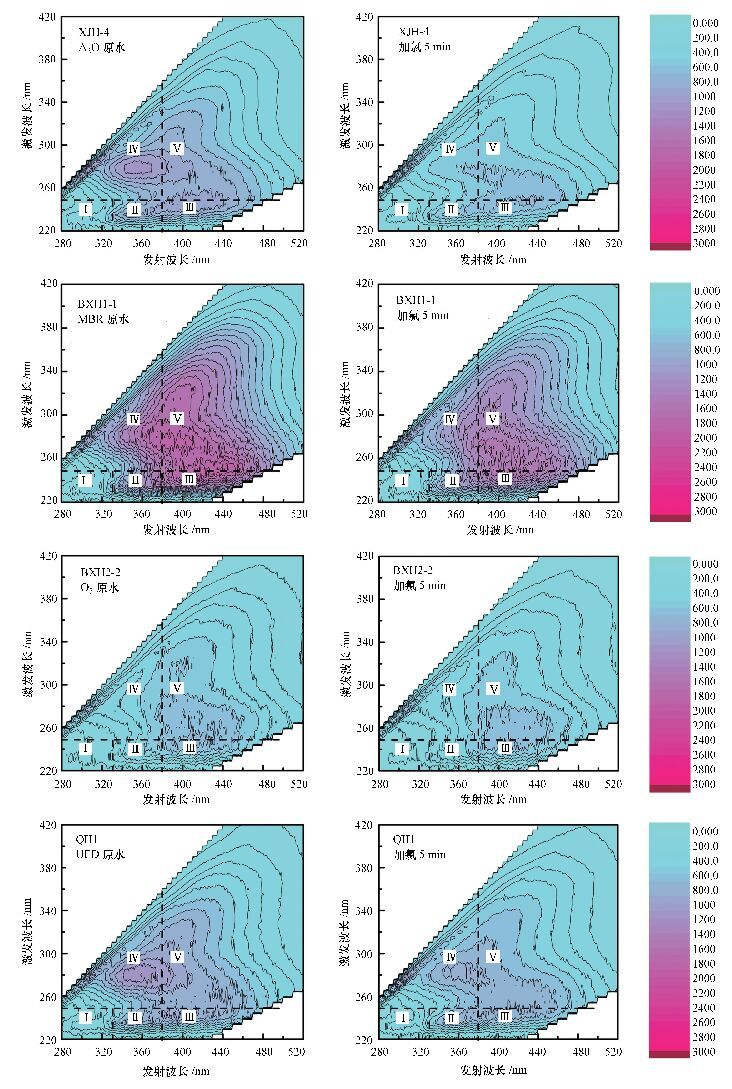 |
| 图 6 不同再生水水样氯消毒后三维荧光图谱的变化 Fig. 6 The 3DEEM before and after chlorination of different water samples |
可以发现, 不同水样中含有的有机物组分不尽相同, 水样XJH-4和水样QH-1荧光图谱中Ⅱ、Ⅳ区有机物含量明显高于其他区域.而在水样BXH1-1和水样BXH2-1的荧光图谱中, Ⅱ、Ⅲ、Ⅳ、Ⅴ区有机物含量均十分接近, 远高于Ⅰ区的有机物含量.各水样有机物组分的不同可能是导致消毒前后各指标变化规律不同的重要原因.
BXH1-1(MBR)的原水荧光强度远高于BXH2-1(臭氧)原水的荧光强度.说明臭氧深度处理工艺对荧光强度的去除效果较好.XJH-4和BXH1-1加氯后荧光强度的降低明显高于BXH2-1和QH-1加氯后的降低, 其中BXH2-1加氯后荧光吸收强度变化很小.说明二级出水中部分具有荧光强度的有机物在深度处理过程中被去除了.
3.3 消毒过程中AOC的变化规律对水样XJH-1、XJH-2、XJH-3、XJH-4(均为A2O工艺出水), 在不同的氯投加量下进行消毒实验.在设计好的消毒时间点, 分别取出100 mL水样进行脱氯, 脱氯后用0.2 μm尼龙膜过滤, 随后量取两份30 mL水样分装到带磨口塞的小锥形瓶中.接种菌种选用ZJ2、G3、G6.将ZJ2、G3、G6 3株菌, 按104 CFU·mL-1的浓度混合接种入另外两个小锥形瓶中.经过培养、稀释、涂布平板等一系列操作, 最后计算得出测出的AOC水平数值.将测得的AOC结果随消毒时间的变化趋势作成折线图, 如图 7所示.
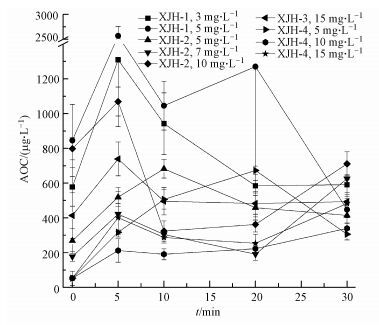 |
| 图 7 二级出水氯消毒过程中AOC变化规律 Fig. 7 AOC of secondary effluent during chlorine disinfection |
可以发现, 二级出水在氯消毒过程中AOC水平均有不同程度的增长, 消毒5 min时增长较为显著, 与5 min时氯消耗、UV254变化、三维荧光强度变化最显著的结论相一致, 说明AOC的增长可能是由于氯与再生水中的有机物发生了反应.30 min内整体上呈现出先增长后降低的趋势, 推测可能由于加氯后5 min中, 水样中的大分子有机物首先和氯反应, 被氧化分解为易被细菌吸收利用的小分子有机物, AOC迅速增长, 而在5~30 min内, 小分子有机物又继续和氯反应, AOC又有一定的下降, 但下降后的AOC水平仍高于消毒前的AOC水平, 说明消毒后再生水的水质生物稳定性明显变差.
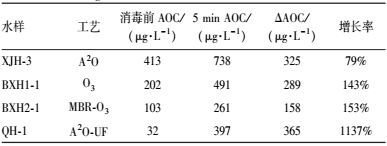
经不同处理工艺的出水, 其溶解性有机物的组成会有较大差异, 它们在氯消毒处理过程中的水质变化规律也可能会有所不同.因此, 研究对不同水样(XJH-3、BXH1-1、BXH2-1、QH-1) 在15 mg·L-1投加量下消毒过程中的AOC变化进行了测定, 如图 8所示.
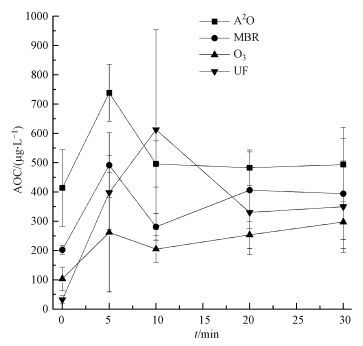 |
| 图 8 不同工艺处理出水氯消毒过程中AOC变化规律 Fig. 8 AOC of effluent in different processes during chlorine disinfection |
通过计算对比各水样5 min时的AOC增长率, 如表 4所示.
| 表 4 不同水样在15 mg·L-1下氯消毒5 min后的AOC变化 Table 4 AOC of different water samples after 5 min chlorine disinfection at 15 mg·L-1 |
由表 4可以发现, 各水样经氯消毒后, AOC均有不同程度的增长, 说明消毒使得再生水的生物稳定性变差.不同处理工艺出水在氯消毒过程中, AOC同样呈现出先增长后降低的趋势, 和二级出水表现出的规律一致.其中, 消毒前二级处理出水水样(A2O、MBR)的AOC水平明显高于深度处理出水水样(O3、UF), 说明二级处理出水中含有更多的可被微生物利用的有机物质, 生物稳定性较差.消毒5 min后, 二级出水的AOC水平仍高于深度处理出水.但从增长率上来看, 深度出水消毒5 min后AOC的增长率却高于二级出水消毒后的增长率, 说明增长率与初始AOC水平没有正相关关系, 推测可能由于深度处理出水含有的有机物分子比二级出水中含有的有机物分子小, 更易于被氧化为可被微生物利用的分子量更小的有机物, 因此增长率高于二级处理出水.
将不同水样在不同氯投加量下, 氯消毒前后AOC水平的变化与消毒过程中三维荧光光谱的变化进行了比较, 结果如图 9所示.
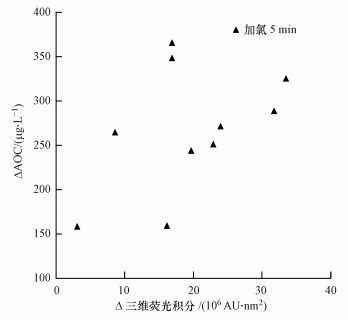 |
| 图 9 氯消毒过程中AOC变化与三维荧光积分值变化的关系 Fig. 9 Relationship between the AOC and 3DEEM during chlorine disinfection |
由图中可以发现, 在不同投加量条件下, 不同水样投加氯后AOC水平的变化与三维荧光光谱积分值的变化在一定的范围内存在正相关关系, 但相关关系并不显著.推测其原因, 可能是由于不同水样中含有的有机物成分差异较大, 与氯发生的反应较复杂, 因此一个从宏观上反映总有机物的变量可能很难预测不同水样中AOC的变化情况.
4 结论(Conclusions)1) 再生水氯消毒过程中, 前5 min, 氯消耗速率最大, 同时UV254和三维荧光强度显著降低.其中, 三维荧光光谱中的Ⅱ区(色氨酸类蛋白质)和Ⅳ区(溶解性微生物代谢产物)荧光强度降低最显著.
2) 再生水经氯消毒后, AOC显著增加, 增长倍数至少为1.8倍, 最高可达19倍.表明再生水氯消毒后生物稳定性明显变差.深度处理出水的AOC水平低于二级出水, 但消毒5 min后AOC的增长率却高于二级处理出水, 推测原因为水样中含有的有机物组成特性不同.
3) 再生水氯消毒过程中, AOC水平的变化与三维荧光光谱积分值的变化在一定程度上存在正相关关系.
| [${referVo.labelOrder}] | Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluoresence Excitation-Emission Matrix Regional Integration to Quantify Spectra for Dissolved Organic Matter[J]. Environmental Science and Technology, 37: 5701–5710. DOI:10.1021/es034354c |
| [${referVo.labelOrder}] | Eaton A D, Clesceri L S, Rice E W, et al. 2005.Standard methods for the exa mination of water and wastewater, 21st ed[M]. American Public Health Association, Washington, DC |
| [${referVo.labelOrder}] | 胡洪营, 黄晶晶, 吴乾元, 等. 2015. 水质研究方法[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | 胡洪营, 吴乾元, 黄晶晶, 等. 2011. 再生水水质安全评价与保障原理[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Jjemba P K, Weinrich L A, Cheng W, et al. 2010. Regrowth of potential opportunistic pathogens and algae in reclaimed-water distribution systems[J]. Applied and environmental microbiology, 76(13): 4169–4178. DOI:10.1128/AEM.03147-09 |
| [${referVo.labelOrder}] | Le Chevallier M W, Shaw N E, Kaplan L A, et al. 1993. Development of a rapid assimilable organic carbon method for water[J]. Applied and Environmental Microbiology, 59(5): 1526–1531. |
| [${referVo.labelOrder}] | Musikavong C, Wattanachira S. 2007. Reduction of dissolved organic matter in terms of DOC, UV-254, SUVA and THMFP in industrial estate wastewater treated by stabilization ponds[J]. Environmental Monitoring and Assessment, 134(1/3): 489–497. |
| [${referVo.labelOrder}] | 钱易. 1996. 污水资源化是解决水危机的有效途径[J]. 北京规划建设, 1996(4): 5–7. |
| [${referVo.labelOrder}] | Sun Y, Chen Z, Wu G X, et al. 2016. Characteristics of water quality of municipal wastewater treatment plants in China: implications for resources utilization and management[J]. Journal of Cleaner Production, 131: 1–9. DOI:10.1016/j.jclepro.2016.05.068 |
| [${referVo.labelOrder}] | van der Kooij D, Visser A, Hijnen W A M. 1982. Deter mining the concentration of easily assimilable organic carbon in drinking water[J]. Journal, 74(10): 540–545. |
| [${referVo.labelOrder}] | Liu W, Wu H, Wang Z, et al. 2002. Investigation of assimilable organic carbon(AOC) and bacterial growth in drinking water distribution system[J]. Water Research, 36: 891–898. DOI:10.1016/S0043-1354(01)00296-2 |
| [${referVo.labelOrder}] | 王占生, 刘文君. 1999. 微污染水源饮用水处理[M]. 北京: 中国建筑工业出版社. |
| [${referVo.labelOrder}] | Zhao X, Hu H Y, Liu S M, et al. 2013. Improvement of the assimilable organic carbon (AOC) analytical method for reclaimed water[J]. Frontiers of Environmental Science and Engineering, 7(4): 483–491. DOI:10.1007/s11783-013-0525-0 |
 2017, Vol. 37
2017, Vol. 37