水葫芦是一种外来入侵物种,对各种水质具有很好的适应性,其快速的生长速度和强大的繁殖能力使得其在江河湖泊上泛滥成灾.水葫芦生长爆发会急剧消耗水体中的溶解氧,破坏了生态平衡,并且造成严重的水体污染(Rezania et al., 2015).水葫芦作为一种水生植物,其含有大量可利用的木质纤维素.已有研究表明,水葫芦可转化为生物燃料等高价值产品,这不仅为有效解决水葫芦处置问题提供出路,降低治理成本,也能够缓解生态压力,减少对环境水体的破坏(Cheng et al., 2013; Singh et al., 2013).天然的木质纤维素由于其致密的稳定结构阻碍了与微生物、酶的接触,大幅增加了其利用难度.为了打破木质纤维素的天然屏障,需要采取一定的预处理.超声-离子液体预处理法中,离子液体与纤维素之间溶解-析出的过程能有效破坏紧密的纤维素-半纤维素-木质素的网状结构,降低纤维素的结晶度和聚合度,去除木质素的位阻,增大原料的多孔性与表面积,提高木质纤维素的可利用性(Sun et al., 2009).超声波不仅能够促进物质的传输和接触,其空化效应对结晶纤维素和木质素间的α-O-4、β-O-4键具有一定破坏效果(Bussemaker et al., 2013).许多研究表明超声-离子液体预处理相比传统的离子液体预处理,有效减少了处理时间,提高了反应效率,并且能够更大程度上降低纤维素的结晶度(Ninomiya et al., 2015、Yang et al., 2015; Montalbo Lomboy et al., 2015).研究发现,表面活性剂的添加能够促进离子液体对木质素的去除并进一步降低纤维素的结晶度(张耿崚等,2017).表面活性剂,一种具有亲水基团和疏水基团的化合物,它具有降低界面间的表面张力和表面自由能的作用.而反应介质的表面张力对超声的空化阀具有很大的影响,通常认为降低体系的表面张力能够促进超声波的预处理效果(Luo et al., 2014; Karimi et al., 2014).所以本试验将SDS运用于强化US/IL预处理水葫芦,探讨SDS的添加对US/IL预处理后的水葫芦酶解产糖以及其微观结构的影响.
2 试验材料与方法(Materials and methods) 2.1 材料本试验所用凤眼莲(水葫芦)采自广州市番禺区大学城(东经113°23′46.87", 北纬23°3′1.18").用去离子水冲洗掉泥沙等杂质,收集茎叶并置于室外自然晾干2 d后于60 ℃下烘干24 h.对材料进行破碎过40目筛,置于60 ℃烘干24 h后密封保存.
2.2 实验药品与仪器氯化-1-丁基-3-甲基咪唑([BMIM]Cl)(上海默尼化工有限公司);十二烷基硫酸钠(SDS)(上海泰坦科技股份有限公司) 65%;3, 5-二硝基水杨酸(Sigama-Aldrich) 98%;酶(纤维素复合酶NS22086,250 FPU·g-1、β-葡萄糖苷酶NS22118,320 CBU·g-1)(Novozymes公司)
FW100高速万能粉碎机(天津泰斯特仪器有限公司);MIX-25迷你混合仪(杭州米欧仪器有限公司);HC-3018高速离心机(安徽中科中佳科学仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);JY88-IIN超声细胞破碎机(宁波新芝生物科技股份有限公司)频率为20~25 kHz;
2.3 预处理水葫芦(1) 离子液体预处理
取0.25 g水葫芦粉末加入含有5 g [BMIM]Cl的20 mL瓶子中,于110~140 ℃油浴下加热搅拌15~120 min.
(2) 超声-离子液体预处理/表面活性剂-超声-离子液体预处理
取0.25 g水葫芦粉末加入含有5 g [BMIM]Cl和0~2% SDS(W/W)的20 mL瓶子中,插入超声波探头(Φ 3) 至混合液1/2处,于120 ℃油浴下超声处理15~60 min,反应结束后记录反应液温度.超声功率设定为100 W,脉冲周期为15 s /15 s.
(3) 水洗回收水葫芦
待反应液冷却后,对样品进行水洗.步骤参照Ninomiya等(2015)所采用的方法并稍作修改,添加10 mL去离子水混合搅拌15 min后移至50 mL离心管再添加去离子水至50 mL,于8000 g下离心10 min后倒掉上清液,重复上述操作5~6次直至水洗液呈无色.过滤后,将滤渣置于60 ℃下烘干24 h,称重后密封保存.所有预处理试验均重复3~6次,以得到充足的样品以待后续分析.
2.4 酶解糖化取1%(W/V)预处理后的样品加入至含0.01 mol·L-1,pH为4.8柠檬酸缓冲溶液和0.02%叠氮化钠的25 mL锥形瓶中,加入纤维素复合酶50 FPU·g-1(生物质)和β-葡萄糖苷酶40 CBU·g-1(生物质),置于50 ℃水浴摇床以150 r·min-1培养,分别在0、48 h取上清液.灭活后在10000 r·min-1下高速离心,采用DNS法测酶解液中的总还原糖含量(Miller, 1959).而纤维转化率采用公式(1) 进行计算(Worasuwannarak et al., 2007).
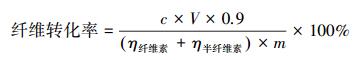
|
(1) |
式中, c表示酶解48 h产生的还原糖浓度(mg·mL-1),V表示反应液总体积(mL), η表示纤维素、半纤维素组分含量(%),m表示水葫芦添加量(mg).试验重复3次,结果以平均值±标准偏差(SD)表示.
2.5 木质纤维素成分分析分别使用硝酸-乙醇法、亚氯酸钠法和72%浓硫酸法测定预处理前后样品的纤维素、半纤维素和木质素含量(石淑兰,2006).预处理后脱木率采用公式(2) 进行计算(Xu et al., 2016).
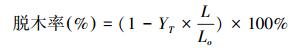
|
(2) |
式中, LO、L分别是预处理前后样品的木质素含量(%),而YT是预处理后样品回收率(%).成分分析试验重复3次,结果以平均值±标准偏差(SD)表示.
2.6 木质纤维素的微观结构与形貌分析(1) 场发射扫描电镜分析(FE-SEM)
将粉末样品用导电胶带固定在铜台上,喷金后对样品的表面形貌进行观察.
(2) X-射线粉末衍射分析(PXRD)
采用Cu靶产生X射线,管压40 kV, 管流40 mA,扫描步长为0.02 °·s-1,2θ为5~50 °.样品的结晶度(CrI%)采用Segal公式(3) 计算(Segal et al, . 1959).
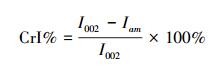
|
(3) |
式中, I002为(002) 晶格面衍射强度,Iam为(001) 与(002) 晶格面间无定形区的衍射强度.
(3) 红外线光谱分析(FTIR)
采用KBr压片方式制备样品,以KBr空白片作为参比扫描红外光谱,扫描范围为4000~400 cm-1.总结晶指数(TCI)和侧枝结构指数(LOI)分别采用公式(4)、(5) 进行计算(Ninoniya et al., 2012).
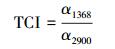
|
(4) |
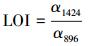
|
(5) |
式中, α896、α1368、α1424以及α2900分别为样品在红外波数为896 cm-1、1368 cm-1、1424 cm-1以及2900 cm-1处的谱带强度.
3 结果与分析(Results and analysis) 3.1 不同预处理水葫芦的酶解产糖 3.1.1 IL预处理图 1a是在不同温度下单独[BMIM]Cl预处理1 h后水葫芦酶解糖化的结果,从图中可以发现,110~130 ℃内酶解48 h产糖量稳步上升,因为温度升高能够破坏纤维素间的氢键并降低离子液体的粘度,增强对纤维素的溶解能力(Nasiropour et al., 2014).温度继续上升至140 ℃时产糖量无较大幅度提升.并且,在140 ℃下回收率为48.26%低于130 ℃时的55.43%,这是因为过高温度下部分纤维素会被破坏,生成可溶性产物,如羟甲基糠醛(HMF)等,造成损失率增大和产糖效率降低(Tadesse et al., 2012).所以考虑回收率、产糖量以及能耗等因素,后续的超声-离子液体(US-IL)预处理和表面活性剂辅助超声-离子液体预(US-IL-SDS)处理都将温度控制在130 ℃.为进一步探讨处理时间对酶解产糖量的影响,在130 ℃分别对水葫芦预处理0~120 min.酶解结果如图 1b所示,未处理的水葫芦即处理时间为0 min产糖量为0.104 mg·mL-1,天然水葫芦其密度较小、纤维素含量低以及木质素对酶的阻碍作用都是导致酶解效果差的原因(Xu et al., 2016).水葫芦经过预处理后,酶解效果得到大幅的提升,在15~45 min内产糖量逐渐增加,而处理时间继续增加至60 min时,产糖量为0.982 mg·mL-1.为了与US-ILs预处理的效率进行对比,试验还进行了120 min预处理,其产糖量继续上升至1.233 mg·mL-1.出现这种趋势的原因可能是处理时间在15~60 min内由于易溶解于IL的纤维素已大部分溶解,而剩余稳固的纤维素需要更长的处理时间才能够溶解进而提升酶解效果.
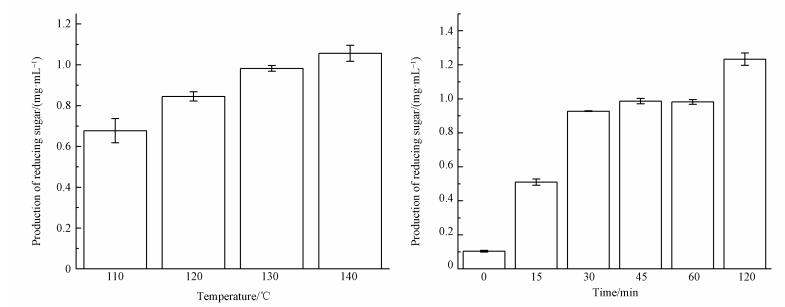 |
| 图 1 不同温度(a)和时间(b)IL预处理对水葫芦酶解影响 Fig. 1 The effect of temperature (a) and time (b) on enzymatic hydrolysis of water hyacinth in IL pretreatment |
为了控制温度对预处理的影响,试验采用功率100 W、油浴温度120 ℃以及脉冲周期15 s/15 s条件下进行试验.从图 2a可发现,处理时间15~60 min内温度基本维持在130~133 ℃,反应结束后反应液温度与处理时间与并无明显的相关性.对于48 h酶解反应,在15~45 min内产糖量逐渐增加,最高达1.358 mg·mL-1,处理时间继续增加时,产糖量基本维持平稳.与传统单独IL热处理120 min相比,超声45 min预处理已达到前者的酶解产糖量,说明US-IL预处理能够缩短预处理时间,提高处理效率.这是因为超声波的空化效应能够促进物质的运输,进而提高反应速率(Montalbo Lomboy et al., 2015).相比传统热处理相同时间,超声辅助处理产糖量提高37.73%.
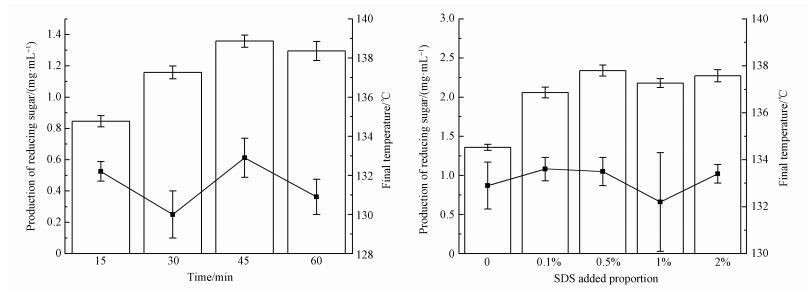 |
| 图 2 不同处理时间(a)和SDS添加量下(b)US-IL预处理对水葫芦酶解影响 Fig. 2 The effect of time (a) and SDS dosage (b)on enzymatic hydrolysis of water hyacinth in US-IL pretreatment |
表面活性剂能够增强木质纤维素的润湿性以及分散性,促进其与离子液体的反应,进而提高处理效率.所以本试验选取十二烷基硫酸钠(SDS)作为研究对象,在US-IL最佳试验条件下添加0~2%剂量的SDS预处理后对样品进行酶解.试验结果如图 2b所示,超声45 min后反应液温度维持在130~133 ℃内;并且随着SDS剂量的增加,产糖量也逐步上升,在0.5%添加量下达到最高,此时48 h产糖量为2.339 mg·mL-1,相比未添加SDS提高72.24%.SDS添加剂量大于1%时,产糖量并无继续增加.这是因为高剂量下,SDS可能会减弱ILs的氢键接受能力,进而影响其与纤维素的反应(Nasirpour et al., 2014).
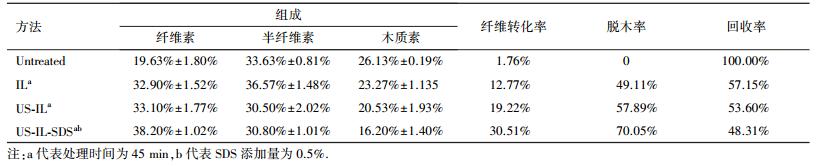
3.2 不同预处理法前后样品成分分析、纤维转化率与表征分析 3.2.1 预处理前后样品成分分析及纤维转化率计算纤维素含量的提高以及木质素的去除都有利于酶解效果的提高.水葫芦经过不同方式的预处理后(处理45 min),成分分析结果如表 1所示.从结果可发现,未处理样品纤维素含量只有19.63%,相比其他预处理后的材料低,并且其含有较高的半纤维素和木质素.木质纤维素含量仅有79.39%,说明含有大约20%的粗蛋白、水分以及灰分等其他物质.这也解释了未处理水葫芦酶解效果差的结果(表 1).经过不同预处理法处理45 min后,样品中木质纤维素含量增加至84%~93%,这是因为粗蛋白等物质在经过高温处理和水洗后得到去除.ILs、US-IL以及US-IL-SDS处理后纤维素比例有较大的提升,分别增加至32.90%、33.10%、38.20%;而木质素分别下降至23.27%、20.53%、16.20%.随着木质素的减少,去除难度也增大,因为木质素与纤维素、半纤维素间的C—O—C以及C—C键非常稳定,而且由于木质素的憎水性,使其难于和脱木剂充分接触(Kim et al., 2003).而SDS具有亲水、疏水基团的润湿特性,促进与木质素的接触,能够进一步对木质素进行脱除.并且,SDS的增加能够降低体系的表面张力,提升超声的空化效应,破坏纤维素与木质素间α-O-4、β-O-4键.从表 1可见脱木率从57.89%增大至70.05%,纤维转化率也得到了相应的提高,由19.22%提高至30.51%.
| 表 1 预处理前后水葫芦的成分分析及纤维转化率 Table 1 The composition and cellulose conversion of untreated and treated water hyacinth |
(1) FE-SEM分析.由SEM图可发现,未处理的水葫芦具有一定网状纹路且表面光滑.在IL处理后,水葫芦表面出现褶皱和破碎,但网状纹路依然存在.而在US辅助IL处理下,表面形貌有较大的改变,纹路基本消失,表面呈凹凸不平.在添加0.5% SDS后,水葫芦表面的凹凸现象更加明显,并有不规则的凹槽和空洞.这说明SDS的添加有助于进一步修饰水葫芦的表面结构,在糖化过程中增大与酶的接触面积,提高酶解效率.
 |
| 图 3 不同预处理方式得到的水葫芦的SEM图(a.未处理,b.IL处理, c.US-IL处理, d.US-IL-SDS处理) Fig. 3 SEM of water hyacinth after different pretreatment methods(a.Untreated, b.IL treated, c.US-IL treated, d.US-IL-SDS treated) |
(2) PXRD分析
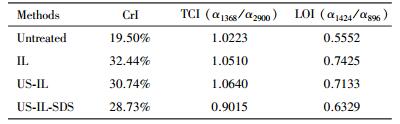
由图 4可看出,在XRD谱图中未处理的(001)、(002) 晶面并无明显的峰出现.而经过处理后,结晶峰有明显加强,相应的结晶度计算结果如表 2所示.由结果可见,经过不同方式处理后样品的结晶度由19.50%分别上升至32.44%、30.74、28.73%.这是因为在处理过程中无定型物质如粗蛋白、部分半纤维素以及木质素等成分会被移除,增加了结晶组分的相对含量;无定型的纤维素的转变与损失也是结晶度上升的原因(Devi et al., 2015、Xu et al., 2016).由结晶度结果也得出US辅助和添加SDS都能相应地提高对纤维素的破坏效果,纤维素结晶度是影响酶解效率的主要因素,降低的结晶度能够减少与酶之间的位阻,提高反应速度.XRD的结果也从结晶度角度证实酶解效果提高的合理性.
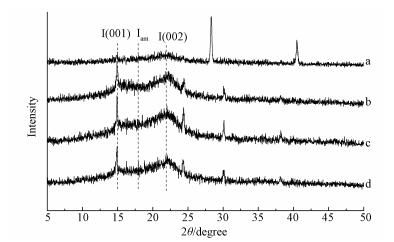 |
| 图 4 不同预处理方式得到的水葫芦的XRD谱图(a.未处理,b.IL处理, c.US-IL处理, d.US-IL-SDS处理) Fig. 4 XRD pattern of water hyacinth after different pretreatment methods (a. Untreated, b. IL treated, c. US-IL treated, d. US-IL-SDS treated) |
| 表 2 预处理前后水葫芦的XRD结晶指数和红外比率 Table 2 The crystallinity index of XRD and the infrared ratios of Fourier transform spectroscopy for untreated and treated water hyacinth |
(3) FTIR分析
纤维素和半纤维素中的特征峰有3372 cm-1(OH伸缩峰)、2926 cm-1(C—H和CH2伸缩峰)、1732 cm-1(半纤维素中乙酰基的C=O伸缩振动峰)、1368 cm-1(纤维素和半纤维素中C—H的弯曲振动峰)、1060 cm-1(纤维素和半纤维素中C—O的伸缩振动峰)、895 cm-1(纤维素中C—H的弯曲振动峰).木质素中的特征峰有1546 cm-1(芳香环骨架振动峰)、1460 cm-1(CH3中不对称弯曲峰)、1318 cm-1和1246 cm-1(紫丁香基中的C—O振动峰)(Ninorniya et al., 2012).而1631 cm-1和781 cm-1处分别对应结合水中的羟基和硅甲基峰(Yang et al., 2015).处理前后水葫芦的FTIR图谱如图 5所示,从结果可知,经过IL、US-IL、US-IL-SDS法处理后样品的谱图中特征峰出现位置与未处理基本一致,峰强度有所变化,说明反应并未发生衍生化.对于IL,3372、2926以及1060 cm-1波长下的峰相比未处理强度均有所下降,这说明纤维素和半纤维的结构受到ILs的作用而发生改变,纤维素之间的氢键有所减弱.由XRD结果中CrI%由19.5%上升至32.44%推论出也有可能是无定型纤维素在重结晶过程形成更紧密结构.而在US-IL中,3372、2926以及1060 cm-1出现上升现象,这可能是本试验中超声波不足以完全破坏水葫芦的结构,其“打浆作用”只破坏原纤维素松弛外表面结构,分离出微细纤维素,暴露出更多游离羟基(候玉林等,2012).更多的纤维素暴露出,增加与纤维素酶的接触概率,提升酶解效果(Yang et al., 2015).在US-IL-SDS谱图(图 5 d)中发现在纤维素、半纤维素特征峰中分别出现明显减弱和“蓝移”,如在3372、2926、1060 cm-1处相比未添加SDS有明显下降、1732 cm-1处的峰消失以及895 cm-1处的波峰偏移向872 cm-1,这都说明SDS的添加能够促进US-IL的预处理效果,削弱大分子纤维素间的氢键并将“打浆作用”中暴露的纤维素进一步破坏,这与XRD结晶度分析结晶度下降结果一致.而木质素对应的特征峰如1460 cm-1波段有明显提高,1546、1318以及1246 cm-1对应的波峰有较大削弱.这说明木质素中的大分子单元如芳香环骨架、紫丁香基环等官能团被破坏进而暴露出更多的甲基,这也可以得出SDS的添加能够更大程度上对木质素进行破坏,其与表 1中成分分析结果一致.781 cm-1对应的硅甲基峰在US-IL-SDS处理下也明显削弱,硅元素在水葫芦中是组成细胞壁的重要元素,其衍生的二氧化硅等物质会阻隔纤维素与酶的接触,抑制酶解反应(武少伟,2011、Yang et al., 2015).LOI(结晶指数或侧枝指数)和TCI(总结晶指数)通常作为判断纤维素结晶度的依据,较高的指数说明样品具有较高的结晶度和结构指数.预处理前后样品的LOI和TCI指数如表 2所示,从结果可见未处理、IL处理、US-IL处理、US-IL-SDS处理的LOI指数分别为0.5552、0.7425、0.7133、0.6329.其趋势与XRD分析中的CrI%一致,其说明SDS能够促进US-IL预处理进一步破坏结晶纤维,进而提高酶解效率.
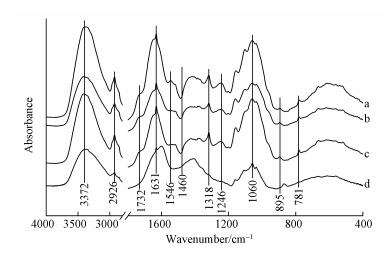 |
| 图 5 不同预处理方式得到的水葫芦的FTIR谱图(a.未处理, b.IL处理, c.US-IL处理, d.US-IL-SDS处理) Fig. 5 FTIR spectrum of water hyacinth after different pretreatment methods (a.Untreated, b.IL treated, c.US-IL treated, d.US-IL-SDS treated) |
US-IL预处理法,结合了US的空化效应以及IL对纤维素的良好溶解性各自的优点,不仅能够促进IL对纤维素的溶解,减少反应时间,而且能够降低纤维素的结晶度,提高酶解效率.然而在功率和频率较高下的情况下超声波会生成大量的羟基自由基,对IL具有一定的降解性,增大了后续的IL回收利用难度.所以依靠超声负载的增加和离子液体自身的溶解纤维素特性以提高预处理效果在工业化运用不具备可行性(Chatel et al., 2014).为了进一步改善US-IL预处理法,本试验采用添加SDS辅助US-IL预处理水葫芦木质纤维素,从试验结果发现,US-IL-SDS相比未添加表面活性剂,产糖量、纤维素转化率以及脱木率分别提高了72.24%、58.74%和21.01%,并且CrI%和LOI等结晶指数都有更大程度的下降.这说明在US-IL预处理中添加一定的SDS确实有助于提高处理效果.课题组前期曾对IL-SDS预处理作过一系列研究,在红外分析中于1460、1546、1318以及1246 cm-1波段并未出现较大改变.而本次试验却发现经过US-IL-SDS预处理后在1460 cm-1波段有明显提高,1546、1318以及1246 cm-1对应的波峰有较大削弱甚至消失(张耿崚等,2016a; 2016b).这说明在US-IL-SDS对木质素的破坏效果更明显和剧烈,这可能由于US体系中,IL和SDS间的耦合作用更强.而781 cm-1对应的硅甲基峰在US-IL-SDS预处理后消失说明SDS能够促进对细胞壁的破坏和残余物的移除.
表面活性剂对US-IL预处理技术的强化机理可能如下:其一表面活性剂作为一种能够改变反应介质界面性质的优良辅助剂,其增湿增容等特性能够促进木质纤维素在IL中的分散和溶解,也能够提高木质素的去除率(表 1),降低回收样品中木质素对酶的无效附着.其二表面活性剂的加入也能够降低体系的表面张力以及界面自由能,提高气泡的生成速率,降低了空化阀,进而在不提高功率下以较低的声能密度增强空化效应,促进IL与木质纤维素间的反应以提高酶解效果(Lee et al., 2005, Keswani et al., 2013).但本研究仅探讨了SDS对US-IL预处理技术的影响,所以对此机理仍未能深入进行探讨.所以在未来研究中会对不同种类型的表面活性剂进行全面、深入的研究,以为生物质能源应用提供一定的技术参考.
5 结论(Conclusions)1) 添加SDS能够促进对水葫芦木质素纤维素结构的破坏,强化酶解反应.
2) 在油浴温度120 ℃,脉冲周期15 s/15 s,SDS添加量0.5%下超声45 min,48 h酶解产糖量、纤维素转化率及其脱木率分别为233.9 mg·g-1(水葫芦)、30.51%及70.05%,相比未添加SDS分别提高72.23%、58.74%及21.01%.
3) SDS的添加能够进一步破坏水葫芦的脉络,提高酶解反应效率.US-IL预处理水葫芦能够降低结晶度,并且SDS对破坏结晶纤维有促进作用.US-IL-SDS预处理能够明显破坏木质素结构和降低纤维素间的氢键作用力.
| [${referVo.labelOrder}] | Bussemaker M J, Zhang D K. 2013. Effect of ultrasound on lignocellulosic biomass as a pretreatment for biorefinery and biofuel applications[J]. Industrial and Engineering Chemistry Research, 52(10): 3563–3580. |
| [${referVo.labelOrder}] | Chang K L, Chen X M, Han Y J, et al. 2016b. Effect of surfactant-assisted ionic liquid pretreatment on enzymatic hydrolysis of rice straw[J]. CIESC Journal, 67(5): 2078–2083. |
| [${referVo.labelOrder}] | Chatel G, Macfarlane D R. 2014. Ionic liquids and ultrasound in combination: synergies and challenges[J]. Chemical Society Reviews, 43(23): 8132–8149. DOI:10.1039/C4CS00193A |
| [${referVo.labelOrder}] | Cheng J, Xia A, Su HB, et al. 2013. Promotion H2 Production by microwave-assisted treatment of water hyacinth with dilute H2SO4 through combined dark fermentation and photofermentation[J]. Energy Conversion and Management, 73: 329–334. DOI:10.1016/j.enconman.2013.05.018 |
| [${referVo.labelOrder}] | Combination of ultrasonic irradiation with ionic liquid pretreatment for enzymatic hydrolysis of rice straw[J]. Bioresource Technology, 164:198-202 |
| [${referVo.labelOrder}] | Devi R R, Dhar P, Kalamdhad A, et al. 2015. Fabrication of cellulose nanocrystals from agriculture compost[J]. Compost Science and Utilization, 23(2): 104–116. DOI:10.1080/1065657X.2014.972595 |
| [${referVo.labelOrder}] | 候玉林, 万金泉, 马邕文, 等. 2012. 超声波对再生植物纤维结构及其水解反应影响的研究[J]. 中华纸业, 2012, 33(4): 41–45. |
| [${referVo.labelOrder}] | Hou Y L, Wan J Q, Ma Y W, et al. 2012. Effect of ultrasound treatment on the structure and hydrolysis of recycled cellulose fibers[J]. China Pulp and Paper Industry, 33(4): 41–45. |
| [${referVo.labelOrder}] | Karimi M, Jenkins B, Stroeve P. 2014. Ultrasound irradiation in the production of ethanol from biomass[J]. Renewable and Sustainable Energy Review, 40: 400–421. DOI:10.1016/j.rser.2014.07.151 |
| [${referVo.labelOrder}] | Keswani M, Raghavan S, Deymier P. 2013. Effect of non-ionic surfactants on transient cavitation in a megasonic field[J]. Ultrasonic Sonochemistry, 20(1): 603–609. DOI:10.1016/j.ultsonch.2012.05.018 |
| [${referVo.labelOrder}] | Kim T H, Mago G, Balan V, et al. 2003. Pretreatment of corn stover by aqueous ammonia[J]. Bioresource Technology, 90: 39–47. DOI:10.1016/S0960-8524(03)00097-X |
| [${referVo.labelOrder}] | Lee J, Kentish S, Matula T J, et al. 2005. Effect of surfactants on intertial cavitation activity in a pulsed acoustic field[J]. Journal of Physical Chemistry B, 109(35): 16860–16865. DOI:10.1021/jp0533271 |
| [${referVo.labelOrder}] | Luo J, Fang Z, Smith R L. 2014. Ultrasound-enhanced conversion of biomass to biofuels[J]. Progress in Energy and Comnustion Science, 41: 56–93. DOI:10.1016/j.pecs.2013.11.001 |
| [${referVo.labelOrder}] | Miller G L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 31(3): 426–428. DOI:10.1021/ac60147a030 |
| [${referVo.labelOrder}] | Montalbo-Lomboy M, Grewell D. 2015. Rapid dissolution of switchgrass in 1-butyl-3-methylimidazolium chloride by ultrasonication[J]. Ultrasonics Sonochemistry, 22: 588–599. DOI:10.1016/j.ultsonch.2014.06.013 |
| [${referVo.labelOrder}] | Nasirpour N, Mousavi S M, Shojaosadati S A. 2014. A novel surfactant-assisted ionic liquid pretreatment of sugarcane bagasse for enhanced enzymatic hydrolysis[J]. Bioresource Technology, 169: 33–37. DOI:10.1016/j.biortech.2014.06.023 |
| [${referVo.labelOrder}] | Ninomiya K, Kamide K, Takahashi K, et al. 2012. Enhanced enzymatic saccharification of kenaf power after ultrasonic pretreatment in ionic liquid at room temperature[J]. Bioresource Technology, 103: 259–265. DOI:10.1016/j.biortech.2011.10.019 |
| [${referVo.labelOrder}] | Ninomiya K, Kohori A, Osawa K, et al. 2015. Ionic liquid/ultrasound pretreatment and in situ enzymatic saccharification of bagasse using biocompatible cholinium ionic liquid[J]. Bioresource Technology, 176: 169–174. DOI:10.1016/j.biortech.2014.11.038 |
| [${referVo.labelOrder}] | Rezania S, Ponraj M, Din M F M, et al. 2015. The diverse applications of water hyacinth with main focus on sustainable energy and production for new era: An overview[J]. Renewable and Sustainable Energy Reviews, 41: 943–954. DOI:10.1016/j.rser.2014.09.006 |
| [${referVo.labelOrder}] | Segal L, Creely J J, Martin J A, et al. 1959. An Empirical Method for Estimating the Degree of Crystallinity of Native Cellulose Using the X-Ray Diffractometer[J]. Textile Research Journal, 29(10): 786–794. DOI:10.1177/004051755902901003 |
| [${referVo.labelOrder}] | Shi S L. 2006. Pulp to analysis and detection[M]. : 1–380. |
| [${referVo.labelOrder}] | Singh A, Bishnoi N R. 2013. Comparative study of various pretreatment techniques for ethanol production from water hyacinth[J]. Industrial Crops and Products, 44: 283–289. DOI:10.1016/j.indcrop.2012.11.026 |
| [${referVo.labelOrder}] | 石淑兰. 2006. 纸浆造纸分析与检测[M]. : 1–380. |
| [${referVo.labelOrder}] | Sun N, Rahman M, Qin Y, et al. 2009. Complete dissolution and partial delignification of wood in the ionic liquid 1-ethyl-3-methylimidazolium acetate[J]. Green Chemistry, 11(11): 646–655. |
| [${referVo.labelOrder}] | Tadesse H, Luque R. 2012. Advances on biomass pretreatment using ionic liquid: an overview[J]. Energy and Environmental Science, 4(10): 3913–3929. |
| [${referVo.labelOrder}] | Worasuwannarak N, Sonobe T, Tanthapanichakoon W. 2007. Pyrolysis behaviors of rice straw, rice husk, and corncob by TG-MS technique[J]. Journal of Analytical and Applied Pyrolysis, 78(2): 265–271. DOI:10.1016/j.jaap.2006.08.002 |
| [${referVo.labelOrder}] | Wu S W, Zhu D W, Zhou W B, et al. 2011. Effect of Fe-Mn-Si on the biomass structure of Eichhornia Crassipes[J]. Spectroscopy and Spectral Analysis, 31(4): 1087–1091. |
| [${referVo.labelOrder}] | 武少伟, 朱端卫, 周文兵, 等. 2011. 铁锰硅对凤眼莲生物质结构的影响[J]. 光谱学与光谱分析, 2011, 31(4): 1087–1091. |
| [${referVo.labelOrder}] | Xu F, Chen L, Wang A L, et al. 2016. Influence of surfactant-free ionic liquid microemulsions pretreatment on the composition, structure and enzymatic hydrolysis of the water hyacinth[J]. Bioresource Technology, 208: 19–23. DOI:10.1016/j.biortech.2016.02.027 |
| [${referVo.labelOrder}] | Yang C Y, Fang T J. 2015. Kinetics for enzymatic hydrolysis of rice hulls by the ultrasonic pretreatment with a bio-based basic ionic liquid[J]. Biochemical Engineering Journal, 100: 23–29. DOI:10.1016/j.bej.2015.04.012 |
| [${referVo.labelOrder}] | 张耿崚, 陈细妹, 韩业钜, 等. 2017. 表面活性剂辅助离子液体预处理稻秆的酶解动力学与结构变化分析[J]. 环境科学学报, 2017, 37(2): 686–693. |
| [${referVo.labelOrder}] | 张耿崚, 陈细妹, 韩业钜, 等. 2016a. 表面活性剂耦合离子液体对稻杆酶解糖化的影响[J][J]. 化工学报, 2016a, 67(5): 2078–2083. |
| [${referVo.labelOrder}] | 张耿崚, 陈细妹, 王小琴, 等. 2016b. 不同种类表面活性剂联合离子液体预处理稻杆的物化特性研究[J]. 环境科学学报, 2016b, 36(9): 3300–3305. |
 2017, Vol. 37
2017, Vol. 37