对羟基苯甲酸酯类是一类常见的药物及个人护理品, 作为防腐抗菌剂近百年来被广泛用于食品、化妆品和药品等领域(Guo et al., 2013).该类物质由于具有内分泌干扰作用, 在环境领域中通常被归类为新兴污染物(Brausch et al., 2011).尽管对羟基苯甲酸酯类物质可被生物降解, 但其在城市污水处理厂出水中的检测浓度仍约为4 μg·L-1(Bledzka et al., 2014), 而在地表水体中的浓度则可高达30 μg·L-1(Galinaro et al., 2015).显然, 对羟基苯甲酸酯类物质在各领域中的大批量使用, 是造成其在水体中大量积累的主要原因, 特别是使用此类物质的大量工业废水的排放.因此, 有必要寻求一种有效的去除手段以降低其在水体中的浓度.
吸附法是去除水中污染物的一种常用方法, 具有操作简单和见效快等优点.近年来, 许多研究采用吸附法去除水中的新兴污染物(Yang et al., 2012).开展吸附法的关键是吸附剂.目前, 已用于新兴污染物去除的吸附剂主要包括碳纳米材料(Yang et al., 2012)、磁性纳米材料(鲍晓磊等, 2008)等.尽管这些吸附剂具有一定的吸附效果, 然而其制备过程复杂、控制条件严苛、制备成本高昂, 不适于大批量生产应用.因此, 寻求较低成本、便捷有效的吸附剂具有一定的现实意义.生物炭是指农作物稻秆、动物粪便、骨骼等生物质在缺氧或厌氧条件下, 经过高温热解获得的一种具有特殊结构的高含碳的聚合物(Wardle et al., 2008).生物炭制备方法简单、成本低廉, 且其表面含有丰富的官能团并具有较高的比表面积, 因此, 基于生物炭开展的污染修复逐渐成为研究领域的热点(Rajapaksha et al., 2014).目前, 有关生物炭在土壤修复(Liang et al., 2006)、大气固碳(Wang et al., 2013)、污染物吸附(Tian et al., 2015)等方面的研究都有文献报道.不同的原料和裂解条件下制备的生物炭在结构特性和表面化学性质上有很大的差别(Jeffrey et al., 2009).目前, 生物炭材料对水体环境的修复中主要是针对重金属离子(Xu et al., 2016)、氮磷离子(He et al., 2014)、有机染料(Sun et al., 2015)等带电污染物的吸附, 对于去除对羟基苯甲酸脂类等疏水性或非极性新兴污染物的研究较少.
本研究采用小麦秸秆作为原料, 在300、500和700 ℃ 3种热解温度下制备生物炭, 并利用元素分析、扫描电镜及傅里叶红外光谱、等电点等对制备的生物炭进行表征分析.同时, 通过控制吸附时间、温度、初始浓度、pH值、背景溶液离子强度等参数对生物炭吸附对羟基苯甲酸乙酯的性能进行研究, 并采用等温吸附模型、动力学模型及热力学模型拟合吸附数据探究其吸附机理, 以期为以后吸附此类污染物提供理论参考.
2 材料与方法(Materials and methods) 2.1 实验材料与仪器仪器:RRH-A400型粉碎机、KABML-602A型马弗炉、扫描电子显微镜(FEI Quanta 400 FEG, 美国)、傅立叶红外光谱仪(EQUINOX-55, 德国布鲁克公司)、元素分析仪(VarioEL Ⅲ, 美国)、JW-BK100A型比表面积分析仪、PHK-616型pH计、紫外可见/分光光度计(UV-1700, 日本岛津)、RH-Q型恒温摇床、LW220型离心机、电子天平(BSA124S-CW, 德国赛多利斯)、JS94-J型电泳仪.
试剂:对羟基苯甲酸乙酯(EP, 理化性质见表 1)、HCl、NaOH、H2SO4、CaCl2、无水乙醇、活性炭(200目, 阿拉丁), 以上试剂均为分析纯;试验用水为去离子水.
| 表 1 对羟基苯甲酸乙酯的物理化学性质 Table 1 Physico-chemical properties of ethyl paraben |
小麦秸秆采自陕西省西安市长安区农田, 用去离子水洗涤, 洗去灰尘和泥土, 再浸泡12 h, 烘干至恒重.将处理好的秸秆用粉碎机粉碎, 过100目筛储备.
生物炭的烧制采用限氧控温炭化法, 具体步骤如下:称取50 g已过筛的小麦秸杆粉末于坩埚中, 包裹锡箔纸后放入马弗炉中, 分别在300、500和700 ℃下炭化3 h;降温至室温后取出, 为去除碳酸钙等灰分物质, 用500 mL 1 mol·L-1盐酸处理6 h, 抽滤后用蒸馏水洗涤至中性, 放入105 ℃烘箱烘至恒重, 贮存于棕色瓶待用, 标记为BC300、BC500和BC700(BC代表小麦秸秆, 数字代表炭化温度).
2.3 吸附实验 2.3.1 初始pH值的影响用0.01 mol·L-1 HCl和0.01 mol·L-1 NaOH溶液调节溶液初始pH值为2~12, 加入0.02 g BC300、BC500和BC700于100 mg·L-1的对羟基苯甲酸乙酯(EP)溶液中, 将盛有混合物的锥形瓶置于恒温水浴(25 ℃)振荡器中以150 r·min-1振荡90 min, 反应平衡后, 用针管抽取10 mL水样取样, 滤纸过滤, 测其去除率.
2.3.2 离子强度的影响在50 mL 100 mg·L-1的EP背景溶液中分别加入0.002、0.02、0.2 mg·L-1的CaCl2, 并与0.02 g BC300、BC500和BC700混合, 混合物在25 ℃、150 r·min-1下恒温振荡90 min, 反应平衡后, 用针管抽取10 mL水样取样, 滤纸过滤, 测其去除率.
2.3.3 等温吸附实验分别取EP配置溶液(25、50、100、200、400、500、600 mg·L-1)50 mL于100 mL锥形瓶中, 加入0.02 g BC300、BC500和BC700, 在25、30、35 ℃以150 r·min-1的转速振荡90 min, 用针管抽取10 mL水样取样, 滤纸过滤, 测其去除率.
2.3.4 吸附动力学实验分别取50、200 mg·L-1的EP溶液, 加入0.02 g BC300、BC500和BC700, 在25 ℃、150 r·min-1下恒温振荡2、5、8、12、17、25、40、55、72、90 min, 用针管抽取10 mL水样取样, 滤纸过滤, 测其去除率.
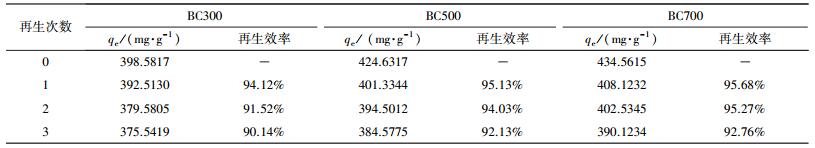
2.3.5 解析-再吸附实验以不同体积分数醇溶液(5%、25%、50%、75%、100%)作为再生液洗脱吸附后的生物炭, 在25 ℃、150 r·min-1下恒温振荡24 h, 测再生液中EP的浓度, 绘制解吸曲线, 考察不同再生液的影响, 得到最佳脱附条件;脱附后的生物炭水洗烘干后进行再吸附实验, 将吸附后的生物炭进行脱附实验, 脱附后的二次生物炭再进行吸附试验, 如此反复3次, 比较其吸附能力及再生效率.
2.3.6 活性炭吸附EP试验分别取EP配置溶液(25、50、100、200、400、500、600 mg·L-1)50 mL于100 mL锥形瓶中, 加入0.02 g BC300、BC500和BC700, 在25 ℃下以150 r·min-1的转速振荡90 min, 用针管抽取10 mL水样取样, 滤纸过滤, 测其去除率.
2.4 分析方法 2.4.1 生物炭的表征用SEM观察生物炭材料的外部形貌;通过FTIR分析生物炭, 将经干燥后的样品与高纯KBr共同研磨, 混合均匀后进行压片处理, 扫描范围为1000~4000 cm-1;生物炭的表面积及孔体积测定采用BET法, 孔径分布采用BJH法分析脱附数据构建而得;采用元素分析仪对生物炭元素含量进行分析.
生物炭产率测定:制得的生物碳称重后与原材料质量比即为该生物炭的产率.
生物炭灰分测定:在有氧条件下将生物炭置于马弗炉中灼烧, 得到的残留粉末称重后与原样品生物炭质量比为该生物炭的灰分含量.
生物炭的零电荷点(pHpzc)测定:采用电泳法测定生物炭的零电荷点.根据计算ζ电位的基本表达式(Helmholz方程)将之转换为ζ电位值, 将测定的ζ电位值对pH值自动作图, ζ电位为零时所对应的pH值即为所测生物炭的等电点(张立永等, 2007).
2.4.2 溶液中对羟基苯甲酸乙酯浓度测定采用紫外分光光度法检测EP的浓度, 制备EP储备液, 以背景溶液为空白, 在200~400 nm波长内扫描, 得到EP的最大吸收波长为259 nm.每组进行3个平行试验, 取其平均值.达到吸附平衡后的EP吸附量qe及去除率η由下列公式计算:
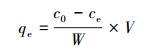
|
(1) |
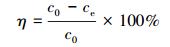
|
(2) |
式中, qe为达到平衡时的吸附量(mg·g-1), c0和ce分别为吸附前和吸附后溶液中的EP浓度(mg·L-1), V为溶液体积(L), W为吸附剂投加量(g).
2.4.3 吸附模型的分析通过等温吸附模型、动力学模型、热力学模型对生物炭吸附水中EP的实验数据进行拟合, 分析生物炭吸附水中EP的吸附机理.
2.4.4 数据处理实验所得数据均采用Origin8.5进行数据拟合, 并通过SPSS进行相关性分析.
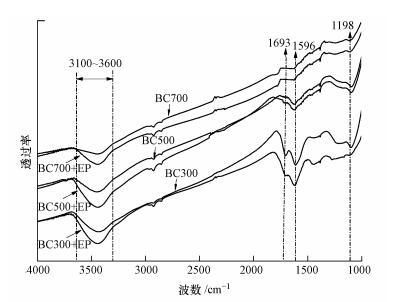
3 结果(Results) 3.1 生物炭的表征本次实验对吸附前后的BC300、BC500和BC700进行了傅里叶红外光谱(FTIR)分析, 结果如图 1所示.BC300具有丰富的表面官能团, 3100~3600 cm-1处为羟基—OH的伸缩振动(Chun et al., 2004);1693 cm-1处为羧酸或酯基中的C=O双键振动(Francioso et al., 2011);1596 cm-1处为多环芳烃的C=C和C=O双键伸缩振动(Cao et al., 2009);1198 cm-1处为纤维素或半纤维素的C—O—C振动(Keiluweit et al., 2010);上述官能团在BC500中也较为丰富, 但峰强度变小, 说明官能团减少.低温制备的生物炭官能团丰富, 对EP的吸附可能以分配作用为主;BC700的各种官能团几乎全部消失, 说明随着热解温度的升高, 小麦秸秆中的脂肪成分与纤维素逐渐被分解, 生物炭的极性也随之降低, 从“软介质”过渡到“硬介质”(陈宝梁等, 2008).
 |
| 图 1 生物炭吸附EP前后的FTIR图谱 Fig. 1 FTIR spectrum of biochars before and after sorption of ethyl paraben |
吸附后的FTIR图显示, 3种生物炭在3100~3600 cm-1处不但发生了右移, 而且吸收峰强度也增大, 这可能是羟基官能团与EP上的—C=O官能团发生了氢键作用, 导致—O—H键拉长, 从而发生了吸收峰红移和增强的现象(Joseph et al., 2007).同时, BC300在1693 cm-1处为羧酸或酯基中的C=O移动至1691 cm-1处, BC300、BC500在1596 cm-1处为多环芳烃的C=O移动至1593 cm-1, 这是由于C=O与EP中的—OH发生氢键作用所致(Fand et al., 2015).
图 2为小麦秸秆生物炭的SEM图像.随着热解温度的升高, 小麦秸秆生物炭表面的形貌变化显著, BC300表面光滑, 孔隙较大, 而BC500与BC700表面开始出现鱼鳞状的纹理, 表面粗糙, 孔隙小而多;相比BC500, BC700的鱼鳞状纹理更丰富, 表面呈现大量不规则碎裂结构.
 |
| 图 2 生物炭的扫描电镜图 Fig. 2 SEM images of biochars |
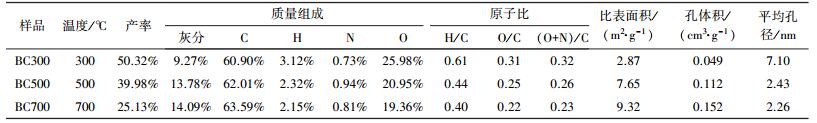
进一步测定了BC300、BC500、BC700的元素组成、原子比、产率及比表面积、孔体积, 结果见表 2.随着热解温度的升高, 具有极性基团的有机碳、氢、氧等含量降低, 生物炭产率从50.32%下降到25.13%;无机氧化矿物质则难以分解残留在生物炭中, 产生灰分.相比相同温度下利用玉米秸秆(Chen et al., 2009)、粪类(Cao et al., 2010)、果皮(Lu et al., 2012)等所制备的生物炭, 小麦秸秆生物炭灰分含量小于粪类生物炭, 高于玉米秸秆及果皮类生物炭.粪类生物炭中硅酸盐等无机含量很高, 因此, 会有高产率的灰分, 秸秆及果皮类生物炭灰分较低, 但小麦秸秆中含有较高的纤维素, 相比有机质高的玉米秸秆及果皮类生物炭热解后无机残留更高.由表中可知, 不同温度下灰分含量也有变化, 随着温度升高, 生物炭灰分从9.27%(BC300) 增加到14.09%(BC700);这可能是由于温度越高, 可挥发性物质、有机质等不断减少, 不可挥发性物质如硅酸盐等大量残存于生物炭中(Guo et al., 2011).不同温度下制备的生物炭中各元素组成含量不同, BC300、BC500、BC700的C含量均高于O、H、N含量, 且随着温度的升高, C含量依次增加, 而O、H含量依次减少, N含量在300~700 ℃逐渐下降;说明升温热解过程中, 有机碳在较低的热解温度就已完全热解, 温度继续上升, 固定碳不再分解减量而继续碳化浓缩, 因此, 碳含量升高(Esben et al., 2013);而由于高温热解, 使有机质分解, 连接在碳上的羟基、羧基、羰基等基团减少(Cantrell et al., 2012).
| 表 2 生物炭的理化性质 Table 2 Physico-chemical properties of biochars |
元素的原子比用来指示生物炭的化学性质, H/C、O/C和(O+N)/C分别指示生物炭的芳香性、亲水性与极性(Chen et al., 2005).由表 2可知, H/C原子比大小顺序为BC300>BC500>BC700, 说明在制备生物炭的过程中, 脂肪炭热解形成芳香炭, 且温度越高, 热解越彻底, 芳香性越高, H/C原子比越低;O/C与(O+N)/C原子比的大小顺序为BC300>BC500>BC700, 温度升高, 二者原子比下降, 代表高温生物炭的极性官能团减少, 且比低温生物炭有着更好的疏水性(Chefetz et al., 2009).
比表面积及孔体积随着炭化温度的升高分别由2.87 m2·g-1、0.049 cm3·g-1增大到9.32 m2·g-1、0.152 cm3·g-1, 平均孔径从7.10 nm下降至2.26 nm.由图 3可知, 相比BC300、BC500, BC700表面拥有更多的微孔, 且孔径集中在2.0~2.4 nm.表明原料的裂解程度随着热解温度的升高而加剧, 孔隙结构也逐渐发育, 导致微孔逐渐增多, 孔隙度和比表面积增大.这与图 2的SEM分析结果一致.
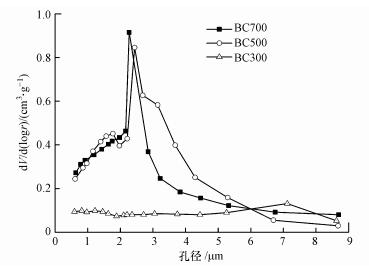 |
| 图 3 生物炭孔径分布 Fig. 3 Pore size distribution of biochars |
零电荷点pHpzc是指生物炭表面正负电荷相等时的pH值.本文研究了BC300、BC500和BC700的pHpzc变化情况, 结果见图 4.由图可知, BC300、BC500、BC700的pHpzc值分别为8.37、8.95、9.42.当pH溶液<pHpzc生物炭时, 生物炭表面呈正电性, 能够吸附溶液中的阴离子, pH溶液>pHpzc生物炭, 生物炭表面呈负电性, 能够吸附溶液中的阳离子.因此, pHpzc越高意味着溶液中吸附剂表面带有的正电荷的pH范围越大.
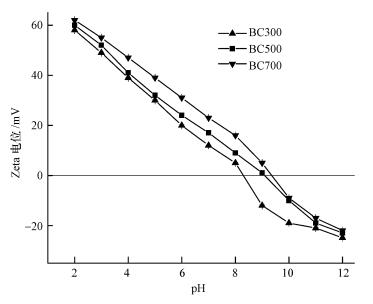 |
| 图 4 Zeta电位测定结果 Fig. 4 Zeta potential of biochars |
EP溶液的pH值作为影响吸附效果的重要控制参数之一, 能够影响生物炭表面电荷类型及被吸附EP的化学性质.实验考察了溶液pH为2~12时, BC300、BC500和BC700对EP去除效果的影响, 结果见图 5.从图 5可以看出, 3种生物炭在不同pH值溶液中对EP的去除趋势大致相同, 且主要分为2个阶段:第1阶段生物炭对EP的去除率随着pH值的升高而略有下降, 但基本保持不变;第2阶段EP的去除率随着pH值的升高而迅速降低.
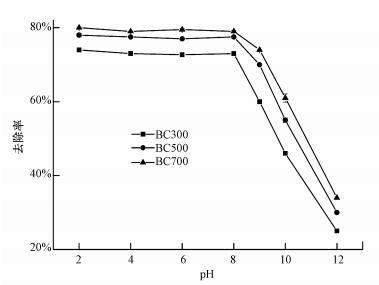 |
| 图 5 pH值对生物炭吸附EP的影响 Fig. 5 Effects of pH on ethyl paraben adsorption onto biochars |
由表 1可知, EP的离解常数pKa值为8.22, 当EP溶液的pH值小于8.22时, EP以中性态分子形式存在, 此时, 生物炭对EP的吸附行为主要是吸附作用, 通过表面活性位点去除EP, 且BC700的表面活性位点相比于BC300较多, 因此, 对EP的去除率相对较高;当溶液pH值大于8.22时, EP离子化加强, 以阴离子团形式存在, 又由于3种生物炭的pHpzc分别为8.37、8.95、9.42, 生物炭的表面电负性增加, 二者之间的电荷排斥作用造成了吸附率的快速下降.
3.4 离子强度对生物炭吸附EP的影响图 6为不同Ca2+强度下BC300、BC500、BC700对EP吸附速率的影响.从图中可以看出, 不同的离子强度对生物炭吸附速率的影响程度不同, 随着离子强度的增加, ct/c0不断升高, 也就是说生物炭对EP的吸附速率及吸附能力不断下降, 且3种生物炭吸附能力的大小顺序为:BC700>BC500>BC300.
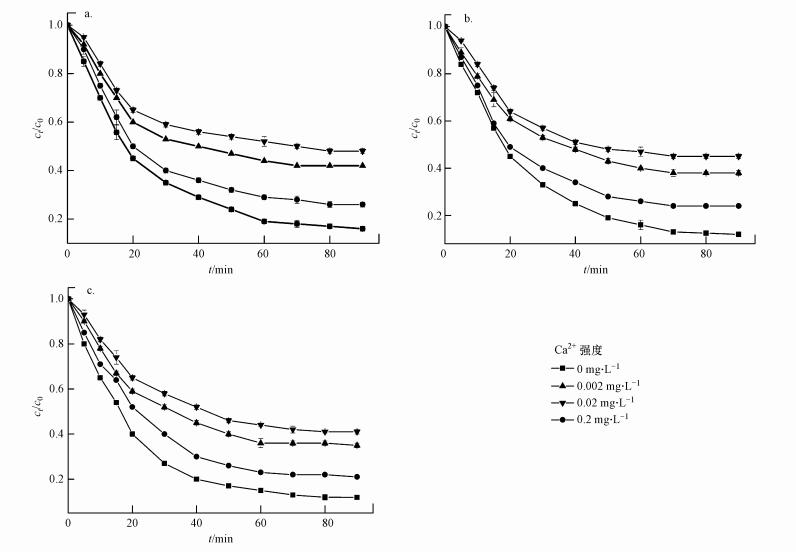 |
| 图 6 离子强度对生物炭吸附EP的影响(a.BC300, b.BC500, c.BC700) Fig. 6 Effects of ion concentration on ethyl paraben adsorption onto biochars |
究其原因可能有以下两点:① 生物炭在溶液中以微粒形态存在, 由于扩散双电层的排斥作用, 生物炭微粒不会团聚;② 加入一定强度的Ca2+, 使得粒子间扩散双电层的厚度受到压缩, 有可能使粒子团聚.当粒子团聚后, 吸附的活性点位数会随着加入的离子强度发生变化, 离子强度越强, 生物炭的收缩及孔隙越小, 吸附点位数也会随之减小;另外, 随着Ca2+的增加, 影响到生物炭之间发生团聚, 疏水力增强, 导致生物炭上的疏水位很难被EP分子接近, 降低了吸附性能.
3.5 其他吸附条件对生物炭吸附EP的影响除pH值、离子强度之外, 溶液初始浓度、温度、固/液比对于吸附效果也有一定的影响.在实验温度为25 ℃、生物炭投加量为0.02 g时, 对不同初始浓度EP溶液在3种生物炭上的吸附量进行了探究, 结果如图 7a所示.随着EP溶液初始浓度的增加, 生物炭对EP的平衡吸附量在逐渐增大, 而且曲线在EP低浓度范围内增加迅速, 在高浓度阶段, 增加幅度微小.初始浓度增加导致吸附效率降低, 这是由于实验中不同浓度吸附质溶液中投加的吸附剂量一定, 在高浓度的吸附质溶液中, 吸附剂表面的吸附点位有限.
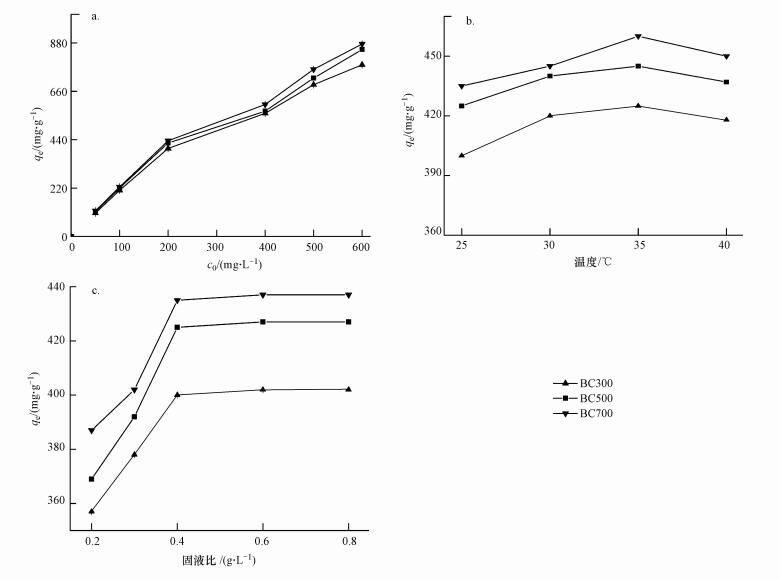 |
| 图 7 实验条件对EP的平衡吸附量的影响(a.初始浓度, b.温度, c.固液比) Fig. 7 Influence of experimental conditions on EP adsorbed amounts at equilibrium |
在初始浓度为200 mg·L-1、4种不同温度(25、30、35、40℃)下, 对3种生物炭吸附EP的性能进行了探究(图 7b).温度小于35 ℃时, 3种生物炭对EP的平衡吸附量都随着温度的升高而升高, 这是由于温度升高, 增强了生物炭吸附的推动力, 使得EP能更容易进入到其表面吸附位点进行吸附;温度超过35 ℃之后, 平衡吸附量呈现下降趋势, 这是由于温度升高, 造成了反应平衡点偏移至解吸方向, 解吸速率与吸附速率发生了改变, 造成了吸附效率的下降.
图 7c为固/液比对于平衡吸附量的影响, 由图可知, 吸附随着固液比的增加而增加.在吸附过程中, 一定浓度(200 mg·L-1)的EP中, 吸附剂投加量越多, 提供的可吸附点位越多, 生物炭对于EP的平衡吸附量就越高;当吸附点位足够多来吸附溶液中的EP时, 吸附剂的投加量达到饱和.从图中可以看出, 当固/液比大于0.4, 平衡吸附量趋于稳定.
3.6 吸附等温模型为了探究BC300、BC500、BC700对EP的吸附效果, 绘制了吸附过程的吸附等温曲线, 结果如图 8所示.由图 8可知, 随着温度的升高, 3种生物炭的平衡吸附量也有所增加, 但3种生物炭吸附EP的吸附曲线大致一致, 最开始随着EP的平衡吸附浓度增大, 平衡吸附量增大;当平衡吸附浓度达到一定值时, 平衡吸附量增长速度减慢;最后达到饱和.3种实验温度下, BC700吸附EP的平衡吸附量最大, BC300最低.这可能是因为高温制备的生物炭的碳含量增加, 芳香性加深, 疏水性强, 孔隙细小密集, 使得其吸附容量增大, 对EP吸附作用增强.
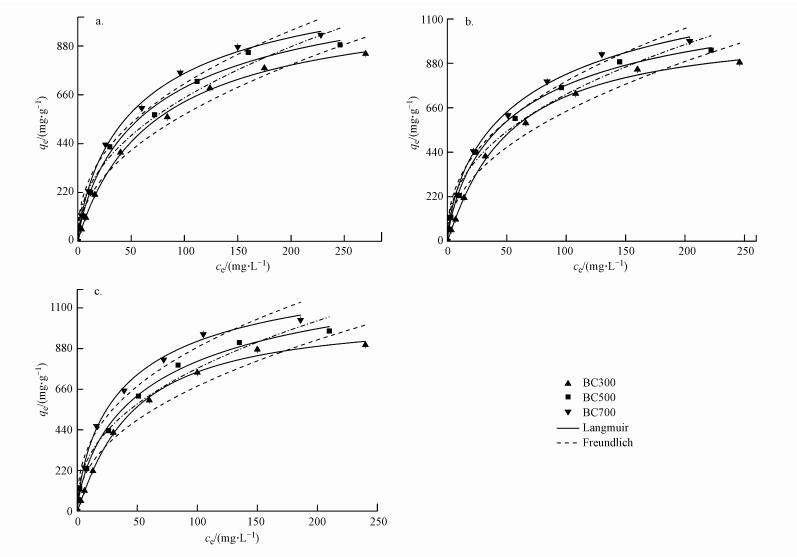 |
| 图 8 生物炭对EP的等温吸附曲线(a.25 ℃, b.30 ℃, c.35 ℃) Fig. 8 Isotherm fitting of ethyl paraben adsorption onto biochars |
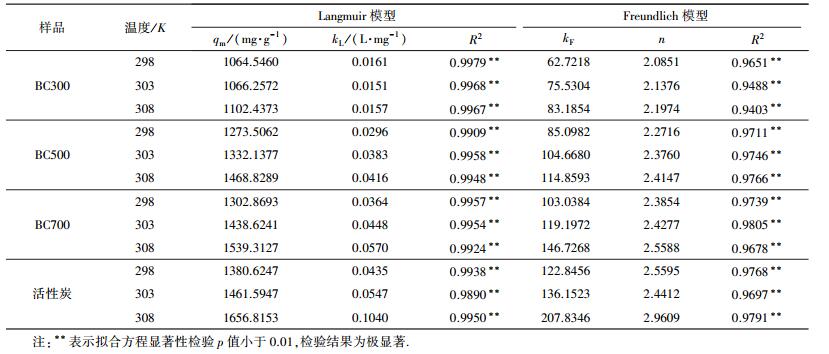
通过Langmuir与Freundlich等温模型对实验数据进行拟合, 拟合曲线及参数见图 8、表 3.从表中的R2可以看出, Langmuir与Freundlich等温模型均可以较好地拟合实验数据, 但Langmuir等温模型对吸附过程的拟合更好, R2均在0.99以上.结合图 8可知, Langmuir等温线与实验数据的拟合度更高, 能够更好地用于描述生物炭对EP的吸附行为.Langmuir等温线适用于单分子层吸附, 表明生物炭对EP的吸附过程是单分子层吸附.此外, 随着温度从298 K增加到308 K, 生物炭吸附EP的等温线在图 8中逐渐升高, 饱和吸附量依次增加, 在308 K时, 饱和吸附量分别为1102.4373、1468.8289、1539.3127 mg·g-1, 说明温度升高有利于生物炭对EP的吸附, 暗示该吸附过程为吸热过程.
| 表 3 生物炭对EP的等温吸附方程参数拟合值 Table 3 Fitting parameters of isotherm equations for adsorption of ethyl paraben onto biochars |
为了评价制备的生物炭对水溶液中EP的吸附性能, 还探究了活性炭在这3种温度下对水中EP的吸附等温模型, 以此来比较本研究所制备的生物炭与商用活性炭的吸附效果, 结果如图 9、表 3所示.由表 3可知, 活性炭在3种温度下对EP的最大吸附量qm分别为1380.6247、1461.5947和1656.8153 mg·g-1, 略高于BC700的最大吸附量qm(1302.8693、1438.6241和1539.3127 mg·g-1).但本研究生物炭的制备工艺与成本都优于活性炭, 表明利用农业秸秆等生物质制备的生物炭对EP的吸附效果较好且成本更低.
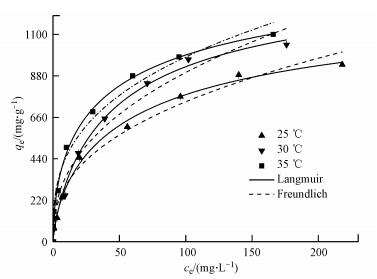 |
| 图 9 活性炭对EP的等温吸附曲线 Fig. 9 Isotherm of ethyl paraben adsorption onto Activated carbon |
生物炭对EP的吸附动力学曲线如图 10所示.由图可知, 生物炭对EP的吸附在初始阶段速率很快, 表明EP在刚开始能够迅速地进入生物炭表面的吸附点.这是由于吸附剂的剂量一定时, 初始浓度导致传质推动力增大, 能够更容易地将EP送入生物炭表面的活性位点进行吸附.随着吸附接触时间的增长, 溶液浓度不断下降, 生物炭表面的吸附点位被EP逐渐填满, 导致传质推动力降低, 速率开始逐渐减慢;当吸附点位趋于饱和, 使得后续EP离子不能进入吸附剂表面吸附位点, 从而吸附达到平衡.
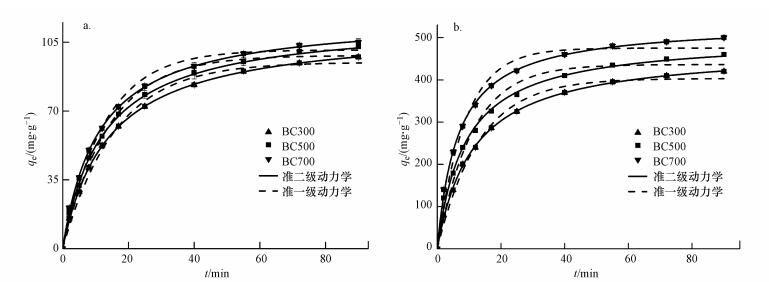 |
| 图 10 生物炭对EP的吸附动力学曲线(a.50 mg·L-1, b. 200 mg·L-1) Fig. 10 Adsorption kinetics of ethyl paraben adsorption onto biochars |
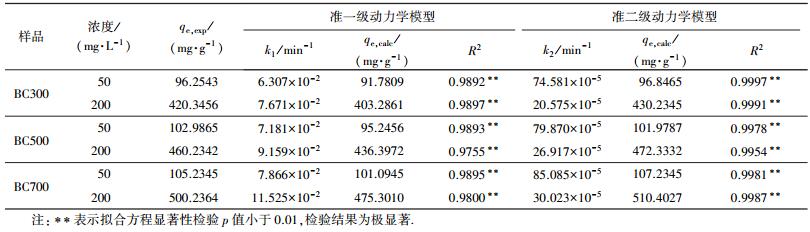
从图 10中还可以看出, 在整个吸附测试时间范围内, 准一级动力学方程仅在快速吸附阶段获得较好的拟合结果, 而准二级动力学方程在整个过程均与实验数据有较好的拟合;且从表 4可以看出, 用准二级动力学拟合得到的决定系数R2大于0.99, 计算所得的吸附量qe, cal与实验值qe, exp较为接近, 因此, 准二级动力学模型能更好地描述生物炭对EP的吸附过程.从表中还可看出, EP浓度为50 mg·L-1时, BC300、BC500与BC700的吸附速率常数K2高于EP浓度为200 mg·L-1时的吸附速率常数K2.这说明生物炭对EP的吸附能力可能与吸附点位有关, 低浓度的EP溶液中, 生物炭的吸附点位充足, 可保证EP进入吸附点位吸附;而高浓度的EP溶液中, 生物炭的吸附点位有限, 吸附逐渐趋于饱和状态后, 吸附速率降低, 吸附能力减弱.不同温度下3种生物炭的平衡吸附量呈现BC700>BC500>BC300.这是由于低温制备的生物炭官能团丰富, 孔隙较大且疏松, 此时生物炭对EP的吸附主要以分配作用为主;而高温制备的生物炭官能团较少, 主要靠微孔隙吸附, 此时的分配作用已经转变为表面吸附.从拟合得到的数据来看, 高温制备的生物炭对EP的吸附效果最好, 说明EP在生物炭上的吸附主要靠表面孔隙填充吸附.
| 表 4 生物炭对EP的吸附动力学方程参数值 Table 4 Fitting parameters of kinetic equations for adsorption of ethyl paraben onto biochars |
图 11为EP在生物炭的粒内扩散模型图.如图所示, 3种生物炭对EP吸附过程曲线呈现多级线性关系.第1阶段中EP吸附量随t0.5不断增加, 说明液相主体中的EP通过边界层扩散迅速聚集到生物炭表面, 并且BC300表面含有丰富官能团, 孔隙较大, 主要发生的是边界层上的大孔隙扩散;BC500和BC700中官能团逐渐消失, 微孔增多(贾明云等, 2014), 主要发生微孔隙扩散.第2阶段相比第1阶段趋势线的斜率变小, 吸附量增加变慢, EP通过颗粒内扩散进入生物炭孔内部, 并发生表面吸附, 颗粒内扩散过程是3种生物炭吸附的速率控制步骤.第3阶段的斜率几乎为零, 说明此时吸附趋于饱和, 溶液浓度不断减小, 吸附点位趋于饱和, 固液相分配逐渐平衡, 吸附达到平衡状态.
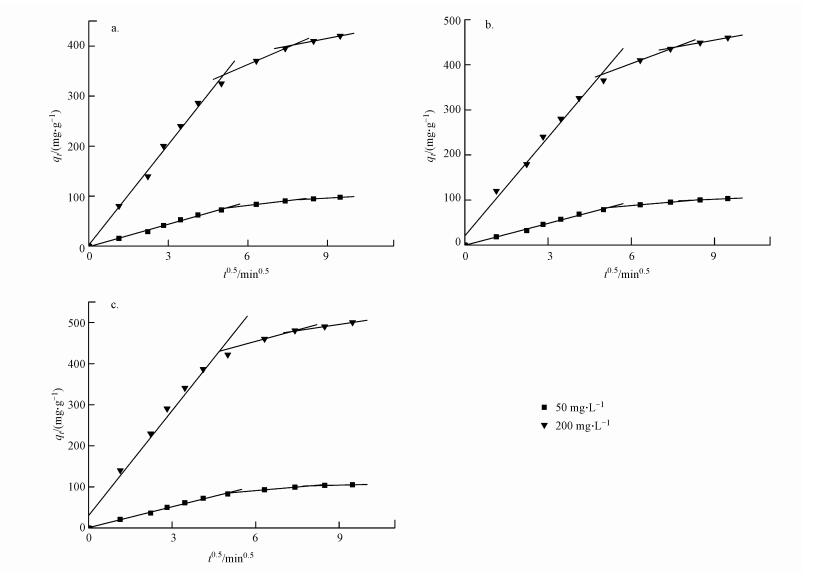 |
| 图 11 生物炭对EP的粒内扩散模型(a.BC300, b.BC500, c.BC700) Fig. 11 Intraparticle diffusion model for adsorption of ethyl paraben onto biochars |
一般认为, 粒内扩散模型图呈现2种结果(Jimena et al., 2015):一种是内扩散模型图为一条直线, 此时吸附过程受粒子内扩散控制, 若这条直线通过原点说明粒子内扩散为唯一的决速步骤;另一种呈现多段线性, 说明吸附过程复杂且受多个决速步骤控制.由图 11可知, EP在生物炭的吸附速率受颗粒内扩散控制, 但不是唯一的速率控制步骤.
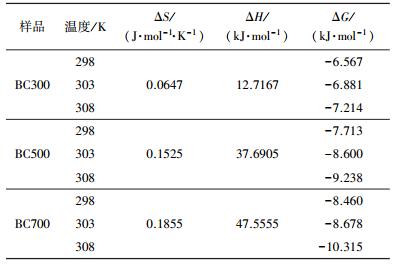
3.8 吸附热力学模型热力学参数结果列于表 5.从表 5可以看出, 不同温度下生物炭ΔG均为负值, 且温度越高, ΔG越小, 说明生物炭吸附EP的过程是一个自发的过程.并且在同一温度下, ΔG的大小顺序为:ΔG(BC700)> ΔG(BC500)>ΔG(BC300), 说明生物炭的烧制温度越高, 吸附自发性越强, EP就越容易被吸附到生物炭上, 这与图 5中提到的BC700吸附平衡量高于BC500、BC300的结果一致.生物炭吸附EP的焓变ΔH为正, 表明反应是吸热反应, 数值变化在12.7167~47.5555 KJ·mol之间, 表明吸附过程主要以物理吸附为主, 这与吸附前后的FTIR变化一致.熵变ΔS为正, 说明吸附过程在固液界面的无序性增加.
| 表 5 生物炭对EP的热力学模型参数值 Table 5 Fitting results of thermodynamic model for adsorption of ethyl paraben onto biochars |
为了考察吸附后生物炭的再生效果, 选择不同体积分数的乙醇溶液对饱和吸附后的生物炭进行了解析实验, 结果如图 12所示.由图可知, 在水溶液中体积分数不同的乙醇溶液解析生物炭的再生效率不同, 乙醇的体积分数越高, 解析效率越好.100%乙醇溶液解析效率达到90%以上, 根据相似相容原理, 乙醇溶液相比生物炭对EP具有更强亲和力, 乙醇的体积分数越高, 生物炭上EP就越容易被萃取, 进而恢复生物炭吸附容量, 因此, 本次再生剂采用100%乙醇溶液.
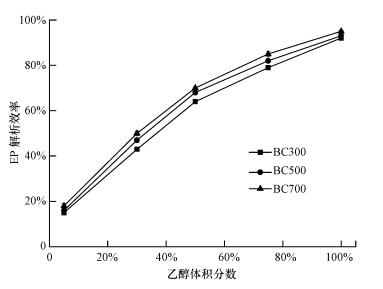 |
| 图 12 不同体积分数的乙醇对EP解析效率的影响 Fig. 12 Effects of alcohol concentration on ethyl paraben adsorption |
为了考察再生后生物炭对EP的吸附稳定性, 利用100%乙醇溶液的再生溶液, 对饱和吸附后的生物炭进行3次吸附解析的实验, 研究化学再生次数对吸附效果的影响, 结果如表 6所示.研究发现, 3轮吸附解析处理后, BC300、BC500、BC700对EP的吸附容量仍然能够达到375.5419、384.5775、390.1234 mg·g-1, 3种生物炭再生效率分别达到90.14%、92.13%、92.76%.这表明生物炭对EP的吸附容量受再生的次数影响较小, 吸附稳定性较好.
| 表 6 生物炭对EP的再生吸附效率 Table 6 Regeneration adsorption efficiency for adsorption of ethyl paraben onto biochars |
1) BC300、BC500、BC700生物炭对EP的吸附分为3个阶段:快速吸附过程、吸附速率减小过程及吸附平衡过程;饱和吸附量分别为1102.4373、1468.8289和1539.3127 mg·g-1;吸附符合Langmuir等温方程, 遵循准二级动力学方程, 是自发吸热的吸附过程.吸附速率受颗粒内扩散控制, 但并不是唯一的因素.
2) 溶液pH值为酸性及弱碱性条件时(pH<9), BC300、BC500、BC700对EP吸附的影响较小;当pH值>9时, EP去除率随着pH值升高而迅速降低;随着溶液中离子强度的增大, 吸附效率减小.
3) 再生吸附试验表明, 乙醇体积分数越高, 生物炭再生效率越高, 3轮再生生物炭吸附EP后的再生效率分别达到90.14%、92.13%、92.76%.
4) 3种生物炭对EP的吸附机制包括表面吸附作用及分配作用, 低温制备的生物炭BC300官能团丰富, 孔隙较大且疏松, 此时生物炭对于EP的吸附主要以分配作用为主, 而高温制备的生物炭BC700官能团较少, 主要靠微孔隙吸附, 此时的分配作用已经转变为表面吸附.从吸附效率来看, BC700>BC500>BC300, 说明吸附以表面吸附作用为主.
| [${referVo.labelOrder}] | Błędzka D, Gromadzińska J, Wąsowicz W. 2014. Parabens.From environmental studies to human health[J]. Environment International, 6: 27–42. |
| [${referVo.labelOrder}] | 鲍晓磊, 强志民, 贲伟伟, 等. 2013. 磁性纳米复合材料CoFeM48对水中磺胺类抗生素的吸附去除研究[J]. 环境科学学报, 2013, 33(2): 401–407. |
| [${referVo.labelOrder}] | 陈宝梁, 周丹丹, 朱利中, 等. 2008. 生物碳质吸附剂对水中有机污染物的吸附作用及机理[J]. 中国科学:B辑, 2008, 38(6): 530–537. |
| [${referVo.labelOrder}] | Brausch J M, Rand G M. 2011. A review of personal care products in the aquatic environment: environmental concentrations and toxicity[J]. Chemosphere, 82(11): 1518–1532. DOI:10.1016/j.chemosphere.2010.11.018 |
| [${referVo.labelOrder}] | Cantrell K B, Hunt P G, Uchimiya M, et al. 2012. Impact of pyrolysis temperature and manure source on physicochemical characteristics of biochar[J]. Bioresource Technology, 107: 419–428. DOI:10.1016/j.biortech.2011.11.084 |
| [${referVo.labelOrder}] | Cao X D, Harris W. 2010. potential of dairy-manure-derived biochar pertinent to its properties use in remediation[J]. Bioresource Technology, 101(14): 5222–5228. DOI:10.1016/j.biortech.2010.02.052 |
| [${referVo.labelOrder}] | Cao X D, Ma L N, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 43(9): 3285–3291. |
| [${referVo.labelOrder}] | Chefetz B, Xing B S. 2009. Relative role of aliphatic and aromatic moieties as sorption domains for organic compounds: a review[J]. Environment Science Technology, 43(6): 1680–1688. DOI:10.1021/es803149u |
| [${referVo.labelOrder}] | Chen B L, Chen Z M. 2009. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures[J]. Chemosphere, 76(1): 127–133. DOI:10.1016/j.chemosphere.2009.02.004 |
| [${referVo.labelOrder}] | Chen B L, Johnson E J, Chefetz B, et al. 2005. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials: role of polarity and accessibility[J]. Environmental Science & Technology, 39(16): 6138–6146. |
| [${referVo.labelOrder}] | Chun Y, Sheng G Y, Chiou C T, et al. 2004. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 38(17): 4649–4655. |
| [${referVo.labelOrder}] | Esben W B, Henrik H N, Norazana I, et al. 2013. Influence of fast pyrolysis temperature on biochar labile fraction and short-term carbon loss in a loamy soil[J]. Biomass and Bioenergy, 35(3): 1182–1189. |
| [${referVo.labelOrder}] | Fang B, Wang T, Chen X, et al. 2015. Modeling vibrational spectra of ester carbonyl stretch in water and dmso based on molecular dynamics simulation[J]. Journal of Physical Chemistry B, 119(38): 12390–12396. DOI:10.1021/acs.jpcb.5b06541 |
| [${referVo.labelOrder}] | Francioso O, Sanchez-Cortes S, Bonora S, et al. 2011. Structural characterization of charcoal size-fractions from a burnt pinus pinea forest by ftir, raman and surface-enhanced raman spectroscopies[J]. Journal of Molecular Structure, 994(1/3): 155–162. |
| [${referVo.labelOrder}] | Galinaro C A, Pereira F M, Vieira E M. 2015. Determination of parabens in surface water from Mogi Guaçu River(São Paulo, Brazil) using dispersive liquid-liquid microextraction based on low density solvent and LC-DAD[J]. Journal of the Brazilian Chemical Society, 26: 2205–2213. |
| [${referVo.labelOrder}] | Guo M X, Song W P. 2011. Quality variations of poultry litter biochar generated at different pyrolysis temperatures[J]. Journal of Analytical and Applied Pyrolysis, 94(94): 138–145. |
| [${referVo.labelOrder}] | Guo Y, Kannan K. 2013. A survey of phthalates and parabens in personal care products from the United States and its implications for human exposure[J]. Environmental Science Technology, 47(24): 14442–14449. DOI:10.1021/es4042034 |
| [${referVo.labelOrder}] | He H, Qian T T, Liu W J, et al. 2014. Biological and chemical phosphorus solubilization from pyrolytical biochar in aqueous solution[J]. Chemosphere, 113: 175–181. DOI:10.1016/j.chemosphere.2014.05.039 |
| [${referVo.labelOrder}] | Jeffrey M N, Isabel L, Xing B S, et al. 2009. Characterization of designer biochar produced at different temperatures and their effects on a loamy sand[J]. Annals of Environmental Science, 3: 195–206. |
| [${referVo.labelOrder}] | Jimena B D, Cynthia S, Noemi E Z. 2015. chromium removal in contaminated water using reticulated chitosan micro/nanoparticles from seafood processing wastes[J]. Chemosphere, 141: 100–111. DOI:10.1016/j.chemosphere.2015.06.030 |
| [${referVo.labelOrder}] | Joseph J, Jemmis E D. 2007. Red-, blue-, or no-shift in hydrogen bonds: A unified explanation[J]. Journal of the American Chemical Society, 129(15): 4620–4632. DOI:10.1021/ja067545z |
| [${referVo.labelOrder}] | 贾明云, 王芳, 卞永荣, 等. 2014. 秸秆生物质炭吸附溶液中Cu2+的影响因素研究[J]. 土壤, 2014, 46(3): 489–497. |
| [${referVo.labelOrder}] | Keiluweit M, Nico P S, Johnson M G, et al. 2010. Dynamicm olecular structure of plant biomass-derived black carbon(biochar)[J]. Environmental Science & Technology, 44(4): 1247–1253. |
| [${referVo.labelOrder}] | Liang B, Lehmann J, Solomon D, et al. 2006. Black carbon increases cation exchange capacity in soils[J]. Soil Science Society of America Journal, 70(5): 1719–1730. DOI:10.2136/sssaj2005.0383 |
| [${referVo.labelOrder}] | Lu J H, Li J F, Li Y M, et al. 2012. Use of rice straw biochar simultaneously as the sustained release carrier of herbicides and soil amendment for their reduced leaching[J]. Agriculture Food Chemistry, 60(26): 6463–6470. DOI:10.1021/jf3009734 |
| [${referVo.labelOrder}] | Mohamed A W, Salah J, Naceur J. 2010. Ammonium biosorption onto sawdust:FTIR analysis, kinetics and adsorption isotherms modeling[J]. Bioresource Technology, 101(14): 5070–5075. DOI:10.1016/j.biortech.2010.01.121 |
| [${referVo.labelOrder}] | Rajapaksha A U, Vithanage M, Zhang M, et al. 2014. Pyrolysis condition affected sulfamethazine sorption by tea waste biochars[J]. Bioresource Technology, 166: 303–308. DOI:10.1016/j.biortech.2014.05.029 |
| [${referVo.labelOrder}] | Sun L, Chen D M, Wan S G, et al. 2015. Performance, kinetics, and equilibrium of methylene blue adsorption on biochar derived from eucalyptus saw dust modified with citric, tartaric, and acetic acids[J]. Bioresource Technology, 198: 300–308. DOI:10.1016/j.biortech.2015.09.026 |
| [${referVo.labelOrder}] | Tan X F, Liu Y G, Zeng G M, et al. 2015. Application of biochar for the removal of pollutants from aqueous solutions[J]. Chemosphere, 125: 70–85. DOI:10.1016/j.chemosphere.2014.12.058 |
| [${referVo.labelOrder}] | Wang C, Lu H H, Dong D, et al. 2013. Insight into the effects of biochar on manure composting: evidence supporting the relationship between N2O emission and denitrifying community[J]. Environmental Science & Technology, 47(13): 7341–7349. |
| [${referVo.labelOrder}] | Wardle D A, Nilsson M C, Zackrisson O. 2008. Fire-derived charcoal causesloss of forest humus[J]. Science, 320(5876): 629–629. DOI:10.1126/science.1154960 |
| [${referVo.labelOrder}] | Xu P, Sun C X, Ye X Z, et al. 2016. The effect of biochar and crop straws on heavy metal bioavailability and plant accumulation in a Cd and Pb polluted soil[J]. Ecotoxicology and Environmental Safety, 132: 94–100. DOI:10.1016/j.ecoenv.2016.05.031 |
| [${referVo.labelOrder}] | Yang W B, Lu Y P, Zheng F F, et al. 2012. Adsorption behavior and mechanisms of norfloxacin onto porous resins and carbon nanotube[J]. Chemical Engineering Journal, 179: 112–118. DOI:10.1016/j.cej.2011.10.068 |
| [${referVo.labelOrder}] | 张立永, 贾树妍, 肖光辉, 等. 2007. 应用Zeta电位研究液态奶的稳定机制[J]. 中国乳品工业, 2007, 35(12): 38–41. DOI:10.3969/j.issn.1001-2230.2007.12.011 |
 2017, Vol. 37
2017, Vol. 37