船舶排放的污染物已经成为港口城市大气污染的重要来源之一(马冬等, 2014).MARPOL公约于1997年新增附则Ⅵ—防止船舶造成大气污染规则(林剑锋, 2006), 2016年1月1日起, MARPOL公约Tier Ⅲ已生效, 对于转速范围低于130 RPM的船舶柴油机, 在NOx排放控制区内所排废气中NOx限值将由14.4 g·kW-1·h-1降为3.4 g·kW-1·h-1, 降幅接近80%.我国也将在珠三角、长三角、环渤海(京津冀)水域设立船舶排放控制区, 控制船舶硫氧化物、氮氧化物和颗粒物排放.船舶尾气中的NOx会引起酸雨、光化学烟雾, 臭氧层破坏以及温室效应等问题(Sun et al., 2016; 郭静等, 2011), 其排放控制已刻不容缓.
目前NOx主要脱除技术为SCR(于国峰等, 2012), 但由于船舶空间有限, 脱硫脱硝一体化技术更具前景(Sun et al., 2016).湿法脱硝技术与烟气脱硫技术(FGD)相结合可高效的同时脱硫脱硝.湿法脱硝技术的关键是如何有效地将NO氧化为NO2, 目前常用的氧化剂为臭氧(O3)(马强等, 2016)、过氧化氢(H2O2)(Liu et al., 2010; 彭敦亮等, 2011)、高锰酸钾(KMnO4)(郭瑞堂等, 2010)、络合亚铁(FeⅡEDTA)(王慧等, 2007)、次氯酸钠(NaClO)(肖灵等, 2011)、亚氯酸钠(NaClO2)(Zhao et al., 2010)等.其中NaClO2氧化性能较好, 许多学者现已对它开展了大量的实验研究.刘凤等在酸性NaClO2溶液中进行了同时脱硫脱硝实验, 利用光化学方法分析了脱硫脱硝产物并阐述了酸性NaClO2溶液脱硫脱硝机理(刘凤等, 2008).秦毅红等在自制鼓泡反应器中研究了NaClO2在碱性溶液中的脱硝反应并进行了吸收反应的热力学计算(秦毅红等, 2012).叶春波等研究了NaClO2水溶液在小型填料塔中脱硝的工艺条件和反应机理(叶春波等, 2016).赵静等在喷淋吸收塔上进行了NaClO2/NaClO混合液同时脱硫脱硝实验, 探讨了复合吸收剂之间的相互作用机理以及脱硫脱硝反应过程(赵静等, 2012a; 赵静, 2012b).
由于NaClO2在脱硝过程中易分解产生氧化性更强的ClO2.如果溶液pH值过低, NaClO2会大量分解, 参与脱硝反应剩余的ClO2将会随烟气进入大气, 降低使用效率, 污染环境(Wei et al., 2009).对于船舶柴油机废气脱硝, 若采用NaClO2淡水溶液, 淡水需求量将十分巨大, 此外还需设置专用舱室放置, 这将严重影响船舶运营的经济性和安全性.船舶航行于大海, 海水取用非常便利.因此, 从经济性和便利性角度, NaClO2海水溶液更适用于船舶柴油机废气脱硝.海水具有天然的碱性和良好的缓冲性能, NaClO2氧化性很强, NaClO2海水溶液有望实现脱硫脱硝一体化技术.本文研究了在循环喷淋条件下NaClO2模拟海水溶液对NO脱除情况, 并分析了反应后溶液中主要成分, 计算了NaClO2利用率.
2 实验部分(The experiment part) 2.1 实验材料实验所用的气体为N2(纯度99.99%)和NO标准气体(纯度10%).所用药品包括亚氯酸钠(NaClO2)、氯化钠(NaCl)、六水氯化镁(MgCl2· 6H2O)、硫酸钠(Na2SO4)、氯化钙(CaCl2)、氯化钾(KCl)、碳酸氢钠(NaHCO3)、氢氧化钠(NaOH)和盐酸(HCl).所用药品都是分析纯试剂(AR), 所使用的NaClO2(纯度80%)为上海阿拉丁生化科技股份有限公司生产.本实验中所述的淡水均为去离子水, 去离子水由二级去离子水机(PURELAB Option, ELGA LabWater)制备, 其电阻率为15 MΩ· cm.
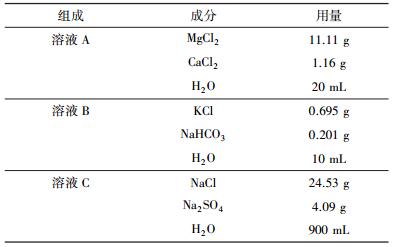
实验所使用的海水为模拟海水, 模拟海水根据美国国标ASTM D1141-98(ASTM, 2008)配制, 在淡水中加入多种主要药品, 使得溶液的各项指标接近天然海水的指标.表 1为实验中1 L模拟海水的配制方法.将11.11 g MgCl2和1.16 g CaCl2溶于20 mL淡水中, 配制成溶液A; 将0.695 g KCl和0.201 g NaHCO3溶于10 mL淡水中, 配制成溶液B; 将24.53 g NaCl和4.09 g Na2SO4溶于900 mL淡水中, 配制成溶液C.溶液C置于磁力搅拌器上连续搅拌, 将溶液A和B分别缓慢加入到溶液C, 再向溶液中加入少量淡水直至溶液体积为1 L.用0.2 mol·L-1 NaOH调节溶液的pH值至8.2.
| 表 1 1 L模拟海水中药品成分及用量 Table 1 The composition and dosage of 1 L simulated seawater |
实验所用NaClO2溶液(5、10、15、20 mmol·L-1)分别用模拟海水和淡水配制, 为研究NaClO2模拟海水溶液和NaClO2淡水溶液缓冲性区别, 用0.2 mol·L-1的HCl分别对NaClO2模拟海水溶液和NaClO2淡水溶液进行滴定实验.
2.2 实验装置和流程图 1为本实验的装置和流程图.本实验主要由模拟烟气系统、循环喷淋反应系统和烟气分析系统组成.来自钢瓶的N2和NO经过质量流量控制器后在混合器内混合, 混合后NO浓度为1227 mg·m-3, 混合气以1.25 L·min-1的流速进入到喷淋反应器内, 由于所使用喷淋塔为空塔, 因此气体经过反应器后的压降极小, 可以忽略不计.喷淋反应器高度为300 mm, 内径为50 mm, 顶部安装有孔径为0.4 mm的喷头, 喷淋密度为2.72 m3·m-2·s-1, 雾化后颗粒直径约为80~100 μm, 气体在喷淋塔内的停留时间约为25 s.贮液槽内0.2 L的NaClO2溶液在恒温水浴锅的作用下温度保持在20 ℃, NaClO2溶液在蠕动泵的作用下被连续喷入到反应器与模拟烟气进行逆流反应, 蠕动泵的转速为200 r·min-1, 对应流量为0.32 L·min-1, 完成反应后的溶液重新回到贮液槽进行循环喷淋.采用pH测量仪在线监测溶液的pH值和温度.在喷淋反应器内经过洗涤后的烟气由上部出口进入到干燥管, 干燥管内装有CaCl2颗粒, 除湿后的烟气进入到烟气分析仪(GA-21, Madur)对脱硝后烟气中NO和NO2浓度进行分析.
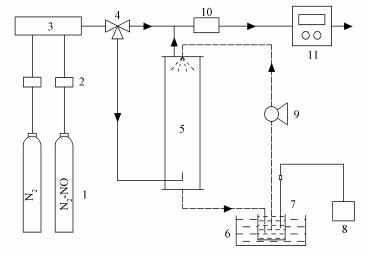 |
| 图 1 实验装置流程示意图(1.气瓶; 2.质量流量控制器; 3.混合器; 4.三通阀; 5.喷淋反应器; 6.恒温水浴锅; 7.贮液槽; 8.pH测量仪; 9.蠕动泵; 10.干燥管; 11.烟气分析仪) Fig. 1 Schematic diagram of the experimental setup (1.gas cylinder; 2.mass flow controller; 3.commingler; 4.three-way valve; 5.spraying reactor; 6.thermostat water bath; 7.storage tank; 8.pH meter; 9.peristaltic pump; 10.drying pipe; 11.gas analyzer) |
为了研究NaClO2模拟海水溶液和NaClO2淡水溶液脱硝反应的区别, 分别对20 mmol·L-1 NaClO2模拟海水溶液和20 mmol·L-1 NaClO2淡水溶液循环喷淋反应后的样品进行离子色谱(ICS-1500, Dionex)分析(赵毅等, 2009).由于模拟海水溶液中Cl-的浓度特别高, 导致无法直接使用离子色谱检测NaClO2模拟海水循环喷淋后的溶液.因此, 在进行离子色谱实验之前要先对样品溶液进行处理.首先将NaClO2模拟海水样品稀释100倍以减少银柱的消耗, 然后将稀释后的样品通过银柱以吸附溶液中大部分Cl-, 经银柱吸附后的溶液利用离子色谱进行分析.为了方便对比实验结果, NaClO2淡水样品在进行离子色谱分析之前也稀释100倍, 但不经过银柱吸附.
本实验中, NO脱除率计算见式(1).
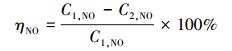
|
(1) |
式中, C1, NO为NO的初始浓度(mg·m-3), C2, NO为反应后NO的浓度(mg·m-3).
本文定义的NaClO2利用率见式(2).
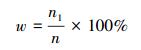
|
(2) |
式中, n1为参与NO吸收和氧化的NaClO2物质的量, n为溶液中NaClO2总的物质的量.
3 结果与讨论(Results and discussion) 3.1 脱硝对比实验NaClO2的脱硝机理主要是利用药品的强氧化性将NO氧化为NO2, NO2溶于水形成NO3-等.NO很难溶于水, 根据双膜理论, NO的氧化反应主要发生在液膜中.用体积为0.2 L的海水溶液和浓度分别为5、10、15、20 mmol·L-1的NaClO2淡水溶液和NaClO2模拟海水溶液进行循环喷淋脱硝实验.图 2为NO脱除率随时间的变化图, 所用溶液分别为模拟海水、20 mmol·L-1的NaClO2淡水溶液和20 mmol·L-1的NaClO2模拟海水溶液.由图 2变化可知, 当溶液为模拟海水时NO脱除率基本为0, 说明模拟海水本身对NO的脱除并不起作用.而20 mmol·L-1的NaClO2淡水和20 mmol·L-1的NaClO2模拟海水溶液都可将NO完全脱除, 且两种溶液在NO完全被脱除时的持续时间不同, NaClO2模拟海水溶液比NaClO2淡水溶液的持续时间多出约6 min.由于持续时间代表喷淋溶液对NO的吸收能力, 所以模拟海水的吸收能力要强于淡水.当溶液中NaClO2被完全耗尽后, NO脱除率迅速减至0.
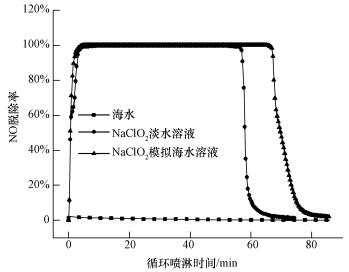 |
| 图 2 NO脱除率随循环喷淋时间变化情况 Fig. 2 The change of NO removal rate with recirculated scrubbing time |
图 3为NO完全被脱除时持续时间随NaClO2浓度的变化情况.在NaClO2浓度为5 mmol·L-1时, NO脱除率达不到100%, 所以此时的持续时间为0.由图 3可知, 在NaClO2浓度为10、15、20 mmol·L-1时模拟海水溶液的持续时间均大于同等浓度下淡水溶液的持续时间, 持续时间的提高幅度分别为19.7%、34.3%、23.1%.与淡水溶液相比, 每升模拟海水中含有419.74 mmol NaCl, 54.62 mmoL MgCl2, 28.79 mmol Na2SO4, 10.45 mmol CaCl2, 9.32 mmol KCl和2.39 mmol NaHCO3.除了以上6种盐类外, 还使用少量的NaOH调节溶液的pH值.模拟海水的成分并不复杂, 而且模拟海水不与NO直接发生反应, 之所以NaClO2模拟海水溶液可以延长持续时间, 是因为模拟海水溶液本身具有缓冲能力, 而这种缓冲能力主要是HCO3-和OH-的作用.为了验证淡水溶液和模拟海水溶液缓冲性能的区别, 用0.2 mol·L-1的HCl分别对20 mmol·L-1的NaClO2淡水溶液和NaClO2模拟海水溶液进行滴定实验.
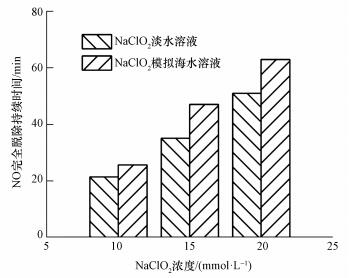 |
| 图 3 NO完全被脱除时持续时间随NaClO2浓度的变化关系 Fig. 3 The change of the duration with NaClO2 concentration when NO was completely removed |
图 4为20 mmol·L-1 NaClO2淡水溶液和NaClO2模拟海水溶液pH值随HCl滴加量的变化情况.由图 4可知NaClO2淡水溶液的初始pH值为10.5, 随着HCl的不断增加pH值急剧下降, 加入0.066 mmol的HCl就可以使0.2 L NaClO2淡水溶液的pH值降到7.NaClO2模拟海水溶液的初始pH值为8.6, 稍高于模拟海水的pH值.随着HCl不断加入到NaClO2模拟海水溶液中, 溶液的pH值下降缓慢, 需要加入0.114 mmol的HCl, 才能使溶液的pH值降到7.可见模拟海水对NaClO2溶液保持pH值的稳定非常有利.在模拟海水溶液的成分中, 能够起到缓冲作用的盐类主要是NaHCO3, HCO3-的水解反应过程见式(3)(Wei et al., 2009).
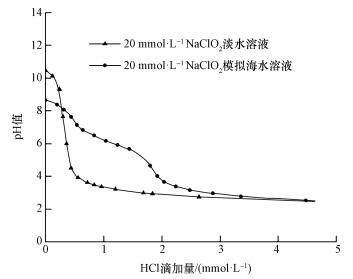 |
| 图 4 溶液pH值随HCl滴加量的变化 Fig. 4 The pH value change with the amount of HCl solution |
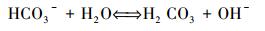
|
(3) |
模拟海水在NaOH和NaHCO3的共同作用下其pH值显碱性, 即便在H+的作用下, 水解方程式(3) 也会向右移动, 在一定程度维持pH值稳定, 直至溶液中的HCO3-被耗尽.
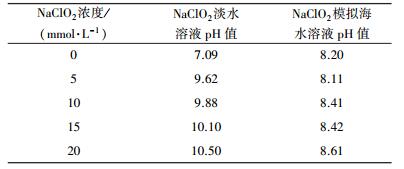
表 2为不同浓度的NaClO2淡水和NaClO2模拟海水溶液的初始pH值.淡水和模拟海水的pH值分别为7.09和8.20.同等浓度下, NaClO2淡水溶液的pH值均高于NaClO2模拟海水溶液的pH值, 且随着NaClO2浓度的不断升高, 两种溶液的pH值均有所提升.由于NaClO2为强碱弱酸盐, 在水溶液中会发生水解, 见式(4).
| 表 2 NaClO2溶液初始pH值 Table 2 The initial pH of NaClO2 solution |
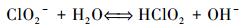
|
(4) |
随着ClO2-浓度的不断增大, 水解反应式(4) 会向右移动, 所以NaClO2淡水和NaClO2模拟海水溶液的pH值都会随NaClO2浓度的增大有所提高.
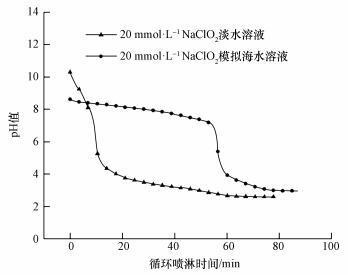
图 5为20 mmol·L-1的NaClO2淡水溶液和NaClO2模拟海水溶液循环喷淋过程中pH值随时间的变化情况.由图可知, 20 mmol·L-1的NaClO2淡水溶液循环喷淋开始后, 其pH值很快便降低到4以下, 其对NO的吸收反应基本上是在酸性环境下进行的.喷淋几分钟后可以观察到溶液中出现黄绿色, 且随着反应的持续, 颜色不断加深直至消失.所出现的黄绿色物质主要为ClO2, 它主要来自于NaClO2在酸性环境下的分解反应, 反应过程见式(5)(刘凤等, 2008).
 |
| 图 5 循环喷淋过程中pH值随时间的变化 Fig. 5 The variation of pH during recirculated scrubbing process |
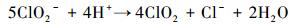
|
(5) |
ClO2是有效的中间产物, 它的氧化性比NaClO2要强, 并且极易溶于水, 可以在循环喷淋过程随溶液进入喷淋反应器参与NO吸收反应.
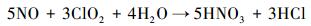
|
(6) |
当所产生的ClO2的量比较少时, 基本可以全部用于NO的氧化反应, 但当pH值过低, 大量的ClO2迅速产生时, 多余的ClO2来不及与NO反应就随模拟烟气一起流出, 降低了NaClO2的利用效率.另外, 据报道在酸性介质中(pH值为3.5~4.0), 还会发生如下反应(Brogren et al., 1998).
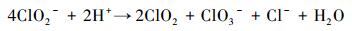
|
(7) |
形成ClO3-消耗了小部分ClO2-, 但对NO的氧化并没有起作用.
由图 5可知, 对于20 mmol·L-1的NaClO2模拟海水溶液, 由于模拟海水具有缓冲能力, 在整个循环喷淋过程中大部分时间溶液的pH值都大于7.在碱性和中性环境下非常有利于抑制ClO2的产生, 在碱性环境下NO直接被氧化为NO2, NO2被吸收(叶春波等, 2016), 吸收过程按照反应式(8) 进行.另外所产生的NO2还会与NO反应生成N2O3, 而NO、NO2、N2O3在水中的溶解度分别为0.032、213、500 g·dm-3(Skalska et al., 2009), 因此, NO2的产生可进一步促进NO的吸收.
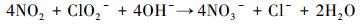
|
(8) |
因此, NaClO2模拟海水溶液在NO完全脱除时, 持续时间的增长, 主要是提高了NaClO2的利用率.在NaClO2淡水溶液中, NaClO2的分解和部分ClO2的逸出在一定程度降低了NaClO2的利用率.为了确定NaClO2的具体利用率, 选取浓度为20 mmol·L-1的溶液进行离子色谱分析, 以获取脱硝后模拟海水溶液和淡水溶液中各离子成分和浓度.
3.3 离子色谱实验离子色谱分析结果如图 6所示, 反应后溶液中未含有ClO2-, 说明在循环喷淋反应过程中ClO2-已经被耗尽.由图可知, NO被溶液吸收后主要生成NO3-, 模拟海水溶液中NO3-浓度明显高于淡水溶液.表明在循环喷淋反应过程中模拟海水溶液吸收了更多的NO, 提高了NaClO2的利用率.另外, 淡水溶液中还含有少量的ClO3-, 主要来自于反应(7).
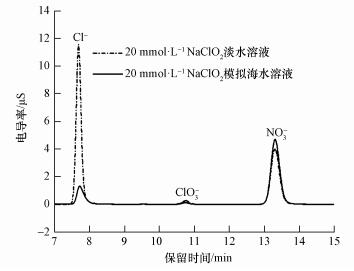 |
| 图 6 反应后吸收液离子色谱图 Fig. 6 The ion chromatograms of NaClO2 solution after reaction |
根据离子色谱分析结果可以近似计算在循环喷淋过程中NaClO2的利用率.模拟烟气中的NO最终转化为NO2和NO3-.NaClO2溶液的浓度为20 mmol·L-1, 体积为0.2 L, 溶液中所含NaClO2总的物质的量为4 mmol.NaClO2模拟海水溶液与NO的反应过程:
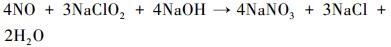
|
(9) |

|
(10) |
根据模拟烟气流量、流速以及循环喷淋反应时间可以计算出NO总的量为4.02 mmol.根据离子色谱检测结果可知溶液中共含有2.72 mmol NO3-离子, 计算出参与反应(9) 的NO和NaClO2的量分别为2.72 mmol、2.04 mmol, 剩余的1.3 mmol NO被氧化为NO2, 得出参与反应(10) 的NaClO2的量为0.65 mmol.因此, 在NaClO2模拟海水溶液中参与反应的NaClO2量为2.69 mmol, 按公式(2) 计算出在模拟海水中NaClO2的利用率为67.25%.同理, 按照如上所述的计算方法, 可以得出在循环喷淋反应过程中, 淡水溶液的NaClO2利用率为56%.与淡水溶液相比, 模拟海水溶液的NaClO2利用率提高约20.1%.
4 结论(Conclusions)1) 与NaClO2淡水溶液相比, 相同浓度下, 模拟海水溶液在NO完全脱除时的持续时间更长.模拟海水所含有的HCO3-和OH-可以有效抑制NaClO2溶液在酸性环境下的分解, ClO2逸出得到有效控制是模拟海水溶液循环喷淋过程中脱除时间提高的主要原因.
2) 脱硝后溶液的离子色谱分析结果可知, ClO2-主要转化为Cl-, 被吸收的NO基本全部生成NO3-.通过对NaClO2利用率的分析计算可知, 在NaClO2浓度为20 mmol·L-1时, 模拟海水溶液循环喷淋脱硝过程中对NaClO2的利用率比淡水溶液高出约20.1%.
3) 在实船应用中可以直接使用NaClO2海水进行船舶废气脱硝, 其对NaClO2的利用率要高于淡水, 在有限的船舶空间中可以减少淡水的携带量和造水机的产水量, 减小船舶能耗.
ASTM International. 2008.D1141-98.Standard practice for the preparation of substitute ocean water[S].West Conshohocken, PA:ASTM International
|
Brogren C, Karlsson H T, Bjerle I. 1998. Absorption of NO in an aqueous solution of NaClO2[J]. Chemical Engineering & Technology, 21(1): 61–70.
|
郭静, 李彩亭, 路培, 等. 2011. CeO2改性MnOx/Al2O3的低温SCR法脱硝性能及机制研究[J]. 环境科学, 2011, 32(8): 2240–2246.
|
郭瑞堂, 潘卫国, 任建兴, 等. 2010. KMnO4/NaOH溶液同时脱硫脱硝的热力学研究[J]. 华东电力, 2010, 38(1): 44–46.
|
林剑锋. 2006. 国际防污公约(MARPOL 73/78) 附则Ⅵ实施要求[J]. 船海工程, 2006, 35(3): 97–99.
|
刘凤, 赵毅, 王亚君, 等. 2008. 酸性NaClO2溶液同时脱硫、脱硝的试验研究[J]. 动力工程, 2008, 28(3): 425–429.
|
Liu Y X, Zhang J, Sheng C D, et al. 2010. Preliminary study on a new technique for wet removal of nitric oxide from simulated flue gas with an ultraviolet (UV)/H2O2 Process[J]. Energy & Fuels, 24(9): 4925–4930.
|
马冬, 丁焰, 尹航, 等. 2014. 我国船舶港口空气污染防治现状及展望[J]. 环境与可持续发展, 2014, 39(6): 40–44.
|
马强, 朱燕群, 何勇, 等. 2016. 活性分子O3深度氧化结合湿法喷淋脱硝机理试验研究[J]. 环境科学学报, 2016, 36(4): 1428–1433.
|
彭敦亮, 李彩亭, 路培, 等. 2011. UV/H2O2液相氧化净化烟气中NO的实验研究[J]. 环境科学, 2011, 32(4): 949–954.
|
秦毅红, 蔡守珂, 何汉兵, 等. 2012. NaClO2碱性溶液脱硝的热力学计算与实验研究[J]. 环境保护科学, 2012, 38(6): 1–5.
|
Sun Y X, Zwolińska E, Chmielewski A G. 2016. Abatement technologies for high concentrations of NOx and SO2 removal from exhaust gases: A review[J]. Critical Reviews in Environmental Science and Technology, 46(2): 119–142.
DOI:10.1080/10643389.2015.1063334
|
王慧, 李先国, 韩欣欣, 等. 2007. 金属络合剂在烟气同时脱硫脱硝中的应用[J]. 化工环保, 2007, 27(5): 421–425.
|
Wei J C, Yu P, Cai B, et al. 2009. Absorption of NO in aqueous NaClO2/Na2CO3 solutions[J]. Chemical Engineering & Technology, 32(1): 114–119.
|
肖灵, 程斌, 莫建松, 等. 2011. 次氯酸钠湿法烟气脱硝及同时脱硫脱硝技术研究[J]. 环境科学学报, 2011, 31(6): 1175–1180.
|
叶春波, 涂先红, 李朝恒, 等. 2016. NaClO2水溶液脱硝的工艺条件及机理[J]. 化学反应工程与工艺, 2016, 32(2): 176–182.
|
Skalska K, Miller J S, Ledakowicz S. 2010. Trends in NOx abatement: a review[J]. Science of the Total Environment, 408(19): 3976–3989.
DOI:10.1016/j.scitotenv.2010.06.001
|
于国峰, 韦彦斐, 金瑞奔, 等. 2012. Mn-Ce-Co/TiO2催化剂低温脱硝活性研究[J]. 环境科学学报, 2012, 32(7): 1743–1749.
|
赵静, 严金英, 邱婧伟, 等. 2012a. NaClO2/NaClO复合吸收液同时脱硫脱硝[J]. 环境工程学报, 2012a, 6(10): 3684–3688.
|
赵静. 2012b. NaClO2/NaClO复合吸收剂烟气脱硫脱硝一体化技术及机理研究[D]. 杭州: 浙江工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10337-1012513298.htm |
Zhao Y, Guo T X, Chen Z Y, et al. 2010. Simultaneous removal of SO2 and NO using M/NaClO2 complex absorbent[J]. Chemical Engineering Journal, 160(1): 42–47.
DOI:10.1016/j.cej.2010.02.060
|
赵毅, 韩静, 马天忠. 2009. 活性炭纤维负载TiO2同时脱硫脱硝实验研究[J]. 中国电机工程学报, 2009, 46(11): 44–49.
DOI:10.3321/j.issn:0258-8013.2009.11.008 |
 2017, Vol. 37
2017, Vol. 37