重金属镉具有潜伏期长、毒性高、难降解等特点(李婧等, 2015), 在20种严重威胁人体健康的元素中排名第7位, 是一种强致癌的重金属元素(Kumari et al., 2014; Mehta et al., 2016).在我国, 大量含镉工业"三废"的排放已导致严重的环境污染问题.我国部分地区的可耕地土壤镉污染物点位超标率达到7.0%(王玉军等, 2014), 全国镉污染的土壤面积已达2×105 km2, 占总耕地面积的1/6(顾继光等, 2002; 王艳娜等, 2014; Mori et al., 2016).同时, 因利用含镉污水进行灌溉, 东北等地已形成了土壤镉含量严重超标的灌污区(文秋红等, 2005).目前, 镉污染的治理方法主要有客土法、物理和化学法、超富集植物技术和微生物修复技术.客土法往往投资巨大, 后续处理污染土壤难度较大(周国华等, 2002); 物理和化学法治理镉污染水体和土壤往往会造成二次污染, 对水体和土壤的原始结构也会造成破坏(周东美等, 2003); 植物修复法可较好地保持土壤肥力和原始结构, 但存在周期较长、收割不便的缺点(Yang et al., 2005).微生物修复技术可以较好地避免以上方法存在的问题, 利用部分微生物的生物成矿作用, 使重金属离子形成稳定的矿物固定下来, 是微生物修复技术的重要手段(罗辉等, 2015).其中, 利用微生物诱导碳酸盐沉积(MICP)技术固定重金属离子已成为当前研究的热点.
产脲酶微生物可分泌脲酶, 脲酶水解尿素会形成CO32-和NH4+, 同时使环境的pH明显升高(许凤琴等, 2015; Fawzy et al., 2016).在偏碱性的条件下, Cd2+可与CO32-形成CdCO3, 进而使游离态Cd2+以碳酸盐的形式结晶富集, 最终固定下来(王瑞兴等, 2007; Mugwar et al., 2016), 从而达到治理镉污染的目的.Li等(2014)从土壤中分离筛选出了一株高效产脲酶菌株, 培养48 h后, 该菌株成功诱导溶液中的Ni2+、Cd2+、Cu2+等重金属离子形成碳酸盐沉淀, 重金属离子的固化去除率达88%~99%.许燕波等(2013)筛选出的产脲酶菌株, 通过形成碳酸盐沉淀, 对土壤中游离态Cd2+的去除率达51%, 对溶液中Sr2+的去除率达99%.Lin等(2016)分离出一种产脲酶的铜绿假单胞菌, 对镉含量为3 mg·kg-1的污染土壤进行修复后, 该土壤所产糙米中镉含量降低了31.2%.Hu等(2014)筛选的产脲酶芽孢杆菌, 对镉浓度为2 g·L-1溶液中Cd2+的去除率为98%.虽然国内外对MICP技术研究较多, 但目前的研究多数仍以筛选高效产脲酶菌株为主要研究目标, 对MICP技术的研究仍存在机理研究不足的问题.
因此, 本研究从土壤中分离出一株高效产脲酶菌株, 并测试该菌株诱导游离态Cd2+形成碳酸盐沉淀的能力, 同时分析产物的特性, 验证该菌株诱导Cd2+形成碳酸盐的机理, 以期为利用产脲酶菌治理含镉废水奠定技术基础.
2 材料及方法(Materials and methods) 2.1 实验材料菌株来源:采集武汉理工大学花木种植园中深度5~20 cm处的土壤样本, 经富集培养(李萌等, 2013)后, 从富集培养液中分离具有产脲酶能力的菌株.分离菌株培养24 h后, 检测培养液的菌浓度(OD600)和氨氮浓度, 选取产脲酶能力最强的菌株进行研究, 并参考王洋洋等(2013)的实验方法对该菌株的生理生化特征进行研究.
产脲酶菌株筛选分离培养基:蛋白胨1 g·L-1, 氯化钠5 g·L-1, 磷酸二氢钾2 g·L-1, 尿素2 g·L-1, 葡萄糖0.1 g·L-1, 0.2%的酚红溶液4 mL·L-1, pH=7.固体培养基添加20 g·L-1的琼脂.其中, 尿素和葡萄糖分别单独配制为溶液灭菌后, 加入灭菌后的培养基(李萌等, 2013).
产脲酶菌株生长培养基:蛋白胨1 g·L-1, 氯化钠5 g·L-1, 磷酸二氢钾2 g·L-1, 尿素2 g·L-1, 葡萄糖0.1 g·L-1, pH=7.尿素和葡萄糖灭菌方式与产脲酶菌株筛选分离培养基相同.
LB培养基:蛋白胨10 g·L-1, 酵母浸出粉5 g·L-1, 氯化钠10 g·L-1, pH=7.
2.2 实验方法 2.2.1 菌株培养从保存产脲酶菌株的LB培养基斜面上挑取部分菌苔, 接种到150 mL的产脲酶菌株生长培养液中, 置于37 ℃、140 r·min-1的恒温摇床中培养.使用分光光度法和HACH哈希2100P便携式浊度仪, 每2 h测量一次培养液的OD600和浊度.同时, 每4 h测量一次培养液中尿素和氨氮浓度, 检测方法分别为对二甲氨基苯甲醛显色分光光度法(苗晓杰等, 2011)和苯酚钠-次氯酸钠分光光度法(郭立新, 2007).使用CT-6021A笔式酸度计和TP320便携式电导率仪, 每2 h测一次培养液的pH和电导率.
2.2.2 固化实验从保存产脲酶菌株的LB培养基斜面上挑取部分菌苔, 接种到150 mL灭菌后的产脲酶菌株生长培养液中, 培养液中补加0.1 g·L-1 Cd2+, 置于37 ℃、140 r·min-1的恒温摇床中培养.每12 h检测一次培养液的Cd2+浓度和OD600, 其中, Cd2+浓度检测采用高连斌等(2006)的检测方法.培养结束后, 将溶液过滤, 截留的固化产物用蒸馏水洗涤3次, 置60 ℃干燥箱中干燥12 h后备用.
2.2.3 固化产物的检测固化产物的形貌特征采用场发射扫描电子显微镜系统(SEM, JSM-IT300型)进行检测, 其结晶性分析采用X射线衍射仪(XRD, D8 Adwance型), 其红外分析采用傅里叶变换红外光谱仪(FTIR, Nicolet6-700型).
固化产物的耐酸性检测参考Li等(2013)的实验方法.依次配制pH为0.5~5.5的盐酸溶液, 从pH为5.5的盐酸溶液开始, 滴3~5滴盐酸溶液于固化产物上, 用放大镜仔细观察2 min, 若有固化产物上有气泡产生, 则其耐受的酸度就为所使用盐酸溶液的pH值的上一个梯度值; 若无气泡产生, 则使用下一个pH梯度的盐酸溶液继续滴定检测.
3 结果与讨论(Results and discussion) 3.1 菌株的产脲酶能力及其生理生化特性将从土壤中分离出的4株菌接种到产脲酶生长培养液中, 培养24 h后分别检测4组培养液的氨氮浓度和OD600, 结果如图 1所示.由图 1可知, 4株产脲酶菌中, 菌株UR-2所分泌的脲酶的活性最高, 24 h后该菌株的培养液中氨氮浓度达0.77 g·L-1, 尿素的水解率达72.3%.同时, 菌株UR-2的培养液最终的OD600为0.873, 菌浓度也较高.因此, 选用菌株UR-2作进一步的研究.
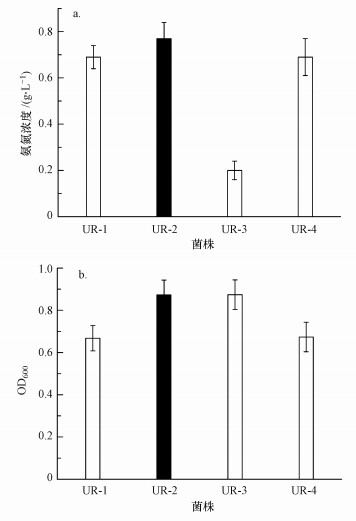 |
| 图 1 培养24 h后4株产脲酶菌株培养液的氨氮浓度(a)与OD600(b)对比 Fig. 1 Comparison chart of 4 kinds of bacteria about concentration of ammonia-nitrogen(a) and growth(b) after incubating for 24 h |
菌株UR-2的部分生理生化特性见表 1, 检测结果显示, 菌株UR-2为革兰氏阳性菌, 生长过程中可利用单糖果糖、葡萄糖和多糖淀粉作为碳源, 有一定的产酸能力.
| 表 1 产脲酶菌株UR-2的部分生理生化特性 Table 1 Physiological and biochemical characteristics of urease-producing bacteria UR-2 |
产脲酶菌株UR-2的生长曲线见图 2.由图可知, 初始的0~8 h是菌株UR-2生长过程的迟缓期; 8 h后菌株已适应培养液环境, 生长进入对数期, 细菌繁殖量呈几何级数增长, 培养液的OD600和浊度都急剧变大; 24 h后菌株生长到达稳定期, OD600和浊度达到最大值, 代谢产物的积累开始影响菌株的生长; 40 h之后, 菌株开始出现衰亡, OD600和浊度开始下降.
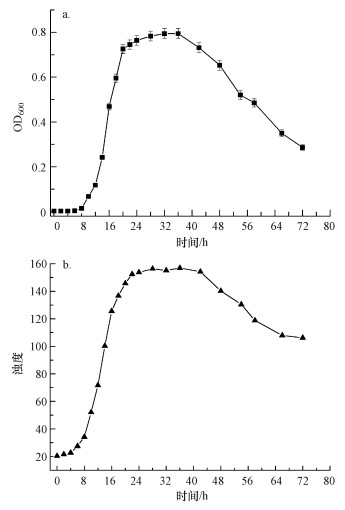 |
| 图 2 产脲酶菌株UR-2的生长曲线(a.OD600, b.浊度) Fig. 2 Growth curve of Urease-producing bacteria UR-2 |
产脲酶菌株分泌的脲酶可水解尿素, 产物为CO32-和NH4+, 通过检测培养进程中尿素和NH4+的浓度, 可确定培养液中脲酶活性.菌株UR-2培养过程中, 培养液中尿素和NH4+浓度的变化情况见图 3.从图 3中可以看出, 随培养时间的延长, 尿素在不断水解, 培养液中NH4+浓度从最初的0.022 g·L-1逐渐上升.特别是在8~24 h的菌株生长对数期, 尿素的水解速率和NH4+的生成速率达到最大, 预示对数期菌株产脲酶速率达到最大.28 h时, 菌株生长处于稳定期, 尿素水解率为82%, 培养液中NH4+浓度达到最大值, 为0.82 g·L-1, 相应的CO32-理论产量为1.45 g·L-1, 可为碳酸盐的形成提供足够的CO32-.
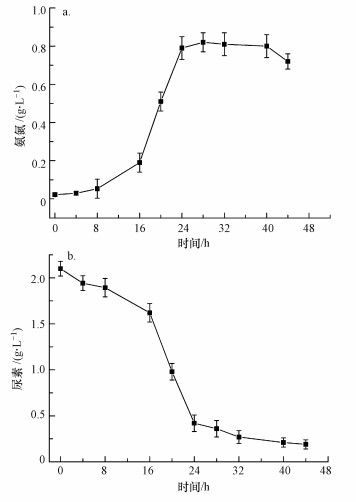 |
| 图 3 菌株UR-2培养进程中氨氮(a)和尿素(b)浓度的变化 Fig. 3 Changes of ammonia nitrogen(a) and urea(b) content in the urease-producing bacterial liquid |
图 4为菌株UR-2培养进程中pH和电导率变化曲线, 由于菌株分泌的脲酶大量水解尿素, 培养液的pH和电导率随培养时间延长不断上升.由图 4a可知, 在4~24 h, 培养液的pH上升最快, 从7.11迅速提高到9.07.此段时间菌株处于生长的对数期, 菌株生长繁殖迅速, 脲酶产率最高, 因而尿素的水解速率最快, 水解产物CO32-的大量产生使培养液的pH迅速上升.随着培养液中营养物质的消耗和代谢产物的积累, 细菌进入衰亡期, 培养液的pH逐渐趋于稳定.pH是影响碳酸盐形成的重要条件, 碱性条件有利于碳酸盐的形成, 产脲酶菌株最终可使培养液pH增加到9.15, 可为碳酸盐的形成提供有利条件.在图 4b中, 培养液电导率也同样随细菌的生长而上升, 并最终趋于稳定.在8 h后培养液的电导率迅速增长, 20 h时达到31.45 mS·cm-1, 之后电导率基本稳定.电导率的提高显示了培养液中离子数量的增加, 电导率在8~20 h快速上升也与该时段尿素大量水解的实验现象互相验证, 即尿素在脲酶催化下水解为CO32-和NH4+, 从而使培养液的电导率上升.
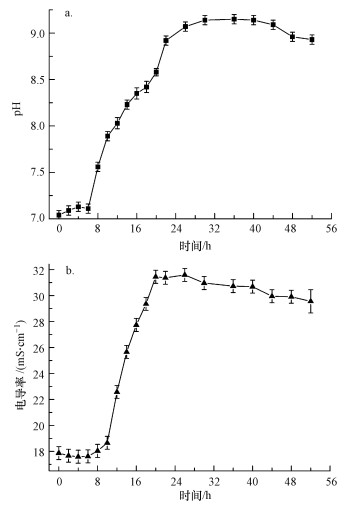 |
| 图 4 菌株UR-2培养进程中pH(a)和电导率(b)的变化 Fig. 4 Changes of pH(a) and conductivity(b) of the urease-producing bacterial culture broth |
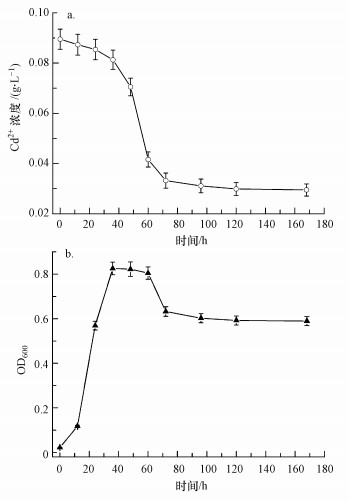
菌株UR-2固化培养液中Cd2+的进程见图 5.由图 5可知, 细菌的生长是其固化Cd2+的前提条件, Cd2+的固化与菌株产酶密切相关.溶液中初始Cd2+浓度低于投加值, 可能是部分Cd2+与培养液中磷酸盐形成沉淀所致.前36 h内, 细菌生长繁殖迅速, 但脲酶产量较低, 尿素水解产物CO32-较少, Cd2+的固化率较低, 仅为4.5%.36 h后, 细菌生长进入稳定期, 随着尿素水解量逐渐增大, 培养液中CO32-浓度提高, 细菌对Cd2+固化率迅速增大, 72 h时固化率已达63.5%.72 h后, 随着细菌开始衰亡, 固化率逐渐趋于稳定, 最终细菌对0.1 g·L-1的Cd2+固化率达70.5%, Cd2+浓度预示该菌株对镉污染水体具有修复治理潜能.
 |
| 图 5 菌株UR-2固化Cd2+的进程(a.Cd2+浓度, b.OD600) Fig. 5 Carbonate mineralization rates of Cd2+ by urease-producing bacteria during different time |
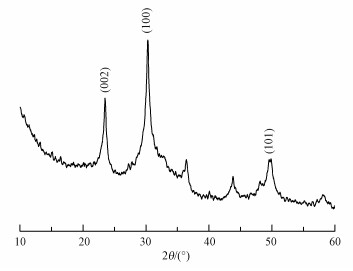
在标准谱图中, CdCO3晶体(JCPDS 85-0989) 的XRD特征峰2θ为23.6°、32.6°和50.1°, 三者分别对应的晶面为002、100和101.图 6为固化产物的XRD图谱, 从图 6中可以看出, 固化产物的2θ吸收峰的位置与标准谱图中基本相同, 证明固化产物为CdCO3.同时, 吸收峰也比较尖锐, 证明固化产物较纯, CdCO3的结晶度很好.这一测试结果与唐鹏飞等(2014)的结果一致, 验证了产脲酶菌株水解尿素生成的CO32-与溶液中Cd2+反应形成CdCO3沉淀的观点.
 |
| 图 6 固化产物的XRD图谱 Fig. 6 XRD patterns of the carbonate mineralized products |
图 7为成矿产物的SEM图, 从图中可以看出, 成矿产物CdCO3是以球形颗粒的形式包裹在细菌细胞壁表面, 细菌间相互聚合形成了较大的聚合体.图 7a中, 聚合体整体的直径约为2~3 μm, 远大于一般细菌的粒径, 证明被CdCO3颗粒包裹的细菌相互间通过CdCO3颗粒桥接的形式, 形成了较大粒径的聚合体.在图 7b中可进一步看到, 聚合体表面较为粗糙, 细菌细胞壁上形成的CdCO3颗粒多为球形, 相互之间团聚现象较为普遍, 球形的粒径分布不均匀, 从10 μm到100 μm不等.之所以形成这种结构, 可能是细菌表面不同位置的pH和CO32-浓度不同, 细菌周围形成CdCO3过饱和溶液的程度也不相同, 析出的CdCO3晶体结合在细菌细胞壁上不同的结合位点, 相互之间出现团聚, 从而CdCO3晶体颗粒的粒径分布也会不同, 最终形成了图 7b中所示的不同粒径球形CdCO3颗粒结构.
 |
| 图 7 固化产物的SEM图(a.×10000, b.×50000) Fig. 7 SEM images of the carbonate mineralized products |
这一实验现象与成亮等(2008)的实验结果一致.针对国内MICP技术机理研究较为薄弱的问题, 本研究在国内相关研究的基础上提出了溶液中MICP过程机理:碳酸盐固化菌株产生的脲酶水解溶液中的尿素, 增大了溶液pH, 使溶液中CO32-浓度不断升高, 同时菌体细胞壁带负电荷, 可吸附重金属离子, 使细菌周围环境中的Cd2+浓度增加, 直至细菌周围形成过饱和溶液并结晶富集, 最终析出重金属碳酸盐晶体颗粒, 在细菌表面形成了CdCO3晶体, 具体反应式如下所示:
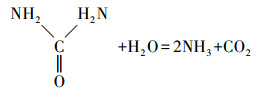
|
(1) |
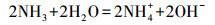
|
(2) |
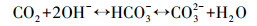
|
(3) |
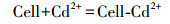
|
(4) |
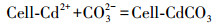
|
(5) |
图 8为产脲酶菌株和固化产物的FTIR测试结果.图中的主要吸收峰简介如下:在3200~3600 cm-1处出现的较宽的吸收峰, 主要是由蛋白质中—NH2和样品水分的—OH基团引起的; 1654 cm-1处吸收峰主要来自蛋白酰胺Ⅰ带的C O基团的伸缩振动; 1540 cm-1处的吸收峰由蛋白酰胺Ⅱ带的N—H键弯曲振动和C—N键伸缩振动引起; 1446 cm-1处是蛋白质碳骨架中—CH3的C—H键不对称变形振动峰和—CH2的变形振动吸收峰; 1416 cm-1处主要为甲基—CH3的伸缩振动吸收峰; 1032 cm-1处为碳酸根的对称伸缩振动吸收峰; 570 cm-1处主要为金属离子与氧原子的共价键振动吸收峰.
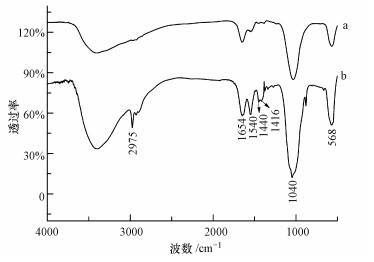 |
| 图 8 与产脲酶菌株(a)和固化产物(b)的FTIR图谱 Fig. 8 FTIR atterns of the urease-producing bacteria(a) and carbonate mineralized products(b) |
未与Cd2+反应的产脲酶菌株的FTIR图谱见图 8中a谱图, 其各处吸收峰显示, 产脲酶菌株细胞中含有一定量的蛋白质、磷酸盐化合物等物质, 细菌的细胞膜等处也含有羰基、羧基、磷酸盐基团, 但吸收峰均较弱.由图 8中b谱图和a谱图对比可知, 固化产物与产脲酶菌株的FTIR图谱呈现出明显的差异性.与产脲酶菌株的FTIR图谱相比, 固化产物在570 cm-1和1032 cm-1处的吸收峰明显增强, 证明Cd—O基团与碳酸根的含量明显上升, 即固化产物中存在较多的CdCO3, 验证了XRD图谱的结果.同时, 在1416、1440、1549、1650 cm-1等处的吸收峰也明显增强, 证明细菌细胞壁和细胞膜上的蛋白质吸附络合了一定量的Cd2+, 蛋白酰胺Ⅰ带和Ⅱ带都与Cd2+进行了反应.在1271 cm-1处也出现了吸收峰, 证明PO43-可能也与Cd2+进行了反应, 从而使该处出现了吸收峰.红外图谱显示, 细菌细胞壁上的基团对Cd2+进行了吸附, 验证了本文提出的机理.
3.9 固化产物的耐酸性固化产物CdCO3是菱镉矿的主要组分, 是自然界中镉元素较为稳定的赋存状态.耐酸性检测结果显示, 固化产物能够耐受的pH为3.0.一般自然条件下产生的酸雨的pH为3.5~5.6(Li et al., 2014), 因此, 产脲酶菌株诱导Cd2+固化产物可耐受酸雨的腐蚀.
4 结论(Conclusions)1) 本研究从土壤中分离纯化出一株高效产脲酶菌株, 培养44 h后, 该菌株对尿素的水解率达90.5%, 培养液中CO32-的理论产量最高可达1.64 g·L-1, 培养液pH最高达9.15, 可为Cd2+的碳酸盐固化提供有利条件.
2) 产脲酶菌株可成功诱导溶液中的Cd2+形成CdCO3沉淀, 对0.1 g·L-1的Cd2+固化去除率达70.5%.
3) XRD图谱和FTIR图谱显示, 固化产物为CdCO3; SEM检测发现, 生成的CdCO3颗粒粒径为10~100 μm, 主要以椭圆形颗粒包裹在细菌表面, 细菌间相互聚合形成了较大的聚合体; 固化产物可耐受的pH为3.5, 是一种较稳定的赋存状态.
成亮, 钱春香, 王瑞兴, 等. 2008. 碳酸盐固化菌株A固结土壤Cd2+的生物固化过程[J]. 硅酸盐学报, 2008, 36(1): 215–221.
|
Fawzy M, Nasr M, Adel S, et al. 2016. Environmental approach and artificial intelligence for Ni(Ⅱ) and Cd(Ⅱ) biosorption from aqueous solution using Typha domingensis biomass[J]. Ecological Engineering, 95: 743–752.
DOI:10.1016/j.ecoleng.2016.07.007
|
高连斌, 张浩然, 梁玉珍, 等. 2006. 镉-碘化钾-罗丹明B-三元络合物光度法测定镉[J]. 理化检验-化学分册, 2006, 42(9): 719–720.
|
郭立新. 2007. 微量铵的分光光度测定[J]. 齐齐哈尔大学学报(自然科学版), 2007, 23(6): 18–18.
|
顾继光, 周启星. 2002. 镉污染土壤的治理及植物修复[J]. 生态科学, 2002, 21(4): 352–356.
|
Hu B, Liang D, Liu J, et al. 2014. Transformation of heavy metal fractions on soil urease and nitrate reductase activities in copper and selenium co-contaminated soil[J]. Ecotoxicology and Environmental Safety, 110: 41–48.
DOI:10.1016/j.ecoenv.2014.08.007
|
Kumari D, Pan X, Lee D J, et al. 2014. Immobilization of cadmium in soil by microbially induced carbonate precipitation with Exiguobacterium undae, at low temperature[J]. International Biodeterioration & Biodegradation, 94(94): 98–102.
|
罗辉, 朱易春, 冯秀娟, 等. 2015. 重金属污染土壤的生物修复技术研究进展[J]. 安徽农业科学, 2015, 43(5): 224–227.
|
李萌, 郭红仙, 程晓辉. 2013. 土壤中产脲酶微生物分离及对重金属的固化[J]. 湖北农业科学, 2013, 52(14): 3280–3282.
DOI:10.3969/j.issn.0439-8114.2013.14.016 |
Li M, Cheng X, Guo H. 2013. Heavy metal removal by bio-mineralization of urease producing bacteria isolated from soil[J]. International Biodeterioration & Biodegradation, 76(1): 81–85.
|
Lin X, Mou R, Cao Z, et al. 2016. Characterization of cadmium-resistant bacteria and their potential for reducing accumulation of cadmium in rice grains[J]. Science of the Total Environment, 569-570: 97–104.
DOI:10.1016/j.scitotenv.2016.06.121
|
李婧, 周艳文, 陈森, 等. 2015. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104–107.
DOI:10.3969/j.issn.1007-7731.2015.24.044 |
苗晓杰, 蒋恩臣, 王佳, 等. 2011. 对二甲氨基苯甲醛显色分光光度法检测水溶液中常微量尿素[J]. 东北农业大学学报, 2011, 42(8): 87–92.
|
Mehta J, Bhardwaj S K, Bhardwaj N, et al. 2016. Progress in the biosensing techniques for trace-level heavy metals[J]. Biotechnology Advances, 34(1): 47–60.
DOI:10.1016/j.biotechadv.2015.12.001
|
Mori M, Kotaki K, Gunji F, et al. 2016. Suppression of cadmium uptake in rice using fermented bark as a soil amendment[J]. Chemosphere, 148: 487–494.
DOI:10.1016/j.chemosphere.2016.01.012
|
Mugwar A J, Harbottle M J. 2016. Toxicity effects on metal sequestration by microbially induced carbonate precipitation[J]. Journal of Hazardous Materials, 314: 237–248.
DOI:10.1016/j.jhazmat.2016.04.039
|
王瑞兴, 钱春香, 吴淼, 等. 2007. 微生物固化固结土壤中重金属研究[J]. 功能材料, 2007, 38(9): 1523–1526, 1530.
|
文秋红, 史锟, 于丽华, 等. 2005. 沈阳张士污灌区4种杂草不同阶段富集Cd的研究[J]. 农业环境科学学报, 2005, 24(5): 843–848.
|
王玉军, 刘存, 周东美, 等. 2014. 客观地看待我国耕地土壤环境质量的现状—关于《全国土壤污染状况调查公报》中有关问题的讨论和建议[J]. 农业环境科学学报, 2014, 33(8): 1465–1473.
DOI:10.11654/jaes.2014.08.001 |
王艳娜. 2014. 土壤重金属污染现状与防治方法[J]. 价值工程, 2014, 33(35): 311–312.
DOI:10.3969/j.issn.1006-4311.2014.35.180 |
王洋洋, 王震, 何希宏, 等. 2013. 三株药用乳酸杆菌的生理生化特征研究[J]. 安徽农业科学, 2013, 41(8): 3310–3313.
|
许凤琴, 代群威, 侯丽华, 等. 2015. 碳酸盐固化菌的分纯及其对Sr2+的固化特性研究[J]. 高校地质学报, 2015, 21(3): 376–381.
|
许燕波, 钱春香, 陆兆文, 等. 2013. 微生物固化修复重金属污染土壤[J]. 环境工程学报, 2013, 7(7): 2763–2768.
|
Yang X, Feng Y, He Z, et al. 2005. Molecular mechanisms of heavy metal hyperaccumulation and phytoremediation[J]. Trace Elements in Medicine and Biology, 18(4): 339–353.
DOI:10.1016/j.jtemb.2005.02.007
|
周东美, 邓昌芬. 2003. 重金属污染土壤的电动修复技术研究进展[J]. 农业环境科学学报, 2003, 22(4): 505–508.
|
周国华, 黄怀曾, 何红蓼, 等. 2002. 重金属污染土壤植物修复及进展[J]. 环境污染治理技术与设备, 2002, 3(6): 33–39.
|
唐鹏飞, 许文杰, 王延飞, 等. 2014. 混凝沉淀处理含镉废水的效果及其作用机理初探[J]. 南华大学学报(自然科学版), 2014, 28(3): 99–102.
|
 2017, Vol. 37
2017, Vol. 37



