2. 南京师范大学地理科学学院, 南京 210097;
3. 江苏省地理信息资源开发与利用协同创新中心, 江苏省环境演变与生态建设重点实验室, 江苏省水土环境生态修复工程实验室, 南京 210023
2. School of Geography Science, Nanjing Normal University, Nanjing 210097;
3. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Jiangsu Key Laboratory of Environmental Change and Ecological Construction, Institute of Water Environmental Eco-remediation, Nanjing 210023
富营养化浅水湖泊在外源性营养盐得到控制的情况下, 蓝藻水华仍持续爆发, 现已成为我国浅水湖泊面临的主要环境问题之一(吴庆龙等, 2008), 2007年的太湖无锡水危机事件更是引起了国内外学者的广泛关注(Guo, 2007; 陆桂华等, 2009).在较高的水温、充足的光照及平静的风浪条件下, 水华蓝藻大量繁殖、聚集和死亡后, 与微生物和底泥相互作用会引发"湖泛"或"黑水团"现象, 周围水体表层有气泡冒出, 水体发黑发臭(钟继承等, 2010; 盛东等, 2010; 孔繁翔等, 2007; 刘国锋等, 2010).湖泛导致的水体长时间的厌氧还原环境, 对湖泊水体及沉积物中敏感元素的迁移转化过程影响极大(申秋实等, 2012; 刘国锋等, 2009), 沉积物中铁的氧化和还原又对磷的释放具有重要作用(Rozan et al., 2002).已有研究表明, 蓝藻腐解会向水体释放大量氮、磷等可溶性营养盐, 改变水体正常氮磷循环进程(孙小静等, 2007), 增加水体营养负荷.刘国锋等(2010)和朱梦圆等(2011)研究表明, 藻源性湖泛发生过程中沉积物间隙水中的磷会向上覆水释放, 加剧上覆水磷营养负荷, 为藻华的再次发生提供基础.沈爱春等(2012)对太湖梅梁湾进行了为期1个月的原位蓝藻堆积围隔实验研究, 发现蓝藻死亡使得水体营养盐在短时间内快速增加, TN、NH4+-N和TP浓度最高值分别为初始值的16、48和46倍.李珂等(2011)在蓝藻碎屑分解速率及氮磷释放形态的实验中发现, 蓝藻碎屑的分解速率较水生植物残体高(0.072~0.271 d-1), 磷释放速率要高于氮, 但水中溶解性TN的升高持续时间较溶解性TP长.堆积密度对蓝藻腐解时营养盐的释放过程有一定的影响, 营养盐释放浓度与蓝藻堆积密度呈正相关关系(Chuai et al., 2011; 尚丽霞等, 2013).可见, 蓝藻腐解过程对水体营养盐和有机物含量变化具有重要影响.
目前, 对于藻类下沉和越冬(吴晓东等, 2008; 阎荣等, 2004)、在底泥表面的复苏(陶益等, 2005; 孔繁翔等, 2010; 曹焕生等, 2006)及在水柱中生物量积累过程对水体不同形态氮磷营养盐浓度的影响(沈爱春等, 2012; 尚媛媛等, 2015)已有较多报道, 而对于蓝藻水华堆积衰亡过程对营养盐的影响则多侧重于对沉积物营养盐释放过程的影响(朱梦圆等, 2011; 王国芳等, 2014; 孔明等, 2014).本研究通过向上覆水体添加不同密度的蓝藻, 监测上覆水中有机物及主要营养盐浓度的变化过程, 从而了解不同藻密度蓝藻衰亡腐解时的营养盐释放规律, 为进一步研究蓝藻水华对湖泊营养盐循环的影响提供理论基础, 并为及时消除堆积蓝藻、防止水源污染提供科学依据.
2 材料与方法(Materials and methods) 2.1 样品采集竺山湾是太湖蓝藻水华爆发的重灾区, 可以作为藻型湖区的典型代表.本研究在竺山湾附近利用柱状采泥器采集沉积物样品, 每根泥柱中沉积物高度保持在20 cm以上, 现场对采集到的沉积物严格按4 cm分层, 共分5层, 每根柱状样的同一层底泥装入聚乙烯自封袋中保存带回.同时, 在采样点附近采集上覆水带回, 作为实验装置填充用水.在室内装置稳定1周后, 用孔径为64 μm的浮游植物采集网再次去太湖采集新鲜蓝藻.
2.2 样品处理及实验设计沉积物样品运回实验室后经80目的不锈钢分样筛对不同层沉积物进行分层过筛, 去除底栖动物和大颗粒物质, 以保证样品的均质性.同时, 用孔径为64 μm的筛网对采集到的原位上覆水进行过滤, 去除浮游藻类及其他浮游生物.结合已有文献资料(刘国锋等, 2010; Zhu et al., 2013; Han et al., 2015), 将处理后的沉积物样品按从底层到表层填充在有机玻璃柱中(内径9 cm, 高50 cm, 底部密封, 上部开口), 共填充20 cm, 再用注射器沿管壁缓慢添加处理后的上覆水15 cm, 稳定1周后再向上覆水中添加过滤后的新鲜蓝藻.
实验共分为4组, 分别标记为A、B、C和D组, 每组共设置10根泥柱.其中, 对照组A不添加蓝藻, B、C、D组为处理组, 结合申秋实等(2011)、Yu等(2016)对太湖湖泛的研究结果, 分别添加20 g(约2500 g·m-2)、60 g(约7500 g·m-2)、120 g(约15000 g·m-2)过滤后的新鲜蓝藻, 再将4组实验柱按顺序统一放置于水浴箱中恒温培养, 保持水浴箱温度为(29±1) ℃, 将水浴箱盖以黑布, 避光培养, 连续培养23 d, 模拟太湖湖泛的发生过程(图 1).
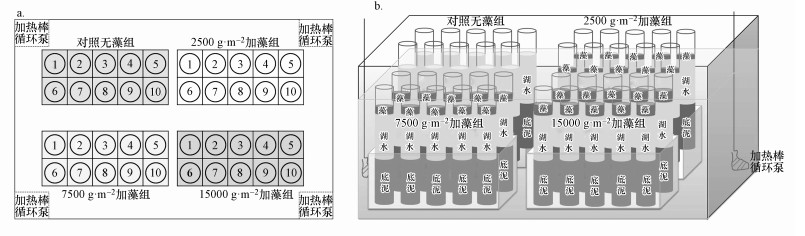 |
| 图 1 实验装置示意图(a.平面图, b.立体图) Fig. 1 Schematic diagram of experimental set-up |
实验开始后, 分别于第1、2、4、6、8、10、14、18、23 d进行样品采集, 每次分别缓慢地从各组中取出1根泥柱, 以保证不扰动上覆水和表层沉积物.首先使用便携式探头(美国, Hach公司)测定上覆水中DO、pH、EC(电导率)和Eh等水质参数, 再用虹吸法吸取沉积物-水界面以上7 cm处的上覆水100 mL, 用于测定总氮(TN)、氨氮(NH4+-N)、硝氮(NO3--N)、总磷(TP)、总有机质(TOC)及溶解态有机质(DOC)的浓度.
2.3 测定指标及方法溶解性营养盐NH4+-N、NO3--N采用0.45 μm醋酸纤维膜抽滤后, 用AA3c流动水质分析仪(德国Bran Luebbe公司)测定; TN采用碱性过硫酸钾氧化紫外分光光度法测定(GB 11894-89), TP的测定采用钼酸铵分光光度法(GB 11893-89)(国家环境保护总局, 2002); DOC经0.45 μm的玻璃纤维膜过滤后测定, DOC和TOC统一采用multi N/C 3100型总有机碳分析仪测定(德国Jena公司).采用SPSS 19.0软件, 利用皮尔逊(Pearson)相关系数法进行营养盐之间的相关性分析, 不同处理组营养盐含量差异显著性检验采用单因素方差分析(one-way ANOVA), 两组数据显著性差异采用独立样本T检验.
3 结果与分析(Results and analysis) 3.1 上覆水DO及Eh变化特征上覆水溶解氧(DO)是反映生物生长状况和污染状况的重要指标(冉祥滨等, 2011), 而氧化还原电位(Eh)反映了体系中所有物质表现出来的宏观氧化-还原性, 表征介质氧化性或还原性的相对强弱(向交等, 2014).添加蓝藻后上覆水DO浓度与Eh值随时间的变化特征如图 2所示.对照组上覆水DO浓度稳定在1.04 mg·L-1左右, 加藻24 h后B组、C组和D组DO浓度显著下降, 分别下降了0.72、1.13和2.55 mg·L-1, 随着试验时间的增加, 分别稳定在0.17、0.12、0.14 mg·L-1, 水体进入厌氧状态.在试验的第23 d, 随着各处理组蓝藻腐解殆尽, 各处理组DO浓度稍有上升.
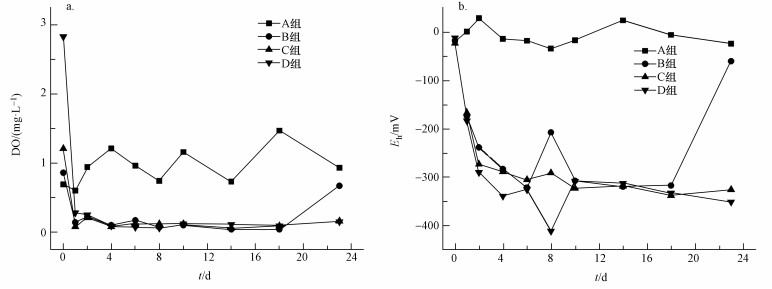 |
| 图 2 上覆水DO(a)和Eh(b)变化特征 Fig. 2 Change of DO concentration(a) and ORP level(b) in overlying water |
上覆水Eh值与DO浓度变化趋势具有同步性.加藻前, Eh值稳定在-11~-22 mV, 加藻后各处理组Eh值迅速下降, 试验的前6 d一直处于下降趋势, 第8 d出现波动, 最终各处理组Eh值稳定在-300~-400 mV之间, 水体呈现出极强的还原性.厌氧强还原条件又加速了蓝藻死亡腐解过程, 促进了藻体营养盐向上覆水的扩散.
3.2 上覆水有机质变化特征蓝藻降解过程中会向水体释放大量有机物质, 对水质造成影响.室内培养期间, 处理组水体有机碳变化趋势如图 3所示, C、D处理组TOC浓度与对照组差异显著(p<0.05).各处理组TOC浓度在第4 d显著增加, 藻密度最低的B组TOC浓度在第6 d达到最大值181.4 mg·L-1, 随后逐渐下降, 而藻密度较高的C、D两组TOC浓度都在第14 d达到峰值, 分别为427 mg·L-1和767.5 mg·L-1.对照组TOC浓度在试验期间较稳定, 维持在35.91~54.00 mg·L-1之间.上覆水中DOC与TOC浓度变化较一致, 但处理组DOC浓度的降低均要早于TOC浓度的下降.B组DOC浓度在第4 d达到最大值144.25 mg·L-1, 而C、D组在第10 d达到最大值, 分别是B组的2.02和3.62倍.由此可见, 高密度蓝藻腐解是引起上覆水中有机质含量大量增加的主要原因.
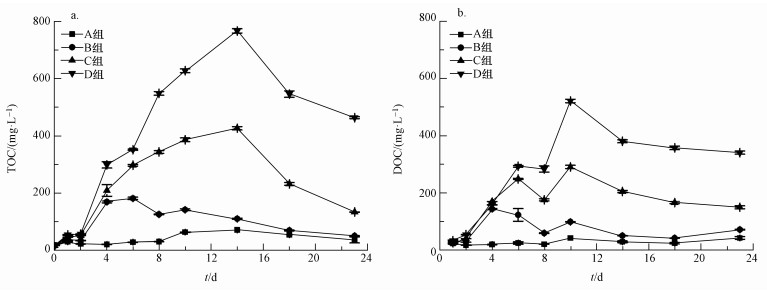 |
| 图 3 试验期间上覆水有机碳浓度变化趋势(a.TOC, b.DOC) Fig. 3 Concentration variation of organic carbon of overlying water during experiment |
试验期间上覆水营养盐浓度随时间的变化特征如图 4所示, B、C、D组营养盐浓度分别于实验第6 d、第10 d和第14 d达到峰值, TN平均增长速率分别为26.67、43.41和67.82 mg·L-1·d-1, TP平均增长速率分别为3.30、5.53和8.35 mg·L-1·d-1.随着蓝藻腐解, 上覆水TP浓度逐渐增加, 各处理组TP浓度在第2 d开始迅速上升, D组水体TP增长速率最快, 4 d内增长速率为6.90 mg·L·d-1.各处理组TP浓度的峰值及达到峰值的时间具有差异性, B组在第8 d达到峰值12.59 mg·L-1, C组在第10 d达到峰值34.81 mg·L-1, D组在第14 d达到峰值63.54 mg·L-1, 随后各处理组TP浓度又呈现出逐渐下降的趋势.试验期间对照组TP浓度无明显变化, 维持在1 mg·L-1左右, 与C、D处理组形成显著差异(p<0.01).相对于TP浓度而言, 上覆水TN浓度的变化具有延迟性.在试验前2 d各处理组TN浓度变化并不明显, 其浓度范围在18.79~23.26 mg·L-1之间.在加藻后的第4 d各处理组TN浓度出现明显的上升趋势, 藻密度相对较高的C组和D组TN变化与对照组差异显著(p<0.01).试验期间, 对照组TN浓度基本维持在15.27 mg·L-1左右, 变化相对稳定.B组在第10 d后TN浓度就维持在108.09 mg·L-1左右, 此时B组上覆水中蓝藻已全部腐解.C组TN浓度在第2~8 d上升最快, 增长速率为43.36 mg·L·d-1, 第2~10 d D组TN增长速率为49.61 mg·L·d-1, 最终C、D组TN浓度峰值分别为298.18 mg·L-1和513.29 mg·L-1, 分别是B组TN浓度峰值的2.40和4.13倍, 试验后期各处理组TN浓度呈现缓慢下降趋势.
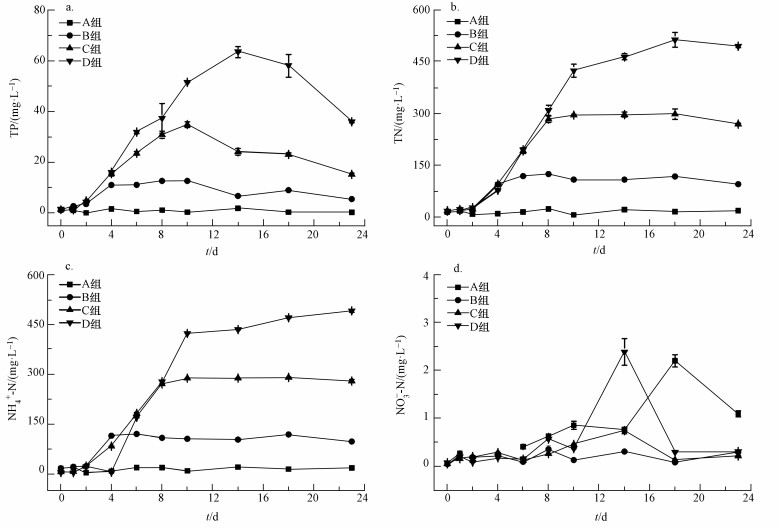 |
| 图 4 试验期间上覆水营养盐变化趋势(a.TP, b.TN, c.NH+-N, d.NO3--N) Fig. 4 Concentration variation of nutrients of overlying water during experiment |
蓝藻腐解过程中NH4+-N的变化趋势如图 4c所示.各处理组变化趋势较为一致, 试验初期呈现出迅速上升并逐渐趋于稳定, 而藻密度最大的D组至试验结束时NH4+-N浓度仍表现出上升的趋势.各处理组NH4+-N最大释放量与蓝藻添加量密切相关, B组、C组和D组NH4+-N浓度最大值分别为初始值的7、51、125倍, 而对照组NH4+-N浓度在试验过程中基本不变, 与C、D处理组差异显著(p<0.01).由图 4d可知, 试验期间各组NO3--N浓度无明显变化, 均维持在较低水平.由此可见, 蓝藻腐解过程中, 水体无机氮主要以NH4+-N的形式存在.
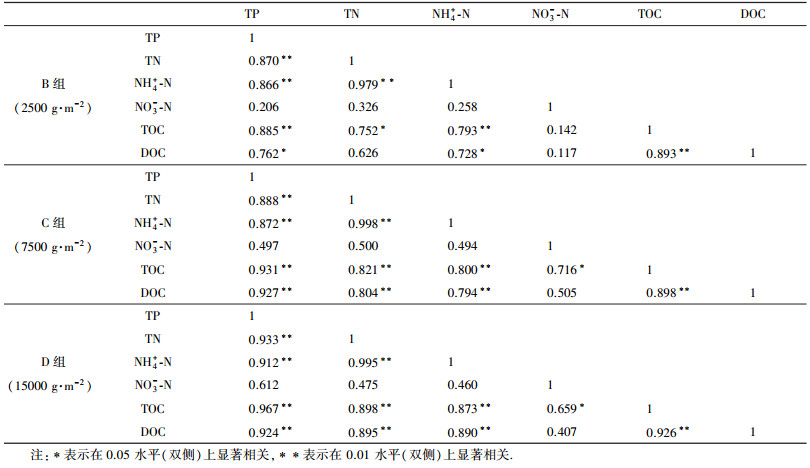
3.4 上覆水营养盐的相关性分析在特定条件下, 大量蓝藻短时间内死亡可能极大地影响水生生态系统的结构和功能.了解蓝藻腐解过程中各营养盐之间的相关关系, 有利于认识不同形态营养盐迁移转化规律.本文中上覆水各营养盐含量及有机质之间的相关关系如表 1所示.除NO3--N外, 各处理组氮、磷营养盐及有机质都表现出显著的相关性, 各营养盐之间呈显著正相关关系(p<0.05).TN、TP与TOC、DOC呈显著正相关关系(p<0.05), 且随着加藻密度的增大, 相关系数越大, 这表明上覆水中氮、磷营养盐与水体有机质含量具有同源性, 上覆水营养盐的增量与蓝藻密度密切相关, 也进一步表明水体营养盐主要来自于蓝藻的腐解作用.进一步分析发现, TOC与TP的相关系数要高于TOC与TN的相关系数, 而TOC含量与蓝藻密度密切相关, 这表明蓝藻腐解对水体磷素的影响要大于对氮素的影响, 实验后期上覆水TP浓度下降要早于TN, 究其原因可能是由于湖泊水环境系统中磷会伴随着藻块团聚体等因沉淀作用下沉进入底泥, 从而使得水中磷含量降低(Royer et al., 1999; 张智等, 2006).处理组NH4+-N与TN呈显著正相关关系(p<0.01), 进一步说明了蓝藻腐解过程中上覆水中NH4+-N是无机氮的主要存在形态, 上覆水氮素主要以无机氮的形式存在.处理组上覆水DOC与TOC显著正相关(p<0.01), 说明水中有机碳主要以溶解态形式存在.
| 表 1 处理组上覆水营养盐的相关性分析 Table 1 Correlation analysis of nutrients of overlying water from treated experiments |
蓝藻腐解过程中, 有机质降解消耗水体中DO, 并使营养盐浓度升高.上覆水氮、磷营养盐浓度在加藻培养后第4 d呈现出明显的上升趋势, 且都表现为随藻密度的增加, 上覆水氮、磷营养盐的释放量增大, 邱阳等(2016)在模拟藻华黑水团的实验研究中也得到了类似结论.究其原因是因为在蓝藻腐解过程中, 上覆水氮形态的变化主要表现在蓝藻细胞破碎释放大量颗粒有机氮(PON), 在微生物作用下PON转化为溶解性有机氮DON, 再进一步腐解为溶解性无机氮(DIN)(尚丽霞等, 2013).处理组DO浓度在第2 d就基本达到厌氧状态, 蓝藻腐解产生的PON在厌氧微生物的作用下直接通过氨化作用生成NH4+-N或者先转化为DON后再逐渐矿化为NH4+-N, 同时还有一部分NO3--N通过氨异化作用被还原成NH4+-N(Downes, 1988).此时, 由于水体处于厌氧环境, DO浓度下降, 硝化作用受到抑制, 反硝化作用增强, NH4+-N难以被氨氧化微生物转化为NO2--N, NH4+-N消耗减弱(孙英等, 2009).朱梦圆等(2011)、申秋实等(2011)在室内模拟蓝藻水华发生过程的实验中发现, 沉积物间隙水具有高浓度的NH4+-N, 且在浓度梯度的作用下会向上覆水释放, 使上覆水NH4+-N浓度进一步上升, 因此, 处理组NH4+-N浓度在蓝藻腐解前期大幅上升.实验培养后期, 藻类基本全部死亡, 不再向水体释放有机氮, TN浓度开始下降, 此时水体还处于还原环境, NO2--N等在反硝化作用下易被还原成N2和N2O释放到大气中, 造成体系中N的损耗(Smith, 2002), TN受到一定程度的削弱.低DO环境下不利于硝化作用的进行, NH4+-N主要通过厌氧氨氧化作用转化为N2从水体中削弱(范俊楠等, 2012), 实验结束时, 上覆水逐渐变清澈, 水体DO开始缓慢回升, 由厌氧逐渐向缺氧状态转化, NH4+-N浓度开始缓慢下降.但由于处理组加藻密度较大, 蓝藻腐解完全所需的时间较长, 到试验后期, 上覆水表层还存在部分藻残体未完全腐烂下沉, 会继续向上覆水释放少量以NH4+-N为主要形式的无机氮营养盐, 造成试验后期上覆水NH4+-N浓度维持较高水平, TN浓度下降较为缓慢.可见水体氮浓度还与蓝藻水华的持续时间有关.
蓝藻腐解过程中, TP浓度的上升主要是蓝藻死亡腐解释放大量磷营养盐造成的, 同时还有一部分是由厌氧环境下间隙水磷酸盐向上覆水迁移转化及沉积物中Fe-P的还原释放引起的(韩沙沙等, 2004; 陈国元等, 2011).培养过程中, 上覆水TP浓度较TN先下降, 这可能与磷主要存在于利于腐解的活性物质中有关(李文朝等, 2001).实验后期, 虽然C、D组上覆水表层还留有一部分藻残体, 但此时的藻体已基本死亡, 其中的活性物质很少.未添加蓝藻的对照组在实验培养期间上覆水氮、磷营养盐均未出现明显变化, 因此, 处理组氮、磷营养盐的增多主要是受蓝藻腐解向上覆水释放的影响.
4.2 蓝藻腐解过程中上覆水有机质变化特征由于蓝藻聚集死亡会引起藻团腐解, 生成体积更小的颗粒物和胶体物质.试验过程中, 有机碳含量的增加量与初始藻密度有关, 蓝藻密度越大的处理组, 有机碳含量增加越多, 同时有机碳含量增加的持续时间越长.试验初期, 蓝藻腐解速度较慢, 水体DO和Eh迅速下降, 死亡藻类易被快速降解, 水体TOC含量无明显变化.随蓝藻死亡量增加, 有机物的释放速率大于降解速率, 上覆水体颗粒物质逐渐增多, 颗粒有机碳(POC)在微生物的作用下被腐解为DOC, 使得水体DOC和TOC含量不断增加.当上覆水表层蓝藻全部死亡, 水体颗粒物不再增加, 有机物的释放速率小于降解速率, TOC含量开始下降.3组处理组DOC含量都要较TOC含量提前下降, 这主要是因为颗粒物之间存在一个动态平衡, 当蓝藻腐解产生的颗粒物逐渐增多的时候, 在颗粒物之间会形成腐解释放小于凝聚沉淀的动态平衡(孙小静等, 2007), DOC的增加量就会逐渐减少, 最终因为藻类的死亡DOC含量下降.
5 结论(Conclusions)1) 高密度蓝藻腐解导致上覆水体DO、Eh在加藻后第1 d就迅速下降, 最终分别维持在0.1 mg·L-1左右和-300~-400 mV之间.上覆水体在短时间内经历了明显的缺氧-厌氧过程, 水体处于厌氧强还原状态, 加速了蓝藻死亡腐解过程, 促进了藻体营养盐向上覆水的扩散, 为湖泛的发生提供了先决条件.
2) 蓝藻腐解对上覆水氮、磷营养盐影响极大, 其释放量随藻密度增加而增大, 加藻密度为2500、7500和15000 g·m-2的处理组, 营养盐含量分别于实验第6 d、第10 d和第14 d达到峰值, TN平均增长速率分别为26.67、43.41和67.82 mg·L-1·d-1, TP平均增长速率分别为3.30、5.53和8.35 mg·L-1·d-1, NH4+-N浓度最大值分别为对照组的7、51、125倍, 水体形成明显的氮磷污染负荷, 且蓝藻腐解导致的上覆水TN浓度升高持续时间较TP要长.
3) 蓝藻腐解过程中向水中释放大量的有机物和可溶性营养盐, 降低水中透明度, 建议多关注蓝藻堆积后的水质情况, 避免因蓝藻腐解而破坏水质.
致谢: 在实验和写作过程中, 南京师范大学环境学院赵艳萍老师给予了大力的帮助和指导, 在实验采样过程中得到南京师范大学环境学院吴松峻、陈双同学的协助, 在此表示诚挚感谢!
曹焕生, 孔繁翔, 谭啸, 等. 2006. 太湖水华蓝藻底泥中复苏和水柱中生长的比较[J]. 湖泊科学, 2006, 18(6): 585–589.
DOI:10.18307/2006.0605 |
陈国元, 赵超. 2011. 不同浓度NH3对富营养化湖泊水体硝化作用的影响[J]. 水生态学杂志, 2011, 32(6): 52–56.
|
Chuai X, Ding W, Chen X, et al. 2011. Phosphorus release from cyanobacterial blooms in Meiliang Bay of Lake Taihu, China[J]. Ecological Engineering, 37(6): 842–849.
DOI:10.1016/j.ecoleng.2011.01.001
|
Downes M T. 1988. Aquatic nitrogen transformations at low oxygen concentrations[J]. Applied & Environmental Microbiology, 54(1): 172–175.
|
范俊楠, 赵建伟, 朱端卫. 2012. 湖泊氮素氧化及脱氮过程研究进展[J]. 生态学报, 2012, 32(15): 4924–4931.
|
国家环境保护总局. 2002. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社.
|
Guo L. 2007. Doing battle with the green monster of Taihu Lake[J]. Science, 317(5842): 1166–1166.
DOI:10.1126/science.317.5842.1166
|
Han C, Ding S, Yao L, et al. 2015. Dynamics of phosphorus-iron-sulfur at the sediment-water interface influenced by algae blooms decomposition[J]. Journal of Hazardous Materials, 300: 329–337.
DOI:10.1016/j.jhazmat.2015.07.009
|
韩沙沙, 温琰茂. 2004. 富营养化水体沉积物中磷的释放及其影响因素[J]. 生态学杂志, 2004, 23(2): 98–101.
|
孔繁翔, 曹焕生, 谭啸, 等. 2010. 水华蓝藻复苏的研究进展与水华预测[J]. 环境监控与预警, 2010, 2(1): 1–4.
|
孔繁翔, 胡维平, 谷孝鸿, 等. 2007. 太湖梅梁湾2007年蓝藻水华形成及取水口污水团成因分析与应急措施建议[J]. 湖泊科学, 2007, 19(4): 357–358.
DOI:10.18307/2007.0401 |
孔明, 张路, 尹洪斌, 等. 2014. 蓝藻暴发对巢湖表层沉积物氮磷及形态分布的影响[J]. 中国环境科学, 2014, 5(5): 1285–1292.
|
李柯, 关保华, 刘正文. 2011. 蓝藻碎屑分解速率及氮磷释放形态的实验分析[J]. 湖泊科学, 2011, 23(6): 919–925.
DOI:10.18307/2011.0614 |
李文朝, 陈开宁, 吴庆龙, 等. 2001. 东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001, 13(4): 331–336.
DOI:10.18307/20010407 |
刘国锋, 申秋实, 张雷, 等. 2010. 藻源性黑水团环境效应:对水-沉积物界面氮磷变化的驱动作用[J]. 环境科学, 2010, 31(12): 2917–2924.
|
刘国锋, 钟继承, 何俊, 等. 2009. 太湖竺山湾藻华黑水团区沉积物中Fe、S、P的含量及其形态变化[J]. 环境科学, 2009, 30(9): 2520–2526.
|
陆桂华, 马倩. 2009. 太湖水域"湖泛"及其成因研究[J]. 水科学进展, 2009, 20(3): 438–442.
|
邱阳, 苗作云, 刘学芝. 2016. 藻华黑水团对上覆水体营养盐变化的模拟研究[J]. 环境科学与技术, 2016(3): 38–44.
|
Royer T V, Monaghan M T, Minshall G W. 1999. Processing of native and exotic leaf litter in two Idaho (U.S.A.) streams[J]. Hydrobiologia, 400(3): 123–128.
|
Rozan T F, Taillefert M, Trouwborst R E, et al. 2002. Iron-sulfur-phosphorus cycling in the sediments of a shallow coastal bay:Implications for sediment nutrient release and benthic macroalgal blooms[J]. Limnology & Oceanography, 47(5): 1346–1354.
|
冉祥滨, 臧家业, 韦钦胜, 等. 2011. 乳山湾口及其邻近海域溶解氧分布特征及影响因素研究[J]. 海洋学报, 2011, 33(4): 173–180.
|
尚丽霞, 柯凡, 李文朝, 等. 2013. 高密度蓝藻厌氧分解过程与污染物释放实验研究[J]. 湖泊科学, 2013, 25(1): 47–54.
DOI:10.18307/2013.0107 |
尚媛媛, 关保华, 郑建伟, 等. 2015. 蓝藻堆积对水环境和沉水植物生长的影响[J]. 中国农学通报, 2015, 31(5): 195–198.
|
申秋实, 邵世光, 王兆德, 等. 2012. 风浪条件下太湖藻源性"湖泛"的消退及其水体恢复进程[J]. 科学通报, 2012, 57(12): 1060–1066.
|
申秋实, 邵世光, 王兆德, 等. 2011. 太湖月亮湾湖泛发生过程模拟及水土物化性质的响应[J]. 水科学进展, 2011, 22(5): 710–719.
|
沈爱春, 徐兆安, 吴东浩. 2012. 蓝藻大量堆积、死亡与黑水团形成的关系[J]. 水生态学杂志, 2012, 33(3): 68–72.
|
盛东, 徐兆安, 高怡. 2010. 太湖湖区"黑水团"成因及危害分析[J]. 水资源保护, 2010, 26(3): 41–44.
|
孙小静, 秦伯强, 朱广伟. 2007. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放[J]. 中国环境科学, 2007, 27(3): 341–345.
|
孙英, 何江, 吕昌伟, 等. 2009. 岱海表层沉积物中影响氨氮释放的模拟研究[J]. 农业环境科学学报, 2009, 28(7): 1464–1468.
|
Smith R. 2002. Limnology-Inland water ecosystems[J]. Journal of the North American Benthological Society, 21(2): 346–347.
DOI:10.2307/1468422
|
陶益, 孔繁翔, 曹焕生, 等. 2005. 太湖底泥水华蓝藻复苏的模拟[J]. 湖泊科学, 2005, 17(3): 231–236.
|
王国芳, 李先宁, 方洋, 等. 2014. 底泥对藻源型局部黑臭水体形成的影响[J]. 湖南大学学报(自科版), 2014, 41(12): 102–108.
|
吴庆龙, 谢平, 杨柳燕, 等. 2008. 湖泊蓝藻水华生态灾害形成机理及防治的基础研究[J]. 地球科学进展, 2008, 23(11): 1115–1123.
DOI:10.3321/j.issn:1001-8166.2008.11.001 |
吴晓东, 孔繁翔, 张晓峰, 等. 2008. 太湖与巢湖水华蓝藻越冬和春季复苏的比较研究[J]. 环境科学, 2008, 29(5): 1313–1318.
|
向交, 徐丽萍, 李和平, 等. 2014. 氧化还原电位的研究及应用[J]. 地球与环境, 2014, 42(3): 430–436.
|
阎荣, 孔繁翔, 韩小波. 2004. 太湖底泥表层越冬藻类群落动态的荧光分析法初步研究[J]. 湖泊科学, 2004, 16(2): 163–168.
|
Yu D, Xie P, Zeng C, et al. 2016. In situ enclosure experiments on the occurrence, development and decline of black bloom and the dynamics of its associated taste and odor compounds[J]. Ecological Engineering, 87: 246–253.
DOI:10.1016/j.ecoleng.2015.11.039
|
张智, 刘亚丽, 段秀举. 2006. 湖泊底泥磷释放影响因素显著性试验分析[J]. 植物资源与环境学报, 2006, 15(2): 16–19.
|
钟继承, 申秋实, 刘国锋, 等. 2010. 藻源性黑水团环境效应:对水-沉积物界面处Fe、Mn、S循环影响[J]. 环境科学, 2010, 31(11): 2652–2660.
|
朱梦圆, 朱广伟, 王永平. 2011. 太湖蓝藻水华衰亡对沉积物氮、磷释放的影响[J]. 环境科学, 2011, 32(2): 409–415.
|
Zhu M, Zhu G, Zhao L, et al. 2013. Influence of algal bloom degradation on nutrient release at the sediment-water interface in Lake Taihu, China[J]. Environmental Science and Pollution Research, 20(3): 1803–1811.
DOI:10.1007/s11356-012-1084-9
|
 2017, Vol. 37
2017, Vol. 37