2. 辽宁省能源研究所, 营口 115003
2. Liaoning Institute of Energy Resources, Yingkou 115003
随着人类社会的发展、生活水平的提高及人口数量的日益增长, 餐厨垃圾的大量产出变成了不可避免的问题, 若不对其进行合理、适当的有效处理将会给人们的生活带来很大危害.预计到21世纪中叶, 全世界城市生活垃圾可能会突破95×108 t·a-1, 其中, 餐厨垃圾所占的比重在不同国家和地区有所差异, 大约达到25%~70%(Pham et al., 2015).餐厨垃圾具有含水率高、有机组分丰富、碳氮比(10~25) 适宜和易生物降解的一般特性, 被证实是最易获得的用于厌氧发酵的理想原料, 其产生的新能源可以用来代替化石燃料的燃烧(Jiang et al., 2013; Karthikeyan et al., 2015).根据反应器内含固率的不同, 厌氧发酵反应体系被分为固态发酵和液态发酵2类, 当含固率高于15%时, 厌氧消化反应体系被界定为固态模式(Li et al., 2011).相对于液态发酵而言, 固态发酵的原料呈固态, 处理过程中不产生污水, 无沼液消纳问题, 消化剩余物可制成有机肥料, 基本上能够实现零污染排放, 同时经济效益良好, 能量呈正效应(黄燕冰, 2015).另一方面, 固态发酵既不需要加水也不需要脱水, 简化了前期预处理, 也降低了能耗, 并且餐厨垃圾TS含量通常在20%以上(Zhang et al., 2007), 固态发酵可以处理高含固率废物的这一特点也满足了目前城市生活垃圾处理的要求(马磊等, 2007).
餐厨垃圾含有较高的可降解有机物(Zhang et al., 2007), 因此, 具有产酸速度快、含氮量高的特点, 在发酵过程中如果餐厨垃圾添加量较大就极易出现酸化和氨氮抑制现象.餐厨垃圾固态发酵水解酸化阶段所产生的挥发性脂肪酸(VFAs)作为水解酸化产物, 是产甲烷菌可以直接利用的反应基质, 其含量和组成直接影响着后续甲烷化阶段的物质转化效率(Komemoto et al., 2009).李红丽等(2014)在牛粪干式发酵过程中添加一定量的餐厨垃圾可加快VFAs的产生并提高VFAs产量, 从而提高甲烷产量, 但总VFAs长时间超过10000 mg·L-1, pH降到不适于产甲烷菌生长的范围时, 将抑制甲烷的生成, VFAs积累导致厌氧发酵酸败.影响餐厨垃圾固态发酵的因素有很多, 但针对固态发酵过程中酸化恢复性控制指标的研究却比较缺乏.VFAs作为主要的中间产物, 直接影响到固态发酵的成败, 因此, 通过测定固态发酵过程中VFAs产量及组成来研究固态发酵的最适宜条件是很有必要的.本文采用连续式完全混合反应器, 通过定期加料不断提高TS含量以期达到固态发酵, 定期监测产气效率、挥发性脂肪酸的含量及其成分, 研究酸化过程中各个参数的变化规律及固态发酵过程中挥发性脂肪酸与产气的变化关系, 从而为餐厨垃圾固态发酵过程中产酸技术的发展提供依据, 这对于餐厨垃圾固态发酵反应器的稳定运行也具有理论指导意义.
2 实验材料及方法(Experimental materials and methods) 2.1 实验原料和接种体性质实验所用餐厨垃圾来自沈阳市沈阳航空航天大学教工食堂产出的餐厨垃圾, 先将餐厨垃圾混合均匀, 取样时手工去除其中的骨头和蛋壳等杂质.然后用绞肉机切割为粒径小于10 mm的匀浆, 处理后的餐厨垃圾袋装集中放入温度为4 ℃的冰箱内贮存待用.餐厨垃圾TS为30.32%, VS为87.42%.接种污泥来自沈阳市北部污水处理厂, 取回后经中温驯化, TS为19.99%, VS为87.44%.
2.2 实验装置与方法实验装置为CSTR反应器(PMMA), 为有机玻璃制成, 反应器容积为20 L, 其中有效容积为17 L, 发酵罐采用水封密闭系统, 顶部设有水封罩, 密封性能好.实验装置见图 1, 本实验采用4个连续反应器, 顶部设有搅拌电机, 通过液封的方式保持装置的密闭性, 防止空气进入; 采用斜叶式不锈钢机械搅拌器, 搅拌时转速为90 r·min-1, 每隔4 h搅拌10 min; 循环水浴锅通过温控仪使温度保持在(37.0±0.2) ℃; 产气量由连续式气体流量计测定.
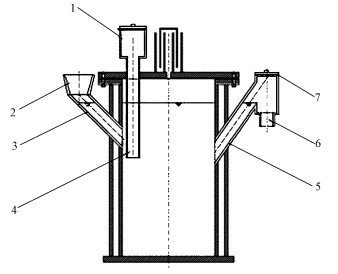 |
| 图 1 实验装置示意图 (1.进料斗, 2.进料斗, 3.进料口, 4.进料管, 5.溢流出料口, 6.出料口, 7.盖板) Fig. 1 Experimental apparatus of anearobic digestion |
实验开始时将3 kg驯化好的厌氧接种污泥和0.1 kg餐厨垃圾混合后投入反应器投料装置中, 用氮气吹脱5 min以防止氧气进入, 之后加入10 L水控制到装置刻度线以下(图 1), 控制温度在(37.0±0.2) ℃的条件下开展中温厌氧发酵实验.自第2 d起向发酵罐中加入0.3 kg餐厨垃圾, 之后再根据当日的产气量及pH值等指标的变化来对投加量做出相应调整, 若产气效果良好便可以继续加料以此来提高系统内总固体含量, 实验期望总固体含量达到20%以上, 厌氧消化反应平稳, 产气速率波动不大.发酵罐侧边进料口与出料口采用连通器原理, 进料口加入物料时出料口会排出相应体积的混合发酵液, 进、出料量基本一致.通过调节, 使反应环境朝利于厌氧消化的方向进行.
实验每天监测记录餐厨垃圾固态发酵产气速率和pH, 控制体系的pH值在6.8~7.4, 当pH值低于6.8时, 系统无法自身调节, 选择NaOH为调节剂, 碱的用量依据每天测得的pH值按照酸碱中和公式计算所得, 人为调节使消化液pH值保持在6.8~7.4之间.每48 h取出罐内物料一次, 监测COD、氨氮、VFAs及各单成分酸的浓度, 分析固态发酵过程中各参数之间的变化趋势及相互关系, 重点研究固态发酵过程中挥发性脂肪酸的变化及与各参数之间的关系.实验稳定运行100 d.
2.3 分析方法TS采用烘干法(105 ℃)测定, VS使用马弗炉(550 ℃)测定; pH值采用上海雷磁PHB-4便携式pH计测定; 液相中的COD采用重铬酸钾法测定(孙丽, 2011); 氨氮浓度采用钠氏试剂比色法测定(崔家荣, 2008); 挥发性脂肪酸(VFAs)采用液相色谱外标法分析测定(孙绪顺等, 2009), 得到出峰时间之后, 进行色谱分析, 出峰时间与挥发性脂肪酸各组分的含量相对应.
3 结果与讨论(Results and discussion) 3.1 餐厨垃圾固态发酵全过程分析根据VFAs与产气及其他参数的变化情况, 将餐厨垃圾固态发酵实验过程划分为4个时期:适应期(0~13 d)、启动期(14~30 d)、抑制期(31~50 d)、恢复及稳定期(51~100 d).
3.1.1 适应期将0.3 kg的餐厨垃圾加入到反应器内, 适应期每隔2 d加一次料, 一次投料0.3 kg, 此时水解类微生物和产甲烷类微生物需要逐渐适应环境的变化, 此阶段只发生水解酸化反应.微生物进入到新的环境当中, 颗粒有机物首先经过物理化学过程初步分解成蛋白质等大分子物质, 随后水解细菌分泌胞外酶将大分子物质转化成可溶解性的单糖、氨基酸等小分子物质.反应器内的TS为4.09%, pH值为5.85(图 2).此时环境中营养物质比较充足, 对于微生物生长繁殖有害的物质浓度较低, 故产气逐渐上升, 最高达到0.74 L·L-1·d-1.随着易被降解的有机底物被降解, 产生小分子有机酸, 在适应期末期(第13 d)pH下降到5.33, 随着pH的降低, VFAs浓度逐渐上升, 达到19.97~22.85 g·L-1, 进而抑制产甲烷菌的活性, 故产气虽然逐渐上升, 但也维持在一个较低的水平上.
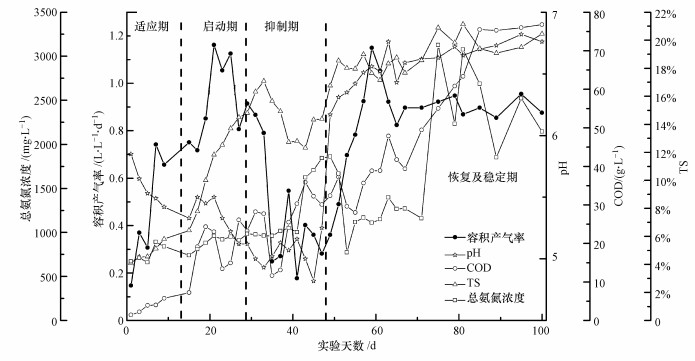 |
| 图 2 餐厨垃圾固态发酵过程中容积产气率与pH、氨氮、COD及TS的变化关系 Fig. 2 Relationship between volume loading rate and pH, total ammonia concentration, COD and TS during solid-state fermentation of food waste |
此阶段微生物已经完全适应了环境, 开始进行快速的生长代谢, 从第14 d开始, 每隔2 d投一次料, 一次增加到0.5 kg, TS含量由6.42%(第15 d)提高到14.8%(第29 d).部分产甲烷菌经过适应期后对餐厨垃圾的适应性逐渐增加, 将一部分水解产出的小分子有机酸转化为沼气, 故容积产气率持续增加, 形成产气高峰, 最高达到1.16 L·L-1·d-1 (冯磊, 2014).但由于TS含量的提高, 反应底物中易被降解的大分子有机物水解后产生的小分子有机酸也更多, 最高达到25.21 g·L-1, 有机酸的积累导致pH下降(第29 d pH下降至5.12), 进而抑制产甲烷菌的活性.随着pH的进一步降低, 虽然产甲烷菌的活性经过适应期后有所提高, 但水解细菌分解大分子有机物的速率要比产甲烷菌代谢有机酸的速率高得多, 故启动期运行状况并不稳定, 启动后期pH持续下降, 产气高峰后产气速率也在降低.
3.1.3 抑制期同启动期相同, 每隔2 d投一次料, 一次投料0.5 kg, 但此时产气速率直线下降, 并持续停留在较低水平, 最低为0.18 L·L-1·d-1, 此时pH最低为4.82(第45 d), 系统自身无法进行调节.在酸性环境下有利于脂肪、纤维素等不易降解的大分子有机物水解成小分子有机酸, 此时有机酸波动明显, 在22.22~26.09 g·L-1之间来回波动, 由于酸化严重导致产甲烷菌等微生物代谢活动受到严重抑制.
3.1.4 恢复及稳定期由于系统无法自行调节pH值到6.8以上, 故加入NaOH来调节反应器内的pH值, 使pH上升并逐步接近7.0, 以提高产甲烷菌的活性, 此时每天投料1 kg, TS含量逐步提高, 在75 d时达到20%以上, 此时容积产气率逐步上升并达到稳定, 平均产气率为0.88 L·L-1·d-1.稳定期后期不需对pH进行调节, 随着进料pH值也无明显下降, VFAs停留在20~22 g·L-1之间, 容积产气率与TS含量保持相对稳定的关系.
3.2 餐厨垃圾固态发酵容积产气率与TS及COD的变化研究不同时期的容积产气率和TS含量表现出不同的阶段性变化, 因产气速率和投料强度的不同而在图 2不同阶段的斜率上表现出明显差异.
适应期每隔2 d加一次料, 一次投料0.3 kg, 由于微生物刚刚进入新的环境需要一个适应过程, 故投料强度较低, 此时TS为4.09%.此时进入到发酵罐内的餐厨垃圾立即被水解类微生物水解, 故产气率逐渐上升, 从开始的0.15 L·L-1·d-1增长到末期的接近0.75 L·L-1·d-1.所产生的沼气中甲烷气体的比例约为25%~35%, 这主要是由于投料过程中虽经过氮气吹脱, 但仍带入少量氧气, 这些氧气被兼性厌氧类微生物利用水解底物, 促进有机酸产出的同时还会产生二氧化碳, 此时厌氧消化产甲烷菌的活性因为处于适应阶段, 并且由于过低的pH值而受到抑制(Culp et al., 1991; Adhikari et al., 2006; Arellano et al., 2006; Feng et al., 2013), 餐厨垃圾固态发酵过程的适应期甲烷含量偏低, 为25%~35%.随着投料次数的增加, 在适应期末期TS达到6%左右.由于投料强度不够, 水解进行较快, 此时产气率的增长速率要比TS的增长速率快.因其投料少, 餐厨垃圾中易被降解的有机质发生水解酸化, 虽然后期的气化产甲烷过程进展不顺利, 但仍能促进有机底物的分解, 所以这段时期的餐厨垃圾平均厌氧生物降解率为68.23%, COD也较低, 为1.43~7.23 g·L-1(图 2).
启动期每隔2 d投一次料, 一次增加到0.5 kg, 随着投料强度的增加, TS含量由6.42%(第15 d)逐步提高到14.8%(第29 d).随着TS的升高, 启动期微生物已经完全适应了环境, 产气骤增, 达到1.16 L·L-1·d-1.微生物生长代谢速度越快则反应越容易进入到产酸阶段和产氢产乙酸阶段, 餐厨垃圾中易被降解的有机底物的水解产物小分子有机酸也越多, 有机酸的积累在降低pH值的同时也抑制了产甲烷菌的活性, 导致有机酸的进一步积累, 进而使pH值进一步降低.因此, 在启动阶段发酵产出的沼气中甲烷含量虽略有提高, 但仍然维持在较低水平, 为40%~45%左右.厌氧发酵过程中水解酸化产甲烷过程的不连续性, 导致反应底物不能及时被降解, 虽发生水解反应, 但水解性能比适应性阶段略有下降, 其生物降解率亦由适应性阶段的68.23%下降至54.95%.
启动期COD最大为23.22 g·L-1(第21 d), 反应器的整体运行情况并不稳定, 尚不能实现每日出料与进料; 抑制期没有人为控制pH, 产甲烷菌受到严重抑制, 产气率为0.18~0.55 L·L-1·d-1.由于过低的pH值抑制了产甲烷菌活性, 同时, 大部分有机质无法分解而导致有机底物的积累, 其生物降解率亦由启动阶段的54.95%下降至23.28%, 此时期产出的沼气中甲烷含量回落至25%~35%, 除易被降解的有机质发生水解反应外, 大部分有机质都没有被分解而直接排出.此时COD值也呈上升趋势, 最高值约为35.89 g·L-1.
恢复及稳定期加入NaOH以调节反应器内的pH值上升并逐步接近于7.0, 此时每天投料1 kg, TS含量逐步提高, 在75 d时达到20%以上, 此时容积产气率逐步上升并达到稳定, 平均产气率为0.88 L·L-1·d-1, 实现每日餐厨垃圾的出料与进料, 产气率与TS含量保持相对稳定的关系.通过碱液(NaOH)调节pH值接近7.0时, 厌氧消化产甲烷菌的生物酶活性增大, 提高了酶促反应速度, 促进了水解产出的有机酸的代谢及甲烷的产出, 恢复及稳定期发酵产出的沼气中甲烷含量达到50%~55%.生物降解率由适应期的68.23%、启动期的54.95%、抑制期的23.28%稳定在55.1%左右.这主要是由于随着进料负荷的增大, 反应器底部出料的TS、VS及挥发性固体占TS的比例都稳步增加(Kim et al., 2002), 这符合隋继超等(2007)研究的有机质去除率随反应器容积负荷升高而降低的一般规律.稳定期每日持续进料, 反应系统完成餐厨垃圾固态发酵.
对于一个长期运行的厌氧消化系统, 随着填料量的增加和TS含量的提高, 消化液的氨氮浓度提高至对厌氧消化产甲烷菌的毒害浓度, 进而抑制其活性, 系统的稳定性与产气能力开始降低的过程称为氨氮抑制.适应期由于TS含量较低, 氨氮浓度在670~740 mg·L-1之间, 这些氨氮主要来源于蛋白质和氨基酸的生物降解; 启动期随着投加物料的增加, 氨氮浓度也稳步上升, 由740 mg·L-1升高到982 mg·L-1.虽然产甲烷菌的活性经过适应期后有所提高, 但水解细菌分解大分子有机物的速率要比产甲烷菌代谢有机酸的速率高得多, 故启动期运行状况并不稳定, 启动后期pH持续下降, 产气高峰后产气率也在降低; 在抑制阶段产气率在0.18~0.55 L·L-1·d-1之间, TS含量下降至12.32%.如图 2所示, 抑制期氨氮浓度稳定持续上升, 直到43 d开始由1002 mg·L-1骤增至1624 mg·L-1; 恢复及稳定期氨氮浓度波动很大, 后期甚至超过其他文献中厌氧消化氨氮抑制上限浓度2500 mg·L-1(Koster et al., 1984), 但并未出现氨氮抑制现象, 可以认为微生物群已经完全适应了餐厨垃圾的固态发酵反应, 对于高浓度的氨氮具有一定的抵抗能力, 可以实现良好的运行状况.
3.3 餐厨垃圾固态发酵VFAs与pH及容积产气率的变化研究挥发性脂肪酸是固态发酵重要的中间产物, 在餐厨垃圾固态发酵过程中主要产生乙酸、丁酸、丙酸、戊酸、异丁酸和异戊酸等有机酸, 总的挥发性脂肪酸指的就是从乙酸到戊酸的混合物.餐厨垃圾固态发酵水解酸化阶段所产生的VFAs作为水解酸化产物, 是产甲烷菌可以直接利用的反应基质, 其含量和组成直接影响着后续甲烷化阶段的物质转化效率, 分析VFAs与容积产气率随时间的变化及产生情况, 可以为餐厨垃圾固态发酵过程中产酸技术的发展提供依据, 对于餐厨垃圾固态发酵反应器的稳定运行也具有理论指导意义.另外, pH和容积产气率的变化对VFAs的产量和组成都有一定程度的影响, pH作为重要的影响因素, 不仅可以影响微生物酶的活性从而影响产气, 也能够决定挥发性有机酸的存在形态(张玉静等, 2013).
3.3.1 VFAs组分及其产量随pH的变化由图 3可以看出, VFAs随着时间的推移先快速增加, 然后逐渐下降且波动明显, 最后又逐渐趋于平稳.分阶段分析, 适应期随着pH的降低, VFAs浓度逐渐上升, 保持在19.97~22.85 g·L-1之间.这是由于微生物逐渐适应环境, 部分细菌可以发生水解将易被降解的大分子有机物水解成小分子有机酸所致, 这时检测到VFAs组成包括乙酸、丙酸、正丁酸、异丁酸、戊酸和己酸, 所占比例为正丁酸>乙酸>己酸>异丁酸>戊酸>丙酸, 且随着pH的降低, 有机酸各组成部分都在呈逐渐上升的趋势.启动期随着TS的提高, pH进一步降低, VFAs快速增加积累, 最高达到25.21 g·L-1, 之后又逐渐下降.这是由于经历适应期后产甲烷菌适应了环境, 部分产甲烷菌将小分子有机酸转化为沼气, 但此阶段水解细菌仍然进行水解不断产出新的有机酸, 故VFAs不会持续下降, 后期还会积累升高.在20 d左右时VFAs各组成部分浓度都出现骤增的现象, 乙酸、丙酸和正丁酸较为明显, 分别从5.01、2.74、5.48 g·L-1上升到6.49、3.71、6.66 g·L-1, 出现一个产酸高峰后又逐渐下降, 此时pH值为5.45.抑制期pH持续降低, 有机酸波动明显, 在22.22~26.09 g·L-1之间来回波动, 在酸性条件下利于产酸细菌的水解, 从而抑制产甲烷菌的活性, 故VFAs总体维持在一个较高的水平上.第30 d有机酸各组分又出现一次产酸升高趋势, 除了异丁酸和戊酸基本保持平稳状态外, 乙酸、丙酸、正丁酸和己酸都又一次升高, 出现二次酸化现象, 此阶段主要产物为正丁酸, 此时pH值为5.0.恢复及稳定期, 由于人为调控了pH值, pH迅速升高接近7.0, 基本解除了对于产甲烷菌的抑制, 有机酸被产甲烷菌分解后逐渐下降, 由于大部分甲烷逸出反应器, 氨以亚硝酸铵和碳酸铵的形式存在于反应器中, 可以中和有机酸, 为产甲烷菌创造碱性环境, 使得有机酸的产生和沼气的生成维持一种动态平衡, VFAs最终停留在一个稳定的水平上(22~22 g·L-1).总的挥发性脂肪酸在第55 d达到最大, 为27.39 g·L-1, 此时pH为6.42.此时乙酸和丁酸(异丁酸、正丁酸)所占比例最大, 分别为21.44%和39.41%;其次是己酸, 占16.87%;戊酸和丙酸分别占12.13%和12.05%.在脱氮除磷过程中, 有机酸被利用的先后顺序为乙酸 > 丁酸 > 戊酸 > 丙酸(Elefsiniotis et al., 2007), 而此时脱氮除磷效率较高的乙酸和丁酸所占比例很大, 有利于脱氮除磷过程的实现.
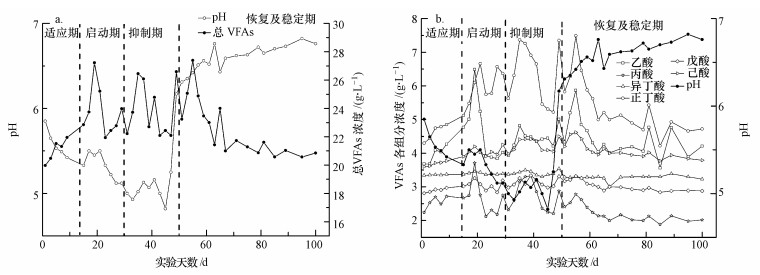 |
| 图 3 餐厨垃圾固态发酵过程中pH与VFAs总量(a)及各组分(b)的变化关系 Fig. 3 Relationship between pH and VFAs during solid-state fermentation of food waste |
根据发酵产物的不同, 固态发酵也被分为不同的发酵类型, 如丁酸型发酵、丙酸型发酵、乙醇型发酵和混合型发酵(张玉静, 2013).发酵产酸的过程可以认为是微生物在共同作用下的结果, 而不同类型的微生物对于环境的要求不同, 在适宜环境下某些微生物成为优势菌种造成某些产物大量产生.pH的改变通过影响细菌的活性, 进而影响产酸.同时, 有机酸的积累又会反过来影响pH.由于对厌氧消化的抑制毒性为丙酸>丁酸>乙酸, 因此, 丙酸的积累又会使pH继续下降, 丁酸的积累对pH的改变不大, 乙酸的积累则会使pH上升(Wittmann et al., 1995).从图中可以看到, 从开始到实验结束, 正丁酸比例一直处于较高水平, 其次是乙酸, 乙酸和丁酸占总VFAs的60%左右.实验过程中pH基本保持在5~7之间, 故可以认为pH在5~7之间时, 为丁酸型发酵, 这与有关文献报道相符(郑明月等, 2012).当pH值为5.45和5.00时, VFAs各组分均有一次产酸高峰, 在pH为6.42时总的VFAs浓度达到最高值, 取3次均值pH接近6.0, 故可以推断餐厨垃圾固态发酵产VFAs的最佳pH为6.0.
3.3.2 VFAs组分及其产量随容积产气率的变化图 4体现了餐厨垃圾固态发酵厌氧消化过程中挥发性脂肪酸及其各组分与产气量的相关性.在反应的适应期, 产气量及VFAs浓度都比较低, 分别为2496 mL·d-1和19.97 g·L-1, 适应期持续时间约为12 d; 在这一时期, 反应进行缓慢, 反应所投加的餐厨垃圾量较少(300 g), 此时的TS含量较低(4.09%~5.81%), 随着产气量升高丁酸所占比例达到最大, 大分子有机物先被降解为小分子有机物丁酸, 并进行积累.随着反应的进行, 固态发酵反应进入启动期(持续约16 d), 在餐厨垃圾固态发酵厌氧消化的启动时期, 随着反应的进行, 产气量和TS逐步上升, 且产气量波动较明显, 同时VFAs的浓度开始下降, 产气量与VFAs呈现相反的变化趋势; 此时期由于TS含量提高, 反应底物餐厨垃圾中易被降解的有机底物的水解产物小分子有机酸也越多, 厌氧消化产甲烷菌的活性经过为期13 d的适应期后, 对餐厨垃圾的适应性逐渐增加, 将一部分水解产出的小分子有机酸转化为沼气, 导致日产气量增加, VFAs浓度降低.适应期积累的丁酸会直接被降解为乙酸, 因此, 在适应期乙酸会有一个最高值, 乙酸所占比例上升, 但随后持续下降, 这是由于VFAs被微生物作为碳源利用, 而乙酸优先被利用(王权等, 2014).随后, 反应进入抑制期, 在这一时期系统产气量锐减, 消化液中pH持续下降, 投料量减少, 反应几乎接近停滞状态; 正丁酸此时占主导地位, 乙酸和丁酸的变化趋势趋同; 此时, 发酵液中的小分子有机酸大量的累积, 系统自身无法调节pH, 因此, VFAs含量大大提高.反应抑制期过后, 进入到恢复及稳定期, 在这一时期, 在加料的同时滴加氢氧化钠(NaOH)来调节系统的pH, 产气量随着pH的上升而呈现上升的趋势, 在抑制期积累的大量有机物及小分子的有机酸开始在细菌的作用下进行消化反应, 因此, VFAs的浓度开始呈现递减趋势, 达到稳定期后, 产气量和VFAs虽有波动, 但都维持在一定的范围内, 并且实验开始稳定地运行.
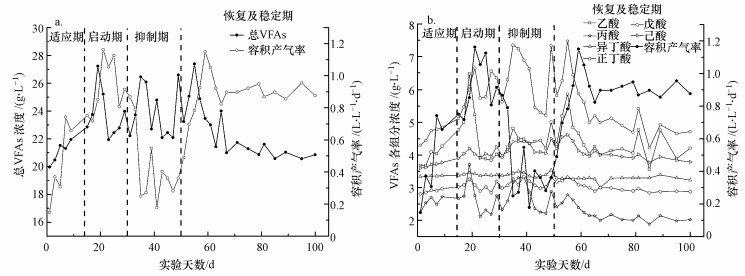 |
| 图 4 餐厨垃圾固态发酵过程中容积产气率与VFAs总量(a)及各组分(b)的变化关系 Fig. 4 Relationship between the total amount of VFAs and the volume loading rate during solid-state fermentation of food waste |
1) 根据产气及其他参数的变化情况, 将餐厨垃圾固态发酵实验过程划分为4个时期:适应期(0~13 d)、启动期(14~30 d)、抑制期(31~50 d)、恢复及稳定期(51~100 d).不同时期的容积产气率和TS含量表现出不同的阶段性变化, 因产气速率和投料强度的不同在不同阶段的斜率上表现出明显差异.
2) 不同时期的容积产气率、VFAs及各参数均表现出不同的阶段性变化.产气和投料强度在适应期和抑制期相对较低, 在恢复及稳定阶段以NaOH稀碱液调节当日回流渗滤液的pH值, 在第63 d时pH值上升至6.76, VFAs含量稳定在20~22 g·L-1之间, 产气量明显提高, 在81 d时TS达到20%以上, 系统容积产气量和生物降解率均保持相对稳定.
3) VFAs产量与组分同pH和容积产气率之间相互影响.pH通过影响细菌的活性而影响产酸, 同时有机酸的积累又反过来影响pH.在餐厨垃圾固态发酵全过程中, pH保持在5~7之间, 正丁酸比例一直处于较高水平, 为丁酸型发酵; VFAs同容积产气率也呈相反的变化趋势, 有机酸被产甲烷菌分解产生甲烷气体导致产气量升高, 同时有机酸被产甲烷菌分解后VFAs产量降低.VFAs与pH和容积产气率在初期基本保持反比关系, 最终在稳定期达到平衡, 均稳定在一定范围内波动.
Adhikari B K, Barrington S, Martinez J. 2006. Predicted growth of world urban food waste and methane production[J]. Waste Management Research, 24(5): 421–433.
DOI:10.1177/0734242X06067767
|
Ahn Y, Gomec C Y, Kim M, et al. 2003. Hydrolysis and acidogenesis of particulate organic material in mesophilic and thermophilic anaerobic digestion[J]. Environmental Technology, 24(9): 1183–1190.
DOI:10.1080/09593330309385659
|
Arellano A V, Cristancho D E, Edgar F C M. 2006. Study of the operational conditions for anaerobic digestion of urban solid wastes[J]. Waste Management, 26(5): 546–556.
DOI:10.1016/j.wasman.2005.06.003
|
Barillon B, Canler J P, Hyaric R L, et al. 2010. Pilot-scale anaerobic digestion of screenings from wastewater treatment plants[J]. Bioresource Technology, 101(23): 9006–9011.
DOI:10.1016/j.biortech.2010.06.150
|
Culp A W. 1991. Principles of Energy Conversion[M]. Singapore: McGraw-Hill.
|
曹霏霏, 李红丽, 王岩. 2014. 挥发性脂肪酸对厌氧干式发酵产甲烷的影响[J]. 环境工程学报, 2014, 8(6): 2572–2578.
|
崔家荣. 2008. 水中氨氮纳氏试剂分光光度法测定[J]. 现代农业科技, 2008(8): 208–209.
|
Deckwer W D, Wittmann C, Zeng A P. 1995. Growth inhibition by ammonia and use of a pH-controlled feeding strategy for the effective cultivation of Mycobacterium chloropheolicum[J]. Applied Microbiology and Biotechnology, 44: 519–525.
DOI:10.1007/BF00169954
|
EI Mashad H, Hartman K, Zhang R H, et al. 2007. Characterization of food waste as feedstock for anaerobic digestion[J]. Bioresource Technology, 98(4): 929–935.
DOI:10.1016/j.biortech.2006.02.039
|
Elefsiniotis P, Wareham D G. 2007. Utilization patterns of volatile fatty acids in the denitrification reaction[J]. Enzyme and Microbial Technology, 41(1/2): 92–97.
|
Feng L, Li R D. 2013. Process parameters of dry co-anaerobic digestion of kitchen waste and cow manure on laboratory scale[J]. Journal of Pure and Applied Microbiology, 21(9): 777–782.
|
冯磊. 2014. 寒冷地区餐厨垃圾干发酵及沼气微氧脱硫机理研究[D]. 天津: 天津大学. 50-62
http://d.wanfangdata.com.cn/Thesis/D655282 |
宫常修, 蒋建国, 王权, 等. 2014. NaCl对餐厨垃圾厌氧发酵产VFA浓度及组分的影响[J]. 中国环境科学, 2014, 34(12): 3127–3132.
|
黄燕冰. 2015. 餐厨垃圾高温干式厌氧消化工艺研究[D]. 北京: 北京工商大学. 4-7
http://cdmd.cnki.com.cn/Article/CDMD-10011-1015812949.htm |
Jiang J, Li K, Zhang Y, et al. 2013. Volatile fatty acids production from food waste:Effects of pH, temperature, and organic loading rate[J]. Bioresource Technology, 143: 525–530.
DOI:10.1016/j.biortech.2013.06.025
|
贾志莉. 2013. 干式厌氧发酵技术研究综述[J]. 广州化工, 2013, 41(14): 40–42.
DOI:10.3969/j.issn.1001-9677.2013.14.015 |
蒋建国, 隋继超, 吴时要, 等. 2007. 有机垃圾单级高固体厌氧消化启动实验研究[J]. 环境科学, 2007, 28(3): 684–688.
|
蒋建国, 王佳明, 张玉静. 2013. pH值对餐厨垃圾厌氧发酵产挥发性脂肪酸的影响[J]. 中国环境科学, 2013, 33(4): 680–684.
|
Karthikeyan O P, Selvam A, Wong J W C. 2015. Hydrolysis-acidogenesis of food waste in solid-liquid-separating continuous stirred tank reactor (SLS-CSTR) for volatile organic acid Production[J]. Bioresource Technology, 200: 366–373.
|
Kaushik R, Parshetti G K, Pham T P T, et al. 2015. Food-waste-to-energy conversion technologies:Current status and future directions[J]. Waste Management, 38: 399–408.
DOI:10.1016/j.wasman.2014.12.004
|
Kim M, Ahn Y H, Speece R E. 2002. Comparative process stability and efficiency of anaerobic digestion; mesophilic vs thermophilic[J]. Water Research, 36(17): 4369–4385.
DOI:10.1016/S0043-1354(02)00147-1
|
Komemoto K, Lim Y G, Nagao N, et al. 2009. Effect of temperature on VFAs and biogas production in anaerobic solubilization of food waste[J]. Waste Management, 29(12): 2950–2955.
DOI:10.1016/j.wasman.2009.07.011
|
Koster I W, Lettinga G. 1984. The influence of ammonium-nitrogen on the specific activity of palletized methanogenic sludge[J]. Agric Wastes, 9(3): 205–216.
DOI:10.1016/0141-4607(84)90080-5
|
李春杰, 孙绪顺, 褚春凤. 2009. 反相高效液相色谱测定厌氧反应上清液中挥发性脂肪酸[J]. 净水技术, 2009, 28(1): 64–66.
|
马磊, 王德汉, 曾彩明. 2007. 餐厨垃圾的干式厌氧消化处理技术初探[J]. 中国沼气, 2007, 25(1): 27–30.
|
Li Y B, Park S Y, Zhu J Y. 2011. Solid-state anaerobic digestion for methane production from organic waste[J]. Renew Sust Energ Rev, 15: 821–826.
DOI:10.1016/j.rser.2010.07.042
|
孙丽. 2011. 重铬酸钾法测定水中COD分析法研究[J]. 冶金动力, 2011(2): 73–75.
|
吴清莲. 2015. 餐厨垃圾厌氧发酵产挥发性脂肪酸的研究[D]. 哈尔滨: 哈尔滨工业大学
http://d.wanfangdata.com.cn/Thesis/D754821 |
张玉静. 2013. 餐厨垃圾厌氧水解产挥发性脂肪酸技术研究[D]. 北京: 清华大学. 22-40
http://cdmd.cnki.com.cn/Article/CDMD-10003-1014020967.htm |
郑明月, 郑明霞, 王凯军, 等. 2012. 温度、pH和负荷对果蔬垃圾厌氧酸化途径的影响[J]. 可再生能源, 2012, 30(4): 75–79.
|
 2017, Vol. 37
2017, Vol. 37


