氮元素是生物生长发育所需的基本元素之一, 虽然地球大气中氮气分子占78%, 但因氮气分子较稳定, 大多数生物体无法直接利用.地球上生物在消化吸收氮元素之前, 需通过各种途径将氮转化为含氮的化合物(葛诚, 2000).自然界固定氮主要通过闪电和固氮细菌, 但自然固氮远远满足不了农业生产的需求, 因此, 人工固氮成为重要的研究方向.目前, 工业上应用较多的人工固氮方法是Haber-Bosch法(Berl et al., 1928), 但该方法需要苛刻的高温、高压反应条件, 这会加剧不可再生化石燃料的消耗及温室效应的发生.因此, 如何能够在温和条件下实现人工固氮是一个有待解决的科学问题.由于固氮体系是一个热力学意义上不能自发进行的反应, 单氮分子的三键键能为94l kJ·mol-1, 第一电离势为15.58 eV, 具有较高的稳定性(谈敏, 2011), 因而很难实现常温常压下的氮转化.光催化技术因其反应条件温和、高效清洁, 在固氮领域越来越受到人们的关注.
在1977年, Guth等(1928)最早探究到可用掺Fe的TiO2粉末进行光催化固氮的还原反应.之后又有研究(Bard et al., 1987; Berl et al., 2005)发现, 负载Fe的TiO2粉末在紫外光的照射下能将氮还原成氨.最近, Zhao等(2015)采用β-Ga2O3作为光催化剂研究了光催化固氮的条件和机理, 也证明β-Ga2O3在紫外光下有很好的光催化固氮效果.Li等(2015)研究了BiOBr纳米片光催化固氮, 发现对BiOBr引入氧空位可极大地提高BiOBr光催化固氮的效果.Ga2O3是一种透明的宽禁带半导体材料, 具有优良的化学稳定性、热稳定性、导电性和发光特性(Binet et al., 1998; Tham, 2005).在自然界, Ga2O3主要有5种不同的晶型, 其中, β-Ga2O3最稳定, 被广泛地应用于光催化研究.β-Ga2O3室温下的禁带宽度约为4.8 eV(Binet et al., 1998), 在紫外光下有很好的光吸收能力, 且因其合适的导带位置使其光生电子具有较强的还原能力, 适合进行光催化固氮的反应.In2O3存在3.6 eV的直接禁带宽度和2.8 eV的间接禁带宽度(Quarto et al., 1997), 对紫外光有很好的吸收, 被应用于半导体气体传感器、光电设备、太阳能电池及紫外光催化中(Xu et al., 2012; Cui et al., 2001).已有研究证实, 掺杂金属离子有利于引入氧空位, 从而提高催化剂的光催化效果(Jing et al., 2006; Choudhury et al., 2013).
因此, 本文拟对Ga2O3掺杂In2O3来进行催化剂的改性, 使其氧空位得以增多, 并利用In2O3自身对紫外光的响应来提高Ga2O3的光催化固氮性能.具体以硝酸铟为前驱体, 将氧化铟掺杂到氧化镓上制得In2O3/Ga2O3, 通过分析测试手段对其进行一系列的表征, 并系统研究材料的焙烧温度、In2O3掺杂比例、空穴捕获剂种类和通入的氮源等因素对光催化固氮性能的影响.
2 材料与方法(Materials and methods) 2.1 实验仪器与材料仪器:HH-2数显恒温水浴锅、85-1磁力搅拌器、BS224S分析天平、DZF-6021真空干燥箱、LD5-10低速离心机、紫外-可见分光光度计VIS-7220、光催化反应仪器XPA-7型、SK2-1-10电阻炉.
材料:硝酸铟水合物(纯度99.9%)、氧化镓(纯度99.99%)购自阿拉丁试剂(上海)有限公司; 草酸钠、正丙醇、正丁醇、叔丁醇均为分析纯, 购自成都市科龙化工试剂厂; 高纯氮气(99.999%)购自南京文达特种气体有限公司; 去离子水为实验室自制.
2.2 样品的制备具体制备过程为:将1 g Ga2O3均匀分散于一定浓度的硝酸铟溶液中, 在恒温80 ℃水浴加热条件下搅拌至干; 将所得材料在60 ℃下真空干燥24 h后, 在一定的温度下焙烧4 h, 最终制得掺杂In2O3的Ga2O3, 命名为x In2O3/Ga2O3(y), 其中, x代表通过ICP-AES检测出的实际In2O3所占质量比, y为焙烧温度, 本实验的焙烧温度分别为300、500和700 ℃.
2.3 样品的表征X射线衍射(XRD)分析采用的是Bruker公司的D8 Advance型X射线衍射仪, 铜靶, Kα射线(λ=0.15045 nm), 管电压30 kV, 管电流20 mA, 扫描速度8°·r-1; 样品微观结构采用日本JEOL公司JEM-200CX型透射电子显微镜(TEM)观察, 加速电压200 kV; XPS分析采用日本Ulvacphiin公司PHIQUANTERA(Ⅱ) X射线光电子能谱仪, 采用PerkinElmer系统(RBD升级的PHI-5000C ESCA系统), 单色器为Al Kα激发射线源, 其能量为hν=1253.6 eV; UV-Vis DRS测试采用日本岛津公司UV-2500型紫外-可见漫反射光谱仪, 测定波长范围为200~800 nm, 以BaSO4为参比样, 采用干压法制备测试样品; 光致发光光谱(PL)分析采用的是法国jobinYvon SPEX Fluorolog-3-P型荧光光谱仪, 测定波长范围为200~800 nm; 采用美国PE公司的Optima 7000DV型电感耦合等离子体原子发射光谱仪(iNductive Coupled Plasmaemission Spectrometer, ICP-AES)对材料实际金属负载量进行测定.
2.4 实验方法在XPA-7型光催化反应器(南京胥江机电厂)中进行光催化固氮反应实验.该反应器通过曝气和磁力搅拌的方法使催化剂在溶液中与通入的氮气充分接触, 光源在反应器内部持续照射, 通入循环水以保持反应装置处于恒温.取50 mL含有一定浓度空穴捕获剂的水溶液置于反应器中, 加入0.02 g催化剂, 以空气或者高纯氮气作为氮源, 密封搅拌30 min, 使催化剂均匀分散在溶液中, 然后打开500 W汞灯作为紫外光光源, 进行光催化固氮实验, 反应时间为3 h, 按设定时间间隔取样.
2.5 分析方法对所取样品溶液进行离心, 将上清液稀释至合适浓度, 根据氨氮测定的国家标准(GB7479-87), 加入适量的纳氏试剂和酒石酸钾钠溶液, 利用紫外-可见分光光度计来测量溶液中NH4+-N浓度, 计算光催化固氮过程中的固氮效率.
3 结果与讨论(Results and discussion) 3.1 催化剂的表征 3.1.1 XRD分析图 1是In2O3、Ga2O3和2.29% In2O3/Ga2O3的XRD谱图.在Ga2O3谱图中, 出现了明显的衍射峰, 分别出现在30.45°、31.74°、33.47°、35.18°、37.25°、38.40°、45.81°、48.59°、57.64°和64.65°, 对应于Ga2O3的(401)、(002)、(111)、(111)、(310)、(311)、(600)、(510)、(313) 和(403) 晶面(JCPDS No.43-1012).在2.29%In2O3/Ga2O3的XRD谱图中, 归属于Ga2O3的衍射峰位置没有明显变化, 这说明采用浸渍法负载In2O3后没有改变Ga2O3的晶格结构.但与Ga2O3相比, 2.29%In2O3/Ga2O3中归属于Ga2O3的XRD图谱与标准图谱更接近, 说明2.29% In2O3/Ga2O3在焙烧之后会有更好的结晶度.此外, 在XRD的谱图中没有发现明显的In2O3衍射峰, 可能是因为In2O3颗粒在In2O3/Ga2O3材料表面的分布比较均匀.
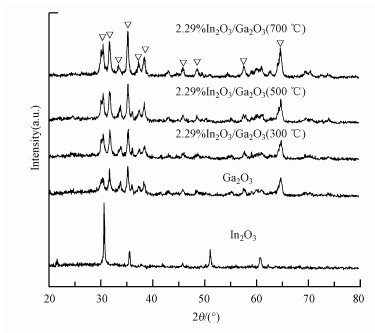 |
| 图 1 In2O3、Ga2O3和2.29%In2O3/Ga2O3的XRD谱图 Fig. 1 XRD patterns of In2O3, Ga2O3 and 2.29%In2O3/Ga2O3 |
TEM图可用来直观地反映金属粒子在载体表面的形貌及分布情况.2.29%In2O3/Ga2O3(500 ℃)的TEM图显示出该催化剂具有棒状结构, 且分布较均匀(图 2a).图 2b为2.29% In2O3/Ga2O3(500 ℃)的HRTEM图, 对其中不同晶格条纹的基底距离进行计算, 得到了0.23、0.27和0.29 nm的晶格间距, 分别与Ga2O3的(311)、(111)、(401) 的晶面相对应.此外, 还计算得到了0.41 nm的晶格间距, 这对应的是In2O3的(211) 晶面.说明在合成过程中没有改变In2O3和Ga2O3晶型, 且In2O3和Ga2O3能够很好地结合在一起.
 |
| 图 2 2.29%In2O3/Ga2O3(500 ℃)的TEM(a)和HRTEM(b)照片 Fig. 2 TEM(a) and HRTEM(b) images of 2.29%In2O3/Ga2O3(500 ℃) |
图 3a为2.29%In2O3/Ga2O3(500 ℃)的XPS In3d谱图.由2.29%In2O3/Ga2O3(500 ℃)中In3d的特征峰可知, In3d的光电子峰是由2个主峰组成, 其结合能分别为443.6 eV和451.2 eV, 分别对应于In 3d5/2和In 3d3/2, 说明掺杂在Ga2O3中的In2O3的In是以In3+的价态形式存在.图 3b为单纯Ga2O3和2.29%In2O3/Ga2O3的XPS O1s谱图.通过分峰发现, O1s的光电子峰是由2个主峰组成, 其结合能分别为530.4 eV和531.4 eV, 分别对应于Ga2O3晶格中的晶格氧(O′)和化学吸附氧(O″); 其中, 2.29%In2O3/Ga2O3中化学吸附氧的比例(O″/(O′+O″))比Ga2O3中化学吸附氧的比例大, 说明掺杂在Ga2O3表面上的In2O3有利于提高Ga2O3的氧空位.对比几种不同焙烧温度下的2.29%In2O3/Ga2O3催化剂, 发现2.29%In2O3/Ga2O3(500℃)的氧空位最多.
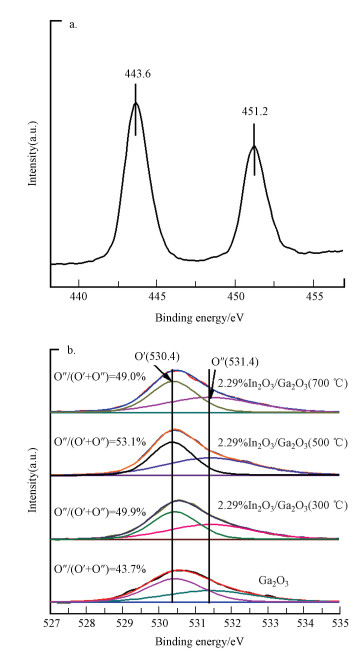 |
| 图 3 2.29%In2O3/Ga2O3(500 ℃)的XPS In3d谱图(a)及Ga2O3和2.29%In2O3/Ga2O3的XPS O1s谱图(b) Fig. 3 XPS spectra of In3d for 2.29%In2O3/Ga2O3(500 ℃)(a) and XPS spectra of O1s for Ga2O3 and 2.29%In2O3/Ga2O3(b) |
图 4a为Ga2O3和2.29%In2O3/Ga2O3的紫外漫反射光谱(UV-Vis DRS)图.可以看出, 2.29%In2O3/Ga2O3与Ga2O3相比, 吸收边际略有红移, 说明掺杂In2O3有利于拓宽材料紫外光范围的吸收域; 并且在紫外光的吸收能力明显增强, 其中, 2.29%In2O3/Ga2O3(500 ℃)紫外光吸收能力最强.Ga2O3和2.29%In2O3/Ga2O3的光致发光光谱(PL)如图 4b所示, 结果表明, 在相同光照激发(激发波长为325 nm)的情况下, 与Ga2O3相比, 2.29%In2O3/Ga2O3显示出更低的峰强, 表明其具有更好的电子空穴分离率, 且其中2.29%In2O3/Ga2O3(500 ℃)的电子空穴分离率相对最高.
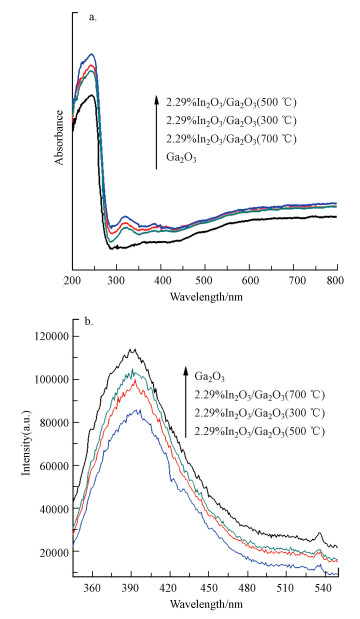 |
| 图 4 Ga2O3和2.29%In2O3/Ga2O3的紫外漫反射光谱图(a)和光致发光光谱图(b) Fig. 4 UV-vis absorption spectra(a) and photoluminescence spectra(b) of Ga2O3 and 2.29%In2O3/Ga2O3 |
图 5为2.29%In2O3/Ga2O3催化剂光催化固氮效果曲线.可以看出, 在紫外光照射3 h之后, 2.29%In2O3/Ga2O3(300 ℃)、2.29%In2O3/Ga2O3(400 ℃)、2.29%In2O3/Ga2O3(500 ℃)、2.29%In2O3/Ga2O3(600 ℃)和2.29%In2O3/Ga2O3(700 ℃)催化剂氨氮的产率分别是195.4、203.5、223.4、187.3和175.2 mg·L-1, 2.29%In2O3/Ga2O3(500 ℃)的光催化固氮效率最高.这可能是因为2.29%In2O3/Ga2O3(500 ℃)中氧空位含量较多, 而氧空位的产生和浓度的增加有利于催化剂对N2的吸附和活化, 使得催化剂表面电子能够更好地转移到N2上, 从而提高了N2光催化还原成NH3的效率(Li et al., 2015).故后面实验所采用的In2O3/Ga2O3材料均是在500 ℃下焙烧而成.
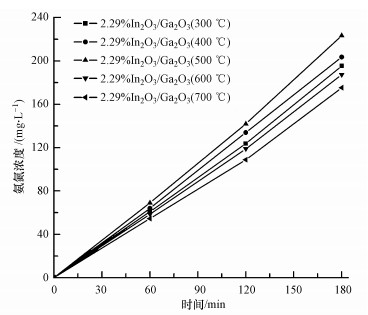 |
| 图 5 2.29%In2O3/Ga2O3的光催化固氮图 Fig. 5 Nitrogen photofixation of 2.29%In2O3/Ga2O3 |
为了进一步了解In2O3掺杂量对材料光催化固氮性能的影响, 图 6a比较了几种不同In2O3掺杂量的In2O3/Ga2O3(500 ℃)催化剂光催化固氮反应曲线.如图 6a所示, In2O3和Ga2O3对应的3 h后的氨氮产率分别为26.6 mg·L-1和168.6 mg·L-1, In2O3掺杂量为0.86%、2.29%、4.67%、9.76%的In2O3/Ga2O3(500 ℃)催化剂对应的3 h后的氨氮产率则分别为178.5、223.4、151.7、72.2 mg·L-1.由此看出, In2O3/Ga2O3的催化活性受In2O3掺杂量的影响, 且随着In2O3掺杂量的增加而先增后减.其原因可能是:当In2O3掺杂量较低时, Ga2O3表面缺乏足够俘获载流子的缺陷, 不能有效去捕获电子和空穴, 电子空穴的复合率较高, 从而导致光催化固氮性能较差; 而掺杂量的增加会导致其提供的捕获陷阱数也随之逐渐增加, 抑制电子空穴复合的效率得到提高, 使其光催化固氮性能变好; 但当掺杂量超过一定程度时, 光生载流子会在杂质位点上多次俘获后很容易失活, 掺杂离子成为电子和空穴的复合中心, 这样不利于载流子向界面的传送, 降低了Ga2O3表面的光强度, 从而降低了材料的光催化固氮效率.
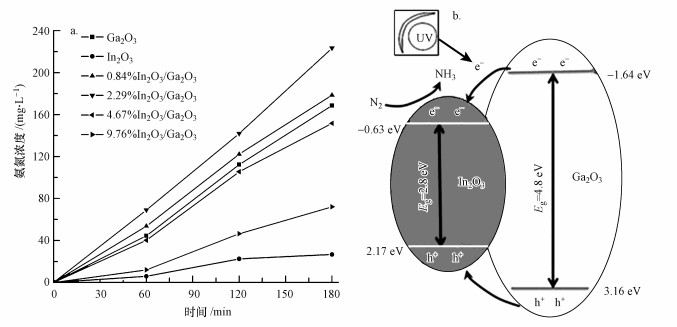 |
| 图 6 Ga2O3 and In2O3/Ga2O3(500 ℃)的光催化固氮效果(a)和在紫外光下In2O3/Ga2O3的光催化固氮机理(b) Fig. 6 Nitrogen photofixation of Ga2O3 and In2O3/Ga2O3(500 ℃)(a) and schematic diagram of nitrogen photofixation over In2O3/Ga2O3 under UV light irradiation(b) |
为说明In2O3/Ga2O3催化剂的光催化固氮过程, 图 6b给出了光生载流子在In2O3/Ga2O3催化剂表面的分离和转移过程.Ga2O3价带位置的氧化还原电位为3.16 eV, 导带位置的氧化还原电位是-1.64 eV(刘玉燕等, 2013), 而In2O3价带位置的氧化还原电位为2.17 eV, 导带位置的氧化还原电位是-0.63 eV(Lv et al., 2010).在500 W汞灯的照射下, Ga2O3被光激发产生电子空穴对, 电子快速地从价带跃迁到其导带上, 由于Ga2O3导带的氧化还原电位(-1.64 eV)比In2O3导带的氧化还原电位(-0.63 eV)更低, 所以Ga2O3表面的光生电子快速地转移到In2O3上, 且由于Ga2O3价带的氧化还原电位(3.16 eV)比In2O3导带的氧化还原电位(2.17 eV)更高, Ga2O3表面的空穴也很容易转移到In2O3上, 从而在Ga2O3和In2O3之间可以建立起优良的异质结构, 可以有效抑制Ga2O3光生载流子的复合, 提高催化剂的量子效率, 使N2更容易被还原成NH3.
3.2.3 空穴捕获剂及通入氮源对In2O3/Ga2O3光催化固氮性能的影响空穴捕获剂与半导体表面空穴在半导体光催化反应中可发生不可逆结合, 抑制其光催化剂表面电子和空穴的复合, 提高电子存在的寿命, 从而提高光催化还原的效率(Mori et al., 1999; Bems et al., 1999).因此, 选择合适的空穴捕获剂, 有效去抑制其中光生电子与空穴的复合, 对光催化固氮反应非常重要.本文主要研究了叔丁醇、正丙醇、正丁醇和草酸钠作为空穴捕获剂对2.29%In2O3/Ga2O3(500 ℃)光催化固氮的效果, 空穴捕获剂的加入量为0.5 mL, 结果如图 7a所示.由图可知, 叔丁醇、正丙醇、正丁醇和草酸钠作为空穴捕获剂时2.29%In2O3/Ga2O3(500 ℃)光催化固氮的氨氮产率分别为223.4、134.2、152.6、58.6 mg·L-1, 可以看出, 用叔丁醇作为空穴捕获剂时In2O3/Ga2O3光催化固氮效果最好.这可能是因为叔丁醇(TBA)的给电子能力(EHoMo)大于本实验中其他的空穴捕获剂, 最易被氧化, 并能够在反应中生成还原能力比较强的CO2·, 更容易将N2转化成NH3, 提高In2O3/Ga2O3的光催化固氮效率.
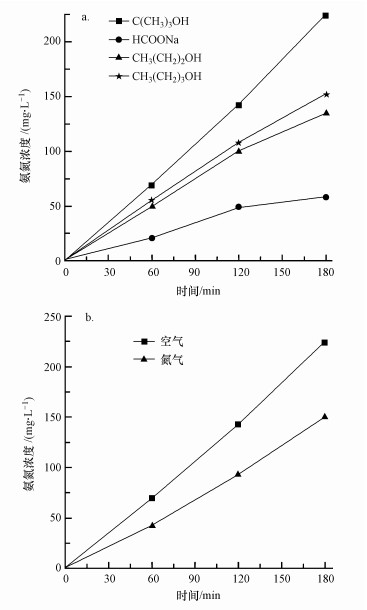 |
| 图 7 空穴捕获剂种类(a)和通入的氮源(b)对光催化固氮效率的影响 Fig. 7 Effect of hole scavengers(a) and effect of nitrogen sources(b) on nitrogen photofixation |
为了解氮源种类对In2O3/Ga2O3光催化固氮的效果, 本文研究了在通入空气和高纯氮气2种不同氮源的情况下2.29%In2O3/Ga2O3(500 ℃)的光催化固氮效果, 选用的空穴捕获剂为叔丁醇(TBA), 结果如图 7b所示.可以看出, 用空气作为氮源时, 2.29%In2O3/Ga2O3(500 ℃)的光催化固氮效果最好, 3 h光催化固氮的氨氮产率为223.4 mg·L-1, 约是高纯氮气作为氮源时氨氮产率的1.5倍.可能主要是因为空气中除了有78%的N2外, 还存在21%的O2, 而在有O2存在的条件下, 产生的O2·-能够快速地转化成·OH, 并能够与TBA反应生成还原能力强的CO2·, 将N2还原成NH3, 即在O2存在时同时存在直接电子转移和间接电子转移过程, 比通入高纯氮气时多了一个间接固氮过程, 有效地提高了其光催化固氮效率.
4 结论(Conclusions)1) 以硝酸铟为前驱体, 将氧化铟掺杂到氧化镓上成功制备出了In2O3/Ga2O3催化剂.结果显示, In2O3和Ga2O3很好地结合在了一起, In2O3的引入提高了Ga2O3的光吸收性能和氧空位的数量, 促进了表面光生电子和空穴的分离.
2) 当In2O3/Ga2O3用于光催化固氮反应时, 最佳In2O3掺杂量为2.29%, 最佳焙烧温度为500 ℃.在500 ℃下焙烧制备的2.29%In2O3/Ga2O3催化剂的光催化固氮效率相对于Ga2O3提高了32.5%.
3) 在空穴捕获剂的选择上, 加入叔丁醇的体系中, In2O3/Ga2O3的光催化固氮效率最高.并且通入的氮源对催化剂的光催化固氮性能也存在较大影响, 以空气作为氮源的光催化固氮过程因多了间接固氮过程, 故相对于以高纯氮气作为氮源的光催化固氮效率更高.
4) In2O3/Ga2O3光催化剂能够具有较高的光催化固氮性能, 一方面可能是由于Ga2O3和In2O3自身之间可以建立起优良的异质结构, 从而有效抑制光生载流子的复合, 促进光生电子-空穴对的分离; 另一方面, 材料氧空位的增加也在一定程度上有利于催化剂对N2的吸附和活化, 有利于表面电子能够更好地转移到N2上, 光生电子与空穴也得到有效分离.在两者的共同作用之下, N2光催化还原成NH3的效率得到了有效的提高.
Bems B, Jentoft F C, Schlögl R. 1999. Photoinduced decomposition of nitrate in drinking water in the presence of titania and humic acids[J]. Appl Catal B Environ, 20(2): 155–163.
DOI:10.1016/S0926-3373(98)00105-2
|
Berl E. 1928. Fritz haber zum 60.geburtstage[J]. Z Elektrochem Angew Phys Chem, 34(12): 797–803.
|
Binet L, Gourier D. 1998. Origin of the blue luminescence of β-Ga2O3[J]. J Phys Chem Solids, 59(8): 1241–1249.
DOI:10.1016/S0022-3697(98)00047-X
|
Choudhury B, Borah B, Choudhury A. 2013. Ce-Nd codoping effect on the structural and optical properties of TiO2 nanoparticles[J]. Mater Sci Eng B, 178(4): 239–247.
DOI:10.1016/j.mseb.2012.11.017
|
Cui J, Wang A, Edleman N L, et al. 2001. Indium tin oxide alternatives—high work function transparent conducting oxides as anodes for organic light-emitting diodes[J]. Adv Mater, 13(19): 1476–1480.
DOI:10.1002/1521-4095(200110)13:19<>1.0.CO;2-S
|
Endoh E, Bard A J. 1987. Heterogeneous photoreduction of nitrogen to ammonia on catalyst-loaded TiO2 powders[J]. New J Chem, 1(3): 217–219.
|
葛诚. 2000. 微生物肥料生产应用基础[M]. 北京: 中国农业科技出版社.
|
Jing L, Xin B, Yuan F, et al. 2006. Defects of surface oxygen vacancies on photophysical and photochemical processes of Zn-doped TiO2 nanoparticles and their relationships[J]. J Phys Chem B, 110(36): 17860–17865.
DOI:10.1021/jp063148z
|
Li H, Shang J, Ai Z, et al. 2015. Efficient visible light nitrogen fixation with BiOBr nanosheets of oxygen vacancies on the exposed {001} facets[J]. J Am Chem Soc, 137(19): 6393–6399.
DOI:10.1021/jacs.5b03105
|
Lv J, Kako T, Li Z, et al. 2010. Synthesis and photocatalytic activities of NaNbO3 rods modified by In2O3 nanoparticles[J]. J Phys Chem C, 114(13): 6157–6162.
DOI:10.1021/jp906550t
|
刘玉燕, 赵宝秀, 王芬. 2013. 氧化镓光催化降解邻苯二甲酸二甲酯(DMP)及动力学研究[J]. 城市建设理论研究:电子版, 2013, 19: 2095–2104.
|
Mori T, Suzuki J, Fujimoto K, et al. 1999. Reductive decomposition of nitrate ion to nitrogen in water on a unique hollandite photocatalyst[J]. Appl Catal B Environ, 23(4): 283–289.
DOI:10.1016/S0926-3373(99)00086-7
|
Quarto F D, Sunseri C S, Piazza A, et al. 1997. Semiempirical correlation between optical band gap values of oxides and the difference of electronegativity of the elements.Its importance for a quantitative use of photocurrent spectroscopy in corrosion studies[J]. J Phys Chem B, 101(14): 333–340.
|
Rusina O, Macyk W, Kisch H. 2005. Photoelectro chemical properties of a dinitrogen-fixing iron titanate thin film[J]. J Phys Chem B, 109(21): 10858–10862.
DOI:10.1021/jp0503314
|
Schrauzer G N, Guth T D. 1977. Photocatalytic reactions.1.Photolysis of water and photoreduction of nitrogen on titanium dioxide[J]. J Am Chem S, 99(22): 7189–7193.
DOI:10.1021/ja00464a015
|
谈敏. 2011. 铁掺杂TiO2光催化剂的制备、表征及光催化固氮性能研究[D]. 杭州: 浙江大学
http://cdmd.cnki.com.cn/article/cdmd-10335-1011052396.htm |
Tham D W W.2005.β-Gallium oxide nanowires: synthesis, characterization and device assembly[D].Pennsylvania:University of Pennsylvania
https://www.researchgate.net/publication/242248085_-GALLIUM_OXIDE_NANOWIRES_SYNTHESIS_CHARACTERIZATION_AND_DEVICE_ASSEMBLY |
Xu J, Yang X, Yang Q D, et al. 2012. Cu2ZnSnS4 hierarchical microspheres as an effective counter electrode material for quantum dot sensitized solar cells[J]. J Phys Chem C, 116(37): 19718–19723.
DOI:10.1021/jp306628m
|
Zhao W, Xi H, Zhang M, et al. 2015. Enhanced quantum yield of nitrogen fixation for hydrogen storage with in situ-formed carbonaceous radicals[J]. Chem Commun, 51(23): 4785–4788.
DOI:10.1039/C5CC00589B
|
 2017, Vol. 37
2017, Vol. 37


