2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
随着我国城市输变电系统、通信系统、交通系统、广播发射系统等基础设施的广泛应用, 不仅改变和影响了人们的生活、出行和通讯等方式, 而且也使电磁环境日趋恶化.电磁辐射不仅会对无线通信、仪器仪表、医疗和电气设备、道路交通运输、智能控制系统、信息安全、消防安全及军事装备安全产生重大影响甚至造成灾难性后果, 也会对人们的心血管系统、神经系统、生殖发育、视觉、免疫功能、能量代谢等造成影响, 对公众健康具有长期潜在的影响和威胁(Frei et al., 2010; Pourlis, 2009; Schüz, 2011; Shi et al., 2015); 除此之外, 复杂电磁环境还会给生态环境和农业生产安全带来一定影响.
早在20世纪80年代就有文献报道, 特定的电磁波能够明显提升藻类的叶绿素含量, 提高光合放氧速率, 促进藻体生长, 增加藻体生物产量(杨大旗等, 1988).王海英等(2005)在研究电磁场对小球藻生理特性的影响及对其机理分析时发现, 稳恒电磁场对小球藻的生长在低强度处理时具有刺激作用, 高强度时则呈现抑制效应.也有研究表明, 电磁波能够抑制藻类的生长, 如微波对藻细胞具有较强的灭杀效果(朱承彬, 2013).电磁环境与水生态环境安全之间可能存在某种必然的关联性值得研究探索.
随着我国城镇化进程的不断推进, 高速铁路急速发展, 移动通信基站迅速扩建, 高压输电线路遍布南北, 这些基础设施的扩建很可能对其途经的湖泊、河流、海洋等各种水体带来影响.我国由于水体富营养化带来的藻类水华现象日趋频繁, 大规模的水华和赤潮给生态系统造成了严重灾害.在环境条件适宜时复杂电磁环境是否对蓝藻水华的发生产生作用值得重点关注.
铜绿微囊藻(Microcystis aeruginosa)属于蓝藻门色球藻科微囊藻属, 是许多湖泊形成水华的优势种群, 在环境中占有重要的生态位, 是环境敏感度较高的常用实验藻种.铜绿微囊藻在适宜条件下可以大量增殖并上升到水面, 形成水华, 产生微囊藻毒素.该毒素有多器官毒性、遗传性和致癌性(Chen et al., 2005), 能够引发严重的生物安全危害.
本研究以铜绿微囊藻为对象, 研究与人们日常生活密切相关的3种典型电磁环境(移动电话使用的典型频率1.8GHz射频电磁辐射(RF-EMF)、工业生产、高压输电线及日常生活居家用电产生的50Hz极低频电磁场(ELF-EMF)、高压输电线路所产生的交变电场(AEF))对铜绿微囊藻细胞氧化应激(超氧化物歧化酶(SOD)、丙二醛(MDA))及光合固碳酶(核酮糖-1, 5-二磷酸羧化酶/加氧酶(Rubisco)、果糖-1, 6-二磷酸醛缩酶(FBA))的作用, 以探究电磁环境暴露对铜绿微囊藻生理状况的影响, 并初步揭示复杂电磁环境与水生态环境的关联性.
2 材料与方法(Materials and methods) 2.1 实验材料实验选用铜绿微囊藻, 藻种来自于中国科学院水生生物研究所, 编号FACHB-905.培养温度(25±1) ℃, 光暗比12 h:12 h, 光照强度(1000±100) lx, 培养基为高压灭菌的BG-11培养基.
2.2 实验装置本实验研究有3种暴露环境, 分别是移动电话使用的典型频率1.8 GHz射频电磁辐射暴露环境、工业生产、高压输电线及日常生活中家用电器产生的50 Hz极低频电磁场暴露环境和高压输电线路所产生的交变电场暴露环境.
射频电磁辐射暴露环境(图 1a):采用矢量信号发生器(PSG E8267D, Agilent)、射频合成信号发生器(AV1485, 电子四十一所)、宽带固态功率放大器(AV38701E, 电子四十一所)等进行射频信号的发生与放大.目前该装置能够实现的暴露条件为:频率800 MHz~3 GHz; 电磁场强度0~500 V·m-1; 温度-60~150 ℃, ±0.5 ℃; 相对湿度30%~90%, ±5.0%;光照0~10000 lx.
 |
| 图 1 射频电磁辐射(a)、极低频电磁场(b)和交变电场(c)暴露环境 Fig. 1 RF-EMF(a), ELF-EMF(b) and AEF(c) exposure system |
极低频电磁场暴露环境(图 1b):利用2组亥姆霍兹线圈、调压器和电源等构建一个可调控及稳定的低频电磁环境.目前该装置能够实现的暴露条件为:频率40~499.9 Hz, 0.1 Hz步进; 磁场强度0.05~5 mT; 电场强度10~1000 V·m-1; 温度5~50 ℃, ±0.5 ℃; 相对湿度50%~95%, ±5.0%;光照0~12000 lx.
交变电场暴露环境(图 1c):由变频电源、变压器、电极板等构成, 变频电源频率为40~499.9 Hz, 电压范围0~3000 V; 采用铜网层作为电极板, 根据E=U/d(其中, E为匀强电场的场强(V·m-1), U是任意两等势面之间的电势差(V), d为这两等势面之间的垂直距离(m)), 通过调节电极板距离调节电场强度, 通过调节电源电压调节电场强度; 本装置可以实现0~10000 V·m-1的电场强度.
为确保实验中对照组与暴露组温湿度的一致性, 对照组和暴露组的温度使用Kimo高精度温湿度仪进行校准, 并用温度记录仪对培养箱内实验区的温湿度进行实时监测, 使两者温度均恒定在(25.0±0.5) ℃, 相对湿度恒定在60%.实验过程中对照组培养箱除未施加电磁暴露外, 其他环境条件与暴露组一致.本研究过程中使用的极低频电磁场暴露装置、射频电磁辐射暴露装置和交变电场暴露装置, 均可在实验过程中确保温度、湿度等环境因素的高精度和高稳定性, 使射频电磁辐射、极低频电磁场、交变电场分别成为唯一的物理场影响因素, 确保了本实验结果的可靠性和重复性.
2.3 总蛋白、SOD、MDA、Rubisco、FBA检测将培养的铜绿微囊藻溶液按体积比5%的比例接种于BG11培养液中, 在温度(25±1) ℃、光暗比12 h:12 h、光照强度(1000±100) lx条件下, 连续培养30 d后, 将铜绿微囊藻溶液(680 nm波长处OD值为1.61) 分别置于射频暴露条件(1.8 GHz, 40 V·m-1)、极低频电磁场暴露条件(50 Hz, 3 mT)、交变电场暴露条件(5000 V)下, 在温度(25±1) ℃, 黑暗短时间(0.5、1、2 h)及长时间(12、24、48 h)暴露处理后测定总蛋白、SOD、MDA、Rubisco、FBA活性或含量.
取藻液15 mL, 10000 r·min-1、4 ℃下离心3 min收集藻细胞, 加入1000 μL PBS和石英砂, 利用高通量组织破碎仪F31.4研磨4 min, 于10000 r·min-1下离心5 min得到上清液.使用南京建成生物工程研究所的考马斯亮蓝总蛋白(TP)测定试剂盒测定总蛋白, 超氧化物歧化酶(SOD)试剂盒测定SOD, 丙二醛(MDA)试剂盒测定MDA; 利用上海岚派生物科技有限公司提供的植物1, 5-二磷酸核酮糖羧化酶(Rubisco)酶联免疫分析(ELISA)试剂盒和植物果糖1, 6二磷酸醛缩酶(FBA)酶联免疫分析(ELISA)试剂盒分别测定Rubisco和FBA酶活.样品测定按照试剂盒说明书进行, 实验重复3次.
2.4 统计学处理数据统计分析采用SPSS 20软件.显著性分析采用One-way ANOVA, 最小显著差数法(LSD)处理, 数据以平均值±偏差(M±SD)表示, 当p<0.05时, 认为对照组与暴露组之间存在显著性差异, 当p<0.01时, 认为对照组与暴露组之间存在极显著性差异.
相关性分析是对2个或多个具备相关性的变量元素进行分析, 用皮尔逊相关系数r值衡量2个变量因素的相关密切程度.
3 结果与讨论(Results and discussion) 3.1 RF-EMF、ELF-EMF及AEF对铜绿微囊藻SOD、MDA的影响从图 2a可以看出, 铜绿微囊藻经RF-EMF、ELF-EMF及AEF短期暴露0.5 h后, 极显著地提高了藻细胞内SOD的活性(p<0.01).暴露1 h, ELF-EMF及AEF处理极显著提高了铜绿微囊藻细胞内SOD的活性(p<0.01), 而RF-EMF处理未见显著差异.暴露2 h, 处理组与对照组相比, 藻细胞内SOD活性未见显著差异.暴露12 h, ELF-EMF处理与对照相比极显著提高了铜绿微囊藻细胞内SOD活性(p<0.01), RF-EMF处理降低了铜绿微囊藻细胞内SOD活性(p<0.01), AEF处理与对照相比未见显著差异.暴露24 h, RF-EMF及ELF-EMF处理极显著提高了铜绿微囊藻细胞内SOD活性(p<0.01), AEF处理显著提高了铜绿微囊藻细胞内SOD活性(p<0.05).暴露48 h, RF-EMF、ELF-EMF及AEF处理均极显著提高了铜绿微囊藻细胞内SOD的活性(p<0.01).总体趋势是电磁暴露处理能够提高铜绿微囊藻细胞内SOD的活性.
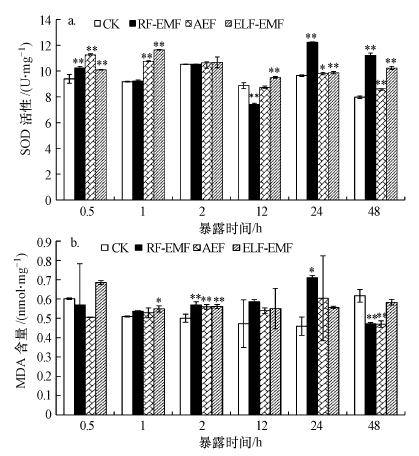 |
| 图 2 铜绿微囊藻细胞SOD活性(a)和MDA含量(b)变化 Fig. 2 SOD activity(a) and MDA content(b) of Microcystis aeruginosa |
如图 2b所示, 当短期暴露0.5 h时, RF-EMF、ELF-EMF及AEF处理与对照相比铜绿微囊藻细胞中MDA含量未见显著变化.暴露1 h, ELF-EMF处理显著提高了铜绿微囊藻细胞内MDA含量(p<0.05), RF-EMF及AEF处理未见显著差异.暴露2 h, 处理组与对照组相比, 铜绿微囊藻细胞内MDA含量均极显著增加了(p<0.01).暴露12 h, 处理组与对照组相比, 铜绿微囊藻细胞内MDA含量未见显著差异.暴露24 h, RF-EMF处理显著提高了铜绿微囊藻细胞内MDA含量(p<0.05), ELF-EMF及AEF处理未见显著差异.暴露48 h, RF-EMF、AEF处理极显著降低了铜绿微囊藻细胞内MDA含量(p<0.01), ELF-EMF处理与对照组相比未见显著差异.
为应对外界环境的胁迫, 生物体一般会产生活性氧自由基.通常, 生物体会通过抗氧化酶的联合作用对其进行清除, 以减轻机体损伤.超氧化物歧化酶(SOD)是生物体内重要的抗氧化酶, 是防御活性氧自由基的第一道防线, 当细胞受到胁迫时, 细胞内SOD的水平会提高, 以降低细胞内的有害的氧自由基.SOD活力的高低与自由基氧化损伤关系密切, 通过对SOD活力的检测可间接评价组织和细胞抗氧化损伤及自由基清除的能力(林康伟等, 2015).从图 2a中可以看出, 经RF-EMF、ELF-EMF及AEF短期(0.5、1 h)暴露的铜绿微囊藻, 藻细胞内SOD活性极显著上升, 这可能是由于铜绿微囊藻遭受胁迫后, 活性氧自由基上升, SOD活性应激性升高, 增强了对活性氧的清除能力.暴露2 h后, 由于铜绿微囊藻对电磁胁迫环境逐渐适应, 因此, SOD水平与对照相比没有显著差异.长时间RF-EMF、ELF-EMF及AEF暴露(12、24、48 h)铜绿微囊藻后, SOD活性整体呈上升趋势, 并且达到显著水平.说明铜绿微囊藻针对RF-EMF、ELF-EMF及AEF暴露的胁迫产生了氧化应激反应.
生物体的器官发生衰老或受到一些外界逆环境影响时, 细胞的脂质会发生过氧化作用, 破坏细胞膜的结构, 而丙二醛(MDA)就是细胞质膜过氧化的最终产物之一, 其含量的高低是评价细胞受损伤程度的重要指标(李娟等, 2015; 刘国锋等, 2016).丙二醛具有与蛋白质、核酸等生命大分子发生交联螯合并加以修饰的特性, 它能够与酶发生反应, 使酶的活性降低或丧失, 也能够影响或抑制蛋白质的生物合成, 甚至成为一种催化错误代谢的分子, 最终干扰细胞内的正常生命活动(Taylor et al., 2003).当细胞内抗氧化酶无法及时清除体内活性氧的时候, 就会导致膜质氧化, 使得机体内MDA含量升高.
RF-EMF、ELF-EMF及AEF短期(0.5、1 h)暴露铜绿微囊藻后, 可能由于藻内抗氧化酶系统清除了细胞体内活性氧自由基, 所以MDA含量与对照相比没有显著差异.而暴露2 h后, 随着暴露时间加长, 电磁环境的刺激造成了活性氧自由基积累, 致使膜质氧化, 因此, 机体内MDA含量与对照相比显著上升.RF-EMF、ELF-EMF及AEF长时间暴露(12、24 h)铜绿微囊藻后, 总体来看, MDA与对照相比没有显著差异.这可能由于电磁场暴露使铜绿微囊藻细胞受到氧化损伤, 铜绿微囊藻细胞通过增加抗氧化酶活性来降低细胞内氧自由基的水平, 从而减轻电磁场胁迫引起的活性氧伤害, 使细胞内活性氧的形成和消除建立了一种新的平衡关系, 因此, 暴露组MDA含量与对照相比无显著差异.RF-EMF及AEF暴露铜绿微囊藻48 h后, MDA含量极显著降低(p<0.01), 可能是由于抗氧化酶活性急剧上升, 清除了过多的氧自由基, 因此, MDA含量降低.
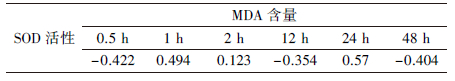
此外, 还分析了处理组与对照组SOD活性与MDA含量的相关性, 相关系数如表 1所示, 结果表明, SOD活性与MDA含量相关性不显著.这可能是虽然SOD是防御活性氧自由基的第一道重要防线, 但抗氧化酶系统还包括了除超氧化物歧化酶之外的硫氧还蛋白过氧化物酶、谷胱甘肽过氧化物酶和过氧化氢酶等, 对于MDA含量的影响是这些酶协同作用的结果.
| 表 1 SOD活性与MDA含量的相关性 Table 1 Correlation between SOD activity and MDA content |
由图 3a可知, 短期暴露0.5 h后, RF-EMF、ELF-EMF及AEF处理提高了铜绿微囊藻细胞Rubisco酶活性, 其中, RF-EMF处理达到显著性差异(p<0.05).暴露1 h, 虽然RF-EMF及AEF处理与对照相比Rubisco酶活未见显著变化, 但ELF-EMF处理却显著提高了Rubisco酶活(p<0.05).暴露2 h和12 h, 处理组与对照组相比Rubisco酶活未见显著差异.暴露24、48 h, RF-EMF处理极显著(p<0.01) 或显著(p<0.05) 提高了Rubisco酶活性, 其它处理未见显著差异.
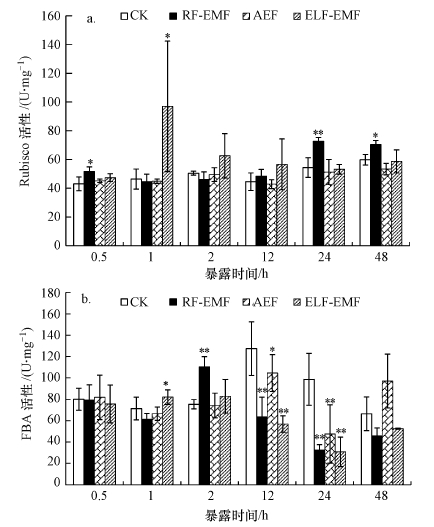 |
| 图 3 铜绿微囊藻细胞Rubisco酶活性(a)和FBA酶活性(b) Fig. 3 Rubisco activity(a) and FBA activity(b) of Microcystis aeruginosa |
由图 3b所示, 短期暴露处理0.5 h后, 暴露组的FBA酶活性与对照组相比未见显著差异.暴露处理1 h, ELF-EMF显著提高了FBA酶活性(p<0.05).暴露处理2 h, RF-EMF极显著提高了FBA酶活性(p<0.01).暴露处理12 h后, RF-EMF和ELF-EMF处理极显著降低了FBA酶活性(p<0.01), AEF处理显著降低了FBA酶活性(p<0.05).暴露处理24 h后, 处理组比对照组均极显著降低了FBA酶活性(p<0.01).持续暴露处理48 h后, 处理组与对照组无显著差异.
光合作用是最基本的物质代谢和能量代谢, 主要由光反应和暗反应2个阶段组成.光合作用的暗反应又称为卡尔文循环, 它主要包括3个阶段:二氧化碳的固定、羧化产物的还原及核酮糖-1, 5-二磷酸的再生.核酮糖-1, 5-二磷酸羧化酶/加氧酶(Rubisco)是一种可溶性高分子蛋白质, 它在卡尔文循环中, 承担着催化CO2固定的作用.Rubisco是所有光合生物进行光合碳同化的关键酶(Tabita, 1988).Rubisco催化光合碳同化的第一步反应, 利用光合作用光反应阶段形成的同化力(ATP和NADPH)把来自空气中的二氧化碳固定还原成有机物.在普通空气条件下, Rubisco酶催化的羧化反应是整个光合作用过程中的主要限速步骤(Woodrow et al., 1988).
外界因素如温度、光照、水分、CO2、源-库水平、氮素水平等都可能对植物Rubisco活性产生影响.薛伟等(2011)在研究疏叶骆驼刺时发现, 随着叶片温度的上升, Rubisco活性先升高后降低, 在34 ℃时达到最高的活性水平.曾晓鹏等(2015)研究表明, 在高光强下培养的威氏海链藻Rubisco活性明显高于低光强下培养, 但三角褐指藻则相反, 并且不同硅藻对光强变化的响应存在着差异.Sawada等(1992)研究表明, 限库处理所导致的光合下降主要是由于叶绿体基质内无机P含量降低导致Rubisco活性下降, 证明无机P是Rubisco活性的重要调节者.此外, 水分胁迫及氮肥也会对Rubisco酶的活性产生影响(李卫芳, 2002).
通常情况下, Rubisco受光照、CO2浓度、温度、水分等条件影响, 本研究中这些敏感因子暴露与对照的处理条件一致.因此, 总体来看, 暴露组与对照组的Rubisco酶活没有显著差异.但RF-ELF处理铜绿微囊藻细胞0.5 h, 即Rubisco酶受到射频电磁波的短期暴露后, 酶活性显著提高, 但在暴露1、2、12 h的处理组与对照组相比并没有显著差异, 这可能是藻细胞对射频电磁波的胁迫产生了一定的适应性.本研究在随后的持续暴露(24、48 h)中又发现了Rubisco酶活的显著提高.以上结果表明, RF-ELF的暴露能够引发Rubisco酶活性的迅速提升, 尽管藻细胞对电磁暴露的自适应机制能够在一定程度上使Rubisco酶的活性恢复到正常水平, 但电磁环境下的长期暴露最终使得Rubisco酶的活性维持在一个较高的水平.Rubisco酶对射频电磁辐射敏感的原因可能是由于光也是属于一定频率范围内的电磁波, 铜绿微囊藻对红橙光、蓝光比较敏感, 其中, 波长622 nm的光是铜绿微囊藻吸收的敏感波段, 选择的1.8 GHz是622 nm倍波长的对应频率, 铜绿微囊藻可能对此频率较为敏感.由此推断, 铜绿微囊藻在进行光合作用时可能对某些与622 nm具有倍频关系的电磁辐射较为敏感, 其作用机理还需进一步深入系统研究.
果糖-1, 6-二磷酸醛缩酶是卡尔文循环和糖质新生代谢过程中必不可少的一个关键调控酶(Stracquadanio et al., 2010), 其主要功能是催化己糖的合成或分解.它参与了包括卡尔文循环、糖酵解、糖异生及磷酸戊糖途径等几乎一切生物体生存和维持正常生理活动所需的代谢反应(王镜岩等, 2002).果糖-1, 6-二磷酸醛缩酶参与了第3阶段:核酮糖-1, 5-二磷酸的再生.果糖-1, 6-二磷酸醛缩酶催化一个磷酸二羟丙酮与三磷酸甘油醛或四磷酸赤藓糖分别产生果糖-1, 6-二磷酸或景天庚酮糖-1, 7-二磷酸的可逆醛醇缩合反应(马为民, 2003).果糖-1, 6-二磷酸醛缩酶是卡尔文循环中固定CO2后第一个催化由3C化合物转化为6 C化合物的酶, 处于第一个分支点上, 同时它也是控制光合作用速率的重要酶之一(Iwaki et al., 1991; Knowles, 1991).
在一些高等植物上的研究表明, 在短期逆境条件(如盐胁迫、高温等)诱导下, CpFBA会被诱导而大量表达, 但长期胁迫会导致CpFBA基因表达水平降低(Michelis et al., 2000; Wei et al., 2005; 张晓宁等, 2002), 这可能是一种“短促长抑”效应.吕科等(2011)研究表明, CpFBA在逆境条件下的表现较为复杂, 它并不是简单的持续增加或降低, 而是呈现出一定的周期性变化规律.本文研究结果也表明, 虽然RF-EMF、ELF-EMF及AEF短期暴露处理铜绿微囊藻后FBA酶含量与对照相比总体没有显著差异, 但长期暴露处理组中的FBA含量却显著降低.造成这种现象产生的生物学意义在于在卡尔文循环中, 通过FBA活性的调节, 可以实现对二羟基丙酮磷酸(DHAP)代谢途径调节, 从而实现糖的碳架构重排.有关电磁暴露对光合作用的生物学效应和分子机理仍有待未来进一步的研究和探索.
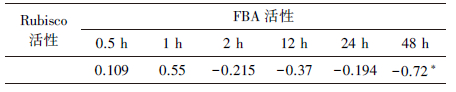
此外, 还分析了处理组与对照组的Rubisco活性与FBA活性相关性, 如表 2所示, 处理0.5、1、2、12、24 h, Rubisco活性与FBA活性相关性不显著.这可能因为Rubisco催化光合碳同化的第一步反应, FBA是主要参与光合碳化第3阶段, 中间还有其他酶作用, 因此, 两者相关性不显著.而处理48 h, Rubisco活性与FBA活性显著相关(p<0.05), Rubisco值增大, FBA值相对变小, 这可能是本实验中所检测的FBA酶存在着调节卡尔文循环中DHAP不同代谢途径的同工异构酶, 相关机理还需进一步研究.
| 表 2 Rubisco活性与FBA活性的相关性 Table 2 Correlation between Rubisco activity and FBA activity |
综上所述, 本文的研究结果如图 4所示, 短期和长期RF-EMF、ELF-EMF及AEF暴露胁迫铜绿微囊藻细胞, 总体能极显著提高藻细胞的SOD活性(p<0.01).铜绿微囊藻经RF-EMF、ELF-EMF及AEF短期暴露处理后, 均极显著提升了藻细胞内MDA含量(p<0.01);铜绿微囊藻经RF-EMF、AEF长期暴露处理后, 藻细胞内MDA含量极显著降低(p<0.01).RF-EMF暴露处理铜绿微囊藻, 总体能显著提高藻细胞Rubisco酶活性(p<0.05).长期RF-EMF、AEF和ELF-EMF暴露下的铜绿微囊藻, 总体表现出FBA酶活性极显著降低(p<0.01).
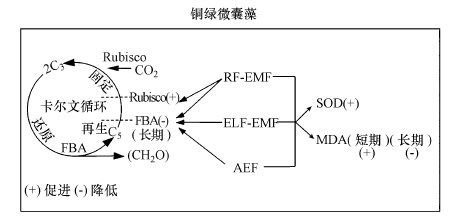 |
| 图 4 铜绿微囊藻作用机理图 Fig. 4 Mechanism of action of summary of Microcystis aeruginosa |
研究表明, RF-EMF(1.8 GHz, 40 V·m-1)、ELF-EMF(50 Hz, 3 mT)、AEF(5000 V)暴露处理铜绿微囊藻, 均能促使藻细胞产生一定的氧化应激反应; 而RF-EMF能够对铜绿微囊藻细胞参与光合作用的关键酶(Rubisco和FBA)产生一定的调控作用, 表明射频电磁波能够在一定程度上影响铜绿微囊藻细胞的光合作用.铜绿微囊藻在进行光合作用时可能对某些频率的电磁波较为敏感, 其作用机理还有待进一步研究并加以阐明, 本实验中电磁环境对蓝藻生长及光合作用的影响也表明, 电磁环境与水生态环境安全之间存在着某种必然的关联性, 在环境条件适宜时复杂电磁环境有可能有利于蓝藻水华的发生, 促使蓝藻水华加重, 应该引起足够重视.
Chen J, Xie P, Guo L G, et al. 2005. Tissue distributions and seasonal dynamics of the hepatotoxic microcystins-LR and -RR in a freshwater snail(Bellamya aeruginosa) from a large shallow, eutrophic lake of the subtropical China[J]. Environmental Pollution, 134: 423–430.
DOI:10.1016/j.envpol.2004.09.014
|
Frei P, Mohler E, Bürgi A, et al. 2010. Classification of personal exposure to radio frequency electromagnetic fields (RF-EMF) for epidemiological research: Evaluation of different exposure assessment methods[J]. Environment International, 36: 714–720.
DOI:10.1016/j.envint.2010.05.005
|
Iwaki T, Wadano A, Yokota A, et al. 1991. Aldolase-an important enzyme in controlling the ribulose 1, 5-bisphosphate regeneration rate in photosynthesis[J]. Plant and Cell Physiology, 32(7): 1083–1091.
DOI:10.1093/oxfordjournals.pcp.a078172
|
Knowles J R. 1991. Enzyme catalysis-not different, just better[J]. Nature, 350: 121–124.
DOI:10.1038/350121a0
|
李娟, 王应军, 高鹏. 2015. 过氧化氢对铜绿微囊藻的损伤效应研究[J]. 环境科学学报, 2015, 35(4): 1183–1189.
|
李卫芳. 2002. 小麦Rubisco和Rubisco活化酶对光合作用的影响[D]. 扬州: 扬州大学. 62-65
http://cdmd.cnki.com.cn/article/cdmd-11117-2003122959.htm |
林康伟, 唐超, 杨传俊, 等. 2015. 50 Hz极低频电磁场对酵母细胞生长和氧化应激的影响初探[J]. 科学技术与工程, 2015, 15(25): 11–16.
DOI:10.3969/j.issn.1671-1815.2015.25.003 |
刘国锋, 韩士群, 刘学芝, 等. 2016. 藻华聚集的环境效应:对漂浮植物水葫芦(Eichharnia crassipes)抗氧化酶活性的影响[J]. 湖泊科学, 2016, 28(1): 31–39.
DOI:10.18307/2016.0104 |
吕科, 刘富兵, 花庆, 等. 2011. 小麦叶绿体果糖-1, 6-二磷酸醛缩酶活性的测定方法及应用[J]. 麦类作物学报, 2011, 31(1): 82–87.
DOI:10.7606/j.issn.1009-1041.2011.01.015 |
Michelis R, Gepstein S. 2000. Identification and characterization of a heat-induced isoform of aldolase in oat chloroplast[J]. Plant Molecular Biology, 44: 487–498.
DOI:10.1023/A:1026528319769
|
马为民. 2003. FBPase、ALD和TPI的蓝藻基因工程及其对光合作用的调控[D]. 上海: 上海师范大学. 1-184
http://cdmd.cnki.com.cn/article/cdmd-10270-2003098823.htm |
Pourlis A F. 2009. Reproductive and developmental effects of EMF in vertebrate animal models[J]. Pathophysiology, 16: 179–189.
DOI:10.1016/j.pathophys.2009.01.010
|
Sawada S, Usuda H, Tsukui T. 1992. Participation of inorganic orthophosphate in regulatin of the ribulose-1, 5-bisphosphate carboxylase activity in response to changes in the photosynthetic source-sink balance[J]. Plant Cell Physiol, 33(7): 943–949.
|
Schüz J. 2011. Exposure to extremely low-frequency magnetic fields and the risk of childhood cancer: Update of the epidemiological evidence[J]. Progress in Biophysics and Molecular Biology, 107: 339–342.
DOI:10.1016/j.pbiomolbio.2011.09.008
|
Shi Z H, Yu H, Sun Y Y, et al. 2015. The energy metabolism in caenorhabditis elegans under the extremely low-frequency electromagnetic field exposure[J]. Scientific Reports, 5: 8471–8481.
DOI:10.1038/srep08471
|
Stracquadanio G, Umeton R, Papini A, et al.2010.Analysis and optimization of C3 photosynthetic carbon metabolism[C].IEEE International Conference on Bioinformatics and Bioengineering.Philadelphia Pennsylvania, USA:44-51
|
Tabita F R. 1988. Molecular and cellular-regulation of autotrophic carbon-dioxide fixation in microorganisms[J]. Microbiological Reviews, 52(2): 155–189.
|
Taylor E R, Hurrell F, Shannon R J, et al. 2003. Reversible glutathionylation of complex Ⅰ increases mitochondrial superoxide formation[J]. The Journal of Biological Chemistry, 278(22): 19603–19610.
DOI:10.1074/jbc.M209359200
|
Wei H, Dhanaraj A L, Rowland L J, et al. 2005. Comparative analysis of expressed sequence tags from cold-acclimated and non-acclimated leaves of Rhododendron catawbiense Michx[J]. Planta, 221: 406–416.
DOI:10.1007/s00425-004-1440-1
|
Woodrow I E, Berry J A. 1988. Enzymatic regulation of photosynthetic CO2 fixation in C-3 plants[J]. Annual Review of Plant Biology, 39: 533–594.
DOI:10.1146/annurev.pp.39.060188.002533
|
王海英, 曾晓波, 郭祀远. 2005. 电磁场对小球藻生理特性的影响及其机理分析[J]. 水产科学, 2005, 24(7): 12–14.
|
王镜岩, 朱圣庚, 徐长法. 2002. 生物化学[M]. 北京: 高等教育出版社: 63–90.
|
薛伟, 李向义, 林丽莎, 等. 2011. 短时间热胁迫对疏叶骆驼刺光系统Ⅱ、Rubisco活性和活性氧化剂的影响[J]. 植物生态学报, 2011, 35(4): 441–451.
|
杨大旗, 周小华. 1988. 特定电磁波对螺旋藻(S.platensis)光合放氧速率及生物量的影响[J]. 西南大学学报, 1988, 10(1): 112–115.
|
曾晓鹏, 夏建荣. 2015. 光强对两种硅藻光合作用、碳酸酐酶和RubisCO活性的影响[J]. 水生生物学报, 2015, 39(2): 368–374.
DOI:10.7541/2015.48 |
张晓宁, 林长发, 王昊, 等. 2002. 受NaCl诱导的盐藻果糖-1, 6-二磷酸醛缩酶cDNA的克隆及其在烟草中的表达[J]. 中国科学, 2002, 32(5): 392–398.
|
朱承彬. 2013. 微波强化混凝去除水中藻类的实验研究[D]. 昆明: 昆明理工大学. 1-60
http://cdmd.cnki.com.cn/Article/CDMD-10674-1013346985.htm |
 2017, Vol. 37
2017, Vol. 37