2. 生物膜法水质净化及利用技术教育部工程研究中心, 马鞍山 243000
2. Engineering Research Center of Water Purification and Utilization Technology based on Biofilm Process, Ministry of Education, Ma'anshan 243000
生物膜法是当前两大污水生物处理工艺之一(Hu et al., 2013a; Hadjiev et al., 2007).在污水处理过程中, 生物膜附着于载体上并固定大量微生物(包括微型动物、细菌、真菌、藻类等)和有机物质, 形成微生物及其代谢产物所组成的活性体系(Hu et al., 2016).生物膜附着、增长和脱落的平衡对产生和维持生物膜功能非常重要(Zhu et al., 2015; Hu et al., 2013).脱落是生物膜代谢的一个重要过程, 可使生物膜维持较高的活性, 从而保证稳定良好的处理效果.生物膜脱落影响着生物膜本身特性和微生物功能, 也影响着生物膜的结构组成与稳定性.若生物膜结构难以稳定, 势必会影响去除效果.因此, 生物膜的脱落问题不容忽视(Nicolas et al., 2013), 在生物膜反应器启动和运行过程中应设法减小脱落速率(陈黎明等, 2005).
进行生物膜脱落分析对生物膜研究具有重要意义(Maik et al., 2013; Etienne et al., 2012; Nicolas et al., 2013), 而生物膜脱落受多种因素影响, 主要包括来自液相或气相流动产生的剪切力及颗粒之间的碰撞.研究表明(Maik et al., 2013; Etienne et al., 2012; 殷俊等, 2012; Elenter et al., 2007; Muatasem et al., 2011), 剪切应力逐步改变会导致颗粒尺寸分布显著变化, 随着剪切应力的增加, 生物膜厚度和膜量逐渐减少.生物膜结构、反应器构型、载体性质等对生物膜脱落有影响, 载体表面粗糙度会影响生物膜脱落效果(Muatasem et al., 2011).而化学清洗剂(盐酸、氢氧化钠、次氯酸钠)和物理干燥方法有助于生物膜脱离和再生(Hu et al., 2013b).
胞外聚合物(Extracellular polymeric substances, EPS)作为生物膜的重要组成成分, 主要来源于微生物细胞代谢分泌物、细胞自溶产生的聚合物、细胞脱落的表面物质及进水基质中相关组分(袁冬琴等, 2012).EPS对维持絮体和生物膜结构的稳定性及系统的处理效果具有重要作用(You et al., 2015).根据EPS与细胞相结合的紧密程度, 可将EPS分为黏液层胞外聚合物(Slime EPS, S-EPS)、疏松结合胞外聚合物(Loosely Bound EPS, LB-EPS)、紧密结合胞外聚合物(Tightly Bound EPS, TB-EPS), 它们与细胞共同构成絮体由外而内的层次结构(袁冬琴等, 2012; 周俊等, 2013).
污水生物处理的实质是通过反应器中微生物的多种酶催化一系列氧化还原反应来实现对有机污染物的分解代谢(窦娜莎等, 2016), 本质上由微生物基本生理功能的呼吸系统电子传递体系与代谢酶活性等决定.脱氢酶能使被氧化的有机物氢原子活化并传递给特定的受氢体, 其活性可反映生物系统活性, 即污水处理中活性微生物量及其有机物的降解代谢能力.
微型动物(原生动物和微型后生动物)是污水生物膜处理系统中微生态系统的重要组成, 广泛地存在于生物膜上, 其多样性可以反映污水处理效果.Dubber等(2011)研究发现, 纤毛虫总数与系统净化能力及污泥沉降性正相关, 其优势度及丰度与活性污泥处理污水出水水质正相关.Lee等(2004)指出, 原生动物可促进絮凝作用, 草履虫和独缩虫等纤毛虫和一些鞭毛虫向胞外分泌的可溶性多糖类物质能促进凝胶颗粒形成絮凝.Liu等(2008)的研究表明, 活性污泥系统中固着型纤毛虫、圆壳虫属(Cyclopyxis sp.)丰富度较高时, SVI值较高, 纤毛虫为污泥沉降性的指示微生物.
然而, 目前大多数研究重点关注物理因子(剪切应力、载体性质等)对生物膜脱落的影响, 而有关生物膜的有机组成(如胞外聚合物)、活性(如脱氢酶活性)及起重要作用的微型动物对生物膜脱落的影响研究则鲜见报道.有机负荷是污水处理的一个重要工艺参数, 对处理效果有巨大影响(刘宏波等, 2009; Bassin et al., 2016).因此, 本文探讨不同负荷条件下生物膜的脱落特性, 分析试验过程中生物膜组成成分、生物膜活性和微型动物多样性的变化, 探索生物膜脱落与生物膜特性之间的相互影响规律, 以期为生物膜良好特性的维护提供理论支撑.
2 材料与方法(Materials and methods) 2.1 试验装置与运行方式试验装置为自制半透明有机塑料筒状反应器, 直径为18 cm, 高度为20 cm, 有效容积为4.0 L.反应器内悬浮一定数量(体积填充率为50%)多面空心球(φ=25 mm), 为生物膜附着生长提供载体.空气压缩机通过置于反应器底部的微孔曝气头为系统提供所需氧气, 同时曝气为水和载体的均匀混合与环流提供动力.通过调节空气流量计控制曝气强度(0.2 L·min-1), 维持水中溶解氧(DO, 2.86~5.53 mg·L-1).反应器在室温(23.73±2.22) ℃下运行.试验共设置3组, 分别为低负荷R1系统、中负荷R2系统、高负荷R3系统.
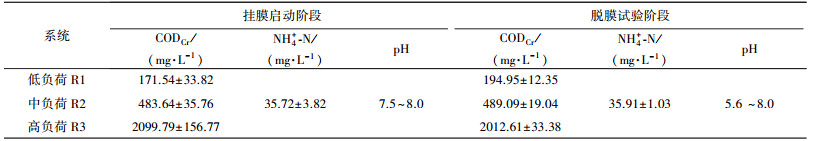
采用自然挂膜法进行挂膜启动.试验用水从马鞍山市某污水处理厂进水口采集, 添加适量碳源(C6H12O6), 使系统中CODCr维持在比较稳定的范围, 进水pH为7.5~8.0(表 1).反应器采用间歇式曝气方式运行, 每天运行2个周期, 每个周期曝气10 h停气2 h.试验挂膜期间, 在每个周期结束前0.5 h内将反应器中水全部排出, 然后补入新鲜原水至原水位, 重新进入下一个周期, 如此循环往复.通过生物膜微型动物群落物种多样性及出水水质等指标进行判定, 运行到第44 d, 生物膜已成熟, 挂膜启动阶段完成.
| 表 1 主要水质参数 Table 1 Main water quality parameters |
试验阶段内, 为了方便考察生物膜脱落状况, 避免脱落生物膜的流失, 反应器仅每周期在曝气已沉降1.5 h时抽出1/3上清液并用实际生活污水进行补充, 同时通过添加适量碳源(C6H12O6)、氮源(NH4Cl)使系统中CODCr、NH4+-N浓度维持在稳定范围(表 1).
2.2 生物膜样品的采集试验过程中, 每隔5 d进行试验数据采集.用1 L量筒从反应器中取1 L均匀混合液(取样后补充1 L实际生活污水), 抽滤、烘干、称重, 得到的单位混合液中含有的悬浮固体质量为生物膜脱落量.在无菌操作条件下将生物膜从载体表面刮落, 搅拌均匀, 以备微型动物、生物膜胞外聚合物、生物膜活性分析使用.
2.3 载体上生物膜组分与活性分析 2.3.1 EPS提取及测定EPS中多糖(Polysaccharides, PS)测定采用苯酚-硫酸法, 以蔗糖作为标准物质; 蛋白质(Proteins, PN)测定采用改进型的Lowry法(Fang et al., 2014), 以牛血清蛋白作为标准物质; DNA测定采用二苯胺比色法, 以DNA钠盐作为标准物质.因DNA不超过0.2%, EPS总量(单位为mg·g-1, 以生物膜干重计)以PS和PN之和表征, 同时以DNA相对含量作为检验细胞相对破裂程度的标准, 避免细胞裂解和溶解释放内聚物而造成EPS的量和成分分析的误差, 并测定不同层EPS(S-EPS、LB-EPS、TB-EPS)含量(周俊等, 2013).
2.3.2 生物膜脱氢酶活性测定脱氢酶活性采用TTC(即2, 3, 5-氯化三苯基四氮唑)法测定, 根据吸光度值计算脱氢酶活性(张洛红等, 2011).反应生成TF(即三苯基甲臢)在485 nm处的吸光度值(y)与其浓度(x)呈线性关系, 测得标准曲线方程为:y=0.0041x+0.0088, R2=0.9942.
2.4 微型动物鉴别计数与分析 2.4.1 微型动物镜检对采集的生物膜混合液进行微型动物镜检, 参照图谱文献(沈蕴芬等, 1989)将微型动物鉴别到种或类群, 记录生物膜上微型动物主要种或类群多度(单位体积(cm3)载体上附着微型动物个体数量).
2.4.2 微型动物物种多样性及稳定性分析对于生物膜微型动物物种多样性, 选取Shannon-Wiener指数H、Margalef指数R、Pielou指数J、Simpson指数λ分别评价微型动物物种多样性、丰富度、均匀度及优势度(马克平, 1994; 马克平等, 1994; 周夏芝等, 2004).
采用物种稳定指数WS和多样性稳定指数WH表征生物膜微型动物群落稳定性.物种稳定指数WS=S/N, 其中, S表示微型动物物种数, N表示微型动物群落所有物种的总多度; 多样性稳定指数WH=dS/dm, 其中, dS、dm分别为试验阶段多样性值H的标准差和平均值(胡小兵等, 2016).上述2个稳定指数值越小, 说明群落越稳定.
2.5 水质指标分析化学需氧量(CODCr)、氨氮(NH4+-N)分别采用重铬酸钾法、纳氏分光光度法进行测定; 溶解氧(DO)、温度采用便携式溶解氧测定仪(雷磁JPBJ-608) 测定; pH值采用数显pH计(雷磁pHS-25) 测定.
3 结果与讨论(Results and discussion) 3.1 不同负荷下生物膜脱落量及载体生物膜特性 3.1.1 不同负荷下生物膜脱落量动态变化不同负荷下自然挂膜1个多月后, 3个系统中载体上生物膜量分别达到24.86、37.13、82.96 mg·g-1.R1、R2系统中CODCr去除率均稳定在80%~95%, R3系统由于进水COD值高, 去除率稳定在60%.同时观察到钟虫、草履虫及轮虫等后生动物, 标志着生物膜生长基本达到稳态.对成熟稳定的生物膜进行自然脱膜试验, 不同负荷条件下生物膜脱落量随运行时间动态变化如图 1所示.
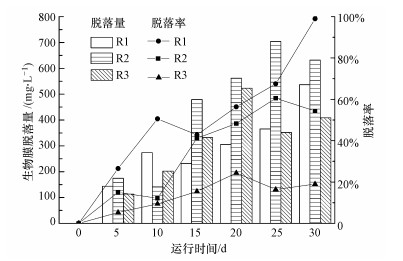 |
| 图 1 不同负荷下生物膜脱落量动态变化 Fig. 1 Biomass changes of biofilm detached in condition under different organic loading |
由图 1可知, 生物膜脱落量随着运行时间的延长而呈现增长趋势, 但不同负荷条件下增长规律不同:① 生活污水培养的低负荷R1系统, 生物膜脱落量在0~10 d内稳步增长, 第15 d有所下降后继续保持增长趋势.观察发现:第0~10 d载体上生物膜不断减少, 生物膜脱落量增长至初始载体上生物膜量的50.57%, 第15~30 d载体上有一些颗粒状生物膜聚集, 系统形成一种生物膜与活性污泥(脱落的生物膜)共存状态, 同时生物膜脱落量接近初始生物膜量(生物膜脱落量/初始生物膜量(即脱落率)为98.97%).② 生活污水+基质培养的中等负荷R2系统, 在前25 d内生物膜脱落量稳步增长, 载体上生物膜不断脱落, 直至第25 d脱落量为初始生物膜量的60.54%;试验后期(第25 ~30 d)载体上生物膜几乎没有生长, 反应器中形成类似于活性污泥的一种污水生物处理系统, 形成松散的絮体和菌胶团分散于反应器中.③ 生活污水+高浓度基质培养的高负荷R3系统, 在前20 d内生物膜脱落量持续缓慢增长, 20 d后呈现下降趋势.
生物膜处理污水过程中, 污水中的营养物质是微生物生命活动的基础(唐兴益等, 1996), 膜表面微生物与废水接触充分, 吸取营养比较容易, 因而增殖迅速; 当生物膜厚度达到一定值时, 膜内部靠近载体表面的微生物很难从外部得到可作为细胞碳源和其他营养物, 从而进入内源呼吸阶段, 丧失了附着于载体表面生长的能力, 呈老化状态而脱落.由此推测, 当生物膜处于低负荷条件下, 生物膜量((22.84±2.87) mg·g-1)较少, 生物膜厚度较薄, 对系统长期运行过程中水环境pH值下降、微生物有害代谢产物积累更加敏感, 同时负荷较低, 生物膜内部微生物得不到足够的营养而容易失去活性, 形成类似于低负荷容易造成颗粒污泥的解体(刘宏波等, 2009), 从而造成生物膜容易解体脱落.中等负荷使得脱落试验前载体表面稳定状态生物膜量((36.97±0.22) mg·g-1)较多, 对不利环境变化的抵抗能力较强, 但如果突破抵御临界点, 生物膜也会快速脱落.高负荷下载体上生物膜量增殖较快, 生物膜量较大, 生物膜厚度增加(张磊等, 2013), 但形成的生物膜与载体之间结合紧密, 生物膜脱落现象不明显.因此, 低负荷条件下生物膜厚度较薄却容易解体脱落, 高负荷下生物膜较厚却粘附性较强, 说明营养条件(即负荷)是生物膜脱落的主要原因.
3.1.2 不同负荷下生物膜胞外聚合物变化试验过程中, 3个系统中载体上的生物膜各层EPS含量分布如图 2所示.由图 2可知, 生物膜EPS总量从高到低依次为:R3系统、R2系统、R1系统, 分别为219.591、106.455、91.649 mg·g-1(以每g生物膜干重所含EPS量计).有机负荷越高, 所提供的营养物质越丰富, 但微生物细胞不能将所有碳源用于细胞合成, 多余碳源被转化成胞内聚合物积累在生物膜内, 使得EPS总量增加(曹秀芹等, 2010; Ye et al., 2011).反之, 有机负荷低时, 能被转化并积累于生物膜中聚合物的多余碳源较少, 生物膜EPS总量也较低.
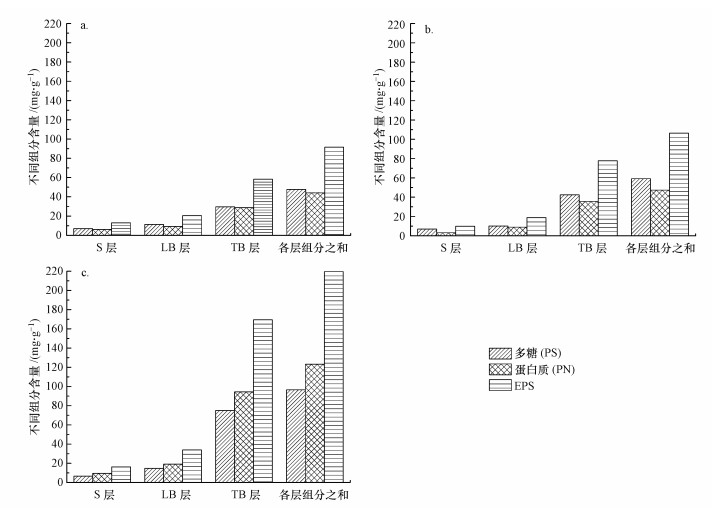 |
| 图 2 生物膜EPS组成分布(a.R1系统, b.R2系统, c.R3系统) Fig. 2 Composition distribution of EPS of biofilm |
比较各层EPS量发现, S-EPS、LB-EPS占EPS总量比例从高到低依次为R1、R2、R3, 说明与细胞间接结合的EPS量(S-EPS、LB-EPS)变化不大, 占EPS总量的比例随着进水负荷的增大而减小; 而TB-EPS占EPS总量的比例则正好相反, 说明与细胞紧密结合的生物膜EPS量和比例随着进水负荷的增大而增大.与细胞紧密结合的TB-EPS量最高, 是生物膜EPS的主要组成部分, 这与一些学者对生物膜的研究结果一致(Fang et al., 2014; Delia et al., 2003).
生物膜EPS以多糖与蛋白质为主(由于DNA占总EPS的比例低于0.5%, 故此处不做分析), 比较各层多糖和蛋白质含量发现, 随着进水负荷的增大, S-EPS、LB-EPS中多糖含量却变化不大.但多糖、蛋白质占各层EPS的比例从外到内(从S层到LB层到TB层)均呈逐层递增的趋势.R1和R2系统中, 多糖/蛋白质比值(PS/PN)较高, 分别为1.081和1.250.这是因为低负荷条件下生物膜EPS释放出较多的多糖到细胞外, 引起胞外聚合物组分中多糖含量增加.在高负荷R3系统中, PS/PN值较低(0.785), 说明高负荷更有利于蛋白质的分泌与在EPS中的积累.
3.1.3 不同负荷条件下生物膜脱氢酶活性变化在废水生物处理中, 脱氢酶活性可以反映处理体系中活性微生物量及其对有机物的降解活性(张洛红等, 2011; 杨涛等, 2016).试验过程中, 3个系统中生物膜脱氢酶活性变化情况如图 3所示.
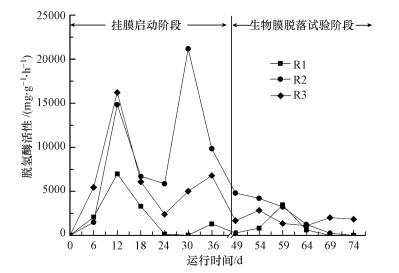 |
| 图 3 不同负荷条件下生物膜脱氢酶活性动态变化 Fig. 3 Dehydrogenase activity changes of biofilm under different organic loading |
由图 3可知, 3个系统中生物膜脱氢酶活性在进行试验阶段前处于较高水平, 分别为(2300.2±2603.3)、(9979.4±7056.6)、(6988.5±4765.4) mg·g-1·h-1(以每g生物膜干重每小时产生的TF计).在挂膜期间生物膜的脱氢酶活性呈现“M”型变化.试验开始(44 d)后, 载体上生物膜脱氢酶活性随着运行时间的增加而呈下降趋势, 说明生物膜活性逐渐下降, 这是由于随着系统中微生物降解有机物和自身代谢过程的进行, 3个系统中pH值均由试验初始为7.50~8.0下降至偏酸性(6.0左右), 而一般生物酶适宜pH为6.5~8.5, 过低的pH会抑制脱氢酶活性.
3.1.4 不同负荷下载体生物膜上微型动物群落结构及多样性动态变化对不同负荷条件下3个系统中生物膜上微型动物进行活体镜检, 共鉴别出34种微型动物, 其中, R3系统中仅第5 d观察到微型动物(337个·cm-3), 主要是半圆表壳虫(Arcella hemisphaerica)和尾草履虫(Paramecium caudatum), 随后数次镜检都未观察到微型动物, 但生物膜中观察到大量丝状霉菌.可能的原因是高碳源有利于丝状霉菌的旺盛生长, 霉菌又产生了一些毒素抑制了微型动物生长.因此, 这里只对试验过程中R1、R2系统中微型动物群落结构进行分析(图 4).
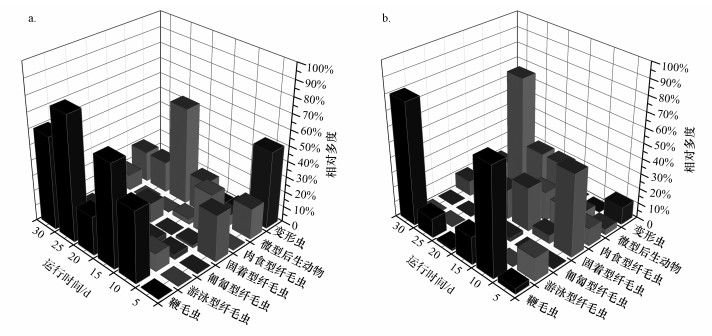 |
| 图 4 生物膜系统中不同类群微型动物的相对多度变化(a.R1系统, b.R2系统) Fig. 4 Variation in relative abundance of microfauna community in the biofilm system |
由图 4可知, R1、R2系统试验前期微型动物总多度较低.其中, R1系统中生物膜上微型动物多度变化主要受鞭毛虫影响; R2系统中微型动物多度变化前期(第1~15 d)主要受鞭毛虫影响, 后期(第16~30 d)主要受纤毛虫和微型后生动物影响.R1、R2系统中不同类群微型动物的动态变化规律相似.2个系统中鞭毛虫相对多度呈现平稳波动, 均表现出“升高→下降→升高”的变化趋势; 变形虫、固着型纤毛虫、游泳型纤毛虫均呈现下降趋势; 微型后生动物整体均呈先升高后降低的变化规律; 对于肉食型纤毛虫多度, R1系统中整体呈“升高→下降→升高”变化, 而R2系统中前期相对多度较高, 后期却未观察到肉食型纤毛虫.
试验中, 载体生物膜上微型动物物种多样性特征指数动态变化如图 5所示.R1系统中生物膜上微型动物群落物种多样性指数H呈小幅波动(1.397±0.295), 并有稍稍下降趋势; R2系统中微型动物群落物种多样性指数H呈大幅波动且明显下降趋势.试验中, 生物膜上微型动物物种多样性会随着运行时间的延长而降低, 系统中微生物自身代谢积累使得水环境对微型动物产生一定的抑制, 导致微型动物多度和物种数都有所减少, 多样性指数H下降.
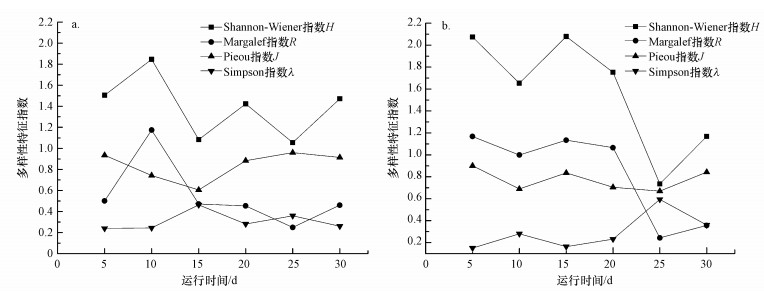 |
| 图 5 生物膜系统中微型动物群落物种多样性随运行时间动态变化(a.R1系统, b.R2系统) Fig. 5 Variation of species diversity of microfauna community in the biofilm system |
R2系统中生物膜上微型动物群落物种Margalef指数大于R1系统, 说明有机负荷较高有利于生物膜系统中微型动物物种丰富度的提高.R1系统中微型动物群落物种均匀程度比R2系统稍高, 但两者相差不大且较为稳定.两系统生物膜上微型动物物种优势度λ相差不大.R2系统中生物膜上微型动物多样性指数H(1.577±0.531) 高于R1系统(1.397±0.295), 说明有机负荷较高有利于生物膜生长及微生态系统的形成和稳定, 使得微型动物群落丰富度较高、多样性较高.
在一段时期内物种多度保持不变的群落为“稳定群落”, 而另外一些物种多度表现出很大变化的群落为“不稳定群落”(张立敏等, 2010).不同负荷下生物膜微型动物群落稳定性指数动态变化如图 6所示.试验中, 前10 d内系统内微型动物群落有一个适应阶段, 第10 d后R1、R2系统微型动物物种稳定指数WS分别稳定在0.744±0.350、0.663±0.210.说明生物膜在适应一定环境条件后, 微型动物物种稳定性增强并逐渐趋于稳定, 负荷较高的R2系统中生物膜微型动物物种稳定性较好且变化较小.
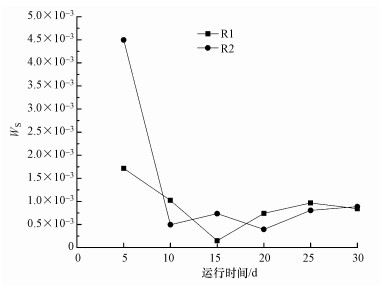 |
| 图 6 不同负荷下生物膜微型动物群落物种稳定指数动态变化 Fig. 6 Dynamic of species stability index of microfauna community of biofilm under different organic loading |
R1、R2系统微型动物多样性稳定指数WH分别为0.211、0.337, 说明负荷较低的R1系统中微型动物多样性稳定性较好.有机负荷较高时, 群落物种数随群落容纳能力(群落物种个体总数)增大而增大的速率(WS)较慢, 而群落物种多样性随时间变化的离散程度(WH)都较大, 有机负荷较高有利于生物膜上微型动物物种稳定性却不利于多样性稳定性, 这是由于多样性不仅受到物种丰富度的影响, 也受到物种均匀度的影响, 也许这也是R3系统中缺失微型动物的原因之一.
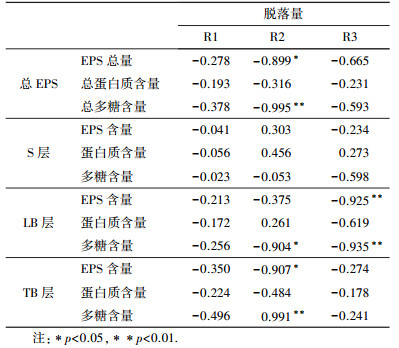
3.2 载体生物膜特性对生物膜脱落的影响通过对3个系统中载体上生物膜组成成分对单次脱落量影响分析发现(表 2), 低负荷R1系统中载体上生物膜EPS组成及含量变化与生物膜脱落量无显著相关性(|r| < 0.05, p > 0.4);中负荷R2系统中生物膜EPS量与生物膜脱落量显著负相关(r=-0.899, p < 0.05), 进一步分析发现其组成成分PS对脱落量影响显著(r=-0.995, p < 0.01), 而PN对脱落量影响不显著(|r| < 0.05, p > 0.05);高负荷R3系统中生物膜LB-EPS含量与脱落量显著负相关(r=-0.925, p < 0.01), 也是由于LB层PS含量对脱落量有显著影响(r=-0.935, p < 0.01) 造成的, 这与Zhu等(2015)的观点:生物膜黏附力与胞外多糖含量有显著正相关性一致.
| 表 2 生物膜组成成分与脱落量的Pearson相关性 Table 2 Pearson correlation between components of biofilm and its loss |
结合3.1.2节分析发现, 低负荷R1系统中生物膜EPS组成及含量变化对生物膜脱落量无显著影响, 可能原因是系统完全采用生活污水, 而且负荷低, 所以形成的生物膜EPS量较少, 生物膜EPS对脱落量的影响不大; 中负荷R2系统中, LB-EPS和TB-EPS的组成成分PS含量减少引起生物膜脱落量增加; 高负荷的R3系统中, 生物膜EPS总量最高, EPS聚集在微生物外部形成保护层抵御外界环境的影响, 胞外多糖(PS)含量呈下降趋势但减少不多, 所以R3系统生物膜也有脱落但脱落量较少.由此说明生物膜中PS含量越低, 生物膜脱落量越大.此外, R2中生物膜脱落量与脱氢酶活性显著负相关(r=-0.940, p < 0.01), 载体上生物膜脱氢酶活性越小, 生物膜越容易脱落, 脱落量越大.
分析还发现, R1、R2系统中, 鞭毛虫(r > 0) 和微型后生动物均促进生物膜脱落, 微型动物个体大, 它们在生物膜上的活动使得生物膜松动, 容易脱落.固着型纤毛虫、变形虫、肉食型纤毛虫、匍匐型纤毛虫和游泳型纤毛虫多度增加对生物膜脱落起抑制作用(r < 0), 固着型纤毛虫、游泳型纤毛虫的大量出现标志着生物膜处于生命力旺盛阶段, 不易脱落.R1系统中第15 d鞭毛虫、微型后生动物多度出现峰值时, 载体上生物膜量最少, 仅为8.53 mg·g-1, 随后随着其多度减少, 生物膜量慢慢增长至12.86 mg·g-1.R2系统中载体上微型动物多度先增长后下降, 生物膜量一直呈现下降趋势.
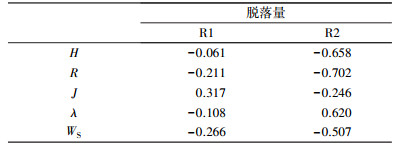
由微型动物物种多样性指数H、丰富度R、均匀度J和优势度λ随着运行时间的变化(图 5), 以及微型动物多样性特征指数与生物膜脱落量间的Pearson相关性分析结果(表 3)可知, 低负荷R1系统中, 除了微型动物均匀度J与生物膜脱落量之间呈正相关(r > 0.3), 其余特征指数H、R、λ与生物膜脱落量之间呈现负相关; 中负荷R2系统中, 除了微型动物优势度λ与生物膜脱落量之间呈现正相关, 特征指数H、R、J与生物膜脱落量之间均呈现负相关.说明生物膜上微型动物群落物种丰富程度、多样性水平越高时, 生物膜脱落现象较少.
| 表 3 生物膜微型动物群落物种多样性特征指数与脱落量的Pearson相关性 Table 3 Pearson correlation between species diversity index of microfauna community and biofilm loss |
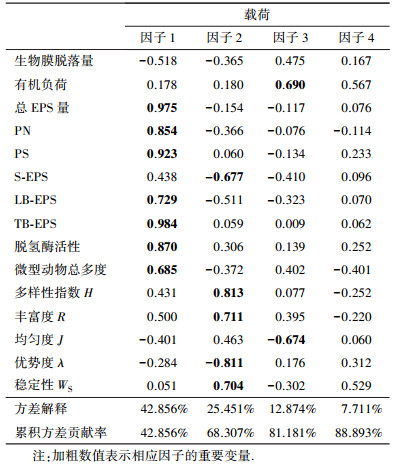
为了综合分析各因子的作用大小, 对生物膜脱落及附着生物膜生物特性各参数进行因子分析.变量与因子间的紧密程度取决于旋转后负荷系数的绝对值.当变量负荷系数的绝对值大于0.5时, 说明该变量与对应因子紧密相关, 该变量是对应因子组成中的重要变量(Esteban et al., 1991).根据因子所能解释总信息量的程度要求(累积解释信息量在85%以上)选取了4个因子, 它们概括了原始变量所包含信息量的88.9%, 分析结果如表 4所示.
| 表 4 生物膜脱落量与生物膜特性参数因子分析 Table 4 Factor analysis of biofilm loss and biological characteristics parameter |
由表 4可知, 因子1在总EPS、PN、PS、LB-EPS、TB-EPS、脱氢酶活性、生物膜脱落量等参数上有较大负荷系数绝对值( > 0.5, 下同), 其中, PN和PS是胞外聚合物(EPS)的主要组成成分, LB-EPS和TB-EPS是与微生物细胞直接结合的胞外聚合物, 脱氢酶活性和微型动物总多度分别从两个方面反映了系统中生物膜活性, 它们与生物膜脱落量间均呈现显著负相关.因此, 可将因子1定义生物膜组成和活性因子, 占总方差解释量的42.86%.
与因子2紧密相关的变量有微型动物多样性指数H、丰富度R、优势度λ、群落物种稳定指数WS等, 它们与生物膜脱落量之间呈负相关.因此, 可将因子2定义为生物因子, 且因子2解释了原始变量所包含总信息量的25.45%.
因子3对应变量中负荷系数绝对值较大的原始变量为有机负荷、微型动物均匀度J等, 且有机负荷与其余变量之间呈正相关, 微型动物均匀度J与其它变量之间呈负相关.故将因子3定义为负荷因子, 该因子解释了原始变量所包含信息量的12.87%.
与因子4紧密相关的变量为有机负荷和微型动物群落物种稳定指数WS, 故将因子4概括为物种稳定因子, 解释了原始变量所包含信息量的7.71%.
3.3 生物膜脱落与生物膜特性的相互影响由上述分析可知, 载体表面附着生物膜特性对生物膜脱落产生很大影响.观察发现, 试验后期生活污水+高浓度基质培养的高负荷R3系统中, 膜与载体表面的结合较为紧密, 脱落现象不明显, 载体上生物膜量变化较小((75.79±12.40) mg·g-1), 生物膜脱落率小于25%.高负荷条件下形成的生物膜具有厚度较大、黏附力较强、脱落较慢的特性.分析表明:R2系统中载体上生物膜脱氢酶活性对下一次生物膜脱落量影响显著(r=-0.960, p < 0.01), 说明载体上生物膜脱氢酶活性会随着生物膜脱落量的增加而下降.生物膜脱落量对微型动物群落也有一定影响:生物膜脱落较多, 会降低微型动物群落物种多样性水平.R1、R2系统中生物膜脱落量与载体上微型动物群落物种稳定指数WS相关性系数分别为-0.266、-0.507(表 3), 这表明生物膜脱落量会对载体生物膜上微型动物物种稳定性产生影响.
因此, 生物膜脱落与载体上附着的生物膜之间是相互作用、相互影响的.脱落生物膜在污水处理工艺系统中, 与附着生物膜在营养物质、溶解氧等方面产生竞争关系, 从而制约与限制载体上附着生物膜的生长与代谢, 对附着生物膜生物特性产生影响, 导致生物膜处理水质效果下降.
图 7展示了生物膜脱落量与CODCr去除率的变化关系.R1、R2、R3系统中生物膜脱落量与CODCr去除率的Pearson相关性系数r分别达到-0.913、-0.646、-0.816, 存在显著负相关, 说明不同负荷条件下生物膜脱落量对CODCr去除率均有一定影响, 随着生物膜脱落量增加, 填料上生物膜量减少, 导致CODCr去除率降低.随着进水浓度的增加, CODCr去除率随生物膜脱落量增加而下降的速度逐渐减小.R2系统生物膜脱落量最大, CODCr去除率变化范围最大; R3系统因进水浓度较高, 整个试验过程CODCr去除率较低, 且变化范围最小.
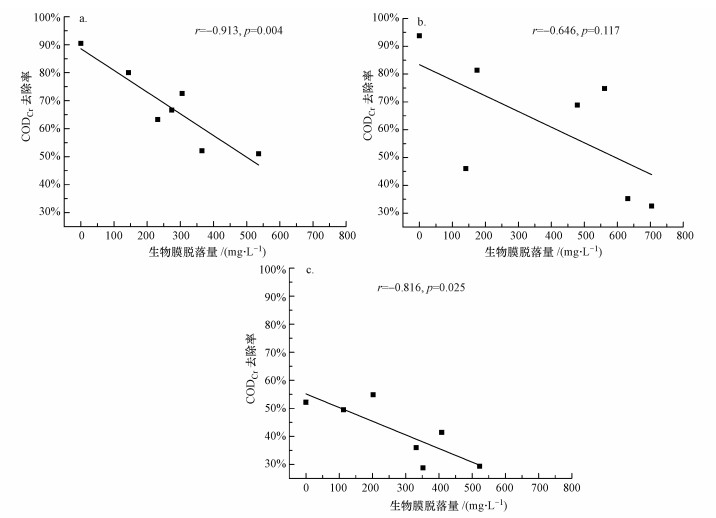 |
| 图 7 生物膜脱落量与COD去除率的相关性(a.R1系统, b.R2系统, c.R3系统) Fig. 7 The correlation between biomass of biofilm detached and COD removal rate |
1) 生物膜脱落是一个动态变化过程, 生物膜脱落量随时间延长而增大; 有机负荷对生物膜脱落量的影响不是单纯的线性关系, 按负荷大小可分为3种类型, 高负荷下形成的生物膜厚度较大, 对载体黏附力较强, 脱落较慢.
2) 生物膜EPS量随有机负荷增大而增大, 与细胞紧密结合的EPS(TB-EPS)是生物膜EPS的主要组成部分; 生物膜脱落量主要受到多糖影响, 生物膜EPS中多糖含量越高, 生物膜越稳定, 不易脱落.
3) 系统中pH值逐渐下降并抑制生物膜活性, 生物膜脱落量与载体上生物膜脱氢酶活性互相影响, 生物膜脱落量随着脱氢酶活性下降而增加, 载体上生物膜脱氢酶活性也会随着生物膜脱落量增加而下降.
4) 在生物膜脱落过程中, 生物膜微型动物多度和物种数有所减少, 微型动物多度变化前期受鞭毛虫影响, 后期受纤毛虫和微型后生动物影响, 物种多样性水平随着运行时间延长而降低; 较高负荷系统的生物膜微型动物群落丰富度较高使得多样性较高, 微型动物物种稳定性越高而多样性稳定性越低, 生物膜脱落越多.
5) 因子分析揭示了不同负荷条件下生物膜脱落与生物膜特性的相互关系, 与生物膜脱落紧密相关的因子依次为生物膜组成和活性因子、生物因子、负荷因子等.
6) 生物膜脱落与载体上附着的生物膜之间是相互作用、相互影响的.系统中脱落生物膜对附着生物膜生物特性产生影响, 导致生物膜处理水质效果变化.不同负荷条件下, 随着生物膜脱落量增加, COD去除率降低.
Bassin J P, Dias I N, Cao S M S, et al. 2016. Effect of increasing organic loading rates on the performance of moving-bed biofilm reactors filled with different support media: Assessing the activity of suspended and attached biomass[J]. Process Safety and Environmental Protection, 100: 131–141.
DOI:10.1016/j.psep.2016.01.007
|
曹秀芹, 赵自玲. 2010. 胞外聚合物(EPS)构成的影响因素分析[J]. 环境科学与技术, 2010, 33(12F): 420–424, 471.
|
陈黎明, 柴立和. 2005. 生物膜废水处理系统的数学模型及机理探讨[J]. 自然科学进展, 2005, 15(7): 843–848.
|
Delia T S. 2003. Investigation of extracellular polymer substances (EPS) and physicochemical properties of different activated sludge flocs under steady-state conditions[J]. Enzyme and Microbial Technology, 32: 375–385.
DOI:10.1016/S0141-0229(02)00309-5
|
窦娜莎, 王琳. 2016. 不同温度下曝气生物滤池运行效能与微生物群落结构[J]. 环境工程学报, 2016, 10(6): 2800–2806.
|
Dubber D, Gray N F. 2011. The influence of fundamental design parameters on ciliates community structure in Irish activated sludge systems[J]. European Journal of Protistology, 47(4): 274–286.
DOI:10.1016/j.ejop.2011.05.001
|
Elenter D, Milferstedt K, Zhang W, et al. 2007. Influence of detachment on substrate removal and microbial ecology in a heterotrophic/autotrophic biofilm[J]. Water Research, 41: 4657–4671.
DOI:10.1016/j.watres.2007.06.050
|
Esteban G, Tellez C, Bautista L M. 1991. Dynamics of ciliated protozoa communities in activated-sludge process[J]. Water Research, 25(8): 967–972.
DOI:10.1016/0043-1354(91)90145-G
|
Etienne P, Juan C O, Yoan P, et al. 2012. Effect of shear stress and growth conditions on detachment and physical properties of biofilms[J]. Water Research, 46: 5499–5508.
DOI:10.1016/j.watres.2012.07.029
|
Fang F, Lu W T, Shan Q, et al. 2014. Characteristics of extracellular polymeric substances of phototrophic biofilms at different aquatic habitats[J]. Carbohydrate Polymers, 106: 1–6.
DOI:10.1016/j.carbpol.2014.02.010
|
Hadjiev D, Dimitrov D, Martinov M, et al. 2007. Enhancement of the biofilm formation on polymeric supports by surface conditioning[J]. Enzyme and Microbial Technology, 40: 840–848.
DOI:10.1016/j.enzmictec.2006.06.022
|
Hu H Zh, He J G, Liu J, et al. 2016. Biofilm activity and sludge characteristics affected by exogenous N-acyl homoserine lactones in biofilm reactors[J]. Bioresource Technology, 211: 339–347.
DOI:10.1016/j.biortech.2016.03.068
|
胡小兵, 饶强, 钟梅英, 等. 2016. SBR工艺活性污泥驯化过程中微型动物群落物种多样性及其稳定性研究[J]. 环境科学学报, 2016, 36(9): 3177–3186.
|
Hu X B, Wang Zh, Xu K, et al. 2013. Biofilm regeneration on carriers in MBBR used for vitamin C wastewater treatment[J]. Water Science and Technology: A Journal of the International Association on Water Pollution Research, 67(6): 1310–1317.
DOI:10.2166/wst.2013.695
|
Hu X B, Xu K, Wang Zh, et al. 2013. Characteristics of biofilm attaching to carriers in moving bed biofilm reactor used to treat vitamin C wastewater[J]. Scanning, 35: 283–291.
DOI:10.1002/sca.v35.5
|
Lee S, Basu S, Tyler C W, et al. 2004. Ciliate populations as bio-indicators at deer island treatment plant[J]. Advances in Environmental Research, 8(3/4): 371–378.
|
刘宏波, 杨昌柱, 濮文虹, 等. 2009. 有机负荷对颗粒化SBR反应器的影响研究[J]. 环境科学, 2009, 30(5): 1449–1453.
|
Liu J, Yang M, Qi R, et al. 2008. Comparative study of protozoan communities in full-scale MWTPs in Beijing related to treatment processes[J]. Water Research, 42(8/9): 1907–1918.
|
Maik W, Ashkan S, Alojz I, et al. 2013. Detachment characteristics of a mixed culture biofilm using particle size[J]. Chemical Engineering Journal, 228: 1140–1147.
DOI:10.1016/j.cej.2013.05.071
|
马克平. 1994. 生物群落多样性的测度方法Ⅰα多样性的测度方法(上)[J]. 生物多样性, 1994, 2(3): 162–168.
DOI:10.17520/biods.1994027 |
马克平, 刘玉明. 1994. 生物群落多样性的测度方法Ⅰα多样性的测度方法(下)[J]. 生物多样性, 1994, 2(4): 231–239.
|
Muatasem A, Cecile L, Caroline G, et al. 2011. Influence of surface topography on biofilm development: Experiment and modeling[J]. Biochemical Engineering Journal, 57: 38–45.
DOI:10.1016/j.bej.2011.08.005
|
Nicolas D, Carole C S, Isabelle Q, et al. 2013. Growth limiting conditions and denitrification govern extent and frequency of volume detachment of biofilms[J]. Chemical Engineering Journal, 218: 368–375.
DOI:10.1016/j.cej.2012.11.061
|
沈韫芬, 章宗涉, 顾曼如, 等. 1989. 微型生物监测新技术[M]. 北京: 中国建筑工业出版社.
|
唐兴益. 1996. 生化处理中的滤塔生物膜脱落[J]. 云南环境科学, 1996, 15(2): 45–47.
|
杨涛, 张静, 何帅, 等. 2016. 投加FeSO4对序批式生物膜反应器中DHA、EPS和处理效果的影响[J]. 环境科学学报, 2016, 36(8): 2838–2843.
|
Ye F X, Ye Y F, Li Y. 2011. Effect of C/N ratio on extracellular polymeric substances (EPS) and physicochemical properties of activated sludge flocs[J]. Journal of Hazardous Materials, 188: 37–43.
DOI:10.1016/j.jhazmat.2011.01.043
|
殷俊, NicolasD, EtienneP. 2012. 限制基质条件下生物膜特性的研究[J]. 中国给水排水, 2012, 28(1): 15–18.
|
You G X, Hou J, Xu Y, et al. 2015. Effects of CeO2 nanoparticles on production and physicochemical characteristics of extracellular polymeric substances in biofilms insequencing batch biofilm reactor[J]. Bioresource Technology, 194: 91–98.
DOI:10.1016/j.biortech.2015.07.006
|
袁冬琴, 王毅力. 2012. 活性污泥胞外聚合物(EPS)的分层组分及其理化性质的变化特征研究[J]. 环境科学, 2012, 33(10): 3522–3528.
|
张磊, 刘平, 马锦, 等. 2013. 基于微气泡曝气的生物膜反应器处理废水研究[J]. 环境科学, 2013, 34(6): 2277–2282.
|
张立敏, 陈斌, 李正跃. 2010. 应用中性理论分析局域群落中的物种多样性及稳定性[J]. 生态学报, 2010, 30(6): 1556–1563.
|
张洛红, 李兴. 2011. 活性污泥性质检测方法的比较研究[J]. 工业用水与废水, 2011, 42(6): 89–93.
|
周俊, 周立祥, 黄焕忠. 2013. 污泥胞外聚合物的提取方法及其对污泥脱水性能的影响[J]. 环境科学, 2013, 34(7): 2752–2757.
|
周夏芝, 邹运鼎, 毕守东, 等. 2004. 桃园节肢动物群落的多样性、均匀度和相对稳定性季节动态[J]. 应用生态学报, 2004, 15(8): 1427–1430.
|
Zhu Y, Zhang Y, Ren H Q, et al. 2015. Physicochemical characteristic and microbial community evolution of biofilm during the start-up period in a moving bed biofilm reactor[J]. Bioresource Technology, 180: 345–351.
DOI:10.1016/j.biortech.2015.01.006
|
 2017, Vol. 37
2017, Vol. 37