2. 首都经济贸易大学特大城市经济社会发展研究协同创新中心, 北京 100070;
3. 浙江大学环境工程系, 杭州 310058
2. Academy of Metropolis Economic and Social Development at Capital University of Economics and Business, Beijing 100070;
3. Department of Environmental Engineering, Zhejiang University, Hangzhou 310058
厌氧氨氧化(anaerobic ammonia oxidization, Anammox)是在缺氧或厌氧条件下, 厌氧氨氧化菌以氨(NH4+)为电子供体将亚硝酸(NO2-)还原为氮气(N2)的生物反应(Mulder et al., 1995; Strous et al., 1998; Strous et al., 1999)(式(1)).厌氧氨氧化工艺是一种高效的新型生物脱氮技术, 其容积氮去除率高达9.5 kg·m-3·d-1, 远高于传统生物脱氮技术, 尤其适用于如污泥消化液等高含氨废水的脱氮处理(van der Star et al., 2007).
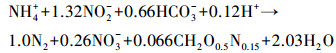
|
(1) |
由式(1) 可知, 氨和亚硝酸是厌氧氨氧化菌的基质.但超过一定阈值时, 它们也会对厌氧氨氧化菌产生抑制, 从而转变为“基质性毒物”.在处理高浓度含氨废水时常常会遇到上述问题, 即在高基质浓度下易出现基质性毒物引发的反应器功能障碍, 导致反应器效能下降或崩溃.国内外研究者们对氨和亚硝酸对厌氧氨氧化富集培养物的抑制浓度和机理展开了研究.由于采用的厌氧氨氧化富集培养物的富集程度、测定方法等不同, 研究者们所得氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度不尽相同.Strous等(1999)在分批培养条件下得到的氨对厌氧氨氧化富集培养物的半抑制浓度超过1000 mg·L-1, 亚硝酸对厌氧氨氧化富集培养物的半抑制浓度仅为100 mg·L-1; 郑平等(2001)在分批培养条件下得到氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度分别为532~1378.5 mg·L-1和76~168 mg·L-1; Dapena Mora等(2007)在分批培养条件下得到氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度分别为770 mg·L-1和350 mg·L-1; 其他研究者们所得氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度范围均分别在1500 mg·L-1以下(Aktan et al., 2012; Bettazzi et al., 2010; Chen et al., 2011; Tang et al., 2010; Fernandez et al., 2012; Jaroszynski et al., 2012)和400 mg·L-1以下(Egli et al., 2001; Isaka et al., 2007; Lotti et al., 2012; Oshiki et al., 2011; Tang et al., 2010).研究者们主要集中于单一基质氨或亚硝酸对厌氧氨氧化富集培养物的影响, 而在实际生产过程中, 氨和亚硝酸同时存在, 很可能出现二者都对厌氧氨氧化富集培养物产生抑制的情况, 而其联合作用是否会加剧抑制效应却鲜有报道.此外, 研究者们对厌氧氨氧化富集培养物受到基质抑制的机理仍有争论, 主要是关于氨和亚硝酸的有效基质形式.Aktan等(2012)认为游离氨浓度过高是抑制厌氧氨氧化富集培养物的原因.Puyol等(2014)认为游离亚硝酸是否会抑制厌氧氨氧化富集培养物和具体的培养条件有关, 在常规条件下, 离子态的亚硝酸根应该是抑制物.厌氧氨氧化工艺在用于处理高含氨废水条件下, 基质浓度不同于常规条件, 因此高浓度基质对厌氧氨氧化的抑制机理仍不明晰.因此, 本文采用分批培养和连续培养试验了基质性毒物对厌氧氨氧化富集培养物的单独和联合抑制效应, 以期为厌氧氨氧化工艺的基质调控提供参考.
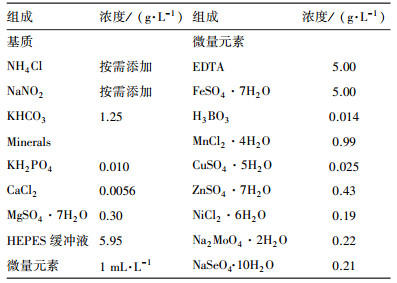
2 材料与方法(Materials and methods) 2.1 分批培养试验分批培养试验采用的厌氧氨氧化富集培养物取自本实验室的高效厌氧氨氧化反应器.所采用的培养基组成如表 1所示, 培养条件为温度35 ℃和pH 7.0.
| 表 1 分批试验培养基组成 Table 1 Compositions of culture medium for batch culture tests |
分批培养试验包括单独抑制效应试验和联合抑制效应试验.单独抑制效应试验中分别测定氨和亚硝酸的毒性效应.在氨的抑制效应试验中, 保持初始亚硝氮浓度为70 mg·L-1, 设定6~8个氨浓度梯度, 每个浓度设定3组平行, 测定基质浓度随时间的变化情况, 并求得比厌氧氨氧化活性(specific Anammox activity, SAA).同理, 在亚硝酸的抑制效应试验中, 保持初始氨氮浓度为70 mg·L-1, 设定6~8个亚硝酸浓度梯度, 每个浓度设定3组平行, 测定基质浓度随时间的变化情况并求得SAA.联合抑制效应试验中, 根据单独抑制效应试验所得氨和亚硝酸的半抑制浓度, 采用等效浓度混合法进行联合抑制效应试验(郑平和冯孝善, 2006).
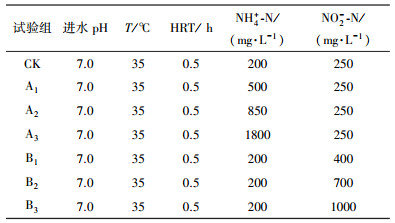
2.2 连续培养试验采用厌氧膨胀颗粒污泥床反应器(Expanded Granular Sludge Blanket Reactor, EGSB)进行连续培养试验.反应器总体积为200 mL, 有效体积为100 mL.平行运行7组反应器, 设定对照组为CK, 氨试验组(A1、A2和A3), 亚硝酸试验组(B1、B2和B3), 7组反应器培养基成分同表 1, 具体设置见表 2.保持进水水温为30 ℃, 进水pH为7.0, 水力停留时间为0.5 h, 以不同的基质浓度运行7组反应器, 监测反应器的性能指标(容积效能、基质去除率和中间产物)的变化.
| 表 2 连续培养试验中各反应器基质浓度设定 Table 2 Different substrates concentrations in continuous tests |
氨氮(NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、联氨(N2H4)、pH、总固体(total solids, TS)和挥发性固体(volatile solids, VS)等项目采用标准方法测定(国家环保总局水和废水监测分析方法编委会, 2002; 雷兆春, 2006).
2.4 相对活性百分数的计算计算样品的相对活性百分数(SAAr, %)和半抑制浓度(IC50, mg·L-1).利用Origin 8.0软件绘制基质浓度随时间的变化曲线, 并进行回归分析求出各处理组中污泥的SAAi.设定对照组(CK)的比厌氧氨氧化活性为SAA0.厌氧氨氧化的抑制程度可以用式(2) 所示的相对活性百分数SAAr表示.
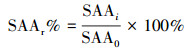
|
(2) |
绘制相对活性百分数SAAr与基质浓度c的曲线, 采用OriginPro8.0软件中非线性拟合中的剂量-效应模型(DoseResp)进行拟合, 其公式如式(3) 所示, 其中C1、C2分别为相对活性百分数的最小值和最大值, p为曲线中点(即拟合曲线最大斜率的绝对值), 根据拟合方程可求得SAAr=50%时对应的基质浓度值即为半抑制浓度值.
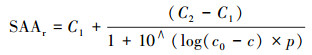
|
(3) |
二元混合体系可采用等效应图法判定混合物的联合作用类型(郑平和冯孝善, 2006), 其具体原理如图 1所示.a2、b2分别为A、B单一物质毒性试验的半抑制浓度值.a1、a3为a2的95%可信限; b1、b3为b2的95%可信限.a0、b0分别为A、B混合物的半抑制浓度值的贡献值.根据P(a0, b0)的位置可以判定联合作用的类型.若P点落在线1和线3之间, 判为相加作用; 若P点落在线1之下, 判为协同作用; 若P点落在线3之上(三角形a3 b3Q范围内), 判为独立作用; 若P点落在由纵坐标轴和横坐标轴以及通过Q(a3, b3)点的两垂线所围成的矩形之外, 则判为拮抗作用.
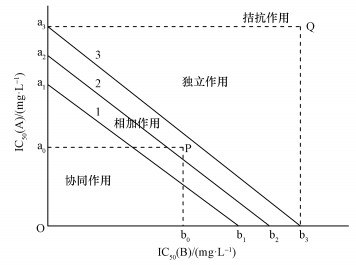 |
| 图 1 联合作用等效应图 Fig. 1 Isoboles of joint effect |
采用分批培养法研究了氨和亚硝酸对厌氧氨氧化富集培养物的影响.厌氧氨氧化富集培养物的相对活性百分数(SAAr)与单一基质性毒物浓度(c)的关系如图 2所示.采用剂量-效应模型进行非线性回归拟合可知, SAAr与c显著相关, R2分别为0.9780和0.9366, 氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度及95%可信限分别为1670.3(1518.3~1832.4) mg·L-1和565.3(239.0~916.3) mg·L-1.两种基质性毒物对厌氧氨氧化富集培养物的相对毒性大小为:亚硝酸 > 氨.
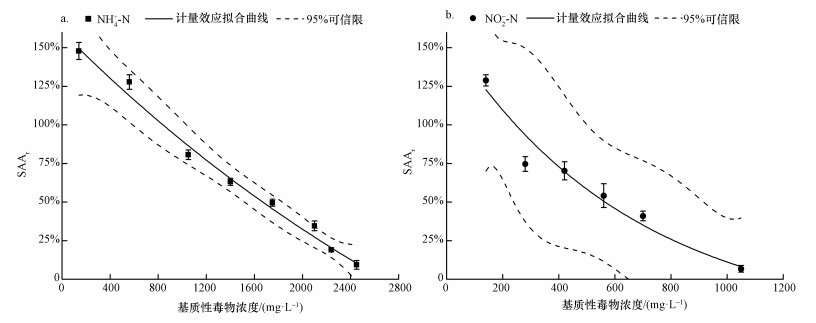 |
| 图 2 厌氧氨氧化富集培养物相对活性百分数与单一基质性毒物浓度的剂量效应关系(a. NH4+-N, b.NO2--N) Fig. 2 Dose-response relationship between SAA and single substrate-toxicant concentrations(a. NH4+-N, b. NO2--N) |
采用分批培养试验研究了基质性毒物混合物对厌氧氨氧化富集培养物的影响, 厌氧氨氧化富集培养物的相对活性百分数(SAAr)与基质性毒物混合物浓度(c)的剂量效应关系如图 3所示.同样, 采用剂量-效应模型进行非线性回归拟合可知, SAAr与c显著相关, R2为0.9568, 二元基质混合物的半抑制浓度及95%可信限为2384.5(2206.9~2574.1) mg·L-1.
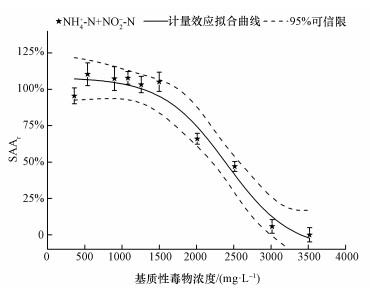 |
| 图 3 厌氧氨氧化富集培养物相对活性百分数与基质性毒物混合物浓度的剂量效应关系 Fig. 3 Dose-response relationship between SAA and substrate-toxicants mixtures concentrations |
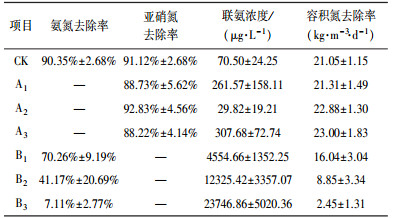
采用连续培养法分别试验不同浓度氨和亚硝酸对厌氧氨氧化反应器性能的影响.由表 3可知, 在所设定的3组氨浓度范围内(培养时间为24 d), 与对照组(CK)相比, 随着氨浓度的上升, 亚硝氮去除率、中间产物联氨浓度和容积氮去除率的平均值未出现下降, 基本保持稳定, 3组反应器运行良好, 与对照组无明显区别.而在所设定的3组亚硝酸浓度范围内(培养时间为12 d), 与对照组相比, 随着亚硝酸浓度的上升, B1、B2和B3的氨氮去除率平均值分别下降了20.09%、49.18%和83.24%;B1、B2和B3的中间产物联氨浓度平均值分别上升了4484.16、11254.5和23676.36 μg·L-1, 中间产物联氨浓度明显上升; B1、B2和B3的容积氮去除率平均值分别下降了5.01、12.2和18.6 kg·m-3·d-1, 反应器的厌氧氨氧化功能急剧下降.亚硝酸浓度与基质去除率、容积氮去除率呈负相关, 与联氨浓度呈正相关; 联氨浓度与反应器效能(基质去除率、容积氮去除率)呈负相关.
| 表 3 基质性毒物浓度对厌氧氨氧化反应器性能影响 Table 3 Performances of Anammox reactors with different substrate concentrations |
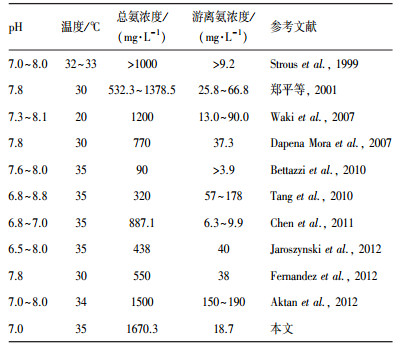
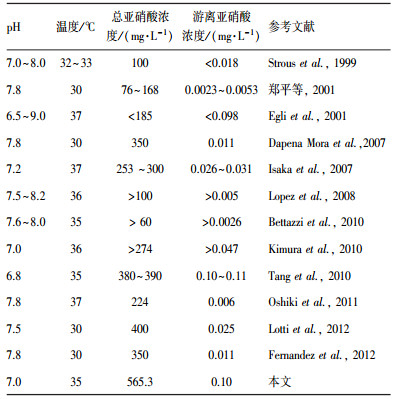
基质性毒物对厌氧氨氧化富集培养物的抑制主要来源自于有效基质性毒物的浓度.在水相中, 氨以游离氨(free ammonia, FA)和铵根离子(NH4+)的形式存在.一般认为, 氨对厌氧氨氧化富集培养物的抑制作用主要来自游离氨, 而不是铵根离子(Aktan et al., 2012).温度和pH均会影响水相中游离氨和铵根离子的分配比例并引起毒性变化, 游离氨占总氨氮浓度的比例可按式(4) 计算(Anthonisen et al., 1976).其中, T为温度; cFA为游离氨浓度; ct, NH3为总氨浓度.由表 4可知, 游离氨对厌氧氨氧化富集培养物的半抑制浓度范围为3.0~190.0 mg·L-1.本文中, T=35 ℃, pH=7.0, ct, NH3=1670.3 mg·L-1, 所得游离氨对厌氧氨氧化富集培养物的半抑制浓度为18.7 mg·L-1, 处在2.0~178.0 mg·L-1范围内, 说明在该游离氨浓度下会对厌氧氨氧化富集培养物产生抑制效应.
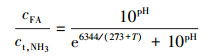
|
(4) |
| 表 4 游离氨对厌氧氨氧化的抑制浓度(Ding et al., 2015) Table 4 Inhibition concentrations of free ammonia to Anammox enrichment culture |
在水相中, 亚硝酸以游离亚硝酸(free nitrite acid, FNA)和亚硝酸根离子(NO2-)的形式存在.亚硝酸与亚硝酸根离子两者谁起主导抑制作用存在临界点(Puyol et al., 2014).温度和pH均会影响水相亚硝酸和亚硝酸根离子的分配比例并导致毒性变化(Puyol et al., 2014).游离亚硝酸占总亚硝酸盐浓度的比例可按式(5) 计算(Anthonisen et al., 1976).其中, T为温度, cFNA为游离亚硝酸浓度, ct, NO2为总亚硝酸盐浓度.由表 5可知, 游离亚硝酸对厌氧氨氧化富集培养物的半抑制浓度范围在0.011~ 0.11 mg·L-1.本文中, T=35 ℃, pH=7.0, ct, NO2=565.3 mgN·L-1, 计算所得游离亚硝酸对厌氧氨氧化富集培养物的半抑制浓度为0.10 mg·L-1, 处在0.011~0.11 mg·L-1范围内, 说明在该游离亚硝酸浓度下会对厌氧氨氧化富集培养物产生抑制效应.
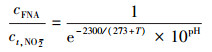
|
(5) |
| 表 5 游离亚硝酸对厌氧氨氧化的抑制浓度(Ding et al., 2015) Table 5 Inhibition concentrations of free nitrite acid to Anammox enrichment culture |
综上所述, 在中性环境和高浓度基质条件下, 游离氨或游离亚硝酸浓度过高会对厌氧氨氧化富集培养物产生抑制作用.游离氨(或游离亚硝酸)的浓度与进水总氨浓度(或总亚硝酸浓度)、温度和pH直接相关, 因此在高浓度基质运行时, 应严格注意进水总基质浓度、温度和pH的波动, 防止由游离态基质浓度的升高引起的反应器效能的降低或崩溃.此外, 在高浓度基质条件下, 由于游离亚硝酸毒性远高于游离氨, 可控制反应器在中性偏碱条件下运行, 防止游离亚硝酸浓度过高造成的抑制.
4.2 基质性毒物对厌氧氨氧化富集培养物的联合作用采用等效应图法判定二元基质性毒物混合物的联合作用类型.由图 4中P点位置可以判定:氨和亚硝酸的联合作用类型为独立作用, 即二者各自对厌氧氨氧化富集培养物产生毒害作用, 互不影响.因此在实际的工程运行过程中, 如出现基质比例失调时, 应该优先控制过量基质的浓度, 减轻其毒害作用, 尤其要注意避免出现基质亚硝酸过量的情况.
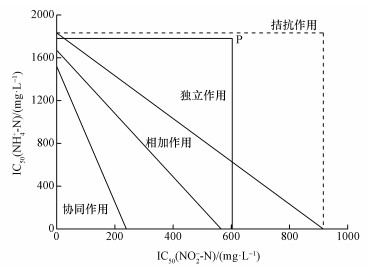 |
| 图 4 二元基质性毒物混合物对厌氧氨氧化富集培养物的联合作用等效应图 Fig. 4 Isoboles of joint effect of binary substrate-toxicants mixtures to Anammox enrichment culture |
分批培养和连续培养中, 和基质氨相比, 基质亚硝酸对厌氧氨氧化富集培养物的抑制效应更强, 其抑制机理值得深究.在自然界, 基质亚硝酸对很多微生物均有抑制作用, 其机理主要有3个方面:① 作为解偶联剂影响微生物产能; ② 直接影响微生物代谢的关键酶; ③ 刺激某种中间产物积累而导致中毒(Zhou et al., 2011).Gao等(2016)研究表明, 对于同属脱氮生物的反硝化模式微生物(Pseudomnas aeruginosa PAO1), 发生游离亚硝酸抑制时, 大多反硝化酶基因的转录表达下降、蛋白合成显著下降, 碳代谢途径从三羧酸循环受阻, 并调整为丙酸盐发酵, 以作为一种可能的维持生存机制.基质亚硝酸对厌氧氨氧化菌的抑制机理是否类似仍不明晰.目前, 宏基因组学、转录组学以及蛋白质组学的研究表明, 厌氧氨氧化的反应过程分为3步:① 在cd1型亚硝酸还原酶的作用下, NO2-被还原成NO.② 在联氨合成酶的作用下, NO与NH4+缩合成N2H4.③ 在联氨脱氢酶作用下, N2H4被分解为N2(Kartal et al., 2013; Strous et al., 2006).在本文连续培养试验中, 受亚硝酸抑制时, 中间产物联氨大量积累, 说明厌氧氨氧化菌的代谢过程中的第3步, 即联氨脱氢受阻, 进而导致厌氧氨氧化的电子传递过程出现障碍, 无法实现ATP的合成.亚硝酸的作用位点很可能是抑制了厌氧氨氧化过程中的联氨脱氢酶.Wang等(2016)报道了当NO2--N浓度超过500 mg·L-1时, 伴随着厌氧氨氧化菌的活性下降, 其nirS\hzsA\hdh酶的mRNA水平以及联氨脱氢酶蛋白水平下降, 这从蛋白质组学和转录组学印证了以上推论.此外, 中间产物联氨也是有毒物质.研究表明联氨对厌氧氨氧化富集培养物的半抑制浓度为96 mg·L-1(Carvajal Arroyo et al., 2013), 而在本文的连续培养试验中, 当亚硝酸浓度为700 mg·L-1和1000 mg·L-1时, 出水联氨浓度的平均值分别也达到了12 mg·L-1和24 mg·L-1, 会进一步抑制厌氧氨氧化富集培养物.综上所述, 过量亚硝酸很可能抑制厌氧氨氧化代谢中的联氨脱氢过程, 进而影响厌氧氨氧化的能量代谢; 另一方面, 联氨积累会进一步加剧对厌氧氨氧化富集培养物的抑制效应.
5 结论(Conclusions)1) 分批培养条件下, 氨和亚硝酸对厌氧氨氧化富集培养物的半抑制浓度及其95%可信限分别为1670.3(1518.3~1832.4) mg·L-1和565.3(239.0~916.3) mg·L-1, 亚硝酸毒性大于氨.氨和亚硝酸的联合作用类型为独立作用, 二者各自对厌氧氨氧化富集培养物产生毒害.
2) 在中性和高基质浓度条件下, 游离态基质性毒物浓度过高是抑制厌氧氨氧化富集培养物的原因.此时, 应严格控制进水基质浓度、温度和pH的波动, 防止由游离态基质浓度的升高引起的反应器效能的下降或崩溃.
3) 厌氧氨氧化富集培养物发生抑制时, 中间产物联氨出现积累, 一方面表明厌氧氨氧化富集培养物的联合脱氢步骤受阻、细胞能量代谢不畅, 另一方面, 联氨作为抑制物可能会加剧抑制效应.
Aktan C K, Yapsakli K, Mertoglu B. 2012. Inhibitory effects of free ammonia on Anammox bacteria[J]. Biodegradation, 23(5): 751–762.
DOI:10.1007/s10532-012-9550-0
|
Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal Water Pollution Control Federation, 48(5): 835–852.
|
Bettazzi E, Caffaz S, Vannini C, et al. 2010. Nitrite inhibition and intermediates effects on Anammox bacteria: A batch-scale experimental study[J]. Process Biochemistry, 45(4): 573–580.
DOI:10.1016/j.procbio.2009.12.003
|
Carvajal Arroyo J M, Sun W, Sierra Alvarez R, et al. 2013. Inhibition of anaerobic ammonium oxidizing (Anammox) enrichment cultures by substrates, metabolites and common wastewater constituents[J]. Chemosphere, 91(1): 22–27.
DOI:10.1016/j.chemosphere.2012.11.025
|
Chen T T, Zheng P, Shen L D, et al. 2011. Kinetic characteristics and microbial community of Anammox-EGSB reactor[J]. Journal of Hazardous Materials, 190(1/3): 28–35.
|
Ding S, Wu J, Zhang M, et al. 2015. Acute toxicity assessment of ANAMMOX substrates and antibiotics by luminescent bacteria test[J]. Chemosphere, 140(SI): 174–183.
|
Dapena-Mora A, Fernandez I, Campos J L, et al. 2007. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme and Microbial Technology, 40(4): 859–865.
DOI:10.1016/j.enzmictec.2006.06.018
|
Egli K, Fanger U, Alvarez P J J, et al. 2001. Enrichment and characterization of an Anammox bacterium from a rotating biological contactor treating ammonium-rich leachate[J]. Archives of Microbiology, 175(3): 198–207.
DOI:10.1007/s002030100255
|
Fernandez I, Dosta J, Fajardo C, et al. 2012. Short-and long-term effects of ammonium and nitrite on the Anammox process[J]. Journal of Environmental Management, 95: S170–S174.
DOI:10.1016/j.jenvman.2010.10.044
|
Gao S H, Fan L, Peng L, et al. 2016. Determining multiple responses of Pseudomonas aeruginosa PAO1 to an antimicrobial agent, free nitrous acid[J]. Environmental Science & Technology, 50(10): 5305–5312.
|
国家环保总局水和废水监测分析方法编委会. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社.
|
Isaka K, Suwa Y, Kimura Y, et al. 2008. Anaerobic ammonium oxidation (Anammox) irreversibly inhibited by methanol[J]. Applied Microbiology and Biotechnology, 81(2): 379–385.
DOI:10.1007/s00253-008-1739-0
|
Jaroszynski L W, Cicek N, Sparling R, et al. 2012. Impact of free ammonia on Anammox rates (anoxic ammonium oxidation) in a moving bed biofilm reactor[J]. Chemosphere, 88(2): 188–195.
DOI:10.1016/j.chemosphere.2012.02.085
|
Kartal B, de Almeida N M, Maalcke W J, et al. 2013. How to make a living from anaerobic ammonium oxidation[J]. FEMS Microbiology Reviews, 37(3): 428–461.
DOI:10.1111/1574-6976.12014
|
Kimura Y, Isaka K, Kazama F, et al. 2010. Effects of nitrite inhibition on anaerobic ammonium oxidation[J]. Applied Microbiology and Biotechnology, 86(1): 359–365.
DOI:10.1007/s00253-009-2359-z
|
雷兆春. 2006. GB/T 6906-2006锅炉涌水和冷血水分析方法联氨的测定[S]. 北京: 中国国家标准化委员会
|
Lopez H, Puig S, Ganigue R, et al. 2008. Start-up and enrichment of a granular Anammox SBR to treat high nitrogen load wastewaters[J]. Journal of Chemical Technology and Biotechnology, 83(3): 233–241.
DOI:10.1002/(ISSN)1097-4660
|
Lotti T, van der Star W R, Kleerebezem R, et al. 2012. The effect of nitrite inhibition on the Anammox process[J]. Water Research, 46(8): 2559–2569.
DOI:10.1016/j.watres.2012.02.011
|
Mulder A, van de Graaf A A, Robertson L A, et al. 1995. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed Reactor[J]. FEMS Microbiology Ecology, 16(3): 177–183.
DOI:10.1111/fem.1995.16.issue-3
|
Oshiki M, Shimokawa M, Fujii N, et al. 2011. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium 'Candidatus Brocadia sinica'[J]. Microbiology, 157(Pt6): 1706–1713.
|
Puyol D, Carvajal Arroyo J M, Sierra Alvarez R, et al. 2014. Nitrite (not free nitrous acid) is the main inhibitor of the Anammox process at common pH conditions[J]. Biotechnology Letters, 36(3): 547–551.
DOI:10.1007/s10529-013-1397-x
|
Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 50(5): 589–596.
DOI:10.1007/s002530051340
|
Strous M, Kuenen J G, Jetten M S M. 1999. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 65(7): 3248–3250.
|
Strous M, Pelletier E, Mangenot S, et al. 2006. Deciphering the evolution and metabolism of an Anammox bacterium from a community genome[J]. Nature, 440(7085): 790–794.
DOI:10.1038/nature04647
|
Tang C J, Zheng P, Mahmood Q, et al. 2010. Effect of substrate concentration on stability of Anammox biofilm reactors[J]. Journal of Central South University of Technology, 17(1): 79–84.
DOI:10.1007/s11771-010-0014-6
|
van der Star W R L, Abma W R, Blommers D, et al. 2007. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale Anammox reactor in Rotterdam[J]. Water Research, 41(18): 4149–4163.
DOI:10.1016/j.watres.2007.03.044
|
Waki M, Tokutomi T, Yokoyama H, et al. 2007. Nitrogen removal from animal waste treatment water by Anammox enrichment[J]. Bioresource Technology, 98(14): 2775–1780.
DOI:10.1016/j.biortech.2006.09.031
|
Wang Y Y, Ma X, Zhou S, et al. 2016. Expression of the nirS, hzsA, and hdh genes in response to nitrite shock and recovery in Candidatus Kuenenia stuttgartiensis[J]. Environmental Science &Technology, 50(SI): 6940–6947.
|
郑平, 胡宝兰. 2001. 厌氧氨氧化菌混培物生长及代谢动力学研究[J]. 生物工程学报, 2001, 17(2): 193–198.
|
郑平, 冯孝善. 2006. 废物生物处理[M]. 北京: 高等教育出版社.
|
Zhou Y, Oehmen A, Lim M, et al. 2011. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants[J]. Water Research, 45(15): 4672–4682.
DOI:10.1016/j.watres.2011.06.025
|
 2017, Vol. 37
2017, Vol. 37