由于石化能源的不可再生性, 作为石化燃料潜在替代品的生物柴油近年来得到了较多的关注.第1代、第2代生物柴油产品主要通过将废弃植物油、动物油等原料进行酯交换制备(Lourinho et al., 2015).然而, 这些原料来源受季节和占地影响大, 且成本过高(Lourinho et al., 2015).目前发展到的第3代生物柴油是以产油微生物合成的微生物油脂作为原料进行合成得到(Navia et al., 2012; Pinzi et al., 2014), 其生产应用的主要瓶颈在于纯种产油微生物培养的成本较高, 因此, 目前的研究重点聚焦于以废弃物为主导的廉价微生物油脂原料的开发、废物基质的高效转化利用等方面.污水处理厂在污水处理过程中产生的剩余污泥富含多种产油微生物, 如聚磷菌和聚糖菌能够在体内合成聚羟基脂肪酸酯颗粒(PHAs), 放线菌、酵母菌和霉菌等可以合成三酰甘油脂(TAGs)等, PHAs和TAGs都属于可皂化的能够合成生物柴油的油脂.此外, 剩余污泥中还含有从污水中吸附的脂质, 因此, 可以利用剩余污泥中的产油微生物及脂质作为合成生物柴油的原料(Dufreche et al., 2007; Sawangkeaw et al., 2013).
采用剩余污泥中的产油微生物为原料制备生物柴油, 最重要的是要保证油脂提取率和高效催化转化率能够满足生物柴油合成的技术经济的要求.基于这个目标, 研究者们相继探寻了油脂提取后再酯化二步法、干污泥直接酯化法、湿污泥直接酯化法(Revellame et al., 2011)等方法以实现剩余污泥油脂的高效转化(Siddiquee et al., 2011).但由于剩余污泥中的原有微生物是在低碳高氮条件下产生, 其油脂含量普遍为7%~10%(Mondala et al., 2009), 生物柴油的产量仅为1%~3%(Dufreche et al., 2007).从剩余污泥合成生物柴油的可行性角度来看, Dufreche等(2007)认为酯化的脂肪酸甲酯含量达到10%以上, 从剩余污泥中提取生物柴油才更具经济价值和可行性, 因此, 直接从剩余污泥中提取制备生物柴油得率偏低使其提取成本偏高限制了该技术的推广应用.近3年来, 国内外学者探索了采用剩余污泥中产脂细菌、真菌等作为产油微生物的菌源, 通过控制发酵条件来进一步提高剩余污泥产油微生物的油脂含量进而提高剩余污泥生物柴油产量(Mondala et al., 2012; 李安婕等, 2015; 王怡等, 2014b).这一研究思路采用剩余污泥微生物作为菌源, 一方面可以资源化利用剩余污泥同时减少灭菌环节降低发酵成本(Upadhyaya et al., 2013); 另一方面, 外加碳源可以取自来源于工业废弃物和农业纤维素残余等高浓度的有机废水作为培养基, 如造纸废水(Upadhyaya et al., 2013)、甘蔗渣水解液(Mondala et al., 2015)等, 实现以废治废和生物柴油合成的双重目标.然而, 如何通过优化培养条件和碳源进一步提高剩余污泥中可皂化油脂的含量并降低生产成本, 是促进剩余污泥制备生物柴油推广应用的重要研究方向.
为提高剩余污泥微生物合成的可皂化油脂的含量, 进而促进后续生物柴油制备的得率.本研究首先考察3种油脂提取方法对剩余污泥微生物油脂提取率和生物柴油合成的影响, 确定pH和C/N的最佳发酵条件, 在此基础上考察以不同模拟含糖废水为碳源对剩余污泥产油微生物合成的微生物油脂及制备的生物柴油的影响.
2 材料与方法(Materials and methods) 2.1 剩余污泥来源与性质剩余污泥取自上海某污水处理厂活性污泥, 该污水处理厂进水主要为生活污水, 部分为工业废水, 采用SBR工艺.取样时间为2015年9—12月, 污水处理厂进水水质平均值为:CODCr 246.9 mg·L-1, BOD5 88.7 mg·L-1, SS 131.7 mg·L-1, NH4+-N 15.7 mg·L-1, COD/N=15.7, BOD/N=5.7, TP 1.75 mg·L-1, TN 29.6 mg·L-1.剩余污泥污泥取样后在4 ℃条件下沉淀浓缩24 h后去除清液, 浓缩后的污泥性质如下:VSS为(20.0±0.6) g·L-1, TSS为(30.0±0.4) g·L-1, TCOD为(26760±480) mg·L-1, 总蛋白类为(17910±352) mg·L-1, 总糖类为(4210±138) mg·L-1, 脂类为(314±24) mg·L-1.
2.2 培养基组成及培养方法发酵培养基组分参照Mondala等(2012)的研究结果:葡萄糖60 g·L-1, NaH2PO4·2H2O 1.95 g·L-1, K2HPO41 g·L-1, 明胶0.15 g·L-1, 淀粉0.21 g·L-1, 酵母提取物0.07 g·L-1, 酪蛋白氨基酸0.01 g·L-1, 硫酸铵1.62 g·L-1, 痕量金属溶液5 mL·L-1.其中, 每升痕量金属溶液组成为:25% HCl 1.00 mL、ZnCl2 70.0 mg、MnCl2·4H2O 100.0 mg、H3BO3 60.0 mg、CoCl2·6H2O 200.0 mg、CuCl2·2H2O 20.0 mg、NiCl2·6H2O 20.0 mg、NaMoO4·2H2O 40.0 mg.在500 mL三角摇瓶中, 接入100 mL发酵培养基, 而后将浓缩得到的剩余污泥以初始MLVSS约为2.65 g·L-1接种至发酵培养基内, 在恒温摇床中培养7 d, 培养温度为25 ℃, 转速为200 r·min-1, 定期取样进行发酵pH、生物量、油脂含量等指标的监测.
在考察发酵过程pH的影响时, 在发酵过程中每24 h采用10.0 mol·L-1 NaOH溶液和2.0 mol·L-1 HCl溶液调节pH分别为2.0、4.0、6.0、8.0和10.0;在考察C/N的影响时, 在培养基中投加的硫酸铵浓度分别为5.66、1.13、0.57、0.38 g·L-1, 使初始C/N值分别为20、100、200和300, 同时控制发酵过程的pH为上述研究中得到的最佳条件; 在考察模拟含糖废水对发酵过程的影响时, 碳源分别设置为60 g·L-1的葡萄糖、蔗糖、木糖和乳糖, 氮源为硫酸铵, 添加2.5 mmol·L-1FeCl3(以Fe3+计量), 同时控制pH和C/N为上述研究中得到的最佳条件.
2.3 微生物油脂提取方法及计量采用文献中常用的酸热法(李植峰等, 2011)、Bligh & Dyer提取法(Bligh et al., 1959)、二甲亚砜-甲醇提取法提取剩余污泥中的油脂, 进行3种方法的比较.同时, 考察均质的预处理方式对油脂提取效果的影响.均质过程采用MonoLyserTMlysing系统(RotaPrep Inc., USA), 具体操作方法为:向2 mL均质小管中加入0.5 mm玻璃珠至约与下端线平, 称取约0.1 g冷干样品加入并记录质量, 加入1 mL甲醇简单摇匀后在4 ℃环境下过夜, 用均质器均质10 s后, 用4 mL氯仿将小管中的样品小心转移至相应容器中, 继续后续处理步骤; 之后采用盐酸和氯仿甲醇溶液进行提取; 最后小心取出下层有机相至预称重的顶空瓶中, 45 ℃负氮吹蒸发15~20 min, 冷却至室温后再次称重, 差值即为提取所得微生物油脂质量; 每个样品至少取3个冷干样品进行测试, 计算结果取平均值.
2.4 生物柴油制备及组成分析采用三氟化硼甲酯化法将微生物油脂酯化为生物柴油, 具体过程参见中华人民共和国国家标准《动植物油脂脂肪酸甲酯制备》(GB/T 17376-2008/ISO 5509:2000).
生物柴油组成(即脂肪酸甲酯组成)测定采用气相色谱法, 标准物质为购于上海安谱实验科技股份有限公司的37种脂肪酸甲酯混标.气相色谱仪型号为6890 N-GC, 具体参数设置:① 色谱柱:TR-FAME石英毛细管色谱柱(60 m×0.25 mm×0.25 μm), 检测器为氢火焰离子检测器(FID); ② 进样口:分流模式, 载气为氮气, 加热器设定值为250 ℃; ③ 进样器:进样量2.0 μL; ④ 柱箱:柱箱配置最高温度为250 ℃, 柱箱程序升温速率中, 初始温度为120 ℃, 以4 ℃·min-1升温至140 ℃, 以5 ℃·m-1升温至175 ℃, 以1 ℃·min-1升温至178 ℃, 以4 ℃·min-1升温至250 ℃, 之后运行温度为250 ℃; ⑤ 色谱柱:模式为恒定流量, 氢气流量为1.5 mL·min-1; ⑥ 检测器:FID检测器, 加热器温度设定值为260 ℃, 氢气流量设定值为40.0~50.0 mL·min-1, 空气流量设定值为450~500 mL·min-1, 尾吹气为氮气, 流量设定值为45~50 mL·min-1.
2.5 其他指标测试方法生物量测试采用离心冷冻干燥法(Mondala et al., 2013), 葡萄糖含量测试方法为DNS二硝基水杨酸法, NH4+-N含量的测定方法为凯氏定氮法, COD采用哈希COD快速消解套装测定.
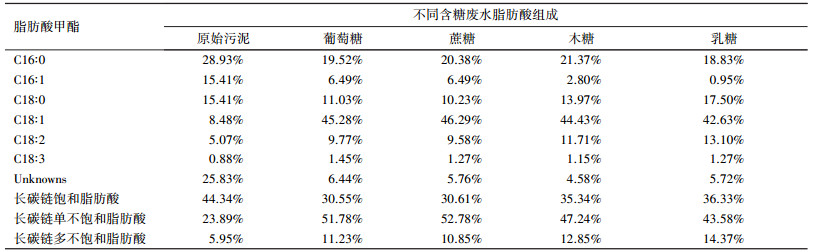
3 结果和讨论(Results and discussion) 3.1 不同提取方法对油脂提取和生物柴油产量的影响考察3种提取方法对原始污泥油脂的提取效果, 结果如图 1a所示.从油脂提取效果来看, 酸热法 > 二甲亚砜-甲醇法 > B&D法, 说明酸热法更适用于剩余污泥中油脂的提取.剩余污泥絮体中的油脂大部分存在于微生物细胞内, 实现这部分油脂的提取需要一定手段使其从胞内释放(Navia et al., 2012).本研究所采用的3种提取方法中, 酸热法先后用冷冻及浓盐酸中煮沸加热的方法使细胞膜松散或破裂, 二甲亚砜-甲醇法采用二甲亚砜化学分解使细胞壁破裂, B&D法则是在有机溶剂浸泡提取过程中使油脂释放, 从程度上来说酸热法破壁反应更为强烈, 这可能是其效果最好的主要原因.与此同时, 从均质对提取效果的影响上来看, 增加均质破碎环节有助于提高油脂提取率, 说明均质破碎能够有助于污泥含油脂组分的溶出和释放, 促进提取率的增加, 也进一步说明强化细胞破碎对剩余污泥油脂提取至关重要.
 |
| 图 1 不同提取方法对剩余污泥油脂提取物含量(a)及生物柴油产率(b)的影响 Fig. 1 The effect of three extration methods on lipid production(a) and biodiesel yield(b) from waste activated sludge |
将不同提取方法得到的微生物油脂进一步甲酯化制成生物柴油, 结果见图 1b.可以发现, 采用酸热法得到的脂肪酸甲酯(即生物柴油)产率最高达到2.1%(21.0 mg·g-1), 这一结果与王怡等(2014a)采用酸催化条件原位酯化污泥得到的生物柴油产率(1.93%)相似, 也说明直接从剩余污泥中提取生物柴油产量偏低.
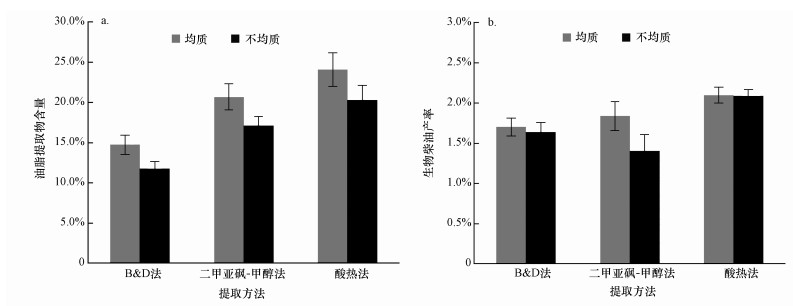
3.2 pH对剩余污泥生物柴油产量和产率的影响考察培养过程中pH对剩余污泥微生物产脂的影响, 结果如图 2所示.对于酯化后得到的生物柴油产量, pH=4条件下在培养第5 d达到最高, 为2.40 g·L-1; 在剩余污泥合成生物柴油方面, pH=4条件略高于pH=8条件, 此时生物柴油产率达到11.34%, 是原始污泥的5.4倍.Sun等(2015)通过稳定控制发酵条件为pH=7.5, 最大酯化脂肪酸甲酯(FAME)的产量可达12.7%左右, 与本研究结果相差不大.考虑在高浓度底物条件和微好氧条件下, 由于电子供体不足导致发酵过程存在厌氧过程, 有大量小分子酸和醇产生, 因此, 污泥发酵时形成酸化现象, 这在Mondala等(2012)研究中也有报道.基于此, 选择pH=4为最佳发酵条件.
 |
| 图 2 培养过程pH对生物柴油产量(a)和产率(b)的影响 Fig. 2 The effect of pH on biodiesel yield from waste activated sludge |
考察培养基初始C/N对剩余污泥微生物产脂的影响, 结果如图 3所示.C/N过高或过低都不利于油脂的合成, 在C/N=100时, 生物柴油产量显著高于其他条件, 生物柴油产量为是原始污泥的6.2倍, 得到的生物柴油产率达到13.06%.这主要是由于高C/N条件下, 限氮的环境有利于产脂微生物利用碳源直接合成微生物油脂(Mondala et al., 2012), 但C/N过高导致氮源含量过低会抑制微生物增殖和代谢, 使产油产脂效果变差.从生物柴油产率可知, 高C/N条件下剩余污泥合成的生物柴油产率高于低C/N, 进一步说明C/N对提高可酯化微生物油脂具有重要的调控作用, 因此, 选择C/N=100为最佳发酵条件.
 |
| 图 3 初始C/N对生物柴油产量(a)和产率(b)的影响 Fig. 3 The effect of initial C/N on biodiesel yield from waste activated sludge |
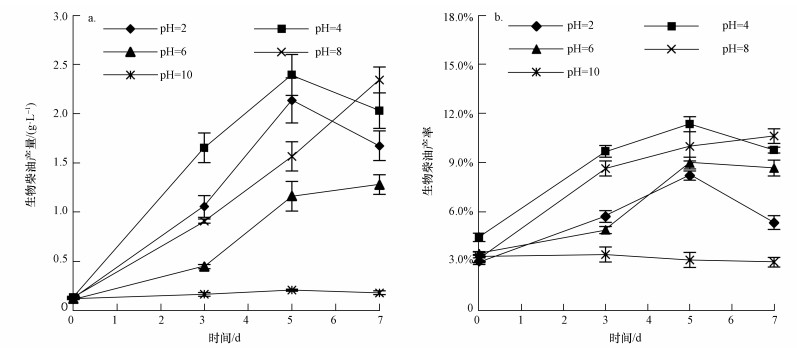
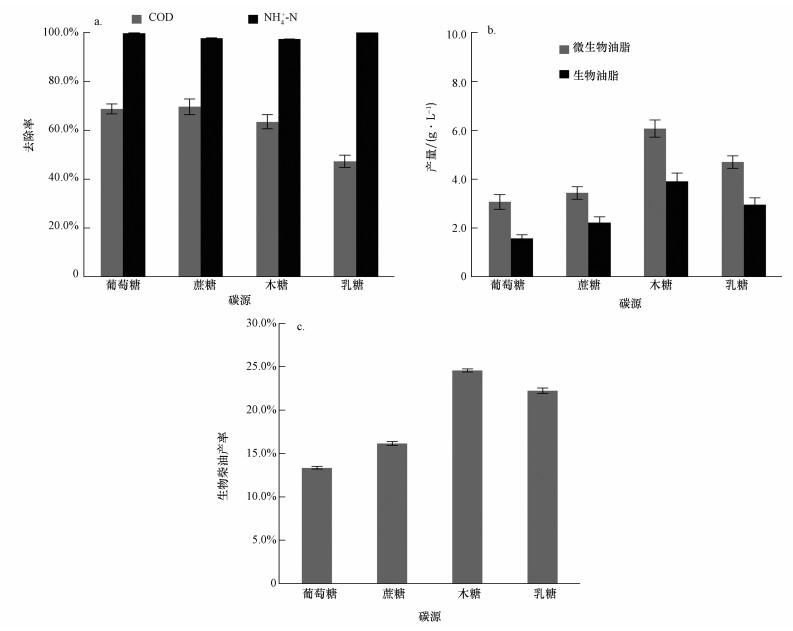
本研究在优化得到的pH、C/N条件下, 以不同糖类物质为碳源模拟含糖废水, 同时在培养基中添加2.5 mmol·L-1 FeCl3以促进可皂化油脂的积累(数据未给出).不同种类含糖废水对剩余污泥微生物发酵的影响如图 4所示.初始浓度相同的情况下, COD、NH4+-N随着发酵过程的进行都能有效的去除, 其中, 葡萄糖为碳源时的去除率最高.然而, 木糖为碳源时, 微生物油脂产量和生物柴油合成产量均最高, 其中, 生物柴油产量、产率分别达到3.90 g·L-1、24.55%, 是葡萄糖条件下的1.97和1.84倍.这可能是因为木糖经还原酶、脱氢酶等转化, 并进入戊糖磷酸化途径(Pentose Phosphate Pathway, PPP), 在这个过程可形成参与脂肪酸合成的还原力NADPH和一些能用于合成乙酰辅酶A的中间产物, 如甘油醛-3-磷酸盐(glyceraldehyde-3-phosphate, G-3-P).由于木糖的利用需要微生物合成额外的利用木糖的酶并经过复杂的生化过程, 因此, 在微生物生长过程中, 葡萄糖等六碳糖更易被代谢用于合成非油脂生物或进行呼吸作用以维持细胞的生命活动, 而木糖则更利于被合成胞内油脂(Mondala et al., 2013).本研究木糖为碳源时生物柴油产率为24.55%, 显著高于Mandala等(2013)在以60 g·L-1木糖为单一碳源中得到生物柴油的产率(9%), 说明本研究条件下采用的培养条件进一步促进了含木糖、乳糖这一类废水作发酵碳源富集微生物油脂.
 |
| 图 4 剩余污泥利用模拟含糖废水合成微生物油脂过程中碳氮源利用及生物柴油产率 Fig. 4 The utilization of carbon and nitrogen source and the biodiesel yield during the lipid production from waste activated sludge using model wastewater as media |
在城市污水处理厂进行实施时, 可现场制备富含木糖的纤维素水解液(Mondala et al., 2013), 如甘蔗渣水解液(Mondala et al., 2015), 进行剩余污泥微生物的培养, 培养得到的含油微生物进行油脂提取和生物柴油制备, 产生的有机溶剂循环再生利用, 提取后的污泥残体进入污泥消化池进行消化实现资源化和能源化(Mondala et al., 2015), 排出的发酵废水可引入到生活污水处理工艺实现进一步处理.
将不同种类含糖废水剩余污泥微生物发酵得到的微生物油脂进行甲酯化得到的生物柴油, 采用GC-MS对其脂肪酸组成进行分析, 一方面可以从脂肪酸组成的差异判断碳源的影响, 另一方面可以从脂肪酸的组成判断生物柴油的基本品质和性能.从表 1可知, 各样品脂肪酸种类基本相似, 主要集中在C16:0、C16:1、C18:0、C18:1和C18:2, 但原始污泥中C16:0含量最高, 而模拟含糖废水培养得到的污泥样品中C18:1含量最高.原始污泥中直接提取的生物柴油以长碳链饱和脂肪酸为主, 而模拟含糖废水培养后转变为以单不饱和脂肪酸为主.陈秀等(2010)的研究结果表明, 生物柴油的低温流动性随饱和脂肪酸甲酯相对含量升高而降低, 黏度和十六烷值随不饱和脂肪酸甲酯双键数的增加而降低.因此, C18:1是较为合适的生物柴油成分, 采用模拟含糖废水制备得到的生物柴油优于从原始污泥中直接提取.本研究进一步对生物柴油的运动黏度、十六烷值、碘值、冷滤点等指标进行计算, 发现模拟废水试验组制备的生物柴油的特征指标能满足国际标准要求.
| 表 1 剩余污泥提取制备的生物柴油脂肪酸组成比较 Table 1 Composition of fatty acid methyl esters (FAMEs) produced in different media using model wastewater |
1) 与其它方法相比, 酸热法结合均质预处理更适合于剩余污泥微生物油脂的提取, 该条件下得到的剩余污泥生物柴油产率达到2.1%.
2) 培养pH和C/N显著影响剩余污泥微生物发酵合成微生物油脂, 试验结果表明, pH=4、C/N=100条件下培养剩余污泥微生物可显著提高微生物油脂合成效果, 微生物油脂甲酯化得到的生物柴油产量和产率可大幅提高.
3) 不同种类含糖废水对剩余污泥微生物的油脂积累产生影响, 与使用其他糖类物质为碳源的培养基相比, 采用富含木糖的废水作为培养基, 可以进一步使剩余污泥发酵合成微生物油脂制备生物柴油的产量、产率分别提高到3.90 g·L-1和24.55%.
Bligh E G, Dyer W J. 1959. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 37(8): 911–917.
DOI:10.1139/o59-099
|
陈秀, 袁银男, 王利平, 等. 2010. 脂肪酸甲酯结构对生物柴油低温流动性的影响[J]. 江苏大学学报(自然科学版), 2010, 31(1): 31–34, 39.
|
Dufreche S, Hernandez R, French T, et al. 2007. Extraction of lipids from municipal wastewater plant microorganisms for production of biodiesel[J]. Journal of the American Oil Chemists Society, 84(2): 181–187.
DOI:10.1007/s11746-006-1022-4
|
Lourinho G, Brito P. 2015. Advanced biodiesel production technologies: novel developments[J]. Reviews in Environmental Science and Bio-Technology, 14(2): 287–316.
DOI:10.1007/s11157-014-9359-x
|
李植峰, 张玲, 沈晓京, 等. 2011. 四种真菌油脂提取方法的比较研究[J]. 微生物学通报, 2011, 28(6): 72–75.
|
Mondala A, Liang K, Toghiani H, et al. 2009. Biodiesel production by in situ transesterification of municipal primary and secondary sludges[J]. Bioresource Technology, 100(3): 1203–1210.
DOI:10.1016/j.biortech.2008.08.020
|
Mondala A, Hernandez R, French T, et al. 2012. Enhanced lipid and biodiesel production from glucose-fed activated sludge: Kinetics and microbial community analysis[J]. Aiche Journal, 58(4): 1279–1290.
DOI:10.1002/aic.12655
|
Mondala A, Hernandez R, Holmes W, et al. 2013. Enhanced microbial oil production by activated sludge microorganisms via co-fermentation of glucose and xylose[J]. Aiche Journal, 59(11): 4036–4044.
DOI:10.1002/aic.v59.11
|
Mondala A, Hernandez R, French T, et al. 2015. Enhanced microbial oil production by activated sludge microorganisms from sugarcane bagasse hydrolyzate[J]. Renewable Energy, 78: 114–118.
DOI:10.1016/j.renene.2014.12.073
|
Navia R, Mittelbach M. 2012. Could sewage sludge be considered a source of waste lipids for biodiesel production?[J]. Waste Management & Research, 30(9): 873–874.
|
Pinzi S, Leiva-Candia D, Lopez Garcia I, et al. 2014. Latest trends in feedstocks for biodiesel production[J]. Biofuels Bioproducts & Biorefining-Biofpr, 8(1): 126–143.
|
Revellame E, Hernandez R, French W, et al. 2011. Production of biodiesel from wet activated sludge[J]. Journal of Chemical Technology and Biotechnology, 86(1): 61–68.
DOI:10.1002/jctb.v86.1
|
Sawangkeaw R, Ngamprasertsith S. 2013. A review of lipid-based biomasses as feedstocks for biofuels production[J]. Renewable & Sustainable Energy Reviews, 25: 97–108.
|
Siddiquee M N, Rohani S. 2011. Lipid extraction and biodiesel production from municipal sewage sludges: A review[J]. Renewable & Sustainable Energy Reviews, 15(2): 1067–1072.
|
Sun Q, Li A, Li M, et al. 2015. Effect of pH on biodiesel production and the microbial structure of glucose-fed activated sludge[J]. International Biodeterioration & Biodegradation, 104: 224–230.
|
Upadhyaya K L, Mondala A, Hernandez R, et al. 2013. Biocrude production by activated sludge microbial cultures using pulp and paper wastewaters as fermentation substrate[J]. Environmental Technology, 34(13/14): 2171–2178.
|
王怡, 白小娟, 艾怡霏, 等. 2014a. 城市污水处理厂污泥制取生物柴油的试验研究[J]. 中国给水排水, 2014a, 30(1): 14–17.
|
王怡, 冯莎, 赵景婵, 等. 2014b. 高碳氮比下生物污泥增脂制取生物柴油的研究[J]. 中国给水排水, 2014b, 30(23): 24–28.
|
 2017, Vol. 37
2017, Vol. 37