2. 无锡市太湖湖泊治理有限责任公司, 无锡 214023
2. Wuxi-Taihu Lake Restoration Co., Ltd, Wuxi 214023
沉积物是一个复杂的多介质多界面系统, 有机质, 尤其可提取态有机质, 是这一环境中最为活跃的化学组成之一(Kang et al., 2002).有机质将沉积物中矿物质与生物成分联系在一起, 在水环境的物理、化学和生物反应以及蓝藻水华暴发过程中都扮演了非常重要的角色(金相灿, 1992; Park et al., 2002).同时, 还可以用于指示沉积物的氮磷污染状况, 因此成为生态和环境科学研究前沿与热点之一.
有机质的组成、结构及其特性对研究沉积物有机质在水环境中的地球化学循环至关重要.自然界中有机质的组成十分复杂, 对其组成和性质的研究主要借助物理、化学分组并结合生物标志物、同位素、光学参数等手段.其中, 通过使用不同的化学试剂, 根据有机质的溶解特性进行分组是最经典和最重要的分组方法一般可分为4大类:水溶性有机质(Water Soluble Organic Matter, WSOM)、富里酸(FA, 既溶于酸又溶于碱), 胡敏酸(HA, 只溶于碱不溶于酸)和胡敏素(HM, 酸碱都不溶)(Kipton et al., 1996; Koivula et al., 2001), 其中可提取态有机质(WSOM+HA+FA)中存在各种各样的官能团, 能够影响和控制水体中营养盐、重金属和持久性有机污染物的迁移转化, 进而影响其毒性和生物可得性(Nguyen et al., 2004; Hruska et al., 2009).近年来发展起来的三维荧光光谱法为传统鉴定方法提供了新的思路, 尤其是可提取态有机质中具有荧光效应的组分-荧光溶解有机质(FDOM), 能够作为标志物, 用以研究可提取态有机质的迁移转化过程.
蠡湖是太湖延伸到无锡市的城市内湖, 多年来的富营养化过程中藻类的死亡分解, 加之生态修复过程中水生植物腐烂淤积, 导致部分区域沉积物中有机质和氮、磷含量居高不下(王书航等, 2015; 王书航等, 2016).先前的研究主要通过化学分组或者可提取有机质的紫外-可见光谱、荧光光谱单独对有机质的组成及其空间分布进行研究(孙莉英等, 2007; 王志刚等, 2006).本次研究将沉积物有机质的连续提取法和三维荧光光谱相结合, 并借助平行因子分析、多元回归分析等统计方法, 研究沉积物有机质的组分组成及其空间分布特征、可提取有机质(WSOM、FA和HA)的荧光组分及其相对比例、可提取有机质组分(WSOM、FA和HA)与生物可利用性氮、磷的相关性, 以期揭示有机质在湖泊沉积物营养物质循环中的作用及其对湖泊富营养化的影响.
2 研究内容及方法(The research content and methods) 2.1 研究区域蠡湖位于太湖北部(120.22~120.29°E, 31.48~31.55°N), 东西长约6 km, 南北宽0.3~1.8 km, 湖面面积约8.6 km2, 其中水面面积约7.82 km2.经梁溪河闸、五里湖闸与梅梁湖相通, 通过曹王泾、长广溪等分别与京杭大运河、贡湖相连接, 湖周围还有数条小河及断头浜, 是一个既相对独立又与太湖相通的水体.
为方便讨论, 以蠡堤、宝界桥和蠡湖大桥为边界将蠡湖划分为4个区域(图 1), 分别为A区、B区、C区和D区.其中, A区和B区为西蠡湖, 已经开展了底泥疏浚和水生植被重建工程, 水质较好; C区和D区为东蠡湖, 实施了沿岸整治工程, 建有长广溪湿地和金城湾公园, 但底泥污染较为严重(张博等, 2013).
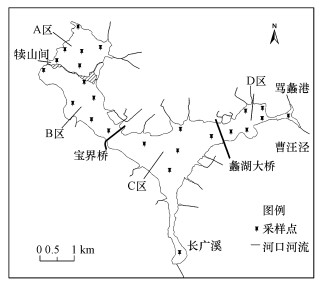 |
| 图 1 蠡湖沉积物采样点位分布示意图 Fig. 1 Sketch of sediment sampling sites in Lihu Lake |
在蠡湖及其出/入湖河口共布置20个采样点, 于2013年冬季(1月)采集沉积物样品, 每个采样点采集6个平行样并现场混匀, 4 ℃保存.采样点位置用GPS进行定位导航, 具体位置见图 1.
2.3 实验方法沉积物pH采用笔式pH计(三信CL200+)现场测定.弱吸附态磷提取用50 mL NH4Cl溶液(1 mol·L-1), 调节pH=7.0, 在25 ℃振荡2 h后, 7000 r·min-1离心分离20 min(以下同), 取上清液过0.45 μm玻璃纤维膜后用磷钼蓝分光光度法测定弱吸附态总磷(WA-TP)、弱吸附态无机磷(WA-IP), 差减法得到弱吸附态有机磷(WA-OP).
可交换态氮(E-TN)提取用25 mL KCl溶液(2 mol·L-1), 提取溶液和土的比例为1:20, 25 ℃振荡2 h后, 离心, 取上清液过0.45 μm玻璃纤维膜后采用纳氏试剂分光光度法测定可交换态氨氮(E-NH4+)、紫外吸收法测定可交换态硝氮(E-NO3-), 碱性过硫酸钾消解-紫外分光光度法测定总氮, 差减法得到可交换态有机氮(E-SON)(姜霞, 2012).
沉积物有机质分级提取过程参照并改进国内外其他有机质分级提取方法(Song et al., 2008), 具体步骤为:取1 g沉积物干样, 加入50 mL H2O置于25 ℃水浴振荡1 h后, 离心, 上清液A用中速定量滤纸过滤(以下同), 此上清液A为水提取有机质(WSOM), 对残渣A加入50 mL NaOH-Na4P2O7混合溶液, 并用0.1 mol·L-1 HCl调节pH=13, 振荡1 h后离心、过滤, 此上清液B为酸碱提取态有机质(HE), 对残渣B用饱和NaCl清洗后于55 ℃烘干, 为稳结合态有机质胡敏素(HM).取20 mL HE溶液, 用0.5 mol·L-1 H2SO4调节pH=1~1.5, 并在60 ℃保持1.5 h后, 静止8 h后, 离心、过滤, 上清液为松结合态有机质富里酸(FA), 沉淀为紧结合态有机质胡敏酸(HA), 见图 2.WSOM、FA、HA测定均采用岛津TOC分析仪(TOC-L, CPH)测定, HM、沉积物总有机质采用重铬酸钾氧化滴定法测定.
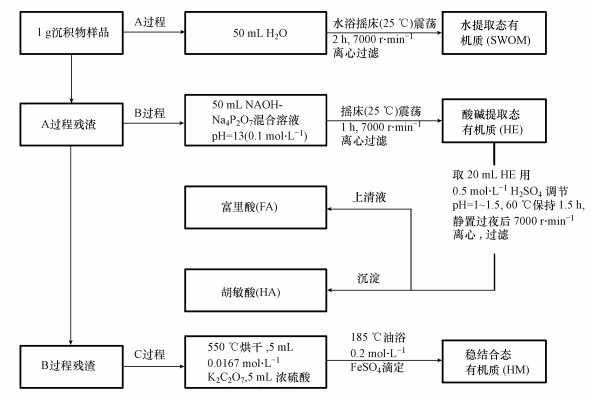 |
| 图 2 沉积物中有机质组分连续提取过程 Fig. 2 Sequential extraction process of organic components in the sediment |
采用(Hitachi F-7000) 进行可提取有机质荧光光谱测定, 扫描速度为2400 nm·min-1, 激发光源为150 W氛弧灯, PMT电压为400 V, 信噪比 > 110, 响应时间为自动, 扫描光谱波长范围为Ex:200~450 nm, Em:250~600 nm, 狭缝跨度均为10 nm; 以Milli-Q超纯水进行空白样测定, 所有样品三维荧光光谱扣除空白样品的光谱信号, 然后在Matlab12.0软件中进行平行因子模型分析, 并通过裂半分析对分离出的组分进行验证, 最后确定最优的可提取有机质组分数目(Stedmon et al., 2008).
2.5 荧光光谱的空白校正为保证荧光光谱特性可比性, 所得到的光谱均经过扣除超纯水空白后的矫正结果, 以减少仪器条件和拉曼散射对荧光光谱的影响.每隔5个样品测定超纯水在350 nm激发波长处拉曼峰(380~420 nm)的面积, 用于监测仪器的稳定性和不同仪器间的比较, 得到相对标准偏差为0.53%.通过扣除λEm < λEx +20 nm的区域消除一级瑞利散射对EEMs的影响, 通过扣λEm > 2λEx-20 nm的区域扣除二级瑞利散射对EEMs的影响, 扣除部分用零替换.光谱以激发波长为350 nm时水的拉曼峰积分面积校准.
为了校正由于内过滤效应或自吸收引起的荧光淬灭, 需要利用公式(1) 对扣除空白荧光之后的荧光光谱进行校正(闫丽红等, 2013).
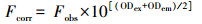
|
(1) |
式中, Fcorr和Fobs分别是校正后的和实测的荧光光谱(已经扣除空白荧光); ODex和ODem分别为激发和发射波长下的吸光度.
2.6 数据处理所有样品分析均做3次平行, 试验结果均以3次样品分析的平均值表示, 误差 < 5%.相关分析采用皮尔逊(Pearson)相关系数法, 不同采样区域磷形态差异显著性检验采用单因素方差分析(one-way ANOVA), 试验数据采用Excel 2010、Origin 9.0、ArcMap10.2、Suffer 11.0以及SPSS19.0软件进行统计检验、绘图和分析.
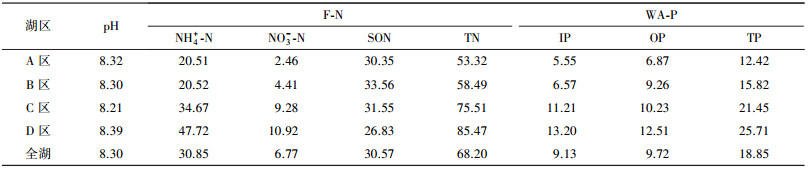
3 结果与分析(Results and analysis) 3.1 沉积物的理化指标分析蠡湖表层沉积物pH为7.40~8.34, 平均为7.89, 总体呈弱碱性.可交换态总氮(F-TN)含量介于39.14~107.73 mg·kg-1, 平均为68.20 mg·kg-1, 以氨氮和有机氮为主, 其中氨氮(NH4+-N)含量为10.68~60.86 mg·kg-1, 平均为30.86 mg·kg-1, 占TN的45.24%;有机氮(SON)含量为15.93~40.31 mg·kg-1, 平均为30.57 mg·kg-1, 占TN的44.83%;硝氮(NO3--N)含量不足F-TN的10%.弱吸附态总磷(WA-TP)含量为9.99~32.22 mg·kg-1, 平均为18.85 mg·kg-1, 其中无机磷(IP)和有机磷(OP)含量分别为3.79~16.44 mg·kg-1和6.00~16.76 mg·kg-1, 均值分别为9.13和9.72 mg·kg-1.沉积物理化指标具体见表 1.
| 表 1 蠡湖表层沉积物理化指标 Table 1 Physical and chemical indicators of the surface sediment in Lihu Lake |
通过表 1可以看出, F-TN和WA-TP空间上分布趋势基本相似, 整体呈现A区 < B区 < C区 < D区的分布特征.其中, NH4+-N、NO3--N与F-TN分布趋势相似, IP、OP与WA-TP分布趋势相似, 而SON与F-TN分布趋势有所差异, 表现为D区 < A区 < C区 < B区的分布趋势.
3.2 沉积物腐殖质组分的含量及空间分布特征沉积物中有机质主要包括水可提取态有机质(WSOM)、酸碱可提取态有机质(HE)和惰性腐殖质(HM)组成.蠡湖沉积物中总有机质含量为5.59~22.11 g·kg-1, 均值为12.28 g ·kg-1, 其中WSOM、HE和HM的含量分别为0.63、2.63和9.02 g ·kg-1, 相对比例为1:4.15:14.22.
水可提取态有机质(WSOM)是有机质中较为活跃的物质, 是微生物生长的速效基质, 其含量高低直接影响土壤、沉积物微生物的活性和微生物量(Sharma et al., 2017).蠡湖各湖区表层沉积物有机质中ω(WSOM)为0.41~1.03 g·kg-1, 占总有机质含量比例3.64%~10.02%.
HE包括富里酸(FA)和胡敏酸(HA)2个组分.FA又称黄腐酸, 具有既溶于酸溶液, 又溶于碱溶液的特点, 颜色较浅, 多呈黄色, 移动性较大.表层沉积物有机质中ω(FA)为0.93~2.48 g·kg-1, 平均值为1.45 g·kg-1, 占总有机质含量的8.61%~23.25%.HA, 具有溶于碱溶液而不溶于酸溶液的特点, 颜色较深, 为棕至暗褐色, 稳定性较强.蠡湖表层沉积物有机质中ω(HA)为0.62~1.97 g·kg-1, 平均值为1.18 g·kg-1(图 3c), 占总有机碳含量的5.12%~15.58%.
 |
| 图 3 蠡湖表层沉积物中有机质各组分含量空间分布特征(a、b、c、d分别表示WSOM、FA、HA和HM) Fig. 3 Spatial distribution characteristics of organic matter components in the surface sediment of Lihu Lake(a, b, c and d denote WSOM, FA, HA and HM, respectively) |
惰性腐殖质(HM)又称为胡敏素、腐殖素, 是与矿物质结合最紧密的腐殖物质, 具有酸、碱不溶性及大分子结构的特点, 难分解.蠡湖表层沉积物有机质中ω(HM)为3.40~17.46 g·kg-1, 平均值为9.52 g·kg-1, 占总有机碳含量的60.08%~81.29%.
从空间上看, 蠡湖表层沉积物有机质各组分呈现差异性特征, 总体上由西向东逐渐递增, 湖岸大于湖心的分布趋势.其中, FA、HA和HM湖区分布趋势为D区 > C区 > B区 > A区, 而WSOM各湖区分布趋势为D区 > C区 > A区 > B区.可以看出, WSOM、FA、HA和HM高值均主要分布在有机质含量较高的D区, 其平均值分别为0.82、1.79、1.60和12.64 g·kg-1.这可能与D区未经过疏浚与生态修复, 历史积累淤泥较深, 均为黑色并带有臭味, 且总有机质含量较高有关.低值则主要分布在A区和B区, 这可能是由于A区原是退渔还湖区, 通过干湖清淤的方式除去底泥, 平均清淤厚度1 m, 水生植物较少, 表层沉积物中有机质含量大大降低.值得注意的是, 活性较高的WSOM在B区平均含量(0.33 g·kg-1)低于A区(0.37 g·kg-1), B区主要为生态修复区, 经过水生植被重建, 尤其是沉水植物大量恢复, 说明水生植物的恢复有利于WSOM的转化.
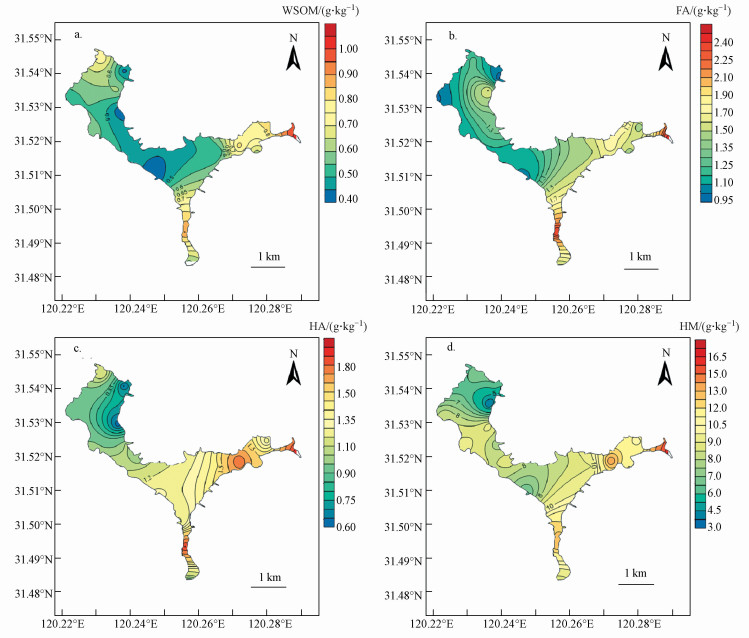
3.3 沉积物可提取腐殖质的三维荧光光谱分析可提取有机质包括WSOM, FA和HA, 对3种提取液进行三维荧光扫描, 可大致分为6个区域, 见图 4.其中, 区域A(λEx/λEm为230~250 nm / 380~440 nm)和区域B (λEx/λEm为280~320 nm / 380~440 nm)都属于类富里酸荧光峰, 区域A为短波紫外区(UVC)类富里酸荧光峰, 区域B为长波紫外区(UVA)类富里酸荧光峰, 类富里酸荧光峰可能与腐殖质结构中的羰基和羧基有关(Fellman et al., 2011).区域C(λEx/λEm为250~280 nm /450~475 nm)和区域D(λEx/λEm为350~380 nm /450~510 nm)分别为短波紫外区(UVC)和长波紫外区(UVC)类胡敏酸荧光峰, 可以指示腐殖化程度的大小.区域E(λEx/λEm为220~240 nm /320~350 nm)和区域F(λEx/λEm为270~290 nm / 320~320 nm)都属于类蛋白荧光峰, 类蛋白荧光峰与DOM中的芳环氨基酸结构有关(Zhang et al., 2013), 详见图 4.
 |
| 图 4 WSOM、FA和HA荧光分布特征(单位:拉曼, RU) Fig. 4 Distribution characteristics of fluorescence for WSOM, FA and HA |
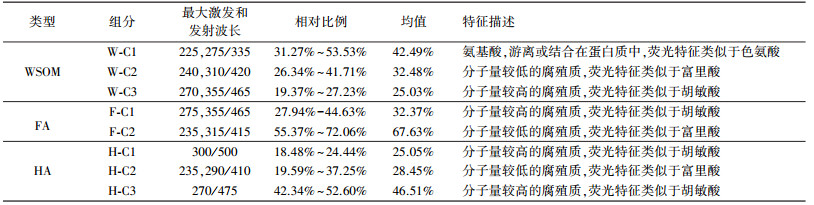
从图 4上可以看出, 不同提取态(WSOM、FA和HA)荧光图谱差异性较大, 尤其是FA和HA的发生峰的带宽较大, 可能是不同种有机质的复合体.为了进一步解析出可提取有机质的荧光组分, 采用平行因子分析法对WSOM、FA和HA三维荧光光谱矩阵数据进行解析, 结果见表 2.
| 表 2 蠡湖沉积物可提取有机质荧光组分及其相对比例 Table 2 The fluorescence components and relative proportion on extractable organic matter of sediment in Lihu Lake |
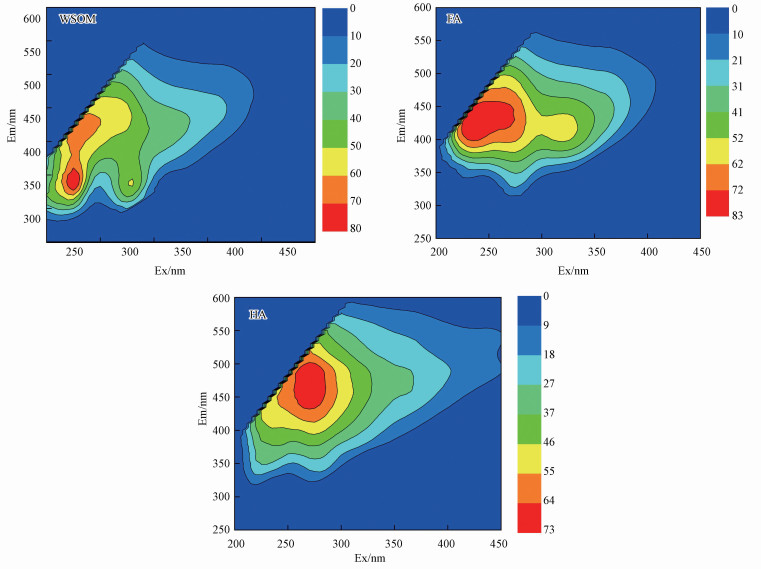
WSOM解析出3个具有单一发射波长的荧光峰, 分别为W-C1、W-C2和W-C3.其中, W-C1有两个激发波长峰值, 分别为225 nm和275 nm, 发射波长峰值为335 nm, 代表类色氨酸峰; W-C2的激发波长在240和310 nm, 发射波长峰值在410 nm, 荧光特征类似于微生物自生源产生的类富里酸, 与Osburn等(2011, 2012)在美国纽斯河和中北部草原湖泊的研究结果一致; W-C3分别在270和355 nm有两个激发波长, 发射波长为465 nm, 与Coble(1996, 1998)、McKnight(2001)、Zhang(2013)定义的类胡敏酸类似.WSOM 3个组分中, 以W-C1为主, 占整个荧光峰强度的相对比例的均值为42.49%, 其次是W-C2, 相对比例的均值为32.48%.
FA解析出2个具有单一发射波长的荧光峰, 分别为F-C1和F-C2.其中, F-C1在275 nm和355 nm处有2个激发波长峰值, 发射波长峰值为465 nm, 与WSOM中的W-C3组分类似, 可能来源于类胡敏酸峰; F-C2也有两个激发波长峰值, 分别为235 nm和315 nm, 发射波长峰值为415 nm, 与WSOM中的W-C3组分类似, 来源于自生源产生的类富里酸物质.FA的2个组分中, F-C2占绝对优势, 占整个荧光峰强度的比例的均值为67.63%.
HA解析出3个荧光峰, 分别为H-C1、H-C2和H-C3.其中, H-C1在激发波长300 nm和发射波长500 nm有一个较强的荧光峰, 在以前的文献中还未发现类似峰, 从其荧光的位置大致可以判断其芳香性、共轭性均较高, 属于分子量较大的类胡敏酸峰, 可能来源于高等植物残体的分解(Coble et al., 1998); H-C2与WSOM中的W-C2组分类似, 而H-C3荧光峰的激发波长和发射波长分别为270 nm和475 nm, 代表类胡敏酸峰.HA的3个组分中, 代表类胡敏素峰H-C1和H-C3的荧光强度占绝对优势, 两者之和占整个荧光峰强度的均值71.55%.
从空间上看, WSOM、FA和HA的总荧光峰强度的空间分布趋势分别与WSOM、FA和HA的含量空间分布趋势相同, 总体上由西向东逐渐递增, 湖岸大于湖心的分布趋势, 高值主要集中在东蠡湖的出口处, 见图 5.
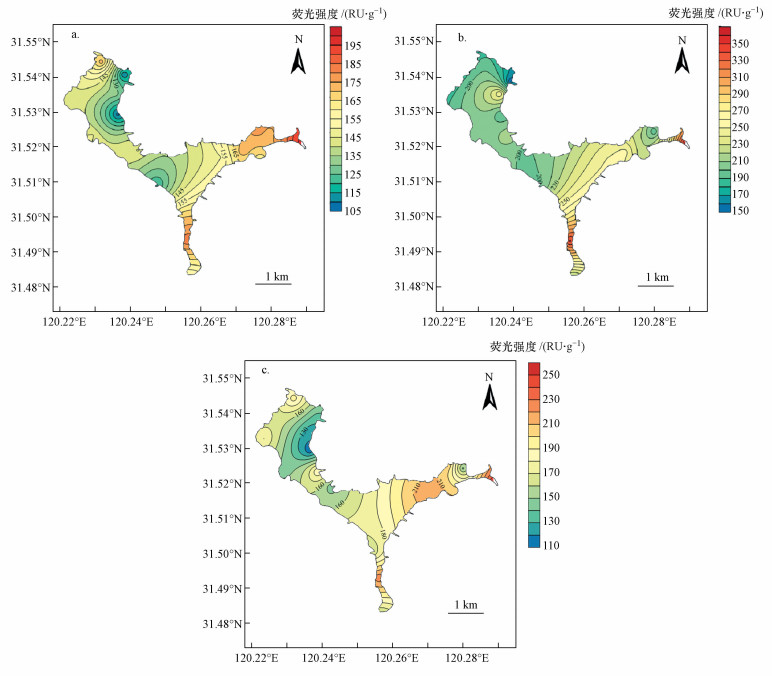 |
| 图 5 WSOM(a)、FA(b)和HA(c)荧光强度(RU·g-1)空间分布 Fig. 5 Spatial distribution characteristics of fluorescence intensity for WSOM(a), FA(b) and HA(c) |
有机质的组成及结构特征是土壤学、生态学及环境学领域共同关注的问题.沉积物碳库变化主要发生在可提取的活性碳库中.沉积物WSOM是水环境中微生物可直接利用的有机碳源, 在沉积物中移动较快, 易矿化分解, 并且可以在水-沉积物界面通过浓度差进行扩散.Grass等(1990)认为DOM组分中大约25%~50%为腐殖酸和富里酸组成, 其余的组分主要是小分子蛋白质、多糖和亲水性有机酸.本次研究中, WSOM占整个可提取态有机质的比例在14.53%~23.83%, 平均为19.48%, 三维荧光-平行因子分析结果表明, 蠡湖沉积物WSOM中类色氨酸峰比例较大, 占WSOM总荧光强度的42.49%, 而相关的研究也表明, 类色氨酸稳定性差、周转速率快、易矿化分解, 对植物和微生物来说是活性较高的那部分有机碳和有机氮(谢理等, 2013).
FA和HA的分离主要根据溶解性不同而通过调节pH来获得, HA仅溶于碱溶液, 当酸化到pH为1~2时从溶液中沉淀出来; FA在任何pH条件下均可溶解.在13C NMR中, FA和HA在脂肪碳、芳香碳以及羧基碳等区域都出现特征峰.HA含有大量的芳香族物质, 烷基链烃物质多且支链长, 分支少; 而与HA相比, FA以含有大量的羧基为主要结构特征, 分子量较低, 芳香族不饱和物质也较HA小.本次研究中, FA占总可提取态有机质的比例为38.00%~56.59%, 均值为44.55%, HA占总可提取态有机质的比例为25.30%~47.47%, 均值为35.93%.蠡湖沉积物FA的平均含量高于HA, 可能与沉积物的pH值为弱碱性有关.研究表明, 碱性环境有利于FA的形成, 而酸性条件有利于HA的形成, 研究结果与易文利等(2011)对长江中下游湖泊的研究结果相似.三维荧光-平行因子分析结果表明, FA的发射波长峰值主要集中在400~465 nm, 而HA的发射波长峰值相对较大, 主要集中在450~510 nm, 也就是发生了所谓的"红移"现象.较大的发射波长代表物质含有更多的共轭荧光分子, 其分子量也较大, 与FA的分子量较低, 芳香族不饱和物质也较HA小相一致, 同时也证实了采用三维荧光光谱对可提取态有机质进行表征的合理性.并且, 线性回归分析表明, WSOM、FA和HA的荧光强度与其相对应的含量呈显著正相关, 反映出沉积物中可提取态有机质的总荧光强度在一定程度上代表了沉积物中有机质含量的大小, 见图 6.
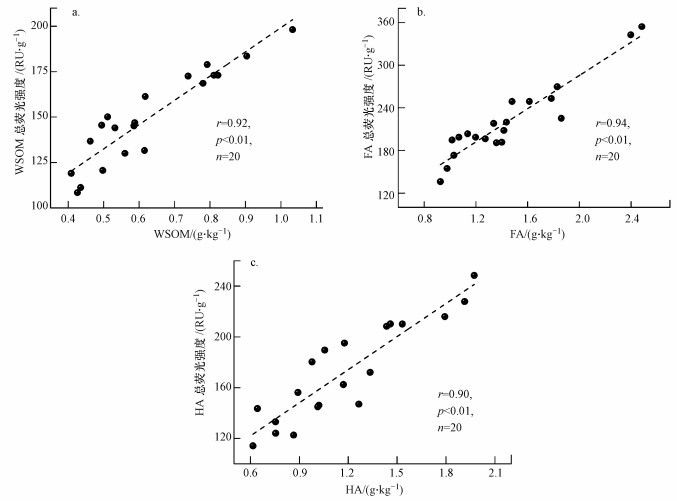 |
| 图 6 WSOM、FA和HA分别与其总荧光强度相关性分析 Fig. 6 Correlation analysis between WSOM, FA, HA and the corresponding total fluorescence intensity |
有机质分解转化过程包括矿化和腐殖化过程.矿化过程是指动、植物残体及腐殖质物质, 在微生物的作用下, 分解成简单无机化合物的过程.腐殖化过程指在微生物的作用下, 土壤或江河湖海等水体沉积物中有机质转变成腐殖质的过程.较高的腐殖化度, 表示气候相对湿润, 湖泊生产力高, 湖泊水生植物大量繁殖, 流域内生物量增大, 从而造成沉积物有机质含量增加, 腐殖质在温湿环境下积累加强; 而较低的腐殖化度, 指示空气相对干燥, 湖泊生产力下降, 流域生物量变小, 陆源有机质输入减少, 有机质含量降低, 不利于腐殖质积累.
PQ(HA/(WSOM+FA+HA))值可以作为表示有机质腐殖化程度的指标.PQ值越高, 说明腐殖化程度越高, 腐殖质积累, 有机碳和其它营养盐暂时退出循环, 反之则说明腐殖化程度低, 即腐殖质被微生物分解发生矿化作用, 有机碳及其它营养元素进入再循环.因此, 湖泊沉积物的腐殖化程度增加会降低对碳循环的贡献.本研究结果表明, 蠡湖PQ比值为31.19%~55.54%, 平均为35.93%, 显著小于太湖(50.56%)、月湖(46.71%), 显著大于乌梁素海(21.47%)和洞庭湖(29.76%)(付绪金, 2013).同时, 各湖区PQ比值趋势为D区>C区>B区>A区, 说明污染严重区域对有机碳和其他营养盐的再循环贡献较小.
三维荧光的腐殖化指数(HIX)用来表征可提取有机质腐殖化的程度或成熟度, 可以通过激发波长为255 nm时, 发射波长从435~480 nm的峰值面积比上300~345 nm的荧光峰值面积计算.当HIX≤4时, CDOM主要由生物活动产生, 腐殖化程度非常小; 4 < HIX≤6时, 有一定的腐殖化特征, 但程度较弱; 当6 < HIX≤10时, 腐殖化特征较为明显, 且形成的时间较长; 当HIX > 10时, 呈强烈的腐殖质特征(Huguet, 2009).本研究中, WSOM的HIX为1.67~3.73, 平均为2.67, 说明蠡湖的WSOM整体处于弱腐殖质特征.FA和HA的HIX均值分别为(10.64±2.69) 和(9.78±3.09), 说明FA和HA都呈现较强的腐殖化特征, 并且差异性不显著(p>0.05).将每个点位的WSOM、FA和HA的相对比例分别乘以各自的HIX数值, 归一化得到可提取有机质的HIX数值, 为6.93~15.52, 均值为8.79, 呈较强的腐殖质特征, 潜在矿化能力较弱, 这与上述沉积物PQ较大相呼应.
4.3 腐殖质组分与氮、磷之间的耦合关系有机质和氮、磷等营养组分循环密切相关, 它们直接影响着生态系统的物质与能量的转换, 并且一起参与生态系统中各种重要的物理、化学和生物过程, 伴随着它们组分含量和化学结构的改变, 它们之间的耦合关系主要是指这些过程中有机质与无机养分的降解(利用)、转化发生的复杂的相互作用等(Coble, 1990).氮、磷本身就是有机质的重要的化学组成, 有机质降解过程中大量耗氧, 同时释放出C、N、P、S等有机和无机营养盐, 进而影响各种养分的吸附/解析、相互转化及生物利用等过程.本次研究中, 利用沉积物可提取有机质组分与生物可利用较好的可交换态总氮(E-TN)和弱吸附态总磷(WA-TP)做回归分析, 见图 7.
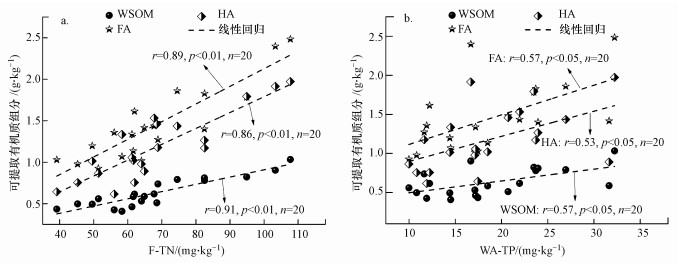 |
| 图 7 蠡湖可提取有机质组分与可交换态N、P相关性分析 Fig. 7 Correlation between exchangeable N, P and extractable organic matter components in Lihu Lake |
可提取有机质组分与可交换态氮和弱吸附态磷都显著正相关, 说明可提取有机质组分是可矿化态氮、磷可能的潜在源, 可通过微生物转化成为生物可直接利用的氮、磷营养物质, 这些营养物质释放到水体中供浮游生物利用, 构成水沉积物界面物质的循环.
可提取有机质组分与氮的相关性系数大于与磷的相关性系数, 说明相对于磷, 可提取有机质各组分与氮的关系更为密切.可能是因为沉积物中可交换态氮直接来源于有机质的矿化分解, 如大分子含氮有机物可直接降解为氨氮、氨基酸态氮、氨基糖态氮等无机和小分子有机氮; 可提取有机质组分与磷的相互作用除了小部分核酸、磷脂类、磷糖类等含磷化合物的分解外, 主要通过有机质对金属Al和Fe等很强的亲和力, 形成有机质-金属-磷络合物, 进而在生物地球化学循环中相互影响.
5 结论(Conclusions)1) 蠡湖沉积物中可提取有机质的组分(WSOM、FA和HA)的空间分布呈现由西向东逐渐递增, 湖岸大于湖心的分布趋势, 且各组分的含量分别与其荧光峰的总荧光强度呈正相关, 反映出沉积物中可提取态有机质荧光峰的总荧光强度在一定程度上代表了沉积物中有机质含量的大小.
2) 可提取有机质的不同组分的相对比例和荧光图谱差异性显著.WSOM占可提取态有机质的比例为19.48%, 荧光光谱中以类蛋白氨基酸峰为主; FA占可提取有机质比例为44.55%, 荧光光谱中以发射波长较短的类腐殖质峰为主; HA占可提取有机质比例为35.93%, 荧光光谱中以发射波长较大的类腐殖质峰为主.
3) 可提取有机质对营养盐N、P迁移转化过程有着重要作用.蠡湖沉积物可提取有机质组分(WSOM、FA和HA)与生物可利用性氮、磷均显著正相关, 且与氮的相关性系数大于磷, 说明可提取有机质各组分与氮的关系更为密切.
Coble P G, Del Castillo C E, et al. 1998. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep-Sea Research, PartⅡ, 245(10/11): 2195–2223.
|
Coble P G. 1996. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 51(4): 325–346.
DOI:10.1016/0304-4203(95)00062-3
|
Coble P G, Green S A, Blough N V, et al. 1990. Characterization of DOM in the Black Sea by fluorescence spectroscopy[J]. Nature, 348: 432–435.
DOI:10.1038/348432a0
|
Fellman J B, Petrone K C, Griersona P F. 2011. Source, biogeochemical cycling, and fluorescence characteristics of dissolved organic matter in an agro-urban estuary[J]. Limnology and Oceanography, 56: 243–256.
DOI:10.4319/lo.2011.56.1.0243
|
付绪金, 贾克力, 史小红, 等. 2013. 乌梁素海沉积物腐殖质的组成及分布特征[J]. 湖泊科学, 2013, 25(4): 489–496.
DOI:10.18307/2013.0405 |
Grasso D, Chin Y P, Weber W J. 1990. Structural and behavioral characteristics of a commercial humic and natural dissolved aquatic organic matter[J]. Chemosphere, 21(10/11): 1181–1197.
|
Hruska J, Kranm P, McDowell W H, et al. 2009. Increased dissolved organic carbon(DOC)in central european streams is driven by reductions in Ionic strength rather than climate change or decreasing acidity[J]. Environmental Science and Technology, 43(12): 4320–4326.
DOI:10.1021/es803645w
|
Huguet A, Vacher L, Relexans S, et al. 2009. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706–719.
DOI:10.1016/j.orggeochem.2009.03.002
|
姜霞, 王书航. 2012. 沉积物质量调查评估手册[M]. 北京: 科学版社.
|
金相灿, 徐南妮, 张雨田, 等. 1992. 沉积物污染化学[M]. 北京: 中国环境科学出版社: 1–26.
|
Kang K H, Shin H S, Park H. 2002. Characterization of humic substances present in landfill leachates with different landfill ages and its implications[J]. Water Research, 36(16): 4023–4032.
DOI:10.1016/S0043-1354(02)00114-8
|
Kipton H, Powell J, Fenton E. 1996. Size fractionation of humic substances: Effect protonation and metal binding properties[J]. Analytica Chimica Acta, 334(1/2): 27–38.
|
Koivula N, Hänninen K. 2001. Concentrations of monosaccharides in humic substances in the early stages of humification[J]. Chemosphere, 44(2): 271–279.
DOI:10.1016/S0045-6535(00)00167-3
|
McKnight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectro-fluorometric characterization of precursor organic materials and aromaticity[J]. Limnol Oceanogr, 46(1): 38–48.
DOI:10.4319/lo.2001.46.1.0038
|
Nguyen K L, Lewisk D M, Jolly M, et al. 2004. Determination of soluble aluminium concentration in alkaline humic water using atomic absorption spectrophotometry[J]. Water Research, 38(19): 4039–4044.
DOI:10.1016/j.watres.2004.07.013
|
Osburn C L, Handsel L T, Mikan M P, et al. 2012. Fluorescence tracking of dissolved and particulate organic matter quality in a river-dominated estuary[J]. Environmental Science and Technology, 46(16): 8628–8636.
DOI:10.1021/es3007723
|
Osburn C L, Wigdahl C R, Fritz S C, et al. 2011. Dissolved organic matter composition and photoreactivity in prairie lakes of the U.S. Great Plains[J]. Limnology and Oceanography, 56(6): 2371–2390.
DOI:10.4319/lo.2011.56.6.2371
|
Park J H, Kalbitz K, Matzner E. 2002. Resource control on the production of dissolved organic carbon and nitrogen in a deciduous forest floor[J]. Soil Biology and Biochemistry, 34(6): 813–822.
DOI:10.1016/S0038-0717(02)00011-1
|
Sharma P, Laor Y, Raviv M, et al. 2017. Compositional characteristics of organic matter and its water-extractable components across a profile of organically managed soil[J]. Geoderma, 286: 73–82.
DOI:10.1016/j.geoderma.2016.10.014
|
Song G, Novotny E H, Simpson A J, et al. 2008. Sequential exhaustive extraction of a Mollisol soil, and characterizations of humic components including humin, by solid and solution state NMR[J]. European Journal of Soil Science, 59(3): 505–516.
DOI:10.1111/j.1365-2389.2007.01006.x
|
Stedmon C A, Bro R. 2008. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial[J]. Limnology and Oceanography: Methods, 6(11): 572–579.
DOI:10.4319/lom.2008.6.572
|
孙莉英, 倪晋仁, 孙卫玲. 2007. 不同粒径黄褐沉积物中可提取腐殖质的含量分布及光谱特性[J]. 环境科学, 2007, 28(6): 1324–1332.
|
王书航, 王雯雯, 姜霞, 等. 2016. 基于三维荧光光谱-平行因子分析技术的蠡湖CODM分布特征[J]. 中国环境科学, 2016, 36(2): 517–524.
|
王书航, 张博, 姜霞, 等. 2015. 采用连续分级提取法研究沉积物中磷的化学形态[J]. 环境科学研究, 2015, 28(9): 1382–1388.
|
王志刚, 刘文清, 李宏斌, 等. 2006. 三维荧光光谱法分析巢湖CDOM的空间分布及其来源[J]. 环境科学学报, 2006, 26(2): 275–279.
|
谢理, 杨浩, 渠晓霞, 等. 2013. 滇池典型陆生和水生植物溶解性有机质组分的光谱分析[J]. 环境科学研究, 2013, 26(1): 7279.
|
闫丽红, 陈学君, 苏荣国, 等. 2013. 2010年秋季长江口外海域CDOM的三维荧光光谱-平行因子分析[J]. 环境科学, 2013, 34(1): 51–60.
|
易文利, 王圣瑞, 杨苏文, 等. 2011. 长江中下游浅水湖泊沉积物腐殖质组分赋存特征[J]. 湖泊科学, 2011, 23(1): 21–28.
DOI:10.18307/2011.0104 |
Zhang Y L, Liu X H, Wang M Z, et al. 2013. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes[J]. Organic Geochemistry, 55(1): 26–37.
|
Zhang Y L, Van Dijk M A, Liu M L, et al. 2013. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: field and experimental evidence[J]. Water Research, 43(18): 4685–4697.
|
张博, 李永峰, 姜霞, 等. 2013. 环境治理工程对蠡湖水体中磷空间分布的影响[J]. 中国环境科学, 2013, 33(7): 1271–1279.
|
 2017, Vol. 37
2017, Vol. 37