恩诺沙星(Enrofloxacin, ENR)又名乙基环丙沙星, 是属于氟喹诺酮类(Fluoroquinolone)的一种抗生素.ENR能够抑制细菌DNA旋转酶的活性, 影响DNA双螺旋结构的形成, 造成细菌染色体损伤(Zhao et al., 2008), 具有抗菌广谱性、作用强(尤其对霉形体及革兰氏阴性菌)、组织穿透力强(王忠斌, 2008)的特点, 因而被广泛应用于医疗卫生、水产养殖、畜牧养殖等产业, 是典型的环境抗生素类新型污染物.ENR会威胁人体健康, 因为其在动物体内代谢缓慢, 容易蓄积(郝福星等, 2015), 且即使加热也不能去除食品中残留的ENR(Zhao, et al., 2008).因此, 相关国际组织制定了食品中的ENR标准, 如欧盟规定ENR在猪、牛、鸡等食品中最高残留量(MRLs)为30 μg·kg-1, 世界卫生组织(WHO)推荐的MRLs为40 μg·kg-1, 日本制定了更为严格的标准, 规定所有鸡组织中的MRLs均为10 μg·kg-1, 而我国规定ENR在蛋、奶中的MRLs为100 μg·kg-1(龙淼, 2006; 蒋文晓, 2014; San Martin et al., 2010).ENR等抗生素不仅影响人体健康, 还会影响生态环境.Boxall等(2003)列出了56种容易进入环境中的抗生素, 其中就包括ENR.世界各地的水环境中都检测出过包括ENR在内的多种抗生素, 如地表水、地下水甚至饮用水中(Tang et al., 2015; Lopez-Serna et al., 2013; Hu et al., 2010; Yiruhan et al., 2010), 水环境抗生素污染是国际上广泛存在的环境风险.虽然环境中恩诺沙星含量较低, 但研究发现, 低浓度的抗生素更能引发细菌产生抗性, 100 ng·L-1的抗生素浓度依然可选择抗性菌(Gullberg et al., 2011; Li et al., 2016); 而且以活性污泥为主体的污水生物处理技术很难降解抗生素, 在处理过程中还会产生大量未知中间产物和抗性基因(张昱等, 2015).因此, 为了控制及有效管理恩诺沙星等抗生素污染, 保障人体健康和生态安全, 亟须开发快速有效、易于操作的检测方法.
目前, 恩诺沙星常见的检测方法有高效液相色谱法(HPLC)、高效液相色谱-质谱联用法(HPLC-MS/MS)、发光分析法、表面等离子共振传感器(SPR)等方法.这些方法操作复杂、仪器昂贵、需要进行繁琐的样品前处理, 难以进行大量样品的快速检测分析(张婧等, 2009).而酶联免疫吸附试验(ELISA)方法不需要复杂的前处理、操作简单、成本低、周期短, 在大量样品快速检测中展现了独特的优势(黎媛萍等, 2007).
目前对恩诺沙星的检测主要集中在食品领域(如牛奶、鸡肉等), 但水体抗生素污染问题逐渐引起人们的关注, 有必要研究水体独特的基质效应(如硬度较高)对检测方法的影响.基于免疫分析中完全抗原的性质会直接影响ELISA的检测效果, 本研究将根据半抗原(目标检测物质, 本研究为恩诺沙星)的理化特性确定适宜的偶联方法、偶联比例及温度时间等偶联条件, 将无免疫原性的恩诺沙星化学基团与蛋白质载体偶联, 以合成理想的完全抗原.此外, 鉴于抗原和抗体的结合受众多外界因素影响, 确定合适的ELISA检测条件也是建立快速免疫分析方法的关键所在.因此, 本研究通过自主合成恩诺沙星优良的完全抗原, 开展间接竞争ELISA优化实验研究, 建立一套完整简便的恩诺沙星免疫检测方法, 并应用于水样检测.
2 材料与方法(Materials and methods) 2.1 仪器与试剂仪器:紫外分光光度计(3900UV Spectrophotometer, Hitachi)、酶标仪(Microplate Reader, Bio-Tek)、MALDI-TOF/TOF质谱仪(AXIMA-PerformanceMA, Shimadzu)、恒温振荡培养箱(BE-9010, Thermo-Shaker)、高速冷冻离心机(CF16RXⅡ, Hitachi).
试剂:恩诺沙星(ENR, Macklin)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC, Sigma-Aldrich)、N-羟基丁二酰亚胺(NHS, Sigma-Aldrich)、牛血清蛋白(BSA, Sigma)、N, N-二甲基甲酰胺(DMF, Sigma-Aldrich)、恩诺沙星单克隆抗体(思瑞普生物科技有限公司)、羊抗小鼠ⅠgG-HRP (Sigma)、BCA试剂(Solarbio)、包被液(0.05 mol·L-1, pH=9.6碳酸盐缓冲溶液)、稀释液(PBS, 0.01 mol·L-1, pH=7.4)、洗涤液(PBST, 1000 mL稀释液加0.5 mL Tween-20)、TMB双组份显色液(Solarbio).
2.2 实验方法 2.2.1 ENR完全抗原合成由于恩诺沙星含有羧基结构, 本研究通过方案比选, 确定采用碳二亚胺法合成完全抗原, 合成原理见图 1.
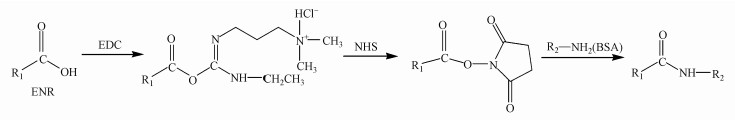 |
| 图 1 ENR完全抗原合成原理示意图 Fig. 1 Principle of the complete antigen synthesis |
选择ENR/EDC/NHS/BSA=750:600:600:1的物质的量比进行合成, 因为恩诺沙星水溶液遇光易分解, 合成过程中要注意避光操作.即20.3 mg ENR、5.19 mg NHS、9.31 mg EDC溶于1 mL DMF中, 室温下避光磁力搅拌2 h, 2000 r·min-1的转速离心10 min, 弃沉淀, 收集上清液.将该上清液逐滴加入BSA溶液(5 mg BSA溶于1 mL 0.01 mol·L-1 pH=7.4的PBS溶液)中, 低温下继续避光搅拌4 h.装入已处理好的透析袋中, 4 ℃避光过夜.用PBS透析3 d(加入30%的DMF, 逐渐减少至0), 每天换液3次, 以除去游离的小分子物质.收集透析后的溶液, 在2000 r·min-1下离心10 min, 弃沉淀, 收集上清溶液.合成过程中严格控制反应比及反应条件, 以得到适宜浓度及适宜偶联比的完全抗原.
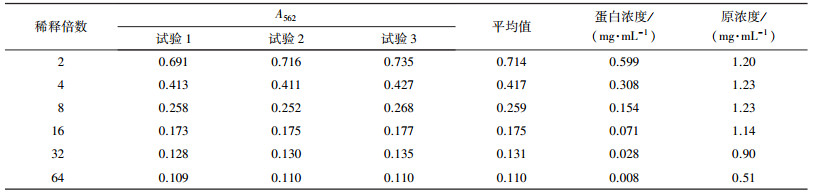
2.2.2 完全抗原蛋白浓度的测定采用BCA法测定BSA-ENR完全抗原的蛋白质浓度(李海玲等, 2008).测定浓度时, 将完全抗原稀释2、4、8、16、32、64倍, 使测量点尽可能落在标准曲线中间.
2.2.3 完全抗原偶联比的测定完全抗原偶联比为连接到蛋白质分子上的半抗原数目, 直接影响合成抗原的质量.采用以下2种方法测定:① 紫外标准曲线法:配制浓度分别为0.03、0.025、0.02、0.015、0.01、0.005 mmol·L-1的BSA标准溶液, 浓度分别为0.075、0.05、0.035、0.025、0.015、0.01 mmol·L-1的ENR标准溶液, 在260~360 nm波长范围内做紫外扫描; ② 基质辅助激光解吸电离飞行时间质谱(MADLI-TOF MS)法:选择合适的基质, 去除样品中的盐离子, 通过离子门控技术提供先行离子分离解析度, 从复杂基质中分辨出目标分子, 得到分子量.
2.2.4 间接竞争ELISA检测采用间接竞争ELISA方法评价自主合成完全抗原的性质, 具体步骤为:① 抗原包被:在96孔板中每孔加入完全抗原200 μL, 4 ℃过夜; ② 洗涤:倒掉包被抗原, 每孔加入200 μL的洗涤液, 洗3次; ③ 封闭:每孔加入250 μL的封闭液(0.5%的BSA), 37 ℃封闭2 h; ④ 洗涤:同第2步; ⑤ 反应:每孔加入100 μL的单克隆抗体, 再加入一定浓度的恩诺沙星竞争溶液100 μL, 37 ℃下竞争反应1 h; ⑥ 洗涤:同第2步; ⑦ 加二抗:倒掉反应液, 加入羊抗小鼠ⅠgG-HRP 200 μL, 37 ℃反应30 min; ⑧ 洗涤:同第2步; ⑨ 显色:加入TMB双组分显色液A液、B液各100 μL, 5 min后加入50 μL的终止液(2 mol·L-1 H2SO4); ⑩ 用酶标仪测定490 nm的吸收值.
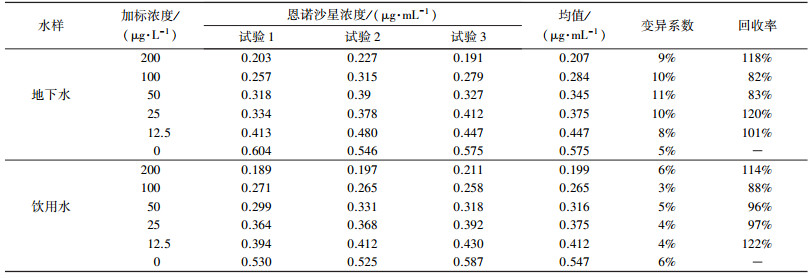
2.2.5 实际水样加标检测分别用清华大学地下水、饮用水配制200、100、50、25、12.5 μg·L-1的恩诺沙星加标样品, 按照2.2.4节的方法测定吸光度, 研究检测方法对实际水样的适用性, 每个浓度做3个平行试验, 计算变异系数和回收率.
3 结果与讨论(Results and discussion) 3.1 完全抗原合成及评价 3.1.1 紫外扫描鉴定完全抗原合成结果ENR在271 nm和334 nm处有吸收峰, 而载体蛋白BSA的特征吸收峰为278 nm.因此, 选择ENR在334 nm处的特征吸收作为判断依据.ENR和BSA偶联的完全抗原在278 nm和334 nm处应该同时具有特征吸收峰, 但由于二者吸收峰的迭加效应, 可能使完全抗原出现的2个特征吸收峰与ENR和BSA纯品的吸收峰相比, 有一定的位移.由图 2可以看出, 合成的完全抗原在278 nm和334 nm附近均有峰, 可初步判定完全抗原偶联成功.峰型与纯物质相比都有一定变化, 那是因为偶联反应并不是2个物质的简单叠加, 而是通过化学键的断裂和生成, 形成了新的化学物质.
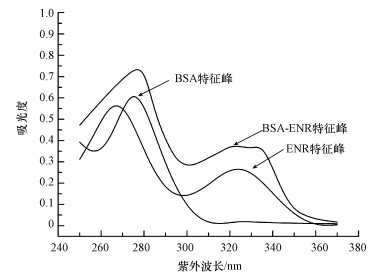 |
| 图 2 BSA、ENR、BSA-ENR紫外吸光度图 Fig. 2 Ultraviolet absorbance spectra of BSA, ENR and BSA-ENR |
采用BCA法测定偶联物的浓度, BSA线性浓度为0~0.5 mg·mL-1, A562为0~0.6, 标准曲线为: y=1.022x+0.102, R2=0.999.因为偶联物的浓度未知, 因此, 将偶联物分别稀释2、4、8、16、32、64倍, 使测量点尽量落到标准曲线的中间, 而减少误差.每个浓度做3个平行试验, 结果见表 1.
| 表 1 BSA-ENR完全抗原浓度测定 Table 1 The concentration of complete antigen |
由于稀释4倍和稀释8倍的数据点落在标准曲线的中间, 因此, 选择这2个测量值计算偶联物浓度.从表 1中也能看出, 这两点的计算结果相同.稀释倍数越大, 误差越大, 一方面是因为稀释倍数过大存在操作误差, 另一方面是因为吸光度值太低没有落在标准曲线的中间, 边界点对标准曲线的符合度不如中间点.
因此, 自主合成的恩诺沙星完全抗原浓度为1.23 mg·mL-1.完全抗原浓度低于原始ENR和BSA浓度, 因为在EDC存在时, BSA会自身偶联形成分子量较大的聚体析出沉淀, 而且在偶联过程中, 部分杂蛋白、不稳定蛋白很容易在条件改变(pH、温度)时析出, 这部分沉淀可通过离心除去, 并不影响完全抗原的效果.完全抗原免疫实验动物的浓度一般在2 mg·mL-1左右(余若祯, 2005), 本研究合成的完全抗原浓度为1.23 mg·mL-1, 满足后续ELISA检测的抗原浓度要求, 同时为特异性单克隆抗体的生产提供了条件.
3.1.3 完全抗原偶联比偶联比为连接到蛋白质分子上的半抗原数目, 是影响完全抗原免疫原性的重要因素, 能够直接体现完全抗原的合成效果.采用以下2种方法确定本研究合成的完全抗原的偶联比.
1) 紫外法分析合成完全抗原的偶联比
恩诺沙星在271 nm和334 nm处有吸收峰, BSA的吸收峰在278 nm处, 因此, 选择334 nm为ENR的特征吸收峰.吸光度具有加和性, 即混合物的总吸光度等于混合物中各组分的吸光度之和.本文分别测定了BSA和ENR在278 nm和334 nm处的吸光度值-浓度的标准曲线, 计算摩尔吸光系数.根据公式(1) 和(2) 求得混合物中各组分的含量, 计算偶联比.
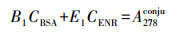
|
(1) |
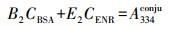
|
(2) |
式中, CBSA、CENR分别为BSA、ENR的浓度(mmol·L-1), A278conju、A334conju分别为偶合物在278、334 nm的紫外吸光度, B1、B2、E1、E2分别为方程系数.
从图 3可以看出, BSA和ENR的紫外扫描结果线性良好, 其中, BSA在较小的浓度范围内(0.005~0.03 mmol·L-1)就有很好的线性梯度变化.但BSA吸光度在278 nm处的斜率达到了42.806, 而在334 nm处只有0.949, 在334 nm处较低的特征吸收峰值会导致摩尔吸光系数一定测量误差的产生.ENR的线性范围较BSA大(0.001~0.75 mmol·L-1), 且在278 nm和334 nm处都有较高的峰值, 浓度越高, 峰型越尖锐, 摩尔吸收系数计算相对准确.根据公式计算出CENR=0.115 mmol·L-1, CBSA=0.007 mmol·L-1, 因此, 偶联比为CENR/ CBSA.ENR分子量为359.4, 属于小分子污染物, 对于小分子物质完全抗原的偶联比应控制在10或15以上(Malaitsev and Azhipa, 1993; Singh et al., 2004), 本研究采用紫外法测得的偶联比为16, 满足该要求.
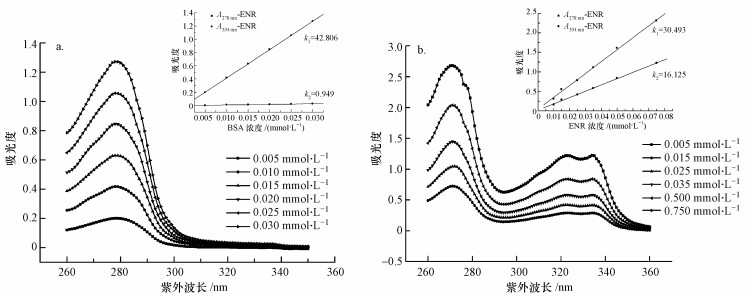 |
| 图 3 不同浓度BSA(a)及ENR(b)的紫外扫描图 Fig. 3 UV spectrums of BSA (a) and ENR (b) at different concentrations |
2) MADLI-TOF MS法分析完全抗原的偶联比
利用MALDI-TOF/TOF质谱仪测定BSA及BSA-ENR偶联物的质谱图见图 4.MADLI-TOF质谱测出BSA的分子量及完全抗原的分子量, 两者之差为偶联上去的ENR小分子总分子量.再根据ENR单个分子的分子量, 即可计算出一个BSA分子上偶联了多少ENR分子.由图 4可知, BSA分子量约为66440.36 Da, 完全抗原分子量约为71096.72 Da.而每脱水缩合一个ENR分子到BSA上, 分子量的增加为Mr, ENR-Mr, H2O=359.4-18=341.4, 因此, 偶联比为(Mr, BSA-ENR-Mr, BSA)/(Mr, ENR-Mr, H2O)=14.
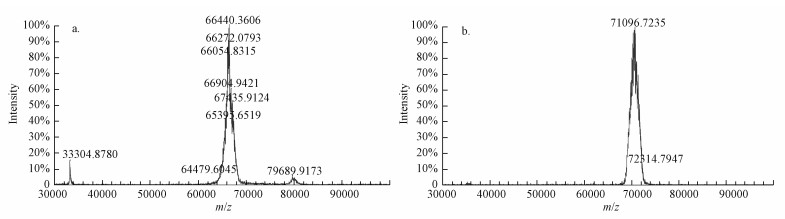 |
| 图 4 BSA(a)及BSA-ENR(b)质谱图 Fig. 4 Mass spectrogram of BSA(a) and BSA-ENR(b) |
从上述研究结果看出, 采用紫外和MADLI TOF-MS 2种方法测得的偶联比基本一致, 理论上说, ENR-BSA完全抗原不是二者的简单混合物, 而是发生了形成酰胺键的交联反应, 因此, 利用混合物的紫外吸收加和特性计算偶联物的偶联比可能存在一定的偏差.另外, 偶联反应中会发生BSA的自身偶联, 反应形成的聚合物掩盖了一些BSA表面能够产生紫外吸收的氨基酸, 紫外吸收数值降低, 导致BSA计算浓度偏小, 偶联比偏大; 而利用MADLI-TOF MS法检测时, 一部分BSA表面结合的ENR较多, 疏水性强, 在纯水中溶解度下降生成沉淀, 无法检测出来, 导致测得偶联物的分子量偏低, 偶联比偏小.综合2种方法, 确定偶联比为14~16.
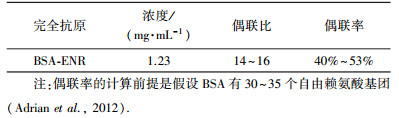
表 2总结了本研究合成的完全抗原性质:浓度为1.23 mg·mL-1, 满足完全抗原免疫实验动物的浓度一般在2 mg·mL-1左右的标准, 为后续ELISA检测提供较高的初始抗原浓度, 利于找到最佳抗原包被浓度; 偶联比为14~16, 满足小分子物质完全抗原的偶联比应控制在10或15以上的标准, 保证了较好的免疫原性和抗原性; 偶联效率为40%~53%, 严格控制反应温度、时间、pH等, 能够在一定程度上提升偶联效率.
| 表 2 BSA-ENR完全抗原性质 Table 2 Quality of the complete antigen |
抗体浓度的升高会提高测量信号值, 同时会降低方法的检测限(Zhang et al., 2011), 而包被抗原浓度的降低会提高相应浓度竞争物的抑制率(Wang et al., 2010).本研究首先需要确定合适的抗原抗体浓度, 通过设计阵列实验, 根据图 5的阵列实验结果, 选取合适的包被抗原浓度1 μg·mL-1, 一抗浓度1:6400 mg·mL-1, 得到图 6所示的间接竞争标准曲线.
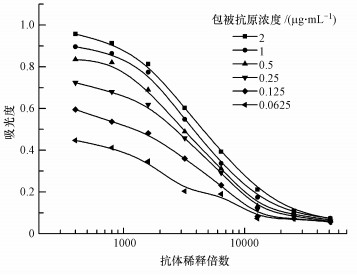 |
| 图 5 恩诺沙星抗原抗体浓度阵列实验 Fig. 5 Array experiments of enrofloxacin at different concentration of antigen and antibody |
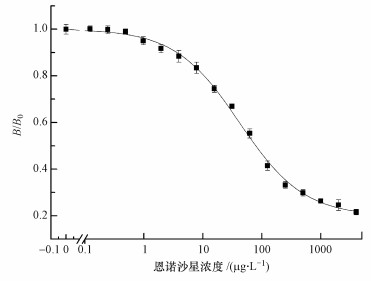 |
| 图 6 恩诺沙星间接竞争ELISA方法标准曲线(B0为不加竞争物时的空白吸光度, B为加入某一浓度竞争物时的吸光度; 每个浓度做3个平行试验) Fig. 6 Optimized standard ELISA inhibition curve of enrofloxacin |
标准曲线为四参数的Logistic方程, 公式为y=A2+(A1-A2)/(1+(x/x0)p), 采用3s法确定检测限和定量检测区间(Midgley et al., 1969), 得到ENR的检测限为1.92 μg·L-1, IC50为41.80 μg·L-1, 定量检测区间(抑制率20%~80%)为7.33~238.24 μg·L-1.选择3种ENR结构相似物氧氟沙星、诺氟沙星、四环素测定对ENR的交叉反应率, 交叉反应率CR均小于1%(IC50 > 4200 μg·L-1).
对比其他方法, 如沈翠香(2010)采用微生物法, 通过对大肠杆菌的抑制作用检测恩诺沙星, 检测限为15 μg·L-1.Lv等(2013)采用HPLC法检测牛奶中的恩诺沙星, 检测限为1.37 μg·kg-1.Yu等(2012)采用LC-MS/MS检测鸡肉中的恩诺沙星, 检测限为0.3 μg·kg-1.Schneider等(2013)通过Tb3+增强DNA的冷光信号测定牛血清中恩诺沙星, 检测限为2.5 μg·L-1.Cao等(2007)利用SPR传感器检测牛奶中的恩诺沙星, 检测限为3 μg·mL-1.本研究的检测限为1.92 μg·L-1, 与其他方法相差不大, 在检测限良好的同时, 检测方法的快速性、准确性、灵敏性成为该方法的优点.
3.3 实际水样检测采用本研究合成的完全抗原及建立的间接竞争ELISA检测方法, 检测清华大学地下水和饮用水配制的加标样品, 结果见表 3.清华大学地下水和饮用水的特点是硬度较高, 2个水样的Ca2+浓度分别为70.6和69.1 mg·L-1, Mg2+浓度分别为29.7和28.7 mg·L-1(电感耦合等离子体发射光谱法测定), Cu2+浓度分别为129.0和60.6 μg·L-1(电感耦合等离子体质谱法测定).从表 3可以看出, Ca2+、Mg2+和Cu2+的存在对检测结果影响不大, 地下水配制的加标溶液检测结果变异系数为8%~11%, 回收率为82%~120%;饮用水配制的加标溶液检测结果变异系数为3%~6%, 回收率为88%~122%, 结果较为理想.表明本研究建立的基于自主合成恩诺沙星完全抗原的间接竞争ELISA检测方法能够应用于实际水样的检测.
| 表 3 加标水样检测结果 Table 3 ELISA results in adding water sample |
1) 本研究自主合成的恩诺沙星完全抗原浓度为1.23 mg·mL-1, 符合完全抗原合成的一般浓度标准; 偶联比为14~16, 符合小分子物质完全抗原合成的偶联比标准, 表明本研究合成了理想的恩诺沙星完全抗原.
2) 本研究使用自主合成的完全抗原, 通过优化包被抗原浓度、一抗浓度, 建立了恩诺沙星间接竞争ELISA标准曲线, 结果表明, 该方法的检测限为1.92 μg·L-1, 定量检测区间为7.33~238.24 μg·L-1, 与HPLC等方法的检测限接近.
3) 本研究进行了清华大学地下水和饮用水配制的恩诺沙星加标样品实际检测, 所有样品变异系数在3%~11%之间, 精密度良好, 回收率为82%~122%, 准确度良好, 表明实际水样中存在一定浓度的Ca2+、Mg2+、Cu2+等离子不会影响间接竞争ELISA检测方法的准确性和稳定性.
Adrian J, Fernández F, Sánchez Baeza F, et al. 2012. Preparation of antibodies and development of an enzyme-linked immunosorbent assay (ELISA) for the determination of doxycycline antibiotic in milk samples[J]. Journal of Agricultural and Food Chemistry, 60(15): 3837–3846.
DOI:10.1021/jf2053355
|
Boxall A, Kolpin D W, Halling-Sorensen B, et al. 2003. Are veterinary medicines causing environmental risks?[J]. Environmental Science & Technology, 37(15): 286A–294A.
|
Cao L, Lin H, Mirsky V M. 2007. Surface plasmon resonance biosensor for enrofloxacin based on deoxyribonucleic acid[J]. Analytica Chimica Acta, 589(1): 1–5.
DOI:10.1016/j.aca.2007.02.034
|
Gullberg E, Cao S, Berg O G, et al. 2011. Selection of resistant bacteria at very low antibiotic concentrations[J]. Plos Pathogens, 119(2): 103–107.
|
李海玲, 彭书明, 李凛, 等. 2008. 4种常用蛋白浓度测定方法的比较[J]. 中国生化药物杂志, 2008, 29(4): 277–278, 282.
|
Hu X, Zhou Q, Luo Y. 2010. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China[J]. Environmental Pollution, 158(9): 2992–2998.
DOI:10.1016/j.envpol.2010.05.023
|
郝福星, 张家禾, 左伟勇, 等. 2015. 恩诺沙星完全抗原合成与鉴定的研究[J]. 黑龙江畜牧兽医, 2015(15): 219–220.
|
蒋文晓. 2014. 动物性食品中喹噁啉类药物代谢物和磺胺类喹诺酮类药物多残留免疫分析方法研究[D]. 北京: 中国农业大学
http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221282.htm |
黎媛萍, 曾光明, 汤琳, 等. 2007. 间接竞争ELISA法测定稻田土壤中除草剂毒莠定的残留量[J]. 环境科学学报, 2007, 27(7): 1222–1226.
|
龙淼. 2006. 分泌抗恩诺沙星单克隆抗体杂交瘤细胞株的建立[D]. 长春: 吉林农业大学. 51
http://cdmd.cnki.com.cn/article/cdmd-10193-2006160367.htm |
Li D, Zeng S, He M, et al. 2016. Water disinfection byproducts induce antibiotic resistance-role of environmental pollutants in resistance phenomena[J]. Environmental Science & Technology, 50(6): 3193–3201.
|
Lopez Serna R, Jurado A, Vazquez Sune E, et al. 2013. Occurrence of 95 pharmaceuticals and transformation products in urban groundwaters underlying the metropolis of Barcelona, Spain[J]. Environmental Pollution, 174: 305–315.
DOI:10.1016/j.envpol.2012.11.022
|
Lv Y, Yang L, Liu X, et al. 2013. Preparation and evaluation of a novel molecularly imprinted hybrid composite monolithic column for online solid-phase extraction coupled with HPLC to detect trace fluoroquinolone residues in milk[J]. Analytical Methods, 5(7): 1848–1855.
DOI:10.1039/c3ay26431a
|
Malaitsev V V, Azhipa O Y. 1993. Influence of epitope density on immunogenic properties of hapten-protein conjugates[J]. Bulletin of Experimental Biology and Medicine, 115(6): 726–728.
DOI:10.1007/BF00791175
|
Midgley A R J, Niswender G D, Rebar R W. 1969. Principles for the assessment of the reliability of radioimmunoassay methods (precision, accuracy, sensitivity, specificity)[J]. Acta Endocrinologica, 142: 163–184.
|
San Martin B, Cornejo J, Lapierre L, et al. 2010. Withdrawal time of four pharmaceutical formulations of enrofloxacin in poultry according to different maximum residues limits[J]. Journal of Veterinary Pharmacology and Therapeutics, 33(3): 246–251.
|
Schneider M J, Yun L, Lehotay S J. 2013. Terbium-sensitised luminescence screening method for fluoroquinolones in beef serum[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 30(4): 666–669.
|
Singh K V, Kaur J, Varshney G C, et al. 2004. Synthesis and characterization of hapten-protein conjugates for antibody production against small molecules[J]. Bioconjugate Chemistry, 15(1): 168–173.
DOI:10.1021/bc034158v
|
沈翠香. 2010. 微生物抑制法检测动物性食品中喹诺酮类药物残留的研究[D]. 乌鲁木齐: 新疆农业大学
http://cdmd.cnki.com.cn/article/cdmd-10758-1011040833.htm |
Tang J, Shi T, Wu X, et al. 2015. The occurrence and distribution of antibiotics in Lake Chaohu, China:Seasonal variation, potential source and risk assessment[J]. Chemosphere, 122: 154–161.
DOI:10.1016/j.chemosphere.2014.11.032
|
Wang L, Zhang Y, Gao X, et al. 2010. Determination of chloramphenicol residues in milk by enzyme-linked immunosorbent assay:Improvement by biotin-streptavidin-amplified system[J]. Journal of Agricultural and Food Chemistry, 58(6): 3265–3270.
DOI:10.1021/jf903940h
|
王忠斌. 2008. 食品中恩诺沙星残留免疫学检测方法的研究[D]. 天津: 天津科技大学. 65
http://cdmd.cnki.com.cn/Article/CDMD-10057-2009256397.htm |
余若祯. 2005. 水中2, 4-D及叶枯唑免疫检测技术研究[D]. 北京: 清华大学
|
Yiruhan, Wang Q, Mo C, et al. 2010. Determination of four fluoroquinolone antibiotics in tap water in Guangzhou and Macao[J]. Environmental Pollution, 158(7): 2350–2358.
DOI:10.1016/j.envpol.2010.03.019
|
Yu H, Tao Y, Chen D, et al. 2012. Simultaneous determination of fluoroquinolones in foods of animal origin by a high performance liquid chromatography and a liquid chromatography tandem mass spectrometry with accelerated solvent extraction[J]. Journal of Chromatography B-Aanalytical Technologies in the Biomedical and Life Sciences, 885: 150–159.
|
Zhang H T, Jiang J Q, Wang Z L, et al. 2011. Development of an indirect competitive ELISA for simultaneous detection of enrofloxacin and ciprofloxacin[J]. J Zhejiang Univ Sci B, 12(11): 884–891.
DOI:10.1631/jzus.B1100076
|
Zhao Y, Zhang G, Liu Q, et al. 2008. Development of a lateral flow colloidal gold immunoassay strip for the rapid detection of enrofloxacin residues[J]. Journal of Agricultural and Food Chemistry, 56(24): 12138–12142.
DOI:10.1021/jf802648z
|
张婧, 魏朝俊, 王春娜, 等. 2009. 溴氰菊酯残留酶联免疫分析方法的建立[J]. 农业环境科学学报, 2009, 28(5): 1065–1069.
|
张昱, 杨敏, 王春艳, 等. 2015. 生产过程中抗生素与抗药基因的排放特征、环境行为及控制?[J]. 环境化学, 2015, 34(1): 1–8.
DOI:10.7524/j.issn.0254-6108.2015.01.2014111303 |
 2017, Vol. 37
2017, Vol. 37