2. 中山大学环境科学与工程学院, 广州 510275;
3. 广东工业大学环境科学与工程学院, 广州 510006
2. School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510275;
3. School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006
随着社会进步, 冶炼、矿产、电镀等工业飞速发展, “三废”尤其是工业废品与生活垃圾等废弃物的不合理排放致使土壤重金属含量明显高于背景值(陈洪等, 2013), 并造成现存的或潜在的土壤质量退化、生态与环境恶化日益严重(陈印军等, 2014).同时农业生产中, 城市污泥、污水在农业中的再利用和大量含重金属农化品的不规范施用(吴荣等, 2014), 更使农用土壤受到镉(Cd)、汞(Hg)、铅(Pb)、铬(Cr)、砷(As)等重金属不同程度的污染, 其中, Cd污染最为严重、复杂(李庆等, 2013).据2014年《全国土壤污染状况调查公报》公布, 全国土壤点位重金属总的超标率为16.1%, 无机污染物超标点位数占全部超标点位的82.8%.其中Cd点位超标率为7.0%(环境保护部, 2014).可见重金属Cd污染问题已经严重危害到我国农用土壤安全, 对粮食安全构成极大的安全隐患, 甚至关系到整个社会的稳定与发展.
水稻作为我国主要的粮食作物, 全国有近2/3的人口以水稻为主食(凌启鸿等, 2005; 安宁等, 2015), 其安全生产更是重中之重, 因此, 探究水稻吸收与积累Cd的相关过程具有重大的意义.关于Cd在水稻中的研究中, 有学者指出, Cd的临界浓度会引起减产问题, 并在根、茎、叶部位积累(Arao et al., 2003; 李坤权等, 2003); 有研究表明, 水稻根系吸收和积累Cd的能力主要取决于环境中有效态Cd的含量和根系中金属离子通道的转运效率(Uraguchi et al., 2011; 丁凌云等, 2006).Cd2+的螯合作用、区域化、吸收利用和转运共同决定了根、茎之间Cd2+的含量及与环境中Cd2+浓度的动态平衡(Nocito et al., 2011).Cd在水稻木质部向地上部的转运则是决定水稻茎鞘及籽粒中Cd含量的最主要和常见的生理过程(Arao et al., 2003; Uraguchi et al., 2009).
目前, 人们已经找到3种控制Cd在水稻体内富集、转运的关键基因, 根据Cd进入水稻体内的先后顺序, 相关的基因分别为OsNramp5、OsHMA3和OsHMA2(陈喆等, 2015).其中, OsNramp5主要调控水稻对Cd的吸收过程(Sasaki et al., 2012), 主要是对根部生理生化活动的影响; OsHMA3主要是调控Cd进入根部细胞的液泡中, 从而区室化阻隔Cd向地上部的转运过程(Ueno et al., 2010); OsHMA2则可调控Cd从水稻根部向地上茎部的转运及Cd向稻穗花序中的再分配过程(Yamaji et al., 2013).
水稻生长发育不同阶段吸收的水分、矿物质与营养物质有所不同, 主要的发育器官、物质转运与合成也不尽相同(张振兴等, 2016).研究表明, 水稻生长过程中Cd随营养元素主要在生长阶段主动吸收(丁园等, 2007), 分蘖期对Cd胁迫最为敏感, Cd在此时积累于根部、茎鞘和叶片的含量达到最大(莫争等, 2002), 水稻分蘖期以后对重金属的耐性和解毒能力会得到增强(仲晓春等, 2015).分蘖期, 根表铁膜的形成能有效抑制Cd向水稻地上部转运(胡莹等, 2013).3种不同生育期阶段Cd胁迫对水稻Cd积累的影响表明, 在扬花期水稻对Cd的耐受能力较强且植株体内Cd含量相对较高(Rodda et al., 2011).还有研究表明, 水稻对Cd的吸收因不同生育期而异, 分蘖期和成熟期是Cd吸收的主要时期(史静等, 2007).王凯荣等(2006)利用水培试验对水稻在不同生长发育期对环境Cd的吸收和再分配特性进行了研究, 结果表明, 水稻对Cd的吸收速率为中期(幼穗分化至抽穗期)>后期(抽穗之后)>前期(幼穗分化之前), 对Cd的积累量为后期>中期>前期.也有研究报道, 不同生育阶段植株体总的Cd净积累量表现为:抽穗至成熟期>移栽至分蘖期>分蘖至抽穗期, 即后期>前期>中期(张利强, 2012).还有研究发现, Lu527-8和Lu17-9两种不同的水稻地上部和整株Cd积累速率随生育期的延长先升高后降低并在灌浆期达最大值, 且在拔节-抽穗期和抽穗-灌浆期显著高于其他生育阶段; Lu527-8和Lu17-9两种水稻整株阶段性Cd积累量在拔节-抽穗期分别占整个生育时期的15.30%、40.45%, 抽穗-灌浆期分别占39.70%、20.74%(唐皓等, 2015).刘昭兵等(2011)提出, 分蘖和成熟期为水稻吸收累积Cd的2个关键时期, 针对该时期采取有效措施控制土壤中重金属活性对于降低水稻籽粒Cd的累积具有重要意义.但这些研究都是以整株水稻为吸收主体, 并未探究稻米的Cd积累, 也未涉及水稻前期吸收于体内的Cd在成熟过程中对糙米Cd含量的影响.
本研究参考中国一般土壤中的Cd含量(95%置信度, 0.017~0.33 mg·kg-1), 设置外源Cd浓度为50 μg·L-1, 通过营养液进行全生育期培养, 利用处理之间的“减法”, 控制单一变量, 排除生长稀释与水稻体内物质迁移变化的影响, 开展水稻不同生育期吸收的Cd对糙米积累Cd的影响, 这对于探究稻米中Cd积累的关键时期, 适时施用改良材料, 开发水稻糙米Cd污染控制技术, 降低水稻糙米中Cd含量等具有非常重要的理论与现实意义.
2 材料与方法(Materials and methods) 2.1 试验材料 2.1.1 水稻品种供试水稻品种为“湘晚籼13号(国审稻2004027)”, 属常规中熟晚籼, 长江中下游作双季水稻种植全生育期平均115 d, 株高98.5 cm, 株型适中(湖南省种子管理站, 2001).
2.1.2 试验装置水培容器为聚乙烯(PE)塑料桶, 上口径为40 cm, 下口径为30 cm, 桶高25 cm; 每桶可盛基础营养液10 L, 微量元素贮备液10 mL.水稻采用泡沫塑料育苗盘和定植篮进行固定.
2.2 营养液营养液采用木村B营养液(吴岳轩等, 1992; 张小娟等, 2014)及Arnon(1938)A-Z微量元素营养液配制, 配置比例为每1 L木村B营养液中添加1 mL Arnon(1938)A-Z微量元素.
2.3 试验方法 2.3.1 试验设计设计7个处理水平, 分别为从移栽至成熟期添加外源Cd(Q)、从移栽至乳熟期添加外源Cd (A)、从移栽至灌浆期添加外源Cd(B)、从移栽至抽穗期添加外源Cd(C)、从移栽至分蘖期添加外源Cd(D)、从移栽至幼苗期添加外源Cd(E)和从移栽至成熟期不添加外源Cd(CK), 每个处理水平重复3次, 将水稻从幼苗移栽, 培育至成熟.利用不同处理中水稻接受外源Cd胁迫时间的长短不一, 进行Cd胁迫时间上的“减法”, 即提取某一个处理Cd胁迫时间内的采样数据作为基准, 然后将其他处理Cd胁迫时间内的数据与该基准作减法处理, 保存差值, 从而递推接受外源Cd胁迫的不同生育期内的数据, 计算不同生育期接受Cd胁迫的时间内, 吸收的Cd经过水稻生长发育过程中的转运、迁移, 最终积累在水稻成熟后各部位的Cd含量(C, 其中, 下标字母表示不同处理水平), 具体为:幼苗期(CE-CCK)、分蘖期(CD-CE)、抽穗期(CC-CD)、灌浆期(CB-CC)、乳熟期(CA-CB)与成熟期(CQ-CA)等6个实际吸收Cd的水稻生育期.外源Cd由CdCl2·2.5H2O(CdCl2≥99.0%, 分析纯, 上海金山亭新化工厂)配置, 使营养液中Cd2+浓度为50 μg·L-1.
2.3.2 试验操作种子育苗:育苗盘为高密度聚乙烯(HDPE)方盘, 规格为575 mm×375 mm×75 mm(长×宽×高), 内垫6层无菌纱布为发芽床, 并保持其湿润.挑选大小一致、子粒饱满的水稻种子用2%的H2O2消毒6 min, 用去离子水反复冲洗5遍.放入去离子水中进行浸种6 h, 再将种子均匀洒在育苗盘湿润的纱布上, 各颗种子之间留有一定的距离, 以保证幼芽的生长空间和减少霉菌的传染, 置于培养箱内(条件控制温度为30 ℃, 湿度为50%)培育.
水稻培养:试验水稻样品育种后, 选取长势均衡的五叶期幼苗, 经去离子水清洗后移栽入营养液培育装置, 5穴·盆-1, 每穴3株, 在试验期间, 每日添加蒸发水量, 保持水量不变, 每2 d用400 g·L-1 NaOH溶液调节培养液的酸碱度, 使pH值保持在5.0~5.5, 每4 d更换一次营养液.试验水稻样品在营养液整个培养过程中生长正常.
2.3.3 测定指标与方法水稻样品采集后, 先用自来水冲洗, 再用去离子水反复清洗, 再拆分为根部、茎鞘、叶片和稻穗4部分, 谷粒风干后按农业部颁布标准《米质测定方法》(NY147-88) 出糙, 分离糙米和谷壳, 称量和记录各部位样品的干重.本研究选用采用混合酸(HNO3:HClO4=4:1) 湿法(刘凤枝, 2001; Liu et al., 2007)进行消解.样品进行消解时每个样品重复3次, 并同时在同一消解仪上做3个空白样和3个灌木枝叶质控样.用ICP-OES(美国PE8300) 测定Cd含量在0.1 mg·kg-1以上的水稻样品, 用原子吸收分光光度计-石墨炉法(GTA120, 美国Varian)测定Cd含量在0.1 mg·kg-1以下的水稻样品(陈喆等, 2013; 2014)
2.4 数据处理方法数据图表处理采用Microsoft Excel 2013, 多重差异显著性分析采用SPSS19.0.
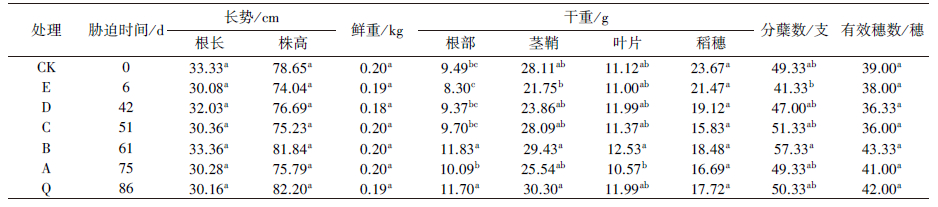
3 结果与分析(Results and analysis) 3.1 不同处理Cd胁迫对水稻生长的影响成熟期检测水稻长势、鲜重、干重、分蘖数及有效穗数等指标, 具体如表 1所示.由表 1可知, 在浓度为50 μg·L-1的外源Cd胁迫下, 水稻的生长基本不受影响.从长势来看, 不同Cd胁迫时间对根长及株高2个指标都没有显著影响; 从鲜重来看, 各处理中的水稻鲜重也没有因为Cd胁迫时间的变化而出现显著性差异; 而对于干重, 与对照相比, 除了根部的B、Q 2个处理外, 其余处理均无显著性差异.从分蘖数、有效穗数来看, 与对照相比, 外源Cd胁迫无显著差异.因此, 可以确定外源Cd浓度控制为50 μg·L-1不会显著影响水稻的正常生长, 能够反映水稻吸收、积累及转运的Cd的真实情况.
| 表 1 不同Cd胁迫时间下的水稻生长情况 Table 1 Rice growth conditions of different Cd stress time |
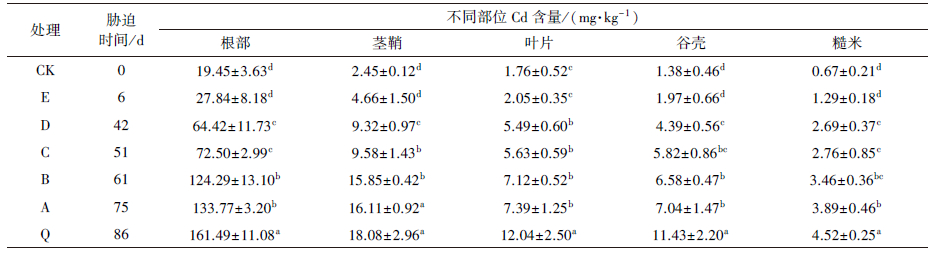
由于不同处理添加外源Cd的时间长短不一, 因此, 各处理接受Cd胁迫的时间也不一致.水稻成熟后各部位含量如表 2所示, 可以发现, 水稻植株不同部位的Cd含量随接受Cd胁迫时间的延长而增加.根部Cd含量变化范围较大, 为19.45~161.49 mg·kg-1, 各处理Cd含量表现为Q > A、B > C、D > E、CK的趋势(“ > ”表示两者达到显著差异水平, “、”表示未达到显著差异水平, 下同); 茎鞘Cd含量为2.45~18.08 mg·kg-1, 各处理Cd含量变化趋势为Q、A > B、C > D > E、CK; 叶片Cd含量为1.76 ~12.04 mg·kg-1, 各处理Cd含量表现出Q > A、B、C、D > E、CK的变化规律; 谷壳作为与糙米最紧密的部位, 其Cd含量为1.38~11.43 mg·kg-1, 表现出较大的变化跨度, 各处理Cd含量变化规律为Q > A、B > C、D > E、CK; 而糙米Cd含量为0.67~4.52 mg·kg-1, 各处理Cd含量变化规律为Q > A > B、C、D > E、CK, 即外源Cd胁迫时间越长, 糙米中Cd含量越高.由表 2还可以明显看出, 各处理对水稻各部位Cd含量的影响都表现出一致的规律:根部 > 茎鞘 > 叶片 > 谷壳 > 糙米.
| 表 2 不同处理水稻各部位中Cd含量 Table 2 Cd content in different parts of rice |
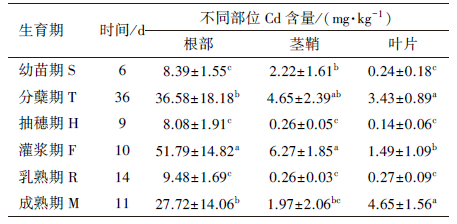
根据试验设计, 将不同处理进行理论上的“减法”, 得到水稻6个生育期水稻不同部位的Cd积累量, 具体结果见表 3.
| 表 3 各生育期不同部位Cd的积累量 Table 3 Accumulation content of Cd in different parts during every growth period |
水稻在不同生育阶段的植株生物量, 以及不同部位的生长、发育及物质合成所需营养物质量并不相同, 因此, 水稻根部对营养物质的吸收量、吸收速率也并不一致.由表 3可知, 不同生育期水稻根部对Cd积累量变化显著, 为8.08~51.79 mg·kg-1, 其中, 各时期Cd积累量排序为F>T、M>R、S、H, 即灌浆期根部Cd积累量最多, 分蘖期、成熟期次之.
不同时期茎鞘中Cd的积累量为0.26~6.27 mg·kg-1, 各时期茎鞘中Cd积累量的排序为:F、T>S>M、R、H, 即茎鞘Cd的积累主要发生在灌浆期、分蘖期.
叶片是水稻的功能器官, 其营养物质的吸收能力随植物不同时期能量的改变而改变, 分蘖期积累量可能较高, 不同时期叶片中Cd的积累量为0.14~4.65 mg·kg-1, 积累量的变化规律为M、T>F>S、R、H, 说明成熟期、分蘖期对叶片积累Cd的贡献最大.
3.3.2 对水稻谷壳及糙米中Cd积累量的影响谷壳和糙米是与稻米Cd积累最相关的部位, 从图 1可以看出, 不同生育期谷壳与糙米内Cd积累量的变化规律, 以及不同生育期Cd的积累对稻米Cd积累的贡献率大小也不尽相同.
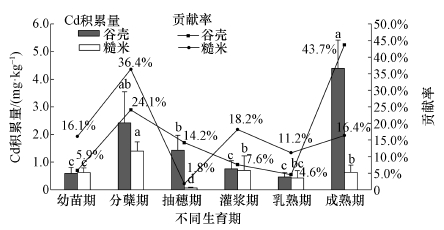 |
| 图 1 不同生育期谷壳及糙米Cd积累量和贡献率 Fig. 1 Cd content and contribution rate of rice and husk in different periods |
对于谷壳而言, 不同生育期Cd积累量为0.46~4.39 mg·kg-1, 贡献率大小为M、T>H>F、R、S, 其中, M、T、H阶段分别占谷壳Cd积累量的43.7%、24.1%、14.2%.由此可知, 水稻谷壳中Cd主要来自成熟期的吸收、分蘖期吸收的Cd后期的转移及抽穗期的吸收.
不同生育期糙米Cd积累量为0.07~1.40 mg·kg-1, 其贡献率的大小为T>F、M>S、R>H, 其中, T、F及M阶段分别占糙米Cd积累量的36.4%、18.2%、16.4%, 说明糙米中Cd主要来源为分蘖期Cd吸收后的转移、灌浆乳熟期时随营养物质传输吸收的Cd及成熟期稻米成熟过程中吸收的Cd.
4 讨论(Discussion)不同时期吸收的Cd在水稻成熟后对水稻各部位的Cd积累量都有一定的影响, 水稻根系直接与外界环境接触, 是水稻从外界环境中吸收所需养分最关键的部位, 也是吸收水分和养分的重要器官, 又具有合成、运输和固定植株的作用, 其生长发育与地上部的生长、产量和品质形成有密切的关系; 同时也是影响植株体内有害物含量最密切的部位, 因为外界有害物质通过根部能最直接、最快速地进入植株体内.灌浆期是水稻生长稻米的重要时期, 此时期营养物质吸收迅速, 但同时水稻生物量, 特别是根、茎、叶生物量基本没有变化, 所以有害物质进入植株体内相对也较快, 且积累多.分蘖期, 水稻生长最为迅速, 植株整体生物量扩张快, 所需营养物质多, 茎、叶生长快, 蒸腾作用加剧, Cd进入植株体内较多.成熟期, 根部继续向上输送营养物质, 时间较长, Cd积累量多.水稻茎鞘主要是作为物质传输通道, 在植物蒸腾作用下, 能够把从根部吸收的养分及其他物质向穗部及叶片运输, 是水稻上部受外界毒害的重要途径, 灌浆期与分蘖期是水稻生殖生长和营养生长的关键时期, 营养物质需求高, 水稻生理活动旺盛, 而茎鞘作为水稻生物量最大的部位, 自然积累了最多的Cd.而叶片Cd积累量的变化主要可能是因为植物抗性及抗逆能力的作用对有害物质进行的转移、储存, 叶片能够暂时存储茎鞘运输的部分Cd2+, 随着叶片的衰老, 通过韧皮部, 而后向穗部转运(Yan et al., 2010).对于谷壳而言, 本试验中成熟期从蜡熟期开始, 经过完熟期后收获, 处理时间长, Cd吸收多; 再者, 在Cd胁迫处理下水稻的自我保护机制发挥作用, 将更多的Cd阻隔在谷壳, 不进入谷粒的胚中.分蘖期作为营养生长的主要时期, 在水稻体内的物质运输、转运及合成中起到很重要的作用, 此时期积累在根部、茎鞘及叶片的Cd, 在水稻生长后期也随着物质移动, 在水稻谷壳中进行积累.抽穗期是水稻谷壳进一步形成、完善的最主要时期, 水稻大部分营养物质提供给此时期主要的生长部位—稻穗, 所以此时期谷壳Cd自然吸收、积累较多.糙米中Cd主要来源为分蘖期吸收Cd的转移、灌浆乳熟期时Cd随营养物质传输的积累及成熟期稻米成熟过程中吸收的Cd.分蘖期, 植株大规模地进行生物量的生长增加, 生理活动旺盛, 水中的Cd随营养物质进入体内, 并积累在根、茎、叶中; 随着水稻进入生殖生长期, 水稻新的部位出现, 水稻植株内物质的流动更加频繁, 先前积累在根、茎、叶中的Cd也在流转中转移进入稻米中.水稻灌浆过程是水稻生长过程中的重要环节, 在此期间, 大量的储存物质被合成转运到籽粒胚乳中, 这些储存物质主要来自于抽穗前茎鞘贮藏物质及抽穗后的光合产物, 前者约占1/3;抽穗期茎鞘贮藏的非结构性碳水化合物不仅是籽粒灌浆物质的一部分, 而且对灌浆初期籽粒库的活性、启动和促进籽粒灌浆起重要作用, 主要表现在影响胚乳的细胞分裂、胚乳发育和物质充实(缪小建, 2009); 也能为萌发中的种子提供营养, 同时也是人体所需的营养及能量来源, 灌浆时物质的传输、转运及合成较快, 稻米基本形成, Cd随营养物质进入植株体内也相对较快.成熟期是蜡熟完熟阶段, 也是水稻最终的生理时期, Cd随物质继续不断地输入, 才有可能出现本试验结果中呈现的系列变化.
5 结论(Conclusions)水稻营养液培育试验表明, 各生育期水稻在50 μg·L-1 Cd胁迫时不会显著影响其生长, 糙米中Cd主要来源为分蘖期根、茎、叶吸收的Cd在后期的迁移, 占36.4%, 灌浆期随营养物质传输的吸收, 占18.2%, 以及成熟期的吸收, 占16.4%.
Arao T, Ae N, Sμgiyama M, et al. 2003. Genotypic differences in cadmium uptake and distribution in soybeans[J]. Plant & Soil, 251(2): 247–253.
|
Arnon D I. 1938. Microelements in culture-solution experiments with higher plants[J]. Protoplasma, 31(1): 488–488.
|
Akimasa S, Naoki Y, Kengo Y, et al. 2012. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. Plant Cell, 24(5): 2155–2167.
DOI:10.1105/tpc.112.096925
|
安宁, 范明生, 张福锁. 2015. 水稻最佳作物管理技术的增产增效作用[J]. 植物营养与肥料学报, 2015, 21(4): 846–852.
DOI:10.11674/zwyf.2015.0403 |
陈洪, 特拉津, 那斯尔, 等. 2013. 伊犁河流域土壤重金属含量空间分布及其环境现状研究[J]. 水土保持学报, 2013, 27(3): 100–105.
|
陈印军, 杨俊彦, 方琳娜. 2014. 我国耕地土壤环境质量状况分析[J]. 中国农业科技导报, 2014, 16(2): 14–18.
|
陈喆, 铁柏清, 雷鸣, 等. 2014. 施硅方式对稻米镉阻隔潜力研究[J]. 环境科学, 2014, 35(7): 2762–2770.
|
陈喆, 铁柏清, 刘孝利, 等. 2013. 改良-农艺综合措施对水稻吸收积累镉的影响[J]. 农业环境科学学报, 2013, 32(7): 1302–1308.
|
陈喆, 张淼, 叶长城, 等. 2015. 富硅肥料和水分管理对稻米镉污染阻控效果研究[J]. 环境科学学报, 2015, 35(12): 4003–4011.
|
丁凌云, 蓝崇钰, 林建平, 等. 2006. 不同改良剂对重金属污染农田水稻产量和重金属吸收的影响[J]. 生态环境, 2006, 15(6): 1204–1208.
|
丁园, 宗良纲, 徐晓炎, 等. 2009. Cd污染对水稻不同生育期生长和品质的影响[J]. 生态环境学报, 2009, 18(1): 183–186.
|
胡莹, 黄益宗, 黄艳超, 等. 2013. 不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响[J]. 农业环境科学学报, 2013, 32(3): 432–437.
|
环境保护部, 国土资源部. 2014. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014(5): 10–11.
|
湖南省种子管理站. 2001. 湘晚籼13号[J]. 湖南农业, 2001(5): 13.
|
李庆, 王应军, 宗贵仪, 等. 2013. 铈缓解Cd对玉米种子的毒害效应研究[J]. 稀土, 2013(6): 1–6.
|
李坤权, 刘建国, 陆小龙, 等. 2003. 水稻不同品种对Cd吸收及分配的差异[J]. 农业环境科学学报, 2003, 22(5): 529–532.
|
Liu J G, Qian M, Cai G L, et al. 2007. Variations between rice cultivars in root secretion of organic acids and the relationship with plant cadmium uptake[J]. Environment Geochemical Health, 29(3): 189–195.
DOI:10.1007/s10653-006-9063-z
|
凌启鸿, 张洪程, 戴其根, 等. 2005. 水稻精确定量施氮研究[J]. 中国农业科学, 2005, 38(12): 2457–2467.
DOI:10.3321/j.issn:0578-1752.2005.12.014 |
刘凤枝. 2001. 农业环境监测实用手册[M]. 北京: 中国标准出版社.
|
刘昭兵, 纪雄辉, 彭华, 等. 2011. 不同生育期水稻对Cd、Pb的吸收累积特征及品种差异[J]. 土壤通报, 2011, 42(5): 1125–1130.
|
莫争, 王春霞. 2002. 重金属Cu, Pb, Zn, Cr, Cd在水稻植株中的富集和分布[J]. 环境化学, 2002, 21(2): 110–116.
|
缪小建, 王绍华, 李刚华, 等. 2009. 大中穗型水稻品种灌浆期非结构性碳水化合物运转特征[J]. 南京农业大学学报, 2009, 32(2): 1–4.
|
Nocito F F, Lancilli C, Dendena B, et al. 2011. Cadmium retention in rice roots is influenced by cadmium availability, chelation and translocation[J]. Plant Cell & Environment, 34(6): 994–1008.
|
Rodda M S, Li G, Reid R J. 2011. The timing of grain Cd accumulation in rice plants: the relative importance of remobilisation within the plant and root Cd uptake post-flowering[J]. Plant and Soil, 347(1): 105–114.
|
史静, 李正文, 龚伟群, 等. 2007. 2种常规水稻Cd、Zn吸收与器官分配的生育期变化:品种、土壤和Cd处理的影响[J]. 生态毒理学报, 2007, 2(1): 32–40.
|
Sasaki A, Yamaji N, Yokosho K, et al. 2012. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. Plant Cell, 24: 2155–2167.
DOI:10.1105/tpc.112.096925
|
唐皓, 李廷轩, 张锡洲, 等. 2015. 水稻镉高积累材料不同生育期镉积累变化特征研究[J]. 农业环境科学学报, 2015, 34(3): 471–477.
DOI:10.11654/jaes.2015.03.008 |
Ueno D, Yamaji N, Kono I, et al. 2010. Gene limiting cadmium accumulation in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 107: 16500–16505.
DOI:10.1073/pnas.1005396107
|
Uraguchi S, Kamiya T, Sakamoto T, et al. 2011. Low-affinity cation transporter (OsLCT1) regulates cadmium transport into rice grains[J]. Proceedings of the National Academy of Sciences, 108(52): 20959–20964.
DOI:10.1073/pnas.1116531109
|
Uraguchi S, Mori S, Kuramata M, et al. 2009. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 60(9): 2677–88.
DOI:10.1093/jxb/erp119
|
王凯荣, 龚惠群. 2006. 不同生育期Cd胁迫对两种水稻的生长Cd吸收及糙米Cd含量的影响[J]. 生态环境, 2006, 15(6): 1197–1203.
|
吴荣, 刘善江, 杜颖. 2014. 城乡有机废弃物农用资源化研究进展[J]. 农学学报, 2014, 4(6): 45–48.
|
吴岳轩, 吴振球. 1992. 杂交稻根系代谢活性与叶片衰老进程相关研究[J]. 杂交水稻, 1992(6): 36–39.
|
Yamaji N, Xia J X, Mitani Ueno N, et al. 2013. Preferential delivery of Zn to developing tissues in rice is mediated by a P-type ATPases, OsHMA2[J]. Plant Physiology, 162: 927–939.
DOI:10.1104/pp.113.216564
|
Yan Y F, Choi D H, Kim D S, et al. 2010. Absorption, translocation, and remobilization of cadmium supplied at different growth stages of rice[J]. Journal of Crop Science and Biotechnology, 13(2): 113–119.
DOI:10.1007/s12892-010-0045-4
|
张小娟, 宋涛, 甄晓辉, 等. 2014. 模拟干旱胁迫对转C4双基因水稻幼苗光合功能及部分抗氧化酶活性的影响[J]. 江苏农业学报, 2014, 30(4): 709–715.
|
张利强. 2012. 水稻重金属Cd的吸收, 转运和积累特性研究[D]. 北京: 中国农业科学院中国水稻研究所
http://cdmd.cnki.com.cn/Article/CDMD-82101-1012414051.htm |
张振兴, 纪雄辉, 谢运河, 等. 2016. 水稻不同生育期施用生石灰对稻米镉含量的影响[J]. 农业环境科学学报, 2016, 35(10): 1867–1872.
DOI:10.11654/jaes.2016-0432 |
仲晓春, 陈京都, 郝心宁. 2015. 水稻作物对重金属Cd的积累、耐性机理以及栽培调控措施进展[J]. 中国农学通报, 2015(36): 1–5.
DOI:10.11924/j.issn.1000-6850.casb15080109 |
 2017, Vol. 37
2017, Vol. 37