厌氧氨氧化(Anammox)作为一种新型脱氮工艺近年来逐渐引起关注, 其原理为厌氧氨氧化菌利用NO2--N作为电子受体将氨氮氧化为氮气.如何高效稳定地获得NO2--N是Anammox工艺成败的关键.在以往的实验研究中, NO2--N的获得主要通过短程硝化来实现, 这一过程通常需要较高的温度(Van et al., 2001)或较低的溶解氧(Tokutomi, 2004), 且该过程不稳定易变成全程硝化.因此, 通过控制反硝化反应条件, 将NO3--N仅还原至NO2--N, 成为获得厌氧氨氧化所需NO2--N的一种新的途径(孟雪征等, 2009).
研究结果表明, 反硝化反应是在硝酸还原酶(NaR)、亚硝酸还原酶(NiR)、一氧化氮还原酶(NoR)和一氧化二氮还原酶(Nos)的作用下, 逐级将NO3--N还原为N2的过程(式(1)).
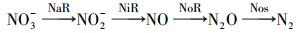
|
(1) |
然而并非所有的反硝化菌都可进行完整的反硝化反应(Bothe et al., 1990;Kloos et al., 1999; Nielsen and Nielsen, 2002), 部分反硝化菌只能完成反硝化反应链中的一个或多个步骤, 这些微生物在反硝化反应链上所承担的角色取决于其所拥有的反硝化还原酶的种类和数量(图 1b).如在活性污泥中常见的假单胞菌(Pseudomonas), 它同时具有反硝化呼吸链中的全部反硝化还原酶, 可将NO3--N还原为N2(Stouthamer, 1992)(图 1a), 而埃希氏大肠杆菌(E.coli)及反硝化古菌(Archaea, ANME-2d)仅含有硝酸还原酶, 只能将NO3--N还原为NO2--N(Ferguson, 1994; Haroon et al., 2013).通过改变反应条件, 富集仅含有硝酸还原酶的反硝化菌, 即可实现亚硝氮的积累.
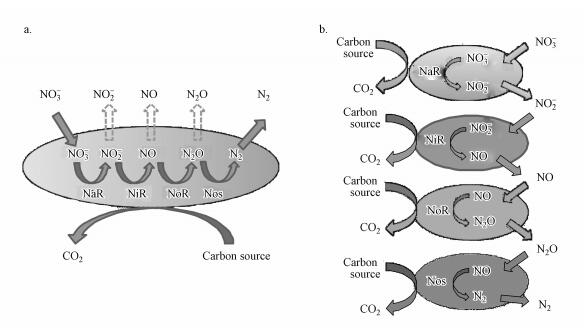 |
| 图 1 两种反硝化路径的示意图(a.含有全部反硝化酶的微生物独立完成反硝化过程, b.含有不同反硝化酶的不同微生物协作完成反硝化过程) Fig. 1 Denitrification schematic diagram of two hypotheses (a.microorganisms contain full denitrifying enzymes; b.microorganisms contain sole denitrifying enzyme) |
碳源种类和碳氮比(COD/NO3--N)也是影响反硝化过程中NO2--N积累的重要因素.研究表明反硝化反应以乙酸钠作为碳源时具有最大比反硝化速率, 且存在NO2--N积累现象(殷芳芳等, 2009).当碳源不足时(C/N < 3.2), NO2--N会出现明显积累, 且积累量随碳源增加而增加(曹相生等, 2010).
本研究以城市污水处理厂营养物去除系统中的活性污泥为对象, 乙酸钠为碳源, 在不同的C/N下, 通过控制反应时间, 将反硝化过程控制在NO3--N还原为NO2--N这一步骤, 以达到为厌氧氨氧化反应提供NO2--N的目的.同时通过对比不同C/N下NO2--N积累率, 探究实现NO2--N稳定积累的最佳C/N, 为现有反硝化系统组成理论提供依据.
2 材料与方法(Materials and methods) 2.1 接种污泥及富集培养方法实验在3个平行的SBR反应器中进行, 进水C/N分别为1、2.5和4.反应器容积均为1 L, 初始污泥浓度为1000 mg·L-1, HRT为12 h, SRT为8 d, 反应温度为25~27 ℃.接种污泥取自西安市第四污水处理厂A/A/O生物反应池中好氧区末端.
试验期间, 通过不断缩短反应时间, 达到将NO3--N仅还原至NO2--N的目的.具体操作方式为:进水结束后, 监测反应器内的亚硝酸盐浓度, 当其浓度达到最大值时, 强制沉淀排水, 终止反应, 此后, 反应器处于闲置状态, 等待下一个循环.之后维持该反应时间不变, 待NO2--N积累率降低时, 再次缩短反应时间, 以此往复.
2.2 实验用水实验用水采用自来水人工配制, 进水NO3--N浓度均为50 mg·L-1, 乙酸钠分别按照C/N=1、2.5和4添加, 同时加入氯化铵和磷酸二氢钾补充微生物增长所需氮磷, 并通过NaHCO3调节pH, 保持混合液的pH为7.0~8.0.
2.3 批次试验(1) 反硝化活性测定
定期测定不同C/N下反硝化过程中NOx--N的浓度变化, 以此考察活性污泥的反硝化活性.具体操作方式为:反应周期结束时从不同C/N反应器中各取200 mL活性污泥, 经淘洗后分别置于3个400 mL广口瓶中, 用氮气吹脱5 min后加入基质(NO3--N:50 mg·L-1), 并按照C/N=1、2.5和4分别添加乙酸钠, 密闭后放入25 ℃恒温水浴振荡器中进行培养.反应过程中每间隔5 min定时取样, 分析测定样品中的NO3--N、NO2--N、COD等指标.
(2) 碳源含量对反硝化活性影响
为了探究碳源含量对反硝化过程中NO2--N积累的影响, 设计实验:取C/N=2.5反应器中的污泥进行反硝化反应, 在NO2--N积累量达到最大时停止反应, 之后继续添加足量COD, 整个反应过程中定时取样, 取样结束后立即分析测定水样的NO3--N、NO2--N、COD等指标.
2.4 分析项目与方法各项指标测定方法均为标准方法(国家环境保护局, 2002), 其中NO3--N采用紫外分光光度法; NO2--N采用乙二胺分光光度法; COD采用重铬酸钾滴定法; NH4+-N采用纳氏试剂分光光度法; pH采用玻璃电极法.由于NO2--N的存在会影响COD的测定, 因此, 对测定COD进行校正: COD校正= COD实测-1.14CNO2--N(付昆明等, 2011).
2.5 反硝化速率及转化效率计算通过活性试验测定反硝化过程中NOx--N的浓度变化及污泥浓度, 根据式(2)~(5) 计算反硝化速率及转化效率.
NO3--N还原速率:
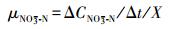
|
(2) |
NO2--N积累速率:
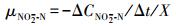
|
(3) |
NO3--N转化率:
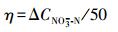
|
(4) |
NO2--N积累率:
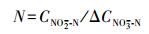
|
(5) |
式中, μNO3--N为NO3--N还原速率(mg·g-1·h-1); μNO2--N为NO2--N积累速率(mg·g-1·h-1); ΔCNO3--N为单位时间还原的NO3--N量(mg·L-1); ΔCNO2--N为单位时间积累的NO2--N量(mg·L-1); X为污泥浓度(g·L-1)(以VSS计); 50为进水NO3--N浓度50 mg·L-1.
2.6 高通量宏基因组微生物测序从反应器中取一定量活性污泥, 经去离子水淘洗, 离心后按照OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒使用说明(http://www.omegabiotek.com.cn/vancheerfile/files/2016/11/20161116125337431.pdf)提取DNA.
以提取的DNA为PCR模板, 采用V4引物(序列为: 5′-CCCTACACGACGCTCTTCCGATCT-3′和5′-GACTGGAGTTCCTTGGCACCCGAG-3′), 在MyiQ Real-time PCR扩增仪(美国, Biorad)上进行PCR反应.扩增产物通过琼脂糖凝胶(1%)电泳检测合格后, 利用Qubit2.0 DNA检测试剂盒(Life, Q10212) 对DNA进行精确定量, 以质量比1:1等量混合后上机测序.
3 结果与讨论(Results and discussion) 3.1 反应器运行情况特征在不同的C/N值下, 通过控制反硝化反应时间, 在SBR反应器中经过108 d的培养后, 实现了NO2--N的稳定积累.图 2为各个反应器出水NOx--N、NO2--N积累率、NO3--N转化率及污泥浓度与反应时间的历时变化.由图可知, 在C/N=1和C/N=2.5的反应器中, 随着反应时间的减少, 出水NO3--N浓度逐渐降低, NO3--N转化率和NO2--N积累率均逐渐增大, 这一结果表明被还原的NO2--N并未继续参与后续反应, 实现了稳定积累; 而在C/N=4的反应器中, 随着反应时间的缩短, NO3--N转化率逐渐增大, 出水NO2--N浓度和NO2--N积累率先增大后减小.这是由于在培养后期, 反硝化菌活性增大, NO2--N快速积累, 反硝化菌利用剩余COD将部分积累的NO2--N继续还原成N2, 从而导致出水NO2--N浓度和NO2--N积累率下降.
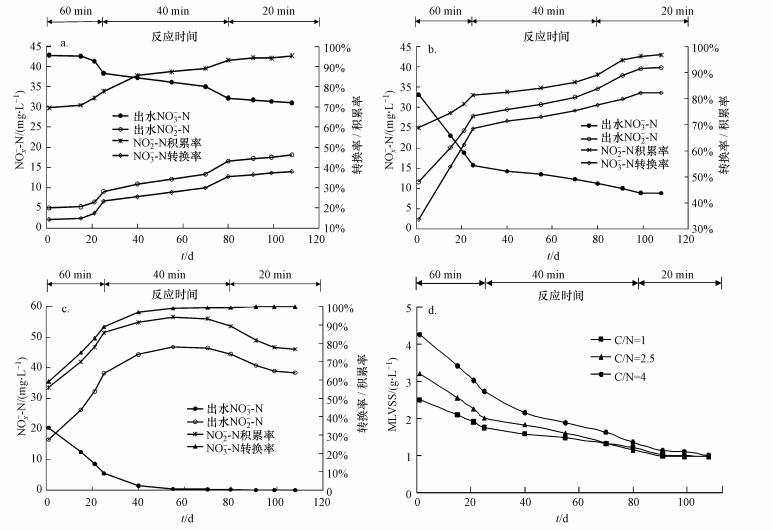 |
| 图 2 各个反应器出水NOx--N、积累率、转化率及污泥浓度与反应时间的历时变化(a. C/N=1; b. C/N=2.5;c. C/N=4; d.污泥浓度的历时变化) Fig. 2 Variation of NOx--N effluent, accumulation rate, transformation rate and sludge concentration with the reaction time in different reactors |
富集培养过程中, 在培养初期由于污泥处于驯化期, 排泥量大于污泥增长量, 导致污泥浓度持续降低, 随着培养过程的进行, 污泥活性增大, 每天排泥量约等于污泥增长量, 污泥浓度恒定在1.1 g·L-1.
3.2 污泥的活性变化培养过程中, 通过定时测定NO3--N最大还原速率和NO2--N最大积累速率来表征反硝化活性, 结果见图 3.当碳氮比为1、2.5和4时NO3--N最大还原速率和NO2--N最大积累速率分别为300.73和300.15、417.29和402.01、426.73和420.86 mg·g-1·h-1.随着培养时间的增长, NO3--N最大还原速率和NO2--N最大积累速率均逐渐增大并达到稳定状态, 且两者之间的差值也逐渐减小, 表明还原的NO3--N几乎全部转化为NO2--N并实现稳定积累.
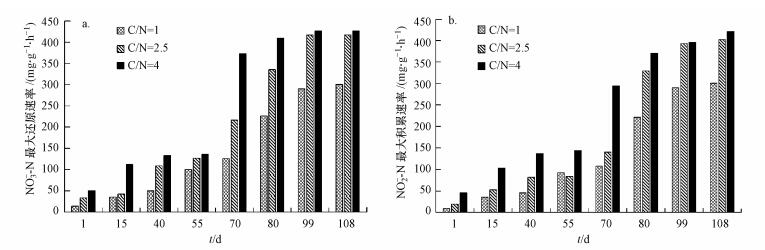 |
| 图 3 不同C/N下反硝化速率变化情况(a. NO3--N最大还原速率; b. NO2--N最大积累速率) Fig. 3 Comparison diagram of denitrification rate in different C/N ratios |
同时碳氮比对反硝化活性也有较大影响.随着碳氮比的增大, 反硝化活性也逐渐增大.不同C/N下的反硝化活性试验结果如图 4所示.当C/N为1和2.5时, 反硝化过程实现了稳定的NO2--N积累, COD在NO2--N积累量达到峰值时基本被完全消耗, 且NO2--N积累量随着C/N值的增大而增大:当C/N=1时, NO2--N最大积累量为20 mg·L-1, 平均积累率为88%;C/N=2.5时, NO2--N最大积累量为40 mg·L-1, 平均积累率为95%;当C/N=4时, NO2--N达到最大积累量(45 mg·L-1)后继续反应还原为N2, 至反应结束时, NO2--N积累率仅为65%, 而COD在NO2--N最大积累量处时仍剩余70 mg·L-1.分析以上实验结果可知, 较低的C/N有利于实现NO2--N的稳定积累, 这是由于在反应过程中基质的限制导致NO2--N无法继续还原为N2.
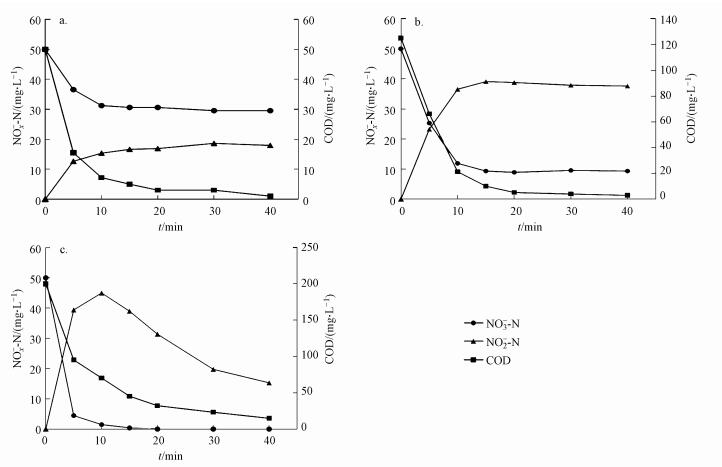 |
| 图 4 不同C/N值下NOx--N和COD变化(第108 d时)(a.C/N=1; b.C/N=2.5; c.C/N=4) Fig. 4 Variation of NOx--N and COD in different C/N ratios (at the 108th day) |
碳源含量对反硝化过程中亚硝氮积累的影响的实验结果如图 5所示.在反应开始20 min内, 由于碳源充足, 反硝化菌活性最大, NO3--N最大还原速率为417.25 mg·g-1·h-1, NO2--N最大积累速率为409.38 mg·g-1·h-1; 反应20~60 min时, 由于基质限制, 反硝化菌活性下降, NO3--N还原速率和NO2--N积累速率均逐渐降低, 分别为92.12 mg·g-1·h-1和52.68 mg·g-1·h-1, 在60 min时NO2--N积累量达到最大; 60 min后碳源耗尽, 反硝化菌利用内源呼吸缓慢还原NO2--N, 最大还原速率仅为23.23 mg·g-1·h-1.随后加入足量COD, 反硝化菌将积累的NO2--N还原为N2, 最大还原速率为65.68 mg·g-1·h-1.
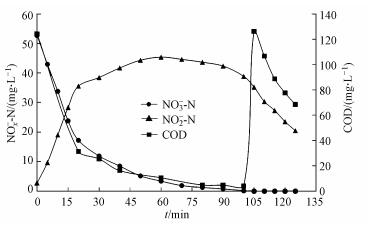 |
| 图 5 碳源含量对反硝化过程的影响 Fig. 5 Effect of carbon concentration on denitrification |
在碳源充足和硝酸盐含量较高的条件下(反应的前20 min), NO3--N还原速率和NO2--N积累速率基本相同.在此期间, NO3--N还原量为35.53 mg, NO2--N积累量为32.81 mg, 消耗COD量为92.79 mg, 对应的NH4+-N消耗量为3.27 mg; 其中NO3--N还原消耗COD量比重(ΔCOD/ΔNO3--N)为1.12 g·g-1(理论值为1.148 g·g-1), 根据NH4+-N消耗量计算合成细胞消耗COD量为49.29 mg, 剩余3.7 mg COD被用于还原部分NO2--N, 1 g NO2--N被还原至N2理论上需要消耗1.72 g COD.由上可知除细胞合成外, COD大部分用于还原NO3--N, 仅有少量COD被用于还原NO2--N.此时, 电子受体NO3--N和NO2--N相互竞争, 反硝化菌利用碳源将NO3--N仅还原至NO2--N, 还原的NO2--N几乎全部积累.由于反硝化酶合成顺序中硝酸还原酶早于亚硝酸还原酶的合成, 并且NO3--N还原比NO2--N的还原释放更多的自由能(Mooyoung et al., 2001), 导致了NO3--N存在会抑制NO2--N的还原, 所以反应初期NO2--N的还原速率和内源呼吸时还原速率基本相同, 从而导致NO2--N的积累.
而当碳源不足时(反应的20~100 min), 基质的限制导致NO2--N积累, 同时反硝化菌的亚硝酸还原酶(NiR)活性逐渐恢复.当向系统补充了足量的COD后(反应的100~125 min), NiR活性增大, 促使积累的NO2--N被迅速还原, 但此时NO2--N的最大还原速率仍远远低于初始NO3--N还原速率, 这可能是由于在培养过程中, 部分反硝化菌中的NaR含量增加, NiR含量降低, 使NO3--N优先还原, 从而出现了上述情况.
3.4 微生物种群组成本研究中培养污泥中的优势菌群为Thauera属(占71.85%), 属于β-Proteobacteria纲, 除此之外活性污泥中还存在Dechloromonas属(占6.48%)、Flavobacterium属(占4.62%)和Bdellovibrio属(占2.35%)等微生物, 培养污泥种群结构组成见图 6.
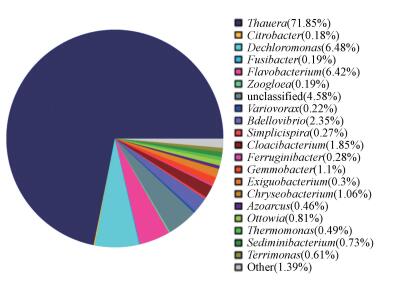 |
| 图 6 培养污泥种群结构组成 Fig. 6 Compositions of bacterial community in the partial denitrification classed by genus |
Thauera和Flavobacterium仅能将NO3--N还原为NO2--N, 从而导致反硝化系统中NO2--N积累.一般认为Thauera属中大部分种仅含有硝酸盐还原酶(Nar), 即在厌氧环境下仅将NO3--N还原为NO2--N(Srinandan et al., 2011; Liu et al., 2013); 而最新的研究表明Thauera属中部分种同时存在其它的反硝化酶, 但当NO3--N存在时, 微生物无法合成亚硝酸盐还原酶(Nir)(Liu et al., 2013), 这也是本研究采用了较短的反应时间, 当硝酸盐消耗殆尽时, 即停止反应, 从而获得最大的NO2--N积累和Thauera属微生物的富集. Flavobacterium具有与Thauera相同的特性(Payne, 1974).而当NO3--N被完全还原后, 此时, 如果继续反应, Thauera和Flavobacterium的亚硝酸盐还原酶(Nir)活性将逐渐恢复, 将NO2--N继续还原至NO, N2O或N2, 且此时NO2--N的最大还原速率低于初始NO3--N的还原速率(图 5).
除此之外, 培养污泥中还含有少量Dechloromonas和Bdellovibrio, 两者为常见反硝化菌, 含有反硝化过程全部酶系, 可将NO3--N还原为N2(Coates et al., 2011; Heylen, 2007).这些菌属的存在也是导致本研究中仍有部分积累NO2--N被还原为N2的原因.
4 结论(Conclusions)1) 通过控制反应时间和碳源供给, 将反硝化过程控制在NO3--N还原为NO2--N这一步骤, 实现NO2--N的稳定积累.
2) 在碳氮比为2.5时, 经108 d的培养, 反硝化反应时间从60 min缩短至20 min, NO3--N还原速率和NO2--N积累速率分别为0.417 g·g-1·h-1和0.402 g·g-1·h-1, NO2--N最大积累率达到95%.
3) 反硝化活性随着碳氮比的增大而增大, 而较低的C/N更有利于实现稳定的NO2--N积累.
4) 在反硝化亚硝氮积累的过程中, 当碳源充足时, NO3--N和NO2--N同时作为电子受体互相竞争碳源, NO3--N的存在会抑制NO2--N的还原, 从而导致NO2--N积累; 而当碳源不足时, 基质的限制使得NO3--N优先还原, 导致NO2--N的积累.
5) 培养污泥中的优势菌群为Thauera(占71.85%), 该菌仅能将NO3--N还原为NO2--N, 从而导致NO2--N的积累.
曹相生, 付昆明, 钱栋, 等. 2010. 甲醇为碳源时C/N对反硝化过程中亚硝酸盐积累的影响[J]. 化工学报, 2010, 61(11): 2938–2943.
|
Coates J D, Chakraborty R, Lack J G, et al. 2001. Anaerobic benzene oxidation coupled to nitrate reduction in pure culture by two strains of Dechloromonas.Research[J]. Nature, 411(6841): 1039–1043.
DOI:10.1038/35082545
|
付昆明, 曹相生, 孟雪征, 等. 2011. 污水反硝化过程中亚硝酸盐的积累规律[J]. 环境科学, 2011, 32(6): 1660–1664.
|
Ferguson S J. 1994. Denitrification and its control[J]. Antonie Van Leeuwenhoek, 66(1/3): 89–110.
|
国家环境保护局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社: 258–282.
|
Hahn Hägerdal B, Jönsson B, Lohmeier Vogel E. 1990. Molecular Analysis of Ammonia Oxidation and Denitrification in Natural Environments[M]//Die Rationen des Ja und des Nein:Suhrkamp:673-690
|
Haroon M F, Hu S, Shi Y, et al. 2013. Erratum:Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 500(7464): 567–570.
DOI:10.1038/nature12375
|
Heylen K. 2007. Study of the genetic basis of denitrification in pure culture denitrifiers isolated from activated sludge and soil[D]. Ghent University. Faculty of Sciences
https://biblio.ugent.be/publication/3050165 |
Kloos K, Hüsgen U M, Bothe H. 1999. DNA-probing for genes coding for denitrification, N2-fixation and nitrification in bacteria isolated from different soils[J]. Zeitschrift für Naturforschung C, 53(1-2): 69–81.
|
Liu B, Mao Y J, Bergaust L, et al. 2013. Strains in the genus Thauera, exhibit remarkably different denitrification regulatory phenotypes[J]. Environmental Microbiology, 15(10): 2816.
|
Liu G, Ling F Q, Magic Knezev A, et al. 2013. Quantification and identification of particle-associated bacteria in unchlorinated drinking water from three treatment plants by cultivation-independent methods[J]. Water, 47(10): 3523.
|
孟雪征, 付昆明, 曹相生, 等. 2009. 一种通过污水反硝化获得稳定亚硝酸盐积累的方法[P]. 中国, 发明专利, CN200910081436. 7. 2009-12-16
http://d.g.wanfangdata.com.cn/Patent_CN200910081436.7.aspx |
Mooyoung M, Anderson W A, Chakrabarty A M. 2001. Environmental biotechnology:principles and applications[J]. Environmental Biotechnology Principles & Applications.
|
Nielsen J L, Nielsen P H. 2002. Enumeration of acetate-consuming bacteria by microautoradiography under oxygen and nitrate respiring conditions in activated sludge[J]. Water Research, 36(2): 421–428.
DOI:10.1016/S0043-1354(01)00224-X
|
Payne W J. 1974. Reduction of nitrogenous oxides by microorganisms[J]. Bacteriological Reviews, 37(4): 409–452.
|
Srinandan C S, Shah M, Patel B, et al. 2011. Assessment of denitrifying bacterial composition in activated sludge[J]. Bioresource Technology, 102(20): 9481–9489.
DOI:10.1016/j.biortech.2011.07.094
|
Stouthamer A H. 1992. Metabolic pathways in Paracoccus denitrificans and closely related bacteria in relation to the phylogeny of prokaryotes[J]. Antonie van Leeuwenhoek, 61(1): 1–33.
DOI:10.1007/BF00572119
|
Tokutomi T. 2004. Operation of a nitrite-type airlift reactor at low DO concentration[J]. Water Sci Technol, 49(5/6): 81–88.
|
Van D U, Jetten M S, van Loosdrecht M C. 2001. The SHARON-Anammox process for treatment of ammonium rich wastewater[J]. Water Science & Technology A Journal of the International Association on Water Pollution Research, 44(1): 153–160.
|
殷芳芳, 王淑莹, 昂雪野, 等. 2009. 碳源类型对低温条件下生物反硝化的影响[J]. 环境科学, 2009, 30(1): 108–113.
|
 2017, Vol. 37
2017, Vol. 37


