2. 水沙科学与水灾害防治湖南省重点实验室, 长沙 410114;
3. 长沙理工大学水科学与环境工程国际研究中心, 长沙 410114
2. Key Laboratory of Water-sediment Sciences and Water Disaster Prevention of Hunan Province, Changsha 410114;
3. International Research Center of Water Science & Environmental Engineering, Changsha University of Science & Technology, Changsha 410114
以颤蚓、仙女虫和摇蚊幼虫等为代表的蠕虫类底栖无脊椎动物(简称“蠕虫”)在淡水水体中分布广泛, 且由于其较强的抗逆境胁迫能力, 往往是水体底栖动物优势种属(Mosleh et al., 2006).当水源水体中蠕虫随原水进入水厂后, 由于其穿透能力较强, 容易穿透各净水单元, 最终进入城市管网系统, 导致供水水质水生生物污染(何文杰, 2006; 聂小保等, 2012).自20世纪90年代以来, 国内外城市供水系统关于蠕虫的污染事例屡见报道, 如英国Essex城(Alexander, 1997)和美国Lowell城(Bay, 1993)的二次储水池中均检测到摇蚊幼虫, 加拿大Ste.-Rose水厂活性炭滤池出水仙女虫密度高达20 ind.·m-3以上.在我国无论是南方城市(如深圳、海口)还是北方城市(如西安、兰州), 供水系统中均有过蠕虫的检测报道(聂小保等, 2012).
蠕虫本身对人类健康并无直接危害, 但由于其颜色鲜明, 肉眼可见, 易引起水质恐慌, 且可能携带细菌、病毒等病原体引起供水水质微生物安全风险(Wolmarans et al., 2005).因此, 水厂必须采取相关措施对蠕虫污染风险进行高效控制.其中, 氧化剂灭活由于成本低、操作简单、灭活效率高等突出优势, 使其成为目前水厂控制蠕虫风险的主流技术手段.
国内外在蠕虫的氧化剂灭活方面, 已经开展过大量研究工作.陈旭等(2010)研究了NaClO对颤蚓幼虫、成虫及卵茧的灭活, 发现NaClO对幼虫杀死作用明显, 成虫其次, 但无法在120 min内对蚓茧造成损伤.周文琪等(2010)研究表明H2O2100%灭活绕线虫所需CT值(氧化剂浓度和接触时间的乘积)高达6000 mg·min·L-1.Driedger等(2000)研究认为O3对蠕虫的灭活效果明显, 但其在水中易分解, 灭活时间有限且当水中存在溴化物时易产生溴酸盐等副产物.
ClO2是世界卫生组织向全球推荐使用的安全高效消毒剂, 其氧化能力强, 消毒效果稳定, 适应pH值范围较广, 可望成为灭活蠕虫的理想氧化剂(冉治霖等, 2011).孙兴滨等(2009)研究表明, 当ClO2浓度为1.5 mg·L-1时, 接触30 min即可对1龄摇蚊幼虫100%灭活.相关学者(黄廷林等, 2011)还对ClO2灭活蠕虫的作用机制进行了研究, 如黄廷林等通过考察灭活前后蠕虫各种酶活性的变化, 认为ClO2对颤蚓成虫灭活显著.目前, 国内外关于ClO2对蠕虫灭活动力学的研究较少, 也鲜见常规水质指标如pH、浊度、CODMn等对ClO2灭活效果影响的研究报道.
本研究以颤蚓为目标蠕虫, 开展了ClO2对蠕虫的灭活研究, 旨在获得ClO2对蠕虫的氧化灭活反应动力学及pH值、浊度和CODMn等因素对灭活效果的影响.此外, 通过分析颤蚓体内蛋白质和SOD(超氧化物歧化酶)活性变化, 进行了ClO2灭活机理的初步探讨.研究成果可为供水系统蠕虫污染风险的高效控制提供直接理论依据和技术支持.
2 材料与方法(Materials and methods) 2.1 材料试验所用颤蚓采自湖南省岳阳市洞庭湖区, 经标准方法放大培养后供试验所需(Mosleh et al., 2007).颤蚓的成长分蚓茧、幼虫和成虫3个阶段, 刚孵化幼虫长度2 mm左右, 当颤蚓开始出现淡白色环带, 标志进入成虫阶段.每次试验前, 从培养器中取出部分颤蚓成虫, 超纯水清洗干净, 然后用包裹硅胶的塑料镊子挑选体长较为接近的颤蚓直至所需数量.颤蚓死亡判断标准是(黄廷林等, 2006):用玻璃棒轻压其尾部3次, 不做“8”字运动.
二氧化氯由亚氯酸钠和硫酸反应, 经亚氯酸钠吸收得纯二氧化氯, 溶液用棕色瓶储存在黑暗处, 使用前用DPD方法测定(APHA, 2005), 二氧化氯投加量按有效氯计算.
试验过程中, 不同浊度通过将浊度贮备液加入二氧化氯贮备液混合获得; 浊度贮备液制取的方法:准确称取10 g高岭土[Al4Si4O10·(OH)8]于较大容器中, 加入500 mL超纯水, 置于磁力搅拌器上以1500 r·min-1的转速搅拌3 h, 然后加入1 L超纯水对悬浮液进行稀释, 静置一晚取上层清液800 mL作为浊度贮备液.CODMn标准液通过腐殖酸配制而成并根据需要投加.体系pH值采用磷酸盐缓冲溶液(0.1 mol·L-1 PBS)进行调节; 灭活温度由恒温培养箱进行控制; 蛋白含量和SOD活性测定试剂盒购自南京建成生物工程研究所.试验中各溶液均用超纯水配置.试验前浊度、pH值、CODMn和ClO2投加量按需要控制.
2.2 试验方法灭活实验在10.5 cm培养皿中完成, 每个培养皿中颤蚓的投放数量N0为100条, 投放颤蚓的长度约10 mm左右, 投放完毕后分别在每个培养皿中加入提前配制的ClO2溶液, 于设定条件下进行灭活试验, 每隔5 min计数存活颤蚓的数量N, 计算颤蚓存活率N/N0, 直至颤蚓全部死亡.各因素试验条件如表 1所示.
| 表 1 各因素试验条件 Table 1 Experiment conditions of various factors |
蛋白的测定用考马斯亮蓝法, SOD活性的测定采用羟胺法.均浆操作的方法为:准确称取待测组织的湿重, 按重量(g):体积(mL)=1:9的比例加入9倍体积的0.86%生理盐水, 冰水浴超声波细胞粉碎成均浆, 均浆液2500 r·min-1离心机离心10 min, 取上清液用生理盐水按1:9稀释成1%组织均浆.按说明书步骤操作加入反应试剂后, 混匀后静止10 min, 用1 cm比色皿在波长595 nm的可见光分光光度计下进行检测.
SOD活性定义:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U·mg-1 prot).
2.3 数据分析用Origin 9.0软件对灭活反应动力学试验数据进行线性拟合和分析; 除灭活动力学试验外, 其余试验均重复3次取平均值, 计算标准差, 并用SPSS 19.0进行t检验分析.
3 结果与分析(Results and analysis) 3.1 ClO2对颤蚓的灭活动力学 3.1.1 CT值的影响图 1给出了温度为(13±0.5) ℃时, ClO2浓度与灭活接触时间对颤蚓灭活效果的影响.不同浓度的ClO2溶液灭活时, 颤蚓存活率的对数值与CT值间的线性拟合结果见图 2a.
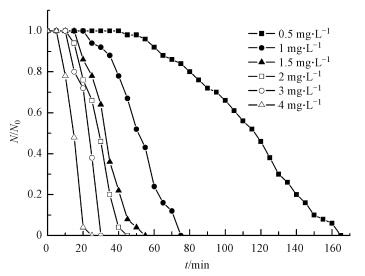 |
| 图 1 浓度与接触时间对二氧化氯灭活颤蚓的影响 Fig. 1 Effect of disinfectant concentration and reaction time on the inactivation of T. tubifex by chlorine dioxide |
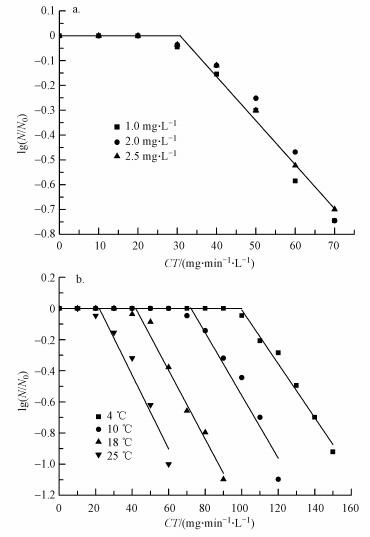 |
| 图 2 CT值(a)和温度(b)对二氧化氯灭活颤蚓动力学的影响 Fig. 2 Effect of CT value (a) and temperature (b) on the inactivation kinetics of T. tubifex by chlorine dioxide |
由图 1可知, ClO2对颤蚓的灭活效果随着ClO2浓度的升高和灭活接触时间的延长而增加; 实验条件下, 当ClO2浓度超过2 mg·L-1后, 45 min以内的灭活接触时间即可实现对颤蚓的100%灭活.需要指出的是, 本研究中试验颤蚓的选择以体长为标准, 并未区分所处生长阶段, 这主要是因为试验所需颤蚓数量较大, 而成虫环带的肉眼识别不易.陈旭等(2010)研究表明, 颤蚓成虫对消毒剂的耐受性要强于幼虫.
尽管ClO2浓度不同, 但相同CT值下颤蚓的存活率非常接近(图 2), 说明CT值可以较好地评价ClO2对颤蚓的灭活效果.图 2a的数据拟合结果表明, ClO2对颤蚓的灭活符合伪一级延迟Chick-Watson模型(R2=0.971), 见式(1).
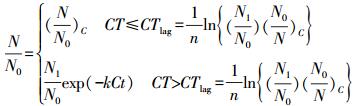
|
(1) |
式中,k为“延滞期”后的反应速率常数; N1/N0为伪一级方程直线延长线与Y轴的截距; (N/N0)c为初始存活率; Ctlag为“延滞期”CT值.
CT值是评价消毒剂对病原微生物消毒效果的重要指标.相关研究者的研究表明, CT值同样可以用来评价氧化剂对水生生物的灭活效果.如许晨等(2015)以CT值作为评判指标, 用于评价氧化剂对藻类抑制的效果, 发现氧化剂对铜绿微囊藻的灭活效果与CT值直接相关.本研究则证实CT值同样可以用于评价氧化剂对蠕虫类水生动物的灭活效率.从图 2a还可以看出, ClO2灭活颤蚓的CTlag值为30 mg·min·L-1左右, Pereira等(2008)和Corona Vasquez等(2002)在对ClO2等氧化剂氧化灭活贾第鞭毛虫和隐孢子虫的研究中也得到类似的“延滞期”.蠕虫氧化灭活过程中CTlag的存在可能与蠕虫表皮层的保护作用有关, 氧化剂需要一定的时间渗透蠕虫表皮层, 进而对蠕虫形成快速灭活效果.因此如何缩短ClO2灭活颤蚓过程中的CTlag, 将是提高其灭活效率的关键因素之一.
3.1.2 温度对灭活动力学过程的影响图 2b给出了ClO2浓度为2 mg·L-1时, 不同温度下颤蚓的灭活动力学过程.各温度下的反应动力学方程、反应速率和拟合相关系数如表 2所示.
| 表 2 各温度下二氧化氯灭活颤蚓拟合结果 Table 2 Fitting results of T. Tubifex inactivation under different temperatures by chlorine dioxide |
图 2b表明, 随着温度的升高, 颤蚓灭活“延滞期”不断缩短; 表 2则表明, 温度的提高有助于提升灭活阶段的灭活速率, 反应速率可由4 ℃时的0.01731增加到25 ℃的0.02373.由于表皮层的保护, 颤蚓灭活反应速率对温度变化的敏感性相比于单细胞病原体较弱.Hsu等(2003)发现当温度低于20 ℃时, 每升高10 ℃, 细菌灭活率成倍增加, 而本研究温度由4 ℃提高至25 ℃时, 颤蚓灭活反应速率仅提高1.37倍.究其原因:颤蚓作为底栖类后生动物, 在氧化灭活过程中由于表皮层的保护作用, 氧化剂对其灭活作用方式可能与细菌、病毒等微生物有所不同.
首先二氧化氯破坏颤蚓表皮层结构并由体表向体内渗透, 在此阶段温度的升高将促进ClO2的渗透速率, 因此, CTlag随着温度的提高而降低(图 2b); 此后, 进入体内的ClO2依靠其氧化能力破坏蠕虫内部组织细胞结构, 进而达到灭活目的, 在此阶段灭活反应速率也会随着温度的增加而提升(表 2).因此, 在整个灭活过程中温度升高不但加快了ClO2的渗透速率, 而且增加了其渗透体内后的灭活反应速率.
3.2 水质条件对ClO2灭活效果的影响 3.2.1 pH值的影响温度为(14±0.5) ℃, ClO2浓度为2 mg·L-1时, pH值对颤蚓灭活效果的影响见图 3a.
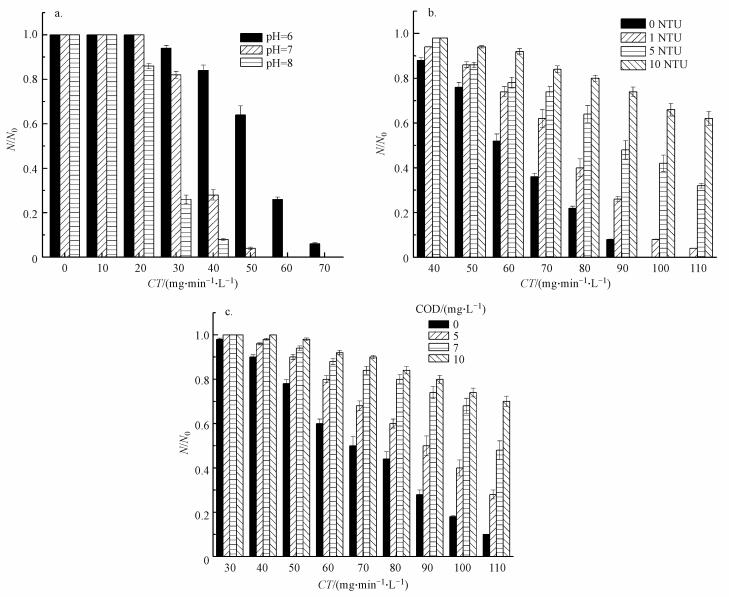 |
| 图 3 pH(a)、浊度(b)和CODMn(c)对二氧化氯灭活颤蚓的影响 Fig. 3 Effect of pH (a), turbidity (b) and CODMn (c) concentration on the inactivation of T. tubifex by chlorine dioxide |
由图 3a可知, 在pH为6~8时, ClO2对颤蚓的灭活效果将随着pH值的增加而提升.数据分析结果表明, 当CT值大于30 mg·min·L-1时, pH值对颤蚓灭活效果的影响极其显著(p<0.01).
相关研究者的研究结果也证实, pH值的增加有助于改善ClO2的消毒效果.Ruffell等(2000)研究了ClO2对隐孢子虫的灭活, 发现当pH值为6~8时其灭活速率较为接近, 但当pH值为10时灭活速率明显提高.ClO2分子结构外层存在一个未成对电子, 在灭活颤蚓时, ClO2与颤蚓表皮有机质发生非均相反应, 该电子可转移至有机质的含氧官能团, 进而生成包含·OH在内的一系列含氧自由基(Ueno et al., 2000).高pH条件下, 氢氧根被证实能对上述非均相反应过程起到催化作用(Kristen et al., 2000).李荣光等(2013)研究了pH值对二氧化氯氧化灭活粪肠球菌的影响, 认为二氧化氯通过单质分子作用对细菌起到灭活效果, 高pH值条件下可能产生氢氧根离子, 从而起到催化作用, 因此,在pH值为6~9时, 随着pH值的增大, 灭活速率逐渐增大.
3.2.2 浊度的影响图 3b为温度为(19±0.5) ℃, ClO2浓度2 mg·L-1时, 浊度对颤蚓灭活效果的影响.从图 3b可发现, 灭活率随着体系浊度的增加而降低, 说明浊度物质有助于颤蚓抵御消毒剂的毒害作用.
数据分析结果表明, 当CT值大于50 mg·min·L-1时, 体系中有无浊度对颤蚓灭活效果影响显著(p<0.05), 当CT大于70 mg·min·L-1时, 浊度大小对颤蚓灭活率的影响极其显著(p < 0.01).分析认为:浊度对灭活效果的影响可能与ClO2从液相向蠕虫表皮层的传质过程有关.蠕虫表皮层会粘附大量的浊度物质, 粘附的浊度物质将延滞ClO2由液相主体向颤蚓表皮层的传质过程, 进而降低ClO2由表皮层向体内的渗透通量, 降低了氧化灭活效率.
由于降低体系浊度有助于颤蚓灭活效果的提升, 因此, 当采用ClO2对自来水厂颤蚓污染风险进行控制时, ClO2投加点宜选择在过滤工艺之后, 以最大程度削减浊度物质对灭活效果的影响, 降低ClO2投加量.
3.2.3 CODMn的影响在温度为(16±0.5) ℃, ClO2浓度2 mg·L-1条件下, CODMn对灭活效果的影响如图 3c所示.由图 3c可知, ClO2对颤蚓的灭活率随着CODMn增加而降低.
数据分析结果表明, 当CT值大于40 mg·min·L-1时, 体系中有无有机物或还原性物质对颤蚓灭活效果影响显著(p<0.05), 当CT大于60 mg·min·L-1时, CODMn对颤蚓灭活率的影响极其显著(p < 0.01).分析认为因为水中有机物或者还原物质与部分ClO2反应, 使得最终渗透入颤蚓体内起氧化灭活作用的ClO2溶液减少, 浓度降低, 导致灭活效果较差.
相关学者的研究结果也印证了此结论, 孙兴滨等(2009)研究了有机物含量对ClO2灭活摇蚊幼虫的影响, 认为ClO2对1龄摇蚊幼虫的灭活率随着有机物含量的增加而降低.赵志伟等(2007)研究发现ClO2对剑水蚤的灭活率随着有机物含量的增加而降低的原因同样是水中有机物的存在会消耗部分ClO2, 使得作用于剑水蚤上实际浓度减小.
3.3 ClO2灭活颤蚓的机理研究 3.3.1 蛋白浓度的变化情况利用考马斯亮蓝法检测ClO2灭活颤蚓前后蛋白浓度的变化.图 4给出了在室温条件下(18±0.5) ℃, ClO2浓度2 mg·L-1时, ClO2对颤蚓蛋白浓度的影响, 其中CT值为0时为对照组.
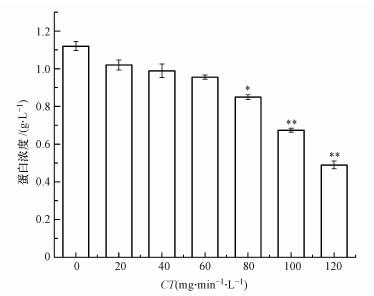 |
| 图 4 灭活过程中颤蚓蛋白质浓度的变化(注:*与对照组比较p<0.05; **与对照组比较p<0.01) Fig. 4 Changes of T. tubifex protein concentration during the inactivation process |
由图 4可见, ClO2在CT值小于60 mg·min·L-1时即氧化初期, 与对照组相比蛋白质浓度变化不显著(p>0.05);当CT值达到80 mg·min·L-1以上时, 其蛋白浓度和对照组相比差异显著(p<0.05), 其中当CT大于100 mg·min·L-1时差异极其显著(p<0.01).说明在ClO2由体表向体内渗透过程中, 由于表皮层的存在使氧化初期蛋白质浓度变化不显著; 当ClO2达到一定CT值时, 表皮层被破坏导致蛋白外泄, ClO2进入细胞, 氧化细胞结构, 导致蛋白浓度显著降低.这一结论印证了前文关于ClO2灭活颤蚓过程中“延滞期”的出现与表皮层保护作用有关的结论.孙兴滨等(2013)研究了ClO2对摇蚊幼虫表皮肌肉细胞超微结构的影响, 发现被ClO2灭活后的摇蚊幼虫真皮细胞层被破坏, 板层结构消失, 表皮层和内表皮层相分离.
3.3.2 SOD活性的变化情况ClO2会引起颤蚓体内SOD活性的改变, 如图 5所示,当CT值小于100 mg·min·L-1时, SOD活性显著增加, 其中CT值为20、60和80 mg·min·L-1时,为极显著增加(p<0.01). CT值超过80 mg·min·L-1后, SOD活性随CT值的增加而降低.
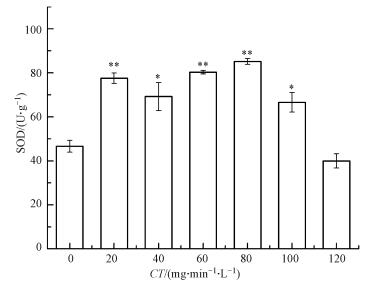 |
| 图 5 灭活过程中颤蚓SOD活性的变化(注:*与对照组比较p<0.05;**与对照组比较p<0.01) Fig. 5 Changes of T. tubifex SOD activity during the inactivation process |
SOD抗氧化酶在生物体内较为常见, 是抗氧化系统不可或缺的重要组成部分, 在维持机体氧化和抗氧化平衡方面尤为重要(林洁, 1994).研究表明(Pinchuk et al., 1998; Melidoua et al., 2005; 林洁, 1994)当生物体组织细胞受到外界氧化剂胁迫时, 体内活性氧自由基(如·OH、O2-)的增加会打破自由基平衡状态, 从而激发抗氧化酶, 导致酶活性增加, 以清除细胞内自由基达到保护细胞的作用.本研究中SOD活性随CT值的增加先升高后降低, 说明ClO2在颤蚓灭活过程中, 具有含氧自由基诱导效应, 进而颤蚓自身抗氧化酶系统被激发, 通过提升SOD活性以清除含氧自由基; 但随着CT值不断增加, 抗氧化系统被破坏, SOD活性开始降低, 直至最后颤蚓被灭活.
4 结论(Conclusions)1) ClO2对颤蚓的灭活效果随着ClO2浓度的升高和灭活接触时间的延长而增加; 试验条件下, 当ClO2浓度超过2 mg·L-1后, 45 min以内的灭活接触时间即可实现对颤蚓的100%灭活.
2) CT值可以较好地用于评价ClO2对颤蚓的灭活效果; 蠕虫氧化灭活过程中CTlag的存在可能与蠕虫表皮层的保护作用有关.ClO2对颤蚓的灭活过程符合伪一级延迟Chick-Watson模型; 温度的升高使颤蚓灭活“延滞期”不断缩短, 且有助于提升灭活阶段的灭活反应速率, 可由4 ℃时的0.01731增加到25 ℃的0.02373.
3) 体系pH的增加有助于提高ClO2灭活效率且当CT值大于30 mg·min·L-1时, pH值对颤蚓灭活效果的影响极其显著(p<0.01);浊度和有机物浓度的增加会导致灭活效率显著降低.
4) 当CT值超过80 mg·min·L-1后, ClO2将导致体系蛋白浓度显著降低.颤蚓灭活过程中“延滞期”的出现和蛋白试验综合表明, 颤蚓表皮层的存在有助于提高其对ClO2的耐受性; 颤蚓体内SOD活性随着CT值的增加先升高后降低, 说明ClO2灭活颤蚓的主要作用机理之一是含氧自由基的诱导效应.
APHA. 2005. Standard Methods for the Examination of Water and Wastewater, 21st ed[S]. Washington, D C:American Public Health Association(APHA)/American Water Works Association(AWWA)/Water Environment Federation(WEF)
|
Alexander M K, Merritt R W, Berg M B. 1997. New strategies for the control of the parthenogenetic chironomid (Paretanytrrsus grimmii)(Diptera:Chironomidae) infecting water systems[J]. Jounal of the American Mosquito Control Association, 13(2): 189–192.
|
Bay E C. 1993. Chironomid(Diptera:chironomidae) larval occurence and transport in a municipal water system[J]. Jounal of the American Mosquito Control Association, 9: 275–284.
|
Corona Vasquez B, Samuelson A, Rennecker J L, et al. 2002. Inactivation of Cryptosporidium parvum oocysts with ozone and free chlorine[J]. Water Research, 36: 4053–4063.
DOI:10.1016/S0043-1354(02)00092-1
|
陈旭, 高文宝, 朱琳. 2010. 消毒剂对饮用水中"红虫"幼虫及虫卵的灭活研究[J]. 中国给水排水, 2010, 26(17): 95–97.
|
Driedger A M, Rennecker J L, Mariñas B J, et al. 2000. Sequential inactivation of Cryptosporidium parvum oocysts with ozone and free chlorine[J]. Water Research, 34(14): 3591–3594.
DOI:10.1016/S0043-1354(00)00097-X
|
Hsu B M, Yeh H H. 2003. Removal of Giardia and Cryptosporidium in drinking water Treatment:a pilot-scale study[J]. Water Research, 37(5): 1111–1117.
DOI:10.1016/S0043-1354(02)00466-9
|
黄廷林, 武海霞, 陈千娇. 2006. 水中颤蚓灭活试验研究[J]. 西安建筑科技大学学报(自然科学版), 2006, 38(2): 263–268.
|
黄廷林, 李晓钰, 聂小保, 等. 2011. 二氧化氯对颤蚓灭活效果及灭活作用机制[J]. 环境工程学报, 2011, 5(11): 2513–2518.
|
何文杰. 2006. 安全饮用水保障技术[M]. 北京: 中国建筑工业出版社: 726–727.
|
林洁. 1994. 生物体内的活性氧清除系统——抗氧化酶[J]. 日本医学介绍, 1994, 15(7): 293–294.
|
李荣光, 何杰, 黄廷林, 等. 2013. 粪肠球菌的二氧化氯消毒试验[J]. 净水技术, 2013, 32(4): 86–89.
|
李仁熙. 2001. 正颤蚓的生长发育及繁殖生物学的研究[J]. 水生生物学报, 2001, 25(1): 14–20.
|
Melidou M, Riganakos K, Galaris D. 2005. Protection against nuclear DNA damage offered by flavonoids in cells exposed to hydrogen peroxide:The role of iron chelation[J]. Free Radical Biology and Medicine, 39(12): 1591–1600.
DOI:10.1016/j.freeradbiomed.2005.08.009
|
Mosleh Y Y, Paris Palacios S, Ahmed M T, et al. 2007. Effects of chitosan on oxidative stress and metallothioneins in aquatic worm Tubifex tubifex (Oligochaeta, Tubificidae)[J]. Chemosphere, 67(1): 167–175.
DOI:10.1016/j.chemosphere.2006.09.019
|
Mosleh Y Y, Paris Palacios S, Biagianti Risbourg S. 2006. Metallothioneins induction and antioxidative response in aquatic worms Tubifex tubifex (Oligochaeta, Tubificidae) exposed to copper[J]. Chemosphere, 64(1): 121–128.
DOI:10.1016/j.chemosphere.2005.10.045
|
聂小保, 黄廷林, 张金松, 等. 2012. 化学氧化和砂滤对净水工艺中颤蚓污染的协同控制[J]. 中国环境科学, 2012, 32(2): 274–278.
|
Pereira J T, Costa A O, Schushard W, et al. 2008. Comparing the efficacy of chlorine, chlorine dioxide, and ozone in the inactivation of cryptosporidium parvum in water from Parana State, Southern Brazil[J]. Applied Biochemistry and Biotechnology, 151(2): 464–473.
|
Pinchuk I, Schnitzer E, Lichtenberg D. 1998. Kinetic analysis of copper-induced peroxidation of LDL[J]. Biochimica Et Biophysica Acta, 1389(2): 155–172.
DOI:10.1016/S0005-2760(97)00139-2
|
Ruffell K M, Rennecker J L, Mariñas B J. 2000. Inactivation of cryptosporidium oocysts with chlorine dioxide[J]. Water Research, 34(3): 868–876.
DOI:10.1016/S0043-1354(99)00187-6
|
冉治霖, 李绍峰, 朱静, 等. 2011. 二氧化氯灭活水中隐孢子虫的影响因素及机理研究[J]. 中国环境科学, 2011, 31(6): 904–909.
|
孙兴滨, 王树涛, 崔福义. 2009. 二氧化氯对水源水中摇蚊幼虫灭活效果的研究[J]. 中国环境科学, 2009, 29(6): 617–612.
|
孙兴滨, 孙雷, 卢颖, 等. 2013. 二氧化氯对摇蚊幼虫表皮和肌肉细胞超微结构的影响[J]. 环境科学与管理, 2013, 38(3): 51–54.
|
Ueno H, Sayato Y, Nakamuro K. 2000. Hematological effects of chlorine dioxide on in vitro exposure in mouse, rat and human blood and on subchronic exposure in mice[J]. Journal of Health Science, 46(2): 110–116.
DOI:10.1248/jhs.46.110
|
Wolmarans E, Du P H, de Wet C M, et al. 2005. Significance of bacteria associated with invertebrates in drinking water distribution networks[J]. Water Science & Technology, 52(8): 171–175.
|
许晨, 李伟英, 王峰, 等. 2015. 氧化剂投加量与作用时间(CT值)对藻类抑制效果及机理分析[J]. 净水技术, 2015, 34(4): 60–64.
|
周文琪, 张明德, 李宁. 2010. 过氧化氢对绕线虫的灭活效果和动力学[J]. 水处理技术, 2010, 36(11): 19–21.
|
赵志伟, 崔福义, 林涛, 等. 2007. 二氧化氯对剑水蚤类浮游动物的灭活与去除[J]. 环境科学, 2007, 28(8): 1759–1762.
|
 2017, Vol. 37
2017, Vol. 37


