2. 厦门大学环境与生态学院海洋生物资源开发利用协同创新中心, 厦门 361102
2. Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, College of Environment and Ecology, Xiamen University, Xiamen 361102
LIU Kaiying, E-mail:kylin@cas.dicp.ac.cn
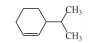
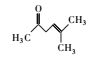
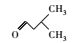
土臭素(Geosmin, GSM)是一种由蓝绿藻及放线菌分泌的次级代谢产物, 具有令人厌恶的土霉味, 它在河流、湖泊、水库等地表水中普遍存在(于建伟等, 2011; Dzialowski et al., 2009; Wee et al., 2015).由GSM引起的嗅味污染多发于夏季富营养化严重的水体中, 特别是在蓝绿藻水华爆发时(雷振等, 2017; Sugiura et al., 2000; Su et al., 2015; 赵艳梅等, 2007). Dzialowski等(2009)研究数据表明2006—2007年期间美国卡萨斯州五大饮用水库区GSM浓度均在20~50 ng·L-1之间. Zamyadi等(2015)对澳大利亚南部供水水厂2011—2012年期间GSM污染严重时可以达到100~120 ng·L-1. 胡嘉东等(2009)对我国南方某城市河流嗅味物质调查表明, 在厌氧环境中水体中GSM平均值为269.8 ng·L-1.同时GSM嗅阈值极低, 纯水中人类嗅阈值低于10 ng·L-1 (Ding et al., 2014; Ma et al., 2011); 加之传统水处理工艺如氯气预氧化-絮凝-沉淀-沙滤-加氯消毒和常规氧化剂如KMnO4、Cl2、ClO2等均不能有效去除GSM (Liang et al., 2016; Yuan et al., 2013), 由它导致的水源水污染为饮用水及其相关行业带来了严重问题, 引起了人们广泛关注(Asghar et al., 2015).
近几年来, 对水中GSM的去除研究主要集中在高级氧化技术(Advanced oxidation processes, AOPs)上.研究表明AOPs如O3、H2O2/UV、O3/H2O2、TiO2/UV等对GSM均有一定的去除效果(Antonopoulou et al., 2014; Meunier et al., 2006; Fotiou et al., 2015).它们的共同之处就是能够生成氧化能力更强的氧活性成分·OH, ·OH氧化还原电位为2.8 V, 是一种氧化性仅次于氟的强氧化剂.它与有机污染物反应速率常数为108~109 L·mol-1·s-1, 可以快速的降解这类有机污染物(Antonopoulou et al., 2014).
Mizuno等(2011)利用O3/H2O2对水中嗅味物质2-MIB和GSM进行氧化降解, 研究表明在O3体系中加入H2O2可以提高对嗅味物质的去除效率. Peter等(2007)报道了采用O3对天然水体中嗅味物质如2-MIB、GSM及其它的致嗅有机物进行去除的研究, 结果表明实验产生的·OH对嗅味物质的去除起主要作用, ·OH与2-MIB和GSM的反应速率常数分别为5.09×109和7.80×109 L·mol-1·s-1. Jo等(2001)研究表明当H2O2剂量6.0 mg·L-1, UV辐射剂量1200 mJ·cm-2时, 对100~200 ng·L-1 GSM去除率为90%.目前大多数研究仍集中在高级氧化剂对嗅味物质的氧化降解效果, 时间及氧化降解速度上, 对GSM氧化降解机制及生成中间产物的分析研究较少, 且未见基于大气压强电场电离放电结合水力射流空化高效制备·OH去除水中嗅味物质GSM的报道.
本文采用大气压强电场电离放电结合水力射流空化的方式制备·OH, 对水中GSM进行氧化降解.研究了氧化剂投加剂量、接触时间因素的影响, 并根据气相色谱-质谱(GC-MS)全扫描获取的中间产物探讨了·OH氧化降解GSM的机制.
2 材料和方法(Materials and methods) 2.1 主要试剂与仪器Geosmin (GSM, ≥99.0%, Wako日本), 叔丁醇(TBA, ≥99.5%, Sigma美国), 超纯水(18.2 MΩ·cm, Milli-Q纯水系统, Millipore法国), NaCl (北京化学试剂公司, 优级纯), 使用前450 ℃烘烤4 h, 其它试剂均为国产分析纯.气相色谱-质谱联用仪(GC 7890A-MSD 5975C, 美国Agilent公司), 大气压强电场电离放电羟基自由基生成设备(大连海事大学自主研制), 顶空固相微萃取装置(HP-SPME, 美国Supelco公司).
2.2 土臭素氧化降解实验图 1为羟基自由基氧化降解水中嗅味物质GSM的实验系统示意图, 该系统主要采用大气压强电场电离放电结合水力射流空化方式制备·OH, 并对水中一定浓度的GSM进行氧化降解.简单地说, 绿色自然物质O2经减压阀调节流量后输入等离子体源中, 与窄间隙、强电场中的高能、高密度电子发生非弹性碰撞, O2受电子激励后发生电离、分解、重组形成O2+、O(1D)、O、O2(a1Δg)、O2-、O3等高浓度氧活性粒子(Bai et al., 2012).这些气相中的氧活性粒子由检测器在线实时显示浓度后, 经流量计注入到射流器中, 在水力射流空化作用下, 氧活性粒子与水分子发生等离子体化学反应生成·OH、HO2-、O2·-、O3·-、HO3·、H2O2等氧活性粒子溶液, 水中氧活性粒子的总浓度表示为总氧化剂(Total reactive oxidants, TRO) (Bai et al., 2016), 其浓度值由气体放电总功率和氧气流量调节控制.水泵将含有不同浓度的嗅味物质GSM水样经流量计输入射流器, 与生成的氧活性粒子溶液进行混匀, 同时发生氧化降解反应.管路中接触反应时间为6 s, 图中1~6取样口的反应时间间隔为1 s.
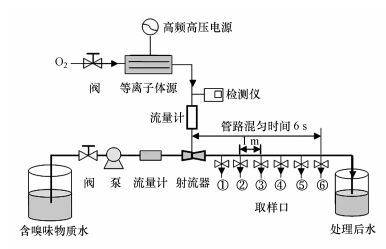 |
| 图 1 羟基自由基氧化降解水中GSM系统示意图 Fig. 1 Schematic diagram of GSM degradation in water by hydroxyl radicals |
使用图 1所示实验系统对纯水配制的不同浓度GSM水样进行氧化降解处理.为了验证·OH为氧化降解GSM的主要活性组分, 实验对照组中加入不同浓度TBA作为·OH淬灭剂.实验取样体积均为40 mL, 在取样瓶中预先装入0.1 mL浓度为0.1 mol·L-1的Na2S2O3终止反应, 每组实验重复3次.
2.3 分析方法对于水中的氧活性粒子浓度, 用总氧化剂(Total reactive oxidants, TRO)表示, 测量方法为KI-4-氨基-N, N-二乙基苯胺分光光度法(EPA 330.5, 1978; Tian et al., 2015).
对于水中溶解的土臭素浓度, 采用顶空固相微萃取结合GC-MS测定分析.首先准确移取20.0 mL水样于预先称取装有6 g NaCl的40 mL顶空瓶中, 60 ℃, 用顶空固相微萃取吸附60 min, 然后把萃取头插入GC进样口250 ℃解析3 min.色谱条件如下:不分流进样模式, 毛细管柱(HP-5MS; 30 m×0.25 mm×0.25 μm):升温条件: 40 ℃(保持2 min)——140 ℃(4 ℃·min-1)——280 ℃(10 ℃·min-1)保持5 min. MS四级杆温度150 ℃、离子源温度230 ℃.定性分析:质谱全扫描m/z: 30~500, GSM特征离子112、125、182.定量分析:选择性离子扫描GSM选择性特征离子m/z: 112.分析方法对GSM测定线性范围为1~500 ng·L-1 (成建国等, 2015).
3 结果与讨论(Results and discussion) 3.1 氧化剂剂量对GSM去除的影响利用图 1所示羟基自由基水处理系统, 处理初始浓度分别为100、300、500 ng·L-1的GSM水样, 通过调节进气量改变TRO投加浓度范围: 0.3~2.6 mg·L-1, 从系统末端取样管路接触反应时间6 s, 然后放置180 s后用0.1 mol·L-1的Na2S2O3终止反应, 用GC-MS进行分析.不同浓度TRO对GSM的氧化降解结果如图 2所示, 随着氧化剂浓度的增加, 对GSM的氧化降解效果也逐渐增加.当GSM初始浓度为100 ng·L-1时, 投加0.8 mg·L-1的TRO处理可以降解到10 ng·L-1以下; 把300 ng·L-1的GSM降解到10 ng·L-1以下需要投加TRO剂量为1.8 mg·L-1; 去除500 ng·L-1的GSM, 投加TRO为1.8 mg·L-1处理后GSM残余浓度为121 ng·L-1, 当TRO浓度提高到2.6 mg·L-1时, 处理后GSM残余为4 ng·L-1, 去除率大于99%.不同初始浓度GSM通过调节TRO投加剂量处理后GSM残余量均可降解到10 ng·L-1以下, 低于人类嗅阈值.可见GSM初始浓度与氧化剂TRO投加剂量关系密切, 水样中GSM含量越高需要投加的TRO剂量也越大.分析原因为, 经强电场电离放电结合水力空化后溶解在水中的TRO中包括·OH、HO2-、O2·-、O3·-、HO3·、H2O2等多种氧化剂组分, 根据Peter等(2007)的研究结果, 对GSM进行氧化降解的主要氧化粒子为·OH.
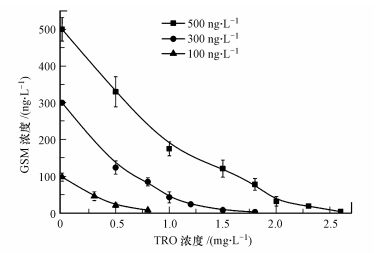 |
| 图 2 TRO浓度对GSM氧化降解的影响 Fig. 2 Influence of TRO concentrations on GSM degradation |
利用图 1羟基自由基水处理系统, 在TRO阈值浓度下对含不同浓度的GSM水样进行处理.然后分别从管路设置的1~6个取样口取样, 并在40 mL取样瓶中预装0.1 mL浓度为0.1 mol·L-1 Na2S2O3用于终止反应. 1~6取样点接触反应时间间隔1 s, 反应时间大于6 s从第6取样点取样放置不同时间用Na2S2O3终止反应, 然后利用GC-MS测定水中GSM含量.实验结果如图 3所示:当GSM浓度为100 ng·L-1投加TRO浓度0.8 mg·L-1时, 6 s内氧化降解率为94%, 经过6 s管路反应就可以降解到10 ng·L-1以下; 当GSM浓度为300 ng·L-1, 投加TRO浓度为1.8 mg·L-1, 6 s内GSM氧化降解率为97%, 延长反应时间到180 s时GSM残余为2 ng·L-1; 当GSM浓度为500 ng·L-1时, 投加2.6 mg·L-1的TRO, 管路中接触反应6 s, GSM从526 ng·L-1降解到26 ng·L-1, 氧化降解率为95%, 延长反应时间到180 s, GSM残余低于1 ng·L-1.
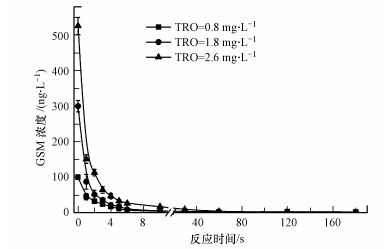 |
| 图 3 接触反应时间对GSM的氧化降解的影响 Fig. 3 Influence of contact reaction time on GSM degradation |
综上研究表明, 在TRO阈值浓度下, 经过6 s的管路混匀反应过程, 对GSM的氧化降解率均可以达到90%以上, 当延长接触反应时间到180 s时, 实验范围内不同浓度的GSM经过氧化降解后均可以降低到10 ng·L-1以下.分析原因为, 经过强电场电离放电形成的氧活性粒子中O2+、O2-可以与H2O直接反应生成·OH, 同时H2O2作为引发剂也大大促进了O3生成·OH (Bai et al., 2016), 而·OH为一种强氧化剂, 与GSM的反应速率常数高达109 L·mol-1·s-1, 所以在TRO阈值浓度下, 生成的·OH可以快速的氧化降解GSM.
3.3 羟基自由基氧化降解GSM的验证TBA是一种有效的·OH淬灭剂, 它与·OH反应速率常数为4.0×108 L·mol-1·s-1, (Guan et al., 2011; Yang et al., 2015).本实验通过在GSM水样中加入0.1 mmol·L-1和4.0 mmol·L-1 TBA, 淬灭反应过程产生的·OH, 验证降解GSM的主要物质为·OH.实验结果如图 4所示, 加入TBA淬灭·OH后, 对GSM的氧化降解效果明显降低.当TRO投加剂量为2.6 mg·L-1, 不加TBA时, 管路中接触反应6 s, 可将初始浓度500 ng·L-1 GSM降解到26 ng·L-1, 反应180 s降解至2.0 ng·L-1, 对GSM氧化降解率为99%;当水样中加入的TBA浓度为0.1 mmol·L-1时, 管路反应6 s, GSM降解到236 ng·L-1, 氧化降解率降低至52.8%, 延长反应时间到180 s, GSM氧化降解率为56.5%;当TBA浓度为4.0 mmol·L-1时, 反应180 s对GSM氧化降解率降低至14.6%.
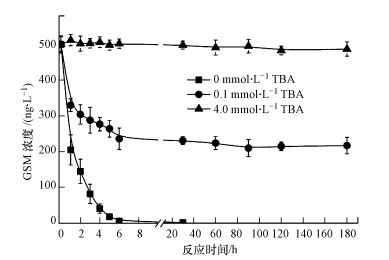 |
| 图 4 羟基自由基淬灭剂对降解GSM的影响(GSM初始浓度500 ng·L-1, TRO浓度2.6 mg·L-1) Fig. 4 Effects of hydroxyl radical quencher on GSM degradation(GSM=500 ng·L-1, TRO=2.6 mg·L-1) |
以上结果表明采用大气压强电场电离放电结合水力射流空化方式生成的总氧化剂TRO中, 对GSM起氧化降解作用的主要是·OH.水中溶解的O3、H2O2等分子形式的氧化剂, 不能直接对GSM进行氧化降解.这与Yang等(2015)研究O3/过硫酸盐高级氧化体系对有机污染硝基苯(NB)、阿特拉津(ATZ)氧化降解发现·OH对有机物氧化降解起主要作用的结果一致.
3.4 羟基自由基氧化降解GSM中间产物及其机制目前, 对GSM氧化降解过程中间产物的生成研究较少.本文采用强电离放电结合水力射流空化方式生成·OH氧化降解水中GSM, 研究初期发现GSM初始浓度500 ng·L-1, 氧化剂浓度为0.5~2.6 mg·L-1范围内, 反应180 s均未检测到中间产物.究其原因是·OH氧化GSM生成的中间产物比其自身更容易进一步降解, 导致中间产物被生成的·OH及其它氧活性粒子快速氧化降解为小分子化合物甚至矿化而难以检测到.
为了更好地探讨·OH氧化降解GSM的过程及机制, 根据前述实验结果, 在GSM水样中加入了0.1 mmol·L-1的TBA用于淬灭部分·OH, 阻止·OH进一步氧化降解GSM的中间产物, 实验选取TRO浓度2.6 mg·L-1, 对初始浓度为500 ng·L-1的GSM水样进行处理.氧化降解GSM生成的中间产物色谱图如图 5所示, 由图 5 Treated (2)所示, 未加TBA淬灭剂时, 水样经2.6 mg·L-1氧化剂处理后, 未检测到任何中间产物; 加入0.1 mmol·L-1的TBA淬灭部分·OH后检测得到8种中间产物, 如图 5 Treated (1)所示, 8种中间产物的质谱图与NIST11质谱数据库匹配结果如表 1所示, 其匹配度均大于80%.
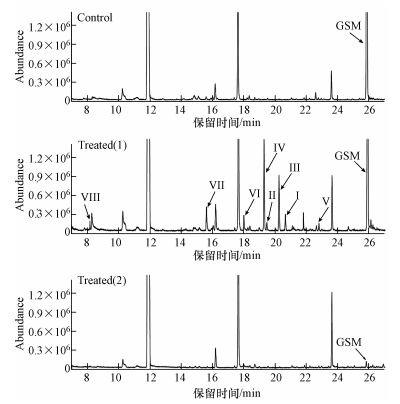 |
| 图 5 GSM氧化降解的中间产物色谱图 Fig. 5 Chromatograms of intermediates during GSM oxidation degradation process |
| 表 1 GSM氧化降解过程中间产物的鉴定 Table 1 Intermediates identification in the degradation of GSM |
由表 1可知, 氧化降解GSM过程中检测捕捉到8种中间产物, 包括1个双环化合物、4个单环化合物和3个开环单链化合物, 初步分析·OH氧化降解GSM的过程为:首先, ·OH对GSM侧链—OH及其相邻的—CH3进行氧化脱氢脱甲基转移自由电子到GSM分子上, 破坏GSM稳定的化学结构, 生成带环内双键的一级氧化降解产物Ⅰ; 其次, ·OH与Ⅰ发生加成反应, 断裂环内C—C单键, 破坏双环结构, 生加成反应, 断裂环内C—C单键, 破坏双环结构, 生成检测到的单环二级氧化降解产物, 如Ⅱ、Ⅲ、Ⅳ、Ⅴ; 再次, ·OH与单环产物继续加成断键, 破坏环状结构, 生成三级小分子醛酮类氧化降解产物, 如Ⅵ、Ⅶ、Ⅷ; 最后, 小分子醛酮类氧化降解产物被·OH最终矿化生成CO2和H2O.这与Fotiou等(2014)研究TiO2光催化氧化降解GSM的中间过程类似.
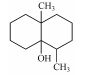
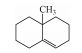
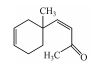
·OH氧化降解GSM生成一级、二级产物的机制如图 6所示, GSM分子中C(1)上—OH是唯一的极性亲水基团, ·OH有一个未配对自由电子, 极易与其发生亲电反应, 脱除一个H2O分子, 同时将自由电子转移到GSM双环内, 破坏双环结构稳定性. ·OH继续进攻C(6)上—CH3, 脱去H2O分子和—CH3生成一级氧化降解产物Ⅰ(1, 2, 3, 4, 4a, 5, 6, 7-octahydro-4a-methyl-Naphthalene), Ⅰ与·OH继续发生加成反应, 获得自由电子, 断裂环内C—C单键, 生成二级单环产物Ⅱ(1-(2-methylcyclohex-2-en-1-yl)but-2-en-1-one).此外, 已脱去H2O分子的GSM也可能直接断开环内C=C生成二级产物Ⅲ (4-(1-methylcyclohex-3-en-1-yl)but-3-en-2-one).综上, GSM稳定的双环结构被·OH破坏, 断键生成了单环中间产物.
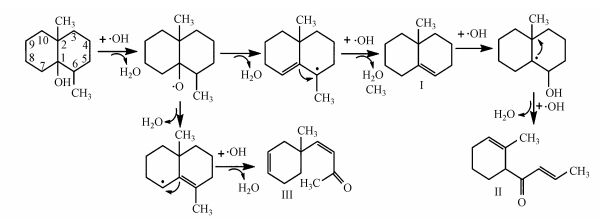 |
| 图 6 ·OH氧化降解GSM生成一级、二级产物的机制 Fig. 6 The mechanism of first and second grade intermediates in the oxidative degradation of GSM by ·OH |
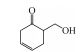
·OH氧化降解二级中间产物的机制如图 7所示, 以二级产物Ⅱ为例, 其侧链比六元环更易与·OH发生加成反应, 被·OH断键生成Ⅳ (1-oxo-5-hydroxy-methyl-2-cyclohexene)和小分子丙酸, 之后·OH攻击Ⅳ环上C=C双键, 断裂己烯环生成三级小分子醛酮酸类产物Ⅵ (3, 4-dimethylpentan-1-ol)、Ⅶ (5-methyl-4(E)-hexen-2-one)以及丙酸, 这些醛、酮、酸类小分子有机物继续被·OH氧化降解, 最终矿化生成H2O和CO2.
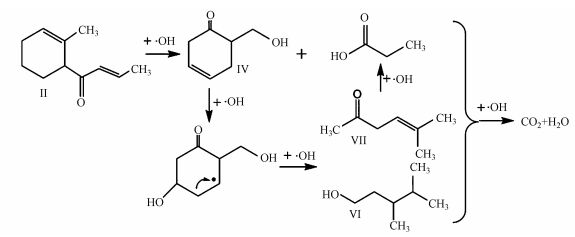 |
| 图 7 ·OH氧化降解中间产物Ⅱ的机制 Fig. 7 The mechanism of oxidative degradation of second grade intermediate Ⅱ by ·OH |
1) 对100~500 ng·L-1范围的GSM, TRO投加剂量在0.8~2.6 mg·L-1范围内, 经过处理后均可氧化降解到10 ng·L-1以下, 低于人类嗅阈值, 满足我国《生活饮用水卫生标准》 (GB5749—2006).
2) 接触反应时间研究影响表明, 在TRO阈值浓度下接触反应6 s, 对100 ~500 ng·L-1范围水样的GSM去除率均大于90%, 延长反应时间至180 s, 水样中GSM残余量均低于10 ng·L-1.投加·OH淬灭剂TBA实验表明, 对GSM起氧化降解作用的主要氧活性粒子为·OH.
3) ·OH氧化降解GSM机制分析表明, ·OH首先攻击GSM分子中侧链上—OH和—CH3, 生成带环内双键的一级氧化降解产物, 再经加成反应, 转移自由电子到桥环上, 断裂桥环单键, 生成二级氧化降解产物, 接着进一步氧化降解为醛、酮和酸类小分子产物, 最终矿化生成CO2和H2O.
综上, 大气压强电场电离放电结合水力射流空化方式制备·OH, 可以有效地去除水体中的GSM, 保障饮用水安全.
Antonopoulou M, Evgenidou E, Lambropoulou D, et al. 2014. A review on advanced oxidation processes for the removal of taste and odor compounds from aqueous media[J]. Water Research, 53(15): 215–234.
|
Asghar A, Khan Z, Maqbool N, et al. 2015. Comparison of adsorption capability of activated carbon and metal doped TiO2 for Geosmin and 2-MIB removal from water[J]. Journal of Nanomaterials, 2: 1–11.
|
Bai M D, Zheng Q L, Tian Y P, et al. 2016. Inactivation of invasive marine species in the process of conveying ballast water using·OH based on a strong ionization discharge[J]. Water Research, 96(1): 217–224.
|
Bai M D, Zhang Z T, Bai M D. 2012. Simultaneous desulfurization and denitri fication of flue gas by·OH radicals produced from O2+ and water vapor in a duct[J]. Environmental Science and Technology, 46(18): 10161–10168.
|
成建国, 刘开颖, 白敏冬, 等. 2015. 顶空固相微萃取-气相色谱-质谱联用测定饮用水中的2-甲基异莰醇和土臭素[J]. 色谱, 2015, 33(12): 1287–1293.
|
Ding Z, Peng S F, Jin Y Q, et al. 2014. Geographical and Seasonal Patterns of Geosmin and 2-Methylisoborneol in Environm-ental Water in Jiangsu Province of China[J]. Journal of Analytical Methods in Chemistry, 2014(2014): 1–6.
|
Dzialowski A R, Smith V H, Huggins D G. 2009. Development of predictive models for geosmin-related taste and odor in Kansas, USA, drinking water reservoirs[J]. Water Research, 43(11): 2829–2840.
DOI:10.1016/j.watres.2009.04.001
|
Environment Protection Agency Method.1978. 330.5 Chlorine, Total Residual (Spectrop-hotometric, DPD)[S]. Environment Protection Agency, USA
|
Fotiou T, Triantis T M, Kaloudis T, et al. 2014. Photocatalytic degradation of water taste and odour compounds in the presence of polyoxometalates and TiO2:Intermediates and degradation pathways[J]. Journal of Photochemistry and Photobiology A:Chemistry, 286: 1–9.
DOI:10.1016/j.jphotochem.2014.04.013
|
Fotiou T, Triantis T M, Kaloudis T, et al. 2015. Evaluation of the photocatalytic activity of TiO2 based catalysts for the degradation and mineralization of cyanobacterial toxins and water off-odor compounds under UV-A, solar and visible light[J]. Chemical Engineering Journal, 261(1): 17–26.
|
Guan Y H, Ma J, Li X C, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environment Science and Technology, 45(21): 9308–9314.
DOI:10.1021/es2017363
|
胡嘉东, 张锡辉, 万正茂, 等. 2009. 典型城市河流中嗅味物质和微生物菌落特征[J]. 环境科学研究, 2009, 22(1): 47–51.
|
Jo C H, Dietrich A M, Tanko J M, et al. 2001. Simultaneous degradation of disinfection byproducts and earthy-musty odorants by the UV/H2O2 advanced oxidation process[J]. Water Research, 45(8): 2507–2516.
|
雷振, 陈荣, 王帅, 等. 2017. 铜胁迫对铜绿微囊藻生长及产毒素的影响[J]. 环境科学学报, 2017, 37(5): 1993–1998.
|
Liang C Z, Wang D S, Chen J Q, et al. 2007. Kinetics Analysis on the Ozonation of MIB and Geosmin[J]. Ozone:Science and Engineering, 29(3): 185–189.
DOI:10.1080/01919510701294197
|
Ma J P, Lu W H, Li J H, et al. 2011. Determination of Geosmin and 2-Methylisoborneol in water by headspace liquid-phase microextraction coupled with gas chromatography-mass spectrometry[J]. Analytical Letters, 44(8): 1544–1557.
DOI:10.1080/00032719.2010.520384
|
Meunier L, Canonica S, Gunten U. 2006. Implications of sequential use of UV and ozone for drinking water quality[J]. Water Research, 40(9): 1864–1876.
DOI:10.1016/j.watres.2006.02.030
|
Mizuno T, Ohara S, Nishimura F, et al. 2011. O3/H2O2 process for both removal of odorous algal-derived compounds and control of bromateion formation[J]. Ozone:Science and Engineering, 33(2): 121–135.
DOI:10.1080/01919512.2011.548200
|
Peter A, Gunten U V. 2007. Oxidation kinetics of selected taste and odor compounds during ozonation of drinking water[J]. Environmental Science and Technology, 41(2): 626–631.
DOI:10.1021/es061687b
|
Su M, Yu J W, Zhang J Z, et al. 2015. MIB-producing cyanobacteria (Planktothrix sp.) in a drinking water reservoir:Distribution and odor producing potential[J]. Water Research, 68: 444–453.
DOI:10.1016/j.watres.2014.09.038
|
Sugiura N, Nakano K. 2000. Causative microorganisms for musty odor occurrence in the eutrophic Lake Kasumigaura[J]. Hydrobiologia, 434(1): 145–150.
|
Tian Y P, Yuan X L, Xu S J, et al. 2015. Biological efficacy and toxic effect of emergency water disinfection process based on advanced oxidation technology[J]. Ecotoxicology, 24(10): 2141–2150.
DOI:10.1007/s10646-015-1559-9
|
Wee L H, Janssens N, Vercammen J, et al. 2015. Stable TiO2-USY zeolite composite coatings for efficient adsorptive and photocatalytic elimination of geosmin from water[J]. Journal of Materials Chemistry A, 3: 2258–2264.
DOI:10.1039/C4TA05941G
|
Yang Y, Jiang J, Lu X L, et al. 2015. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate:A novel advanced oxidation process[J]. Environment Science and Technology, 49(12): 7330–7339.
DOI:10.1021/es506362e
|
于建伟, 陈克云, 苏命, 等. 2011. 不同营养源条件下螺旋鱼腥藻生长与产嗅特征研究[J]. 环境科学, 2011, 32(8): 2254–2259.
|
Yuan B L, Xu D M, Li F, et al. 2013. Removal efficiency and possible pathway of odor compounds (2-methylisoborneol and geosmin) by ozonation[J]. Separation and Purification Technology, 117(30): 53–58.
|
赵艳梅, 于建伟, 郑红, 等. 2007. 均相表面扩散模型(HSDM)在活性炭吸附去除水中典型嗅味物质中的应用[J]. 环境科学学报, 2007, 27(12): 1944–1950.
DOI:10.3321/j.issn:0253-2468.2007.12.002 |
Zamyadi A, Henderson R, Stuetz R, et al. 2015. Fate of geosmin and 2-methylisoborneol in full-scale water treatment plants[J]. Water Research, 83: 171–183.
DOI:10.1016/j.watres.2015.06.038
|
Zoschke K, Dietrich N, Bornick H, et al. 2012. UV-based advanced oxidation processes for the treatment of odour compounds:Efficiency and by-product formation[J]. Water Research, 46: 5365–5373.
DOI:10.1016/j.watres.2012.07.012
|
 2018, Vol. 38
2018, Vol. 38