甲醛(Formaldehyde,FA)是一种常见的室内空气污染物,严重影响人类的身体健康.世界卫生组织在其“International Agency for Research on Cancer”文件中,强调甲醛是“1类致癌物”(International Agency for Research on Cancer, 2004;2006).甲醛可以导致白血病的发生,但其中的分子机制仍不清楚(Zhang et al., 2010).甲醛的遗传毒性和致癌作用的分子机制至少可以归纳为(Conaway et al., 1996):染色体方面,包括染色体畸变、姐妹染色体交联和微核形成;DNA方面,包括DNA链断裂、DNA加合物形成;基因方面,包括基因突变;细胞毒性方面包括DNA氧化损伤、促进细胞增殖.美国健康基金委员会(American health foundation)专家组指出:在气态甲醛的遗传毒性和致癌作用中,起首要作用的是DNA-蛋白质交联(DNA-protein cross-linking,DPC)的形成,其次是加强细胞的增殖作用(Conaway et al., 1996).
Tyihák等(2001)用不同浓度的甲醛处理人结肠癌HT-29细胞,发现0.1 mmol·L-1的甲醛促进了该细胞的增殖.Hayasgi等(2004)发现,0~2.7 μmol·L-1的FA可以增加酪氨酸羟化酶免疫阳性球旁的细胞数量.Rizzi等(2015)研究证实甲醛浓度为10 μmol·L-1时,可以促进恶性黑色素瘤细胞增殖.本实验室前期研究中,Ke等(2014)培养Hela细胞,发现10 μmol·L-1的FA促进细胞增殖的效应最大.可见,已有不少研究证明低浓度甲醛能促进细胞增殖,但相关的具体分子机制的报道却很少.
肿瘤细胞的快速生长使其处于缺氧状态,于是在葡萄糖代谢至丙酮酸后,细胞不通过三羧酸循环而是通过乳酸脱氢酶转变成乳酸,利用乳酸作为能量代谢的来源,以供生长的需求,这就是Warburg效应(Chen et al., 2007).Warburg效应的一个关键酶是丙酮酸激酶M2型同工酶(pyruvate protein kinase M2,PKM2),其在肿瘤细胞中含量异常增加.外界因子可以刺激PKM2,使其二聚体表达上调并发生核转位,与核内低氧诱导因子(hypoxia inducible factor-1-α,HIF-1-α)作用后促进了HIF1-α与DNA的结合,增强下游靶基因的转录,细胞增殖率上升(Yang et al., 2012).
在细胞增殖过程中,周期蛋白复合物起到重要的作用(Gérard et al., 2012).CDKs (cyclin-dependent kinases)是一类丝氨酸和苏氨酸蛋白激酶,只有当与激活的亚单位细胞周期蛋白cyclins结合形成复合物,才会发挥作用(Geleta et al., 2015).当机体受到某些因子的刺激,会对细胞中周期蛋白产生一定的影响,调节细胞周期的进行.在G1到S期转换的过程中,细胞周期复合物如Cyclin D-cdk4等发挥着重要作用,同时它们可以使RB蛋白(retinoblastoma protein)磷酸化,导致与之结合的转录因子E2F的释放,促进细胞向S期的转换,细胞增殖速度加快(Nevins et al., 2001).
本实验以人慢性髓系白血病细胞K562为研究对象,用不同浓度的甲醛处理细胞,观察甲醛是否可以促进细胞的增殖,并探究低浓度甲醛是否通过Warburg效应及细胞周期调控因子来促进细胞增殖.
2 材料与方法(Materials and methods) 2.1 材料与试剂及仪器实验材料为人慢性髓系白血病细胞K562细胞,购于武汉大学中国典型生物保藏中心(武汉,中国).
主要实验试剂:4%甲醛(Sigma公司),维生素E(国药集团化学试剂有限公司),CCK-8试剂盒(C0038,同仁化学研究所),还原型谷胱甘肽glutathione(GSH)(A006-2)、葡萄糖(F006)、乳酸(A019-2)试剂盒(南京建成生物工程研究所),葡萄糖转运蛋白1(glucose transporter 1,GLUT1)(MLGR-E11167)、乳酸脱氢酶A(lactate dehydrogenase A,LDHA)(MLGR-E11232)、丙酮酸激酶M2型同工酶(pyruvate protein kinase M2,PKM2)(MLGR-E12223)、Cyclin D-cdk4(MLGR-E11807)、转录因子E2F1(transcription factor,E2F1)(MLGR-E12320)试剂盒(R & D公司).
主要实验仪器:细胞培养箱(长沙华曦电子科技有限公司),全波长酶标仪DNM-9602(北京普朗新技术有限公司),荧光酶标仪FLx 800(Bio-Tek).
2.2 实验方法 2.2.1 细胞培养人慢性髓系白血病细胞K562用含10%胎牛血清的RPMI1640培养基,于37 ℃、5% CO2条件下培养,每隔2~3 d进行换液和传代.
2.2.2 促细胞增殖的甲醛浓度筛选将处于对数生长期的K562细胞按1×105个·mL-1的接种量接种于96孔板,培养24 h.用不含血清的培养基将4%的甲醛溶液依次配制成0、25、50、75、100、125、150、200 μmoul·L-1的染毒液,染毒2 h.细胞活力用CCK 8法(Hu et al., 2017)和MTT法(Stockert et al., 2012)测定,并依据公式:细胞增殖率=[(实验组A值-对照组A值)/(对照组A值-空白组A值)] × 100%(A表示各组的吸光度),分析细胞活力.每个浓度设定8个平行孔,重复3次.
2.2.3 低浓度甲醛通过氧化应激诱导Warburg效应的研究选择可使细胞增殖率最高、细胞活性最大的甲醛溶液,对细胞进行染毒处理2 h,并设计实验分组:0 μmol·L-1 FA组;FA组;FA + VE组;VE组.VE的浓度、体积与上述甲醛染毒液的浓度、体积均相同,于染毒前0.5 h加入.
① 细胞活力检测:按上述分组,将处于对数生长期的K562细胞按1×105个·mL-1的接种量接种于96孔板,培养24 h;甲醛染毒2 h.细胞活力用CCK 8法(Hu et al., 2017)和MTT法(Stockert et al., 2012)测定,并依据公式:细胞增殖率=[(实验组A值-对照组A值)/(对照组A值-空白组A值)] × 100%(A表示各组的吸光度),分析细胞活力.每个浓度设定8个平行孔,重复3次.
② 活性氧簇(reactive oxygen species,ROS)测定:按上述分组,选取对数生长期生长状态良好的K562细胞,调整细胞密度为3.5×105个·皿-1,接种于60 mm细胞培养皿,培养24 h;甲醛染毒2 h.离心留细胞沉淀待测.用预冷的磷酸盐缓冲液(phosphate buffered solution,PBS)将10 mmol·L-1的荧光染料2′, 7′-二氯荧光黄双乙酸盐(Dichloro-dihydro-fluorescein diacetate,DCFH-DA)稀释50000倍,于避光条件下加入细胞沉淀中,37 ℃避光孵育20 min.用FL×800荧光酶标仪在激发波长488 nm和发射波长525 nm下检测吸光度.每组3次重复.
③ GSH测定:将各组的细胞悬液离心,往细胞沉淀加入细胞裂解液,于冰上裂解2 h,弃去沉淀,取上清液,严格按照GSH测定试剂盒说明书进行操作.
④ 丙酮酸激酶M2型同工酶(PKM2)、葡萄糖转运蛋白1(GLUT1)、乳酸脱氢酶A(LDHA)、葡萄糖、乳酸含量的测定:将各组的细胞悬液离心,往细胞沉淀中加入细胞裂解液,于冰上裂解2 h,弃去沉淀,取上清液,丙酮酸激酶M2型同工酶(PKM2)、葡萄糖转运蛋白1(GLUT1)、乳酸脱氢酶A(LDHA)、葡萄糖、乳酸含量的测定严格按照试剂盒说明书进行.
2.2.4 低浓度甲醛通过氧化应激诱导细胞周期调控因子的研究将各组的细胞悬液离心,往细胞沉淀加入细胞裂解液,于冰上裂解2 h,弃去沉淀,取上清液,严格按照Cyclin D-cdk4、转录因子E2F1测定试剂盒说明书进行.
2.3 数据分析使用SPSS 22.0软件和Graph Pad Prism 5.0软件,采用单因素方差分析(one-way ANOVA)和q检验、双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test检验对实验数据进行统计与整理;使用Graph Pad Prism 5.0软件制图.其中,p < 0.05表示差异具有统计学意义,用“*”或“#”表示,p < 0.01表示差异具有高度统计学意义,用“**”或“##”表示,实验数据用Mean ± SD来表示.
3 实验结果(Results) 3.1 促进细胞增殖的甲醛浓度筛选用不同浓度的甲醛处理细胞2 h后,采用CCK-8法和MTT法测定细胞活力,如图 1所示.其中,图 1a表示用CCK-8法测定得出的细胞活性,同样的方法测得的细胞增殖率如图 1b所示.图 1c、图 1d则分别表示用MTT法测定出的细胞活性及细胞增殖率.
 |
| 图 1 细胞活力图(采用单因素方差分析(one-way ANOVA)和q检验对实验数据进行统计分析,n=3.*表示p < 0.05,**表示p < 0.01,***表示p < 0.001,与对照组相比. & & & 表示p < 0.001,75 μmol·L-1与200 μmol·L-1相比) Fig. 1 Cell vitality (The one-way ANOVA and q test were used to analyze the experimental data. n=3. *: p < 0.05, **: p < 0.01, ***: p < 0.001, compared with the control; & & & :p < 0.001, 75 μmol·L-1 compared with 200 μmol·L-1) |
从图 1可以看出,两种测定方法均表明:与对照组相比,甲醛浓度在0 ~ 125 μmol·L-1之间时,细胞活力上升,增殖率提高,表明甲醛确实促进了细胞的增殖;超过125 μmol·L-1后,细胞活力、增殖率均降低.采用CCK-8法测得当甲醛浓度为75 μmol·L-1时,细胞活性最大且增殖率达到最大值,差异具有统计学意义(p < 0.05);MTT法同样测得75 μmol·L-1的甲醛,可使细胞活性最大且增殖率有最大值,差异具有高度统计学意义(p < 0.01).结果表明,只有低浓度的甲醛才能促进细胞增殖,高浓度甲醛则抑制增殖.
3.2 低浓度甲醛通过氧化应激诱导Warburg效应的研究 3.2.1 细胞活力检测结果将处于对数生长期的K562细胞按1×105个·mL-1的接种量接种于96孔板,培养24 h;在甲醛染毒0.5 h前加入抗氧化剂Vitamin E(VE)后,细胞活力的变化如图 2所示.其中,图 2a表示CCK-8法的测定结果,与对照组相比,染毒组的细胞增殖率升高(p < 0.05);与染毒组相比,FA + VE组的细胞增殖率下降(p < 0.01).图 2b表示MTT法测定结果,与对照组相比,染毒组的细胞增殖率升高(p < 0.01);与染毒组相比,FA + VE组的细胞增殖率下降(p < 0.05).
 |
| 图 2 加入VE后的细胞活力(采用双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test检验对实验数据进行统计分析,n=3.*表示p < 0.05,**表示p < 0.01,与对照组相比;#表示p < 0.05,##表示p < 0.01,FA组与FA + VE组相比) Fig. 2 Cell vitality after the addition of VE (The two-way ANOVA with the Bonferroni′s post hoc test were used to analyze the experimental data. n=3. *:p < 0.05, **: p < 0.01, compared with the control; #: p < 0.05 ##:p < 0.01, compared with the FA + VE group) |
用75 μmol·L-1的甲醛处理细胞2 h后,细胞内氧化损伤情况如图 3所示.由图 3a可知,与对照组相比,染毒组ROS含量升高(p < 0.01);与染毒组相比,FA + VE组的ROS含量下降(p < 0.01).图 3b显示,与对照组相比,染毒组的GSH含量降低(p < 0.05);与染毒组相比,FA + VE组的GSH含量上升(p < 0.05).
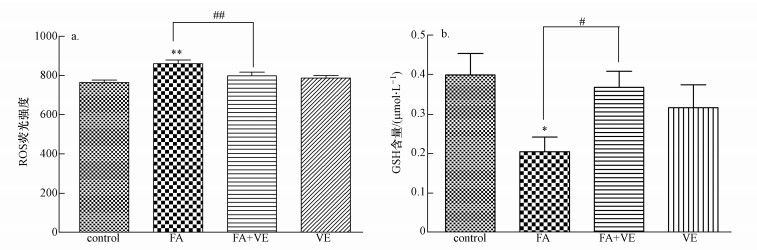 |
| 图 3 细胞中氧化损伤情况(采用双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test检验对实验数据进行统计分析,n=3.*表示p < 0.05,**表示p < 0.01,与对照组相比.#表示p < 0.05,##表示p < 0.01,FA组与FA + VE组相比) Fig. 3 Oxidative damage in the cell (The two-way ANOVA with the Bonferroni′s post hoc test were used to analyze the experimental data. n=3. *:p < 0.05, **:p < 0.01, compared with the control; #: p < 0.05, ##: p < 0.01, compared with the FA + VE group) |
用75 μmol·L-1的甲醛处理细胞2 h后,细胞内丙酮酸激酶M2型同工酶PKM2含量变化如图 4所示.由图 4可知,与对照组相比,染毒组的PKM2含量呈升高趋势;与染毒组相比,FA+ VE组的PKM2含量下降(p < 0.01).
 |
| 图 4 细胞中PKM2的含量(采用双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test对检验实验数据进行统计分析,n=3.##表示p < 0.01,FA组与FA + VE组相比) Fig. 4 Contents of PKM2 in the cell (The two-way ANOVA with the Bonferroni′s post hoc test were used to analyze the experimental data. n=3. ##:p < 0.01, compared with the FA + VE group) |
图 5是细胞经甲醛处理后,GLUT1、葡萄糖、LDHA、乳酸含量的变化结果.与对照组相比,染毒组胞内GLUT1、葡萄糖、LDHA的含量均上升(p < 0.05),乳酸含量呈上升趋势;与甲醛处理组相比,FA + VE组的细胞内GLUT1、葡萄糖含量下降(p < 0.01),乳酸含量也下降(p < 0.05),LDHA呈下降趋势(图 5c).
 |
| 图 5 细胞中GLUT1、葡萄糖、LDHA、乳酸含量(采用双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test检验对实验数据进行统计分析,n=3.*表示p < 0.05,与对照组相比.#表示p < 0.05,##表示p < 0.01,FA组与FA + VE组相比) Fig. 5 Contents of GLUT1, glucose, LDHA, lactic acid in the cell (The two-way ANOVA with the Bonferroni′s post hoc test were used to analyze the experimental data. n=3. *: p < 0.05, compared with the control; #:p < 0.05, ##: p < 0.01, compared with the FA + VE group) |
图 6显示细胞经甲醛处理后,胞内Cyclin D-cdk4、E2F1的含量发生变化.图 6a表明,与对照组相比,甲醛处理使胞内Cyclin D-cdk4含量上升(p < 0.05);与甲醛处理组相比,FA+ VE组的Cyclin D-cdk4含量下降(p < 0.01).图 6b中,与对照组相比,E2F1含量上升;与甲醛处理组相比,FA + VE组中,E2F1下降(p < 0.05).
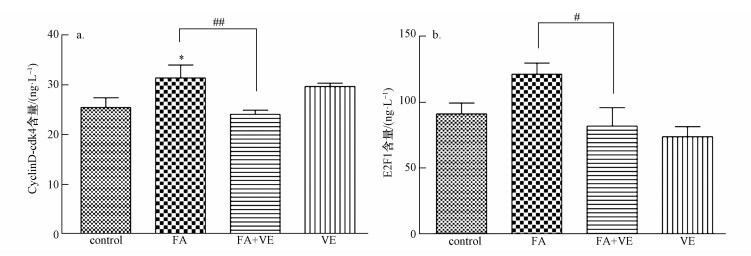 |
| 图 6 细胞中Cyclin D-cdk4、E2F1含量(采用双因素方差分析(two-way ANOVA)和Bonferroni′s post hoc test检验对实验数据进行统计分析,n=3.*表示p < 0.05,与对照组相比.#表示p < 0.05,##表示p < 0.01,FA组与FA + VE组相比) Fig. 6 Contents of Cyclin D-cdk4 and E2F1 in the cell (The two-way ANOVA with the Bonferroni′s post hoc test were used to analyze the experimental data. n=3.*: p < 0.05, compared with the control; #: p < 0.05, ##: p < 0.01 compared with the FA + VE group) |
K562细胞是人类慢性髓系白血病细胞,常常用于研究肿瘤和白血病的治疗及药物靶标等领域.慢性粒细胞白血病(chronic myelognous leukemia,CML)是一类由造血干细胞恶性克隆形成的疾病,增殖失控是其典型特征,逐渐浸润骨髓及其临近组织,最终导致骨髓造血功能受损(Chandia et al., 2014).早在2004年,国际癌症研究所(International Agency for Research on Cancer, IARC)就发现甲醛能加大人类获得骨髓性白血病的风险,甲醛暴露与白血病发生之间的关系一直是科学研究的热点问题,但仍存在诸多未知的分子机制.鉴于上述原因,本实验选择K562细胞为研究对象,探究低浓度甲醛促进其细胞增殖的分子机制,对研究甲醛与白血病发生有重要意义.
4.2 促进细胞增殖的甲醛浓度的筛选考虑到甲醛在低浓度和高浓度水平对细胞效应的差异,本实验设置了较宽的浓度梯度.结果表明,与对照组相比,甲醛浓度在0 ~75 μmol·L-1之间时,细胞活力随着甲醛浓度的上升而提高,到75 μmol·L-1时,细胞活力最大且增殖率最大,超过75 μmol·L-1后,细胞活力和增殖率均降低.上述结果表明,低浓度甲醛确实可以促进细胞的增殖,高浓度甲醛则抑制细胞增殖.Marcsek等(2007)以人肝癌HepG2细胞和人乳腺癌MCF-7细胞为研究对象,发现只有10 ~10 μmol·L-1的甲醛才能增强细胞的存活力.Liu等(2011)以人支气管上皮16HBE细胞为研究对象,用CCK-8法测定了细胞活力,并用5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyUridine, BrdU)掺入法测定了细胞周期中S期的比例,发现低剂量甲醛有促进细胞增殖并抑制凋亡活性的效应.本实验的结果表明促进K562细胞增殖的甲醛浓度也在低剂量水平,当甲醛浓度为75 μmol·L-1时细胞增殖率最高、活性最大,这可能是因为实验环境有所差异,且不同种系的细胞对甲醛的耐受性不同.
4.3 低浓度甲醛对细胞内氧化应激水平的影响氧化应激是指体内氧化与抗氧化作用失衡,倾向于氧化状态(Vohr et al., 2005).ROS含量可以反映氧自由基水平(You et al., 2015).在正常的生理条件下,机体存在抗氧化系统,其中GSH可以和ROS结合形成硫代半缩醛,并可通过抗坏血酸-谷胱甘肽循环生成具更强抗氧化作用的抗坏血酸(Valko et al., 2006),故GSH也是一种有效评价氧化应激的重要指标.
课题组研究证实,在甲醛暴露试验中,随着甲醛浓度的升高,ROS含量也在上升.在本实验中,发现用低浓度甲醛处理细胞后ROS含量的确上升(p < 0.01),GSH含量则下降(p < 0.05),表明甲醛处理后使细胞内氧化损伤加重,而加入的抗氧化剂VE有效减少了氧化应激的产生,如图 3所示,ROS含量下降(p < 0.01),GSH含量上升(p < 0.05).ROS的轻微升高可以促进细胞的增殖,Topaloglu等(2015)以细菌为研究对象,发现低水平的ROS促进了细菌细胞的增殖;Shiratsuki等(2015)研究发现低氧水平增加了牛颗粒细胞的增殖和代谢变化.在图 2中,采用CCK-8与MTT法分别检测加入VE后细胞的活力,发现与对照组相比,染毒组的细胞增殖率升高(p < 0.05或p < 0.01);与染毒组相比,FA+VE组的细胞增殖率则下降(p < 0.01或p < 0.05),即本实验结果同样表明低浓度甲醛可以通过提升氧化应激水平促进细胞的增殖.
4.4 低浓度甲醛通过氧化应激介导Warburg效应促进细胞增殖对于肿瘤细胞来说,Warburg效应几乎成为其“第七大特征”(Mayevsky et al., 2009; Kroemer et al., 2008).Warburg效应涉及的生物因子多、过程复杂,每一步反应都需要特异性酶的参与,其中丙酮酸激酶(pyruvatekinase,PK)是其主要的限速酶之一,葡萄糖转运因子GLUT1和乳酸脱氢酶LDHA也起着重要作用.人体的丙酮酸激酶同工酶有L、R、M1和M2型4种,PKM2在多种癌症中含量呈现上升趋势(Mazurek et al., 2011).本实验采用的是白血病K562细胞,同样发现低浓度甲醛处理细胞后,染毒组的PKM2含量上升,与文献所述结果相同.PKM2会受到外界因子的影响,进入细胞核,与核内HIF1-α结合使下游靶基因的转录增强,细胞增殖率上升(Gao et al., 2012).在图 4中,加入抗氧化剂VE后,PKM2含量降低(p < 0.01),说明低浓度甲醛处理细胞后,产生的ROS影响了PKM2的表达.
为进一步证明甲醛引起的PKM2是否能通过葡萄糖转运蛋白1(GLUT1)、乳酸脱氢酶(LDHA)来影响Warburg效应,促进细胞增殖,我们检测了细胞中GLUT1和LDHA的含量.GLUT1是最常见的一种葡萄糖转运蛋白,也是葡萄糖跨膜转入细胞质中的关键限速因子,在恶性肿瘤组织中高表达(Carvalho et al., 2011).图 5a、5c表明染毒组的细胞中GLUT1、LDHA含量确实上升,加入VE后含量下降,表明ROS可以通过PKM2改变GLUT1和LDHA的含量.肿瘤细胞需要不断地进行糖酵解供给自身增殖需要的能量,该过程需要摄取更多的葡萄糖,而产生的丙酮酸又会进一步转化生成乳酸,同时LDHA也可催化丙酮酸向乳酸转化乳酸(Fantin et al., 2006).乳酸在多种生物的合成过程中有重要作用,其含量的上升会使细胞增殖加快(Chouinard et al., 2012).故在本实验中,我们测定了乳酸的含量变化,发现经过甲醛处理组的细胞中乳酸含量上升,细胞增殖率上升,而加入VE后,乳酸含量下降(p < 0.05),细胞增殖受到抑制.以上结果表明,低浓度甲醛可以通过产生氧化应激调控由PKM2介导的Warburg效应,促进细胞的增殖.
4.5 低浓度甲醛通过氧化应激介导细胞周期促进细胞增殖外界信号会刺激细胞周期蛋白cyclins及其对应的周期蛋白依赖性激酶CDKs复合物,使细胞周期发生改变,从而影响细胞增殖(Graña et al., 1995).本实验结果发现,经过低浓度甲醛处理后的细胞,Cyclin D-cdk4的含量上升(p < 0.05),而加入VE后其含量则下降(p < 0.01),表明低浓度甲醛在细胞内产生的ROS可能作为一种细胞周期刺激信号,作用于细胞周期中的Cyclin D-cdk4.转录因子E2F家族由E2F1,E2F2,E2F3组成,E2F1的突变使得细胞周期受阻(Nevins et al., 2001).故本实验选择E2F1为研究对象,通过ELISA法测定其含量变化.结果发现,甲醛处理组的E2F1含量上升,FA + VE组的含量则下降(p < 0.05).上述实验结果表明,ROS通过影响细胞周期中的Cyclin D-cdk4及转录因子E2F1,促进了细胞的增殖.
5 结论(Conclusions)1) 低浓度甲醛可以促进细胞的增殖,75 μmol·L-1的甲醛可以使K562细胞有最高的增殖率和最大的细胞活性.
2) 低浓度甲醛可能通过氧化应激诱导的Warburg效应和影响细胞周期调控因子两条途径促进细胞的增殖.
Carvalho K C, Cunha I W, Rocha R M, et al. 2011. GLUT1 expression in malignant tumors and its use as an immunodiagnostic marker[J]. Clinics, 66(6): 965–972.
DOI:10.1590/S1807-59322011000600008
|
Chouinard J A, Rousseau J A, Beaudoin J F, et al. 2012. Positron emission tomography detection of human endothelial cell and fibroblast monolayers:effect of pretreament and cell density on 18 FDG uptake[J]. Vascular Cell, 4(1): 1–10.
DOI:10.1186/2045-824X-4-1
|
Chandia M, Sayagués J M, Gutiérrez M L, et al. 2014. Involvement of primary mesenchymal precursors and hematopoietic bone marrow cells from chronic myeloid leukemia patients by BCR-ABL1 fusion gene[J]. American Journal of Hematology, 89(3): 288–294.
DOI:10.1002/ajh.v89.3
|
Chen Z, Lu W, Garcia-Prieto C, et al. 2007. The Warburg effect and its cancer therapeutic implications[J]. Journal of Bioenergetics and Biomembranes, 39(3): 267–274.
DOI:10.1007/s10863-007-9086-x
|
Conaway C C, Whysner J, Verna L K, et al. 1996. Formaldehyde mechanistic data and risk assessment:endogenous protection from DNA adduct formation[J]. Pharmacology & Therapeutics, 71(1/2): 29–55.
|
Fantin V R, Stpierre J, Leder P. 2006. Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance[C]//Cancer Cell. 425-434
|
Gao X, Wang H, Jenny J Y, et al. 2012. Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase[J]. Molecular Cell, 45(5): 598–609.
DOI:10.1016/j.molcel.2012.01.001
|
Geleta B, Makonnen E, Abay S M. 2015. Cyclic Dependent Kinases (CDKs) in cancer pathogenesis and therapeutics[J]. International Journal of Cancer Research, 12(2): 109–121.
|
Gérard C, Goldbeter A. 2012. From quiescence to proliferation:Cdk oscillations drive the mammalian cell cycle[J]. Frontiers in Physiology, 3(413): 1–18.
|
Graña X, Reddy E P. Graña X, et al. 1995. Cell cycle control in mammalian cells:Role of cyclins, cyclin dependent kinases (CDKs), growth suppressor genes and cyclin dependent kinase inhibitors (CDKIs)[J]. Oncogene, 11(2): 211–219.
|
Hayashi H, Kunugita N, Arashidani K, et al. 2004. Long-term exposure to low levels of formaldehyde increases the number of tyrosine hydroxylase-immunopositive periglomerular cells in mouse main olfactory bulb[J]. Brain Research, 1007(1/2): 192–197.
|
Hu Y, Zang J, Cao H, et al. 2017. Liver X receptors agonist GW3965 re-sensitizes gefitinib-resistant human non-small cell lung cancer cell to gefitinib treatment by inhibiting NF-κB in vitro[J]. Oncotarget, 8(9): 15802–15814.
|
International Agency for Research on Cancer, WHO. 2004. IARS Classifies Formaldehyde As Carcinogenic To Humans[Z]. Genevese:WHO
|
International Agency for Research on Cancer, WHO. 2006. IARC Monographs on the Evaluation of Carcinogenic Risks to Human:Volume 88 Formaldehyde[Z]. Lyon, France:WHO
|
Ke Y J, Qin X D, Zhang Y C, et al. 2014. In vitro study on cytotoxicity and intracellular formaldehyde concentration changes after exposure to formaldehyde and its derivatives[J]. Human & Experimental Toxicology, 33(8): 822–830.
|
Kroemer G, Pouyssegur J. 2008. Tumor cell metabolism:cancer's Achilles' heel[J]. Cancer Cell, 13(6): 472–482.
DOI:10.1016/j.ccr.2008.05.005
|
刘庆成, 杨淋清, 陶功华, 等. 2011. 低剂量甲醛对16HBE细胞的增殖促进及DNA损伤作用[J]. 中华疾病控制杂志, 2011, 15(11): 927–930.
|
Marcsek Z L, Kocsis Z, Szende B, et al. 2007. Effect of formaldehyde and resveratrol on the viability of Vero, HepG2 and MCF-7 cells[J]. Cell Biology International, 31(10): 1214–1219.
DOI:10.1016/j.cellbi.2007.01.039
|
Mayevsky A. 2009. Mitochondrial function and energy metabolism in cancer cells:past overview and future perspectives[J]. Mitochondrion, 9(3): 165–179.
DOI:10.1016/j.mito.2009.01.009
|
Mazurek S. 2011. Pyruvate kinase type M2:A key regulator of the metabolic budget system in tumor cells[J]. International Journal of Biochemistry & Cell Biology, 43(7): 969–980.
|
Nevins J R. 2001. The Rb/E2F pathway and cancer[J]. Human Molecular Genetics, 10(7): 699–703.
DOI:10.1093/hmg/10.7.699
|
Rizzi M, Cravello B, Renò F. 2015. Textile industry manufacturing by-products induce human melanoma cell proliferation via ERK1/2 activation[J]. Cell Proliferation, 47(6): 578–586.
|
Shirasuna K, Shimamura N, Seno K, et al. 2015. Moderate Hypoxia Down-Regulates Interleukin-6 Secretion and TLR4 Expression in Human Sw.71 Placental Cells[J]. Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology, 36(6): 2149–2160.
|
Stockert J C, Blázquezcastro A, Cañete M, et al. 2012. MTT assay for cell viability:Intracellular localization of the formazan product is in lipid droplets[J]. Acta Histochemica, 114(8): 785–796.
DOI:10.1016/j.acthis.2012.01.006
|
Topaloglu N, Guney M, Aysan N, et al. 2015. The role of reactive oxygen species in the antibacterial photodynamic treatment:photoinactivation vs proliferation[J]. Letters in Applied Microbiology, 62(3): 230–236.
|
Tyihák E, Bocsi J, Timár F, et al. 2001. Formaldehyde promotes and inhibits the proliferation of cultured tumour and endothelial cells[J]. Cell Proliferation, 34(3): 135–141.
DOI:10.1046/j.1365-2184.2001.00206.x
|
Valko M, Rhodes C J, Moncol J, et al. 2006. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 160(1): 1–40.
DOI:10.1016/j.cbi.2005.12.009
|
Vohr H W. 2005. Encyclopedic Reference of Immunotoxicology[M].Springer:181-182
|
Yang W, Zheng Y, Xia Y, et al. 2012. ERK1/2-dependent phosphorylation and nuclear translocation of PKM2 promotes the Warburg effect[J]. Nature Cell Biology, 14(12): 1295–1304.
DOI:10.1038/ncb2629
|
You B R, Park W H. 2015. Auranofin induces mesothelioma cell death through oxidative stress and GSH depletion[J]. Oncology Reports, 35(1): 546–551.
|
Zhang L, Freeman L E, Nakamura J, et al. 2010. Formaldehyde and leukemia:epidemiology, potential mechanisms, and implications for risk assessment[J]. Environmental & Molecular Mutagenesis, 51(3): 181–191.
|
 2018, Vol. 38
2018, Vol. 38


