2. 清华-伯克利深圳学院, 环境与新能源技术工程实验室, 深圳 518055
2. Shenzhen Environmental Science and New Energy Technology Engineering Laboratory, Tsinghua-Berkeley Shenzhen Institute, Shenzhen 518055
污水再生利用是应对和解决水资源危机的重要手段(胡洪营等, 2015).反渗透(Reverse Osmosis, RO)脱盐技术具有产水质量高、稳定、自动化程度高、占地面积小等优势, 在污水再生处理中的应用越来越广泛(Singh, 2011; 汤芳等, 2013).但膜污堵问题严重影响了RO系统的产水效率并提高了其运行成本, 是制约RO技术应用的重要因素(Falath et al., 2017).
RO膜的污堵根据污堵物来源可分为4类:无机盐沉积污堵、颗粒和胶体污堵、有机污堵及生物污堵(谢文州等, 2015).反渗透工艺在处理二级出水过程中, 进水中的有机物在RO膜表面形成凝胶层, 这层凝胶层会导致RO膜的产水速率大幅下降, 并且还可以作为条件层, 为进水中的细菌附着和生长形成生物膜提供条件(Asif et al., 2011), 导致RO膜面的生物污堵.细菌分泌物又进一步加剧有机污堵, 导致RO系统产水率和产水水质降低、生产成本增加(孙丽萍等, 2007).
城市污水厂二级出水中污水有机物(Effluent Organic Matter, EfOM)的来源主要包括3种:①难以降解的天然有机物(Natural Organic Matter, NOM);②污水生物降解过程中产生的溶解性微生物产物(Soluble Microbial Products, SMPs);③人工合成的难降解有机化合物(Jarusutthirak et al., 2006; Menahem Rebhum et al., 1971; Chon et al., 2012a).其中, NOM与SMP在组成上有部分重叠, 难以完全区分, 通常认为腐殖酸或腐殖质是NOM的主要组分, 而蛋白质和多糖是SMP的主要组分(杨文澜等, 2013).
在污水二级处理过程中, 微生物在降解有机物的同时, 会产生大量的SMP, 导致SMP成为EfOM的主要组分, 其中, 蛋白质约占EfOM的50%, 多糖约占EfOM的40%(Jarusutthirak et al., 2006; Shon et al., 2006).
研究表明, SMP中亲水性物质容易造成RO膜污堵, SMP中的多糖、蛋白质可以通过形成滤饼或凝胶层的形式附着在RO膜表面, 导致RO膜产水速率下降(Barker et al., 1999).而现有RO膜有机污堵的研究多局限于特定单一有机物的模拟, 如腐殖酸(Hung et al., 2013)、海藻酸钠(Yu et al., 2012)、牛血清蛋白(Ang et al., 2007; Mo et al., 2007)等.由于污水中微生物产生的SMP组成成分复杂, 难以分辨其导致RO膜污堵的关键性成分(Jarusutthirak et al., 2007), 对SMP的RO膜污堵潜力的研究则十分欠缺, 而目前关于单一有机物RO膜污堵潜力的研究无法有效指导RO工艺实际运行中对膜污堵的控制.
基于此, 本研究以再生水厂RO膜面分离的典型污堵细菌(Pseudomonas sp. AM1-1和Chromobacterium sp.AM1-2)产生的SMP为研究对象, 比较不同细菌SMP的组成成分及其对RO膜的污堵能力, 分析SMP的RO膜污堵特性与现有RO膜有机污堵研究成果间的关系, 从而识别导致RO膜污堵的关键性SMP组分, 以期为控制二级出水EfOM中SMP导致的RO膜污堵提供理论基础.
2 材料与方法(Materials and methods) 2.1 选用细菌与培养方法 2.1.1 菌种本研究使用的细菌菌种是从实际再生水厂RO膜面的凝胶层中分离纯化得到的两株细菌, 经16S rRNA基因测序并与EZTaxon数据库(http://www.ezbiocloud.net/eztaxon)(Kim et al., 2012)进行比对后, 分别鉴定为Pseudomonas sp.AM1-1(下文简称为AM1-1)与Chromobacterium sp. AM1-2(下文简称为AM1-2).
2.1.2 培养方法为了排除SMP膜过滤实验中培养基中有机物的干扰, 研究采用葡萄糖基础培养基培养菌种, 培养基组成为(mg·L-1):葡萄糖500、硝酸铵1000、磷酸二氢钾500、磷酸氢二钠1500、氯化钠1000和硫酸镁100.菌种接种于培养基后使用摇床培养, 培养温度25 ℃、摇床摇速150 r·min-1、培养时长72 h.
2.2 细菌SMP提取与分析方法 2.2.1 SMP提取细菌在葡萄糖基础培养基内培养72 h后, 使用0.45 μm滤膜过滤培养液, 分离菌体与培养液, 培养液内剩余的有机物即为细菌产生的SMP及残余葡萄糖.
2.2.2 SMP的组成分析DOC测定使用岛津TOC-VCPH型总有机碳分析仪.葡萄糖含量使用葡萄糖氧化酶法(Spriko et al., 1989)测定, 使用长春汇力生物技术有限公司生产的葡萄糖测定试剂盒.蛋白含量使用Lowry法(Lowry et al., 1951)测定, 使用Thermo公司生产的Modified Lowry蛋白试剂盒.多糖含量使用蒽酮-硫酸法(Rondel et al., 2013)测定, 以葡萄糖为标准样品.三维荧光测定使用日立F-7000型荧光分光光度计(Wang et al., 2010).分子量测定使用岛津LC-20AD型液相色谱仪, 配置SPD-M20A PDA检测器, 串联TKSgel G3000PWxl和G2500PWxl色谱柱, 外接GE Sievers M9便携式总有机碳分析仪(吴艳芳等, 2012; 岳兰秀等, 2005; Huber et al., 2011).
2.3 SMP膜污堵特性评价方法 2.3.1 RO错流过滤污堵实验装置采用实验室RO错流过滤污堵实验装置模拟SMP的膜污堵过程, 评价其膜污堵潜力, 装置如图 1所示.研究选用的RO膜为美国海德能(Hydranautics)生产的Proc10型芳香族聚酰胺复合膜, 膜通量为16 L·m-2·h-1, 运行压力为0.8~1.6 MPa, 脱盐率为97%, RO系统回收率为65%.此种RO膜被广泛运用于污水处理厂的RO系统中, 具有代表性(汤芳, 2015).
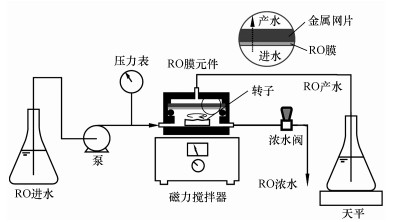 |
| 图 1 实验室RO错流过滤污堵实验装置示意图 Fig. 1 Flow diagram of the lab-scale RO crossflow fouling experiment |
利用实验装置模拟RO膜污堵过程时, 将剪切好(直径37 mm, 有效面积8.05 cm2)的RO膜洗净后装入RO膜元件中.实验进水采用恒压错流的方式:利用柱塞泵按1 mL·min-1的流速将进水注入RO膜元件;利用浓水阀调节施加在RO膜表面的压力, 控制在1.2 MPa;利用磁力搅拌器以250 r·min-1的速率进行搅动, 从而缓解膜面浓差极化现象;利用电子天平实时记录RO膜的产水量, 从而计算RO膜的产水速率.
2.3.2 RO膜性能测试RO膜片的产水回收率高于60%, 且脱盐率达到90%以上, 则认为该膜片表面无破损, 性能满足研究要求.
2.3.3 膜污堵速率计算方法进行SMP膜污堵特性评价实验时, 以两种细菌产生的SMP为基础, 分别配制DOC值为1、2、3、4、5和8 mg·L-1的SMP溶液各3 L, 作为进水水样的SMP浓度梯度, 调节溶液pH为7, 并在水样中加入NaCl调节其电导率至1000 μS·cm-1, 从而保证水样在RO错流过滤污堵实验装置实验时产生的浓差极化现象对膜过滤的影响相同.
研究过程中利用电子天平实时称量RO产水的质量, 而本研究中使用水样的密度均可视为1 g·mL-1, 因此,可以由RO产水的质量计算得到RO产水的体积.从SMP水样作为进水水样接入RO错流过滤污堵实验装置后, 开始进行实验测定, 第一个5 min内的平均产水速率J0作为RO膜片的初始膜通量, 之后每1 h取一个点, 计算该点5 min内的平均产水速率Ji作为第i小时的平均产水速率, 计算公式如下:
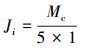
|
(1) |
式中, Ji为第i小时的平均产水速率(mL·min-1), 其中, i=0、1、2、3…;Mc为第i小时的前5 min的RO产水总量(g), 5的单位为min, 1的单位为mg·L-1.
根据计算所得的第i小时的平均产水速率, 并将Ji与J0的比值作为RO产水速率的标准化值, 计算公式如下:
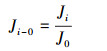
|
(2) |
式中, Ji-0为标准化后的第i小时的平均产水速率;Ji为第i小时的平均产水速率(mL·min-1);J0为第一个5 min的平均产水速率(mL·min-1), 即初始平均产水速率.
将计算得到的标准化产水速率Ji-0作为纵坐标, 将该产水速率对应的第i小时ti作为横坐标, 绘制标准化产水速率Ji-0随着ti的变化曲线(Vrijenhoek et al., 2001; Turan et al., 2002).
3 结果与讨论(Results and discussion) 3.1 细菌生长情况经预实验确定实验菌种在葡萄糖基础培养基中培养36~48 h达到稳定期, 并且稳定期持续96 h以上, 生长曲线如图 2所示.结果表明, 选择稳定期偏后期的细菌SMP作为实验对象, 此时细菌SMP的产量及SMP成分的稳定性均较为符合实验需求.因此, 按照前文所述的SMP提取方法, 收集两种细菌培养72 h后产生的SMP作为后续研究的对象.培养结束时发现, 两种菌种培养液内剩余葡萄糖浓度均低于5 mg·L-1(葡萄糖对应DOC低于2 mg·L-1), 剩余葡萄糖浓度较低, 基本可以认为对后续实验没有影响.
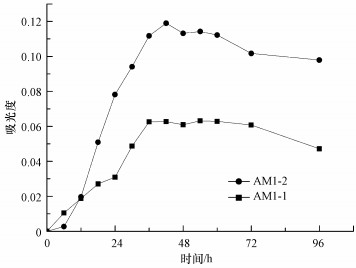 |
| 图 2 AM1-1及AM1-2在葡萄糖基础培养基内的生长曲线 Fig. 2 Growth curve of AM1-1 and AM1-2 in glucose basal medium |
本研究系统对比了两株细菌产生的SMP的三维荧光光谱及分子量分布特征.采用三维荧光法对SMP中含有的荧光物质进行分析, 结果如图 3所示.根据与活性污泥细菌SMP中典型荧光物质(氨基酸、多糖及腐殖酸等)的对应关系(Stedmon et al., 2003; Wang et al., 2010), 将三维荧光图划分为六大区域, 每个区域对应不同的物质.测定前根据SMP内荧光物质的强度进行稀释, 可以发现, AM1-1产生的SMP中荧光物质主要对应类聚羧酸类腐殖酸类、类多环芳烃类腐殖酸类和类富里酸组分(Ⅳ、Ⅴ、Ⅵ区域), AM1-2产生的SMP中荧光物质主要对应蛋白质及类多环芳烃类腐殖酸类组分(Ⅱ、Ⅴ区域).两种菌种产生的SMP中的主要荧光物质成分差异明显.
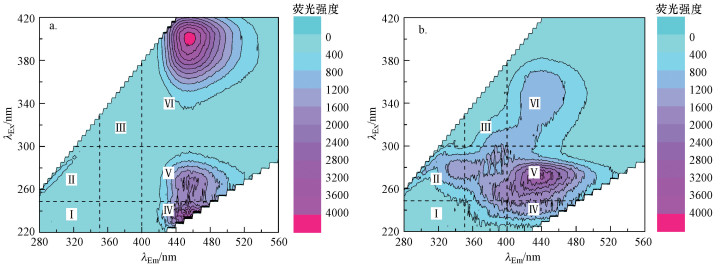 |
| 图 3 AM1-1(a, 稀释60倍)和AM1-2(b, 稀释6倍)的SMP三维荧光特征 (6个区域对应可能的物质:Ⅰ.类酪氨酸、色氨酸;Ⅱ.类酪氨酸、色氨酸蛋白;Ⅲ.多糖;Ⅳ.类聚羧酸类腐殖酸类物质;Ⅴ.类多环芳烃类腐殖酸类物质;Ⅵ.类富里酸类物质) Fig. 3 Fluorescence characteristics in SMP of AM1-1(a, diluted 60 times) AM1-2(b, diluted 6 times) |
运用高效体积排阻色谱(HPSEC)法测定SMP中含有物质的分子量分布, 以分子量分别为210、4300、6800、10600、34700和126700 Da的聚苯乙烯磺酸钠(PSS)为标准物质, 可以测定的分子量分布范围为102~106 Da.根据Huber等(2011)的研究, 水体中常见的腐殖质类大分子化合物和芳香族化合物中的C=C双键和C=O双键在波长为254 nm处(UV254)有较强的紫外吸收, 在SMP中主要对应的是蛋白质类物质, 而SMP中的多糖类物质不具有此处的紫外吸收特征.为了反映SMP中所有含碳有机物的分子量分布, 分析仪器配置了TOC检测器, 以弥补紫外检测器的不足.
从图 4a的紫外吸收检测器出峰情况(主要是蛋白类物质)可以发现, AM1-1产生的SMP中蛋白质类物质主要分布于分子量大于105 Da和分子量小于103 Da的范围内, 呈双峰式分布;AM1-2产生的SMP中蛋白质类物质主要集中分布于分子量在102~103 Da的范围内.此结果说明AM1-1产生的SMP中包含大分子和小分子的蛋白质, 而AM1-2产生的SMP中则只有小分子蛋白质.而从图 4b的TOC检测器出峰情况可以发现, AM1-1产生的SMP中的多糖类物质主要分布在分子量大于105 Da和小于103 Da的范围, 呈双峰式分布;AM1-2产生的SMP中的多糖类物质主要分布在分子量大于106 Da的范围, 同时存在少量多糖分子量小于103 Da.此结果说明AM1-1与AM1-2均可以产生大分子多糖, 但AM1-2产生的多糖分子量更大.
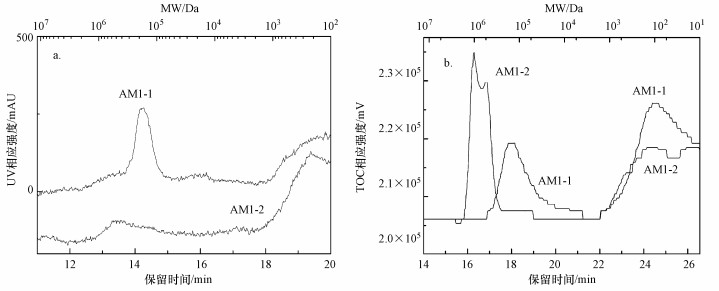 |
| 图 4 紫外吸收分子量图谱(a)及TOC分子量图谱(b) Fig. 4 Molecular weight distribution of UV254(a) and molecular weight distribution of TOC(b) |
定量测定两种细菌产生的SMP的DOC及多糖、蛋白质浓度, 结果如图 5和图 6所示.培养72 h后, 两种菌种培养液内剩余葡萄糖浓度均低于5 mg·L-1(葡萄糖对应DOC低于2 mg·L-1).培养液中AM1-1的SMP的DOC为26.17 mg·L-1, 多糖浓度为59.30 mg·L-1, 蛋白质浓度为57.48 mg·L-1;AM1-2产生的SMP的DOC约为24.55 mg·L-1, 多糖浓度为56.56 mg·L-1, 蛋白质浓度为54.45 mg·L-1.细菌AM1-1与AM1-2产生的SMP总量相当.从SMP的组成成分来看, AM1-1与AM1-2产生的SMP中多糖和蛋白的比例均约为1:1, 二者产生的多糖和蛋白质浓度相当.
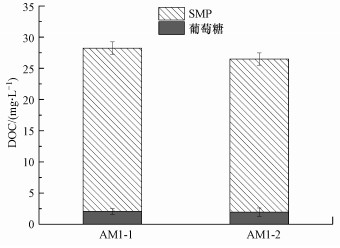 |
| 图 5 实验菌种产生的SMP及培养基剩余葡萄糖的DOC值 Fig. 5 DOC of SMP produced by strains and residual glucose in culture medium |
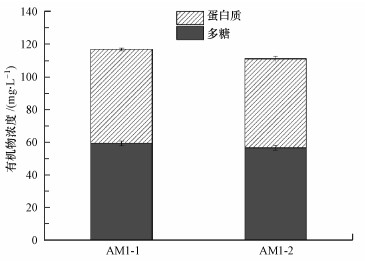 |
| 图 6 实验菌种产生的SMP中多糖及蛋白质浓度 Fig. 6 Concentration of protein and polysaccharide produced by strains |
为了避免培养基中残余无机盐的干扰, 用NaCl将本研究中使用的SMP溶液的电导率统一调整为1000 μS·cm-1, 因此, 在使用RO膜过滤水样时, 影响过膜压差从而导致产水速率下降的因素主要有两个:无机盐导致的浓差极化现象和有机物造成的RO膜污堵(Abdul et al., 2000).为了确定实验水样中浓差极化现象对产水速率的影响, 采用不含盐的高纯水与电导率1000 μS·cm-1的NaCl溶液作为RO错流过滤污堵实验装置进水水样, 测定二者在运行48 h内的标准化产水速率, 结果如图 7所示.可见高纯水在实验过程中的标准化产水速率基本没有变化;而NaCl溶液的标准化产水速率在第1 h内由100%下降到80%左右, 之后的标准化产水速率则保持稳定.由此可知, 在本研究的RO错流过滤污堵实验装置中, 使用电导率1000 μS·cm-1的进水水样时, 由于无机盐的存在, 将产生浓差极化现象导致RO膜的产水速率在第1 h显著下降, 但不会导致RO膜的产水速率持续下降.
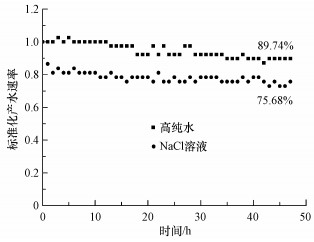 |
| 图 7 高纯水和NaCl溶液标准化产水速率变化曲线 (图中百分比数字为实验结束时的标准化产水速率) Fig. 7 Experimental flux decline(fouling) data for high purity water and NaCl solution |
将同样浓度的AM1-1和AM1-2产生的SMP标准化产水速率进行对比, 结果如图 8所示.可以发现, 在测试的各DOC浓度下, AM1-2产生的SMP均比AM1-1产生的SMP更容易造成RO膜污堵, 从而导致产水速率下降.AM1-2产生的SMP在实验初期(5~10 h)就会导致明显的产水速率下降, 说明此类SMP内的物质更容易快速在RO膜表面积累, 从而形成稳定的有机凝胶层.AM1-1产生的SMP会使产水速率在实验过程中较为稳定的缓慢下降, 说明此类SMP在RO膜表面形成稳定有机凝胶层的速率较慢, 产生RO膜污堵的过程较缓.
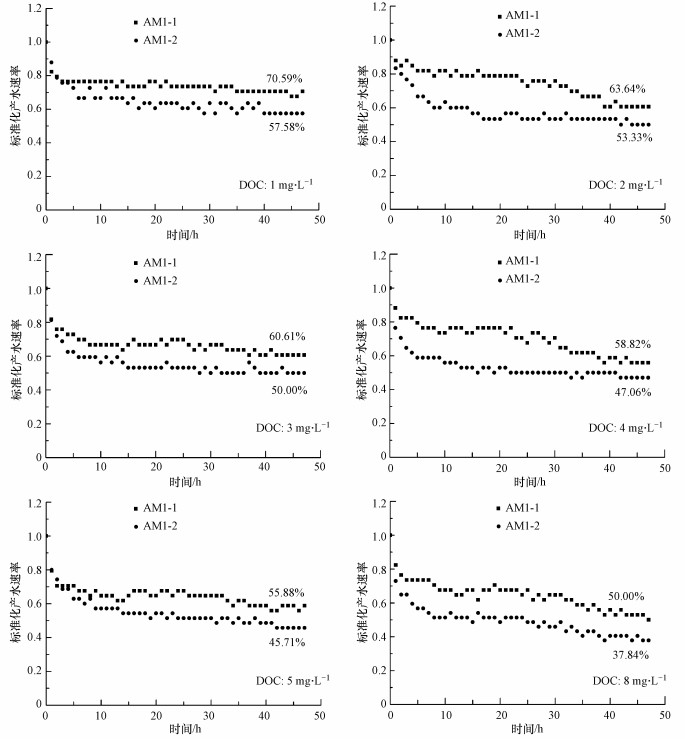 |
| 图 8 不同DOC浓度下AM1-1与AM1-2产生的SMP产水速率变化曲线对比 (图中百分比数字为实验结束时的标准化产水速率) Fig. 8 Experimental flux decline(fouling)data for different SMP of AM1-1 and AM1-2 in same concentration as comparison |
结合两种细菌SMP的组成成分进行分析:与AM1-1相比, AM1-2产生的SMP中含有更多分子量更大的有机物(图 4).有研究表明, 分子量更大的有机物更容易快速地在RO膜表面积累形成有机凝胶层, 会导致RO膜的快速且严重的有机污堵(Bellona et al., 2004; Jarusutthirak et al., 2007).
分析SMP中大分子的成分可以发现, AM1-1与AM1-2产生的SMP中多糖、蛋白质含量比均约为1:1, 并且均含有大分子多糖(分子量>105 Da), 但AM1-1能产生大分子蛋白质(分子量>105 Da)而AM1-2不能.因此, AM1-1的SMP中同时存在大分子多糖和大分子蛋白, AM1-2的SMP中只有大分子多糖, 但AM1-2产生的大分子有机物分子量(>106 Da)大于AM1-1产生的大分子有机物分子量(>105 Da).然而AM1-2产生的SMP的RO膜污堵能力仍比AM1-1产生的SMP强, 说明SMP中大分子有机物的分子量是影响其膜污堵特性的关键, 大分子多糖与蛋白质的比例则对SMP的膜污堵特性没有关键性的影响.也有相关研究表明, 大分子蛋白质对RO膜污堵的贡献不如大分子多糖强(Ang et al., 2007; Li et al., 2007; Yu et al., 2012), 因此, AM1-2中的大分子多糖也有可能是决定其膜污堵特性的关键性物质.
4 结论(Conclusions)1) 在葡萄糖培养基中, 细菌Pseudomonas sp.AM1-1和Chromobacterium sp.AM1-2产生的SMP内多糖和蛋白质的比例均约为1:1, 但SMP的分子量分布不同.AM1-1的SMP中多糖的分子量分布范围为大于105 Da和小于103 Da, AM1-1的SMP中多糖的分子量分布范围为大于106 Da和小于103 Da, 二者多糖分子量均呈双峰式分布, 但AM1-1中大分子多糖的分子量低于AM1-2, 且AM1-2中小分子多糖浓度相对较低;AM1-1的SMP中蛋白质类物质主要分布于分子量大于105 Da和分子量小于103 Da的范围内, 呈双峰式分布;AM1-2的SMP中蛋白质类物质主要集中分布于分子量小于103 Da的范围内.
2) SMP中有机物的分子量越大, 越容易沉积到RO膜表面形成滤饼层, 从而导致RO膜污堵, 因此, SMP中大分子有机物的分子量是决定其膜污堵特性的关键性物质, 并且SMP中大分子(分子量大于105 Da)多糖、蛋白质的比例与其RO膜污堵潜力没有必然关系.去除SMP中的大分子有机物特别是大分子多糖, 有利于削弱其RO膜污堵潜力.
Ang W, Elimelech M. 2007. Protein(BSA)fouling of reverse osmosis membranes:Implications for wastewater reclamation[J]. Journal of Membrane Science, 296(1/2): 83–92.
|
Ang W S, Tiraferri A, Chen K L, et al. 2011. Fouling and cleaning of RO membranes fouled by mixtures of organic foulants simulating wastewater effluent[J]. Journal of Membrane Science, 376(1/2): 196–206.
|
Barker D J, Stuckey D C. 1999. A review of soluble microbial products(SMP) in wastewater treatment systems[J]. Water Research, 33(14): 3063–3082.
DOI:10.1016/S0043-1354(99)00022-6
|
Bellona C, Drewes J E, Xu P, et al. 2004. Factors affecting the rejection of organic solutes during NF/RO treatment——a literature review[J]. Water Research, 38(12): 2795–2809.
DOI:10.1016/j.watres.2004.03.034
|
Chon K, Cho J, Shon H K, et al. 2012. Advanced characterization of organic foulants of ultrafiltration and reverse osmosis from water reclamation[J]. Desalination, 301: 59–66.
DOI:10.1016/j.desal.2012.06.011
|
董春娟, 吕炳南. 2004. 污水处理中的溶解性微生物产物(SMP)[J]. 中国给水排水, 2004, 20(1): 22–25.
DOI:10.3321/j.issn:1000-4602.2004.01.006 |
Falath W, Sabir A, Jacob K I. 2017. Novel reverse osmosis membranes composed of modified PVA/Gum arabic conjugates:Biofouling mitigation and chlorine resistance enhancement[J]. Carbohydrate Polymers, 155: 28–39.
DOI:10.1016/j.carbpol.2016.08.058
|
胡洪营, 吴光学, 吴乾元, 等. 2015. 面向污水资源极尽利用的污水精炼技术与模式探讨[J]. 环境工程技术学报, 2015, 5(1): 1–6.
DOI:10.3969/j.issn.1674-991X.2015.01.001 |
Huber S A, Balz A, Abert M. 2011. New method for urea analysis in surface and tap waters with LC-OCD-OND(liquid chromatography-organic carbon detection-organic nitrogen detection)[J]. Journal of Water Supply:Research & Technology-AQUA, 60(3): 159–166.
|
Hung P V X, Oh B S, Tung B X, et al. 2013. Reflection of the structural distinctions of source-different humic substances on organic fouling behaviors of SWRO membranes[J]. Desalination, 318: 72–78.
DOI:10.1016/j.desal.2013.03.019
|
Jarusutthirak C, Amy G. 2007. Understanding soluble microbial products(SMP) as a component of effluent organic matter(EfOM)[J]. Water Res, 41(12): 2787–2793.
DOI:10.1016/j.watres.2007.03.005
|
Kim O S, Cho Y J, Lee K, et al. 2012. Introducing EzTaxon-e:a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. International Journal of Systematic & Evolutionary Microbiology, 62(Pt 3): 716–721.
|
Li Q, Xu Z, Pinnau I. 2007. Fouling of reverse osmosis membranes by biopolymers in wastewater secondary effluent:Role of membrane surface properties and initial permeate flux[J]. Journal of Membrane Science, 290(1/2): 173–181.
|
Lowry O H, Rosebrough N J, Farr A L, et al. 1951. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 193(1): 265–275.
|
Matin A, Khan Z, Zaidi S M, et al. 2011. Biofouling in reverse osmosis membranes for seawater desalination:Phenomena and prevention[J]. Desalination, 281: 1–16.
DOI:10.1016/j.desal.2011.06.063
|
Mo H, Tay K G, Ng H Y. 2008. Fouling of reverse osmosis membrane by protein(BSA):Effects of pH, calcium, magnesium, ionic strength and temperature[J]. Journal of Membrane Science, 315(1/2): 28–35.
|
Rondel C, Marcato-Romain C E, Girbal-Neuhauser E. 2013. Development and validation of a colorimetric assay for simultaneous quantification of neutral and uronic sugars[J]. Water Research, 47(8): 2901–2908.
DOI:10.1016/j.watres.2013.03.010
|
Shon H K, Vigneswaran S, Snyder S A. 2006. Effluent organic matter(EfOM) in wastewater:Constituents, effects, and treatment[J]. Critical Reviews in Environmental Science and Technology, 36(4): 327–374.
DOI:10.1080/10643380600580011
|
Singh R. 2011. Analysis of energy usage at membrane water treatment plants[J]. Desalination and Water Treatment, 29: 63–72.
DOI:10.5004/dwt.2011.2988
|
Spriko K, Linek V, Cerkasov J. 1989. Glucose-concentration measurement using immobilized glucose-oxidase[J]. Journal of Electroanalytical Chemistry, 259(1/2): 155–171.
|
Stedmon C A, Markager S, Bro R. 2003. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 82(3/4): 239–254.
|
孙丽萍, 吴珊, 居江, 等. 2007. 污水再生回用中的膜技术及其发展趋势[J]. 水工业市场, 2007, 15(11): 34–37.
|
Tang F, Hu H Y, Sun L J, et al. 2014. Fouling of reverse osmosis membrane for municipal wastewater reclamation:Autopsy results from a full-scale plant[J]. Desalination, 349: 73–79.
DOI:10.1016/j.desal.2014.06.018
|
汤芳, 孙迎雪, 石晔, 等. 2013. 污水再生处理微滤-反渗透工艺经济分析[J]. 环境工程学报, 2013, 7(2): 417–421.
|
汤芳. 2015. 污水再生处理反渗透工艺膜污堵组分识别与控制[D]. 北京: 清华大学
|
Wang Z P, Zhang T. 2010. Characterization of soluble microbial products(SMP) under stressful conditions[J]. Water Research, 44(18): 5499–5509.
DOI:10.1016/j.watres.2010.06.067
|
吴艳芳, 李晓鸽, 车铁军, 等. 2012. 低分子量硫酸化多糖的体积排阻色谱法分离及其组成定量分析[J]. 色谱, 2012, 30(2): 178–183.
|
谢文州, 郦和生. 2015. 反渗透膜有机污染的研究现状综述[J]. 净水技术, 2015, 34(5): 21–25.
DOI:10.3969/j.issn.1009-0177.2015.05.004 |
杨文澜, 潘丙才, 张淑娟, 等. 2013. 污水二级出水有机物(EfOM)的组成、性质及处理技术[J]. 水处理技术, 2013, 39(5): 1–6.
DOI:10.3969/j.issn.1000-3770.2013.05.001 |
Yu S, Chen Z H, Liu J Q, et al. 2012. Intensified cleaning of organic-fouled reverse osmosis membranes by thermo-responsive polymer(TRP)[J]. Journal of Membrane Science, 392-393: 181–191.
DOI:10.1016/j.memsci.2011.12.025
|
Yu Y, Lee S, Hong S. 2010. Effect of solution chemistry on organic fouling of reverse osmosis membranes in seawater desalination[J]. Journal of Membrane Science, 351(1/2): 205–213.
|
岳兰秀, 吴丰昌, 刘丛强, 等. 2005. 红枫湖和百花湖天然溶解有机质的分子荧光特征与分子量分布的关系[J]. 科学通报, 2005, 50(24): 2774–2780.
DOI:10.3321/j.issn:0023-074X.2005.24.016 |
 2018, Vol. 38
2018, Vol. 38


