过氧乙酸(Peracetic acid, 简称PAA)是乙酸的过氧化物, 商业的PAA溶液是一种含有PAA、乙酸、过氧化氢和水的混合物, 其平衡式表示如下:
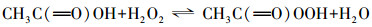
|
(1) |
PAA由于高效的消毒、漂白和无毒无害的性能, 已被广泛应用于食品、医疗器具、制药、纺织、纸浆及水产养殖中(Kitis, 2004; 张帅等, 2017).近30年来, PAA在污废水中的应用逐渐引起了人们的关注(Luukkonen et al., 2017).美国、丹麦等国家将PAA作为一种可替代的消毒剂应用于合流污水溢流及污水消毒(USEPA, 2012; Chhetri et al., 2014).有研究表明, PAA相比次氯酸或二氧化氯对霍乱弧菌或典型细菌指标的消毒效率更高(Baldry et al., 1995; De Luca et al., 2008).由于PAA受有机物质的影响较小, 不产生或少产生消毒副产物, 且消毒效率高, 因此, PAA可能替代氯消毒剂广泛应用于水处理中.同时作为一种新型的有机过氧氧化剂, PAA的标准氧化还原电位相对于在pH=0和pH=14下的标准氢电极(SHE)分别为1.748和1.005 V;在生化标准状态条件下(pH=7、25 ℃、101.325 Pa), PAA的氧化还原电位与SHE相比为1.385 V(Zhang et al., 2018).另外, PAA的过氧键键能(38 kcal·mol-1)小于过氧化氢的过氧键键能(51 kcal·mol-1), 可能导致PAA产生更多的自由基(Bianchini et al., 2002).如可以通过超声联用过渡金属氧化物催化剂(Rokhina et al., 2013)、UV照射(Bianchini et al., 2002)及活性炭纤维(ACFs)(Zhou et al., 2015)来活化PAA产生羟基自由基(HO·)、酰基(CH3COO·)及过氧酰基(CH3COOO·)等活性氧自由基.其中, 单独使用PAA或通过产生活性自由基的方式能有效去除水溶液中的有机微污染物, 如个人护理产品(Cai et al., 2017)、抗生素(Zhang et al., 2017)、酚类(Rokhina et al., 2010)、染料(Zhou et al., 2015)等.因此, 活化PAA可以作为一种新型的高级氧化技术应用于污染物的去除.我国工业废水中的重金属离子种类较多、含量较高, 其中, 过渡态金属离子由于其自身结构有空轨道, 易失去电子或夺取电子, 常被用来活化氧化剂产生自由基达到降解污染物的目的.
研究表明, 过渡态Co(Ⅱ)对无机过氧化物如过一硫酸盐(PMS)有优异的活化性能, 微量的Co(Ⅱ)即可迅速活化PMS的过氧键产生高活性的硫酸根自由基(SO4-·)(Anipsitakis et al., 2003;2004;Chen et al., 2007; Sun et al., 2009).因此, 为了探索过渡态Co(Ⅱ)是否对有机过氧化物PAA的过氧键也有同样的效果, 本实验采用均相的Co(Ⅱ)/PAA体系, 研究该体系对不同染料的脱色效果.其中, 以AO7为主要目标污染物, 对比Co(Ⅱ)/PMS、Co(Ⅱ)/PS、Co(Ⅱ)/HP、Fe(Ⅱ)/PAA、Fe(Ⅱ)/HP等其他氧化体系的效果, 以及探索Co(Ⅱ)浓度、PAA浓度、初始pH值、自由基抑制剂、Cl-浓度及腐殖质浓度等主要因素对AO7脱色的影响.
2 材料与方法(Materials and methods) 2.1 材料试剂染料试剂:酸性橙(AO7)、刚果红(CR)、亚甲基蓝(MB)及结晶紫(CV)均购置于国药集团化学试剂有限公司, 具体参数如表 1所示.过氧化物氧化剂:过氧乙酸(CH3COOOH, 质量分数约36%, PAA)、过一硫酸盐(HKSO5·0.5KHSO4·0.5K2SO4, PMS)及过二硫酸盐(Na2S2O8, PS)均购于Sigma-Aldrich, 过氧化氢(质量分数约36%, H2O2, HP)购于Aladdin试剂公司.氯化钴(CoCl2·6H2O)购置于国药集团化学试剂有限公司;实验所用抗坏血酸(C6H8O6, AA)、甲醇(CH3OH, MeOH)、叔丁醇(C4H9OH, TBA)、硫代硫酸钠(Na2S2O3)、乙二胺四乙酸二钠(EDTA)、腐殖酸(HA)、N, N-二乙基-1, 4-苯二胺硫酸盐(DPD)、碘化钾(KI)、三水合磷酸氢二钾(K2HPO4·3H2O)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钾(KH2PO4)均为分析纯, 实验中用水均为超纯水.
| 表 1 染料的相关参数 Table 1 The properties of dyes |
本实验操作过程以偶氮染料AO7为例, 在一定温度下, 先加入一定量的AO7溶液和Co(Ⅱ)溶液至注有一定超纯水的锥形瓶中, 再加入一定量的PAA来启动反应并迅速调节溶液pH至设定值.整个反应置于搅拌器上搅拌均匀, 在预定时间内快速取样, 加入0.2 mol·L-1的Na2S2O3来淬灭反应并随后测定其吸光度.重复试验两次以上以减少实验误差.
2.3 分析方法染料的浓度变化采用Mapada UV-1600 PC紫外可见分光光度计测定, AO7、CR、MB、CV分别于最大吸收波长484、496、664、580 nm处测定其吸光度, 代入标准曲线求得其浓度.采用国标法(GB/T 19104-2008)(中华人民共和国国家质量监督检验检疫总局, 2008)校准PAA的初始浓度;PAA剩余浓度采用DPD法测定(Cai et al., 2017).总有机碳(TOC)采用TOC测定仪(TOC-LCPH, 岛津)测定.
3 结果与讨论(Results and discussion) 3.1 Co(Ⅱ)活化PAA的性能图 1a~d显示了Co(Ⅱ)/PAA体系下, 不同有机染料的脱色情况, 其中, C0对应物质的初始浓度, C对应物质的剩余浓度.从图中可以看出, 单独的钴离子对所选目标有机染料均没有脱色效能;单独的PAA对各染料均有一定的脱色能力, 其中对AO7的脱色率为12%, 对CR、MB、CV的脱色率分别为40%、27%、44%.PAA除了对刚果红(CR)的脱色呈近似直线趋势外, 对其他3种污染物在前10 min内去除最快, 之后的脱色率几乎不再变化.加入Co(Ⅱ)后, 染料的脱色速率快速增加, 同样在前10 min内是增速阶段;30 min后, 染料的脱色率基本达到平衡;60 min后, AO7、CR、MB及CV的脱色率分别为92%、98%、52%和67%.同时可以发现, 含有偶氮键的染料(如AO7和CR)相比不含偶氮键的染料(如MB和CV)易于脱色, 含有多个偶氮键的染料(如CR)优先于含有单个偶氮键的染料(如CR)脱色.综上表明, Co(Ⅱ)可以有效促进PAA脱色有机染料, 其脱色能力与染料的结构密切相关.
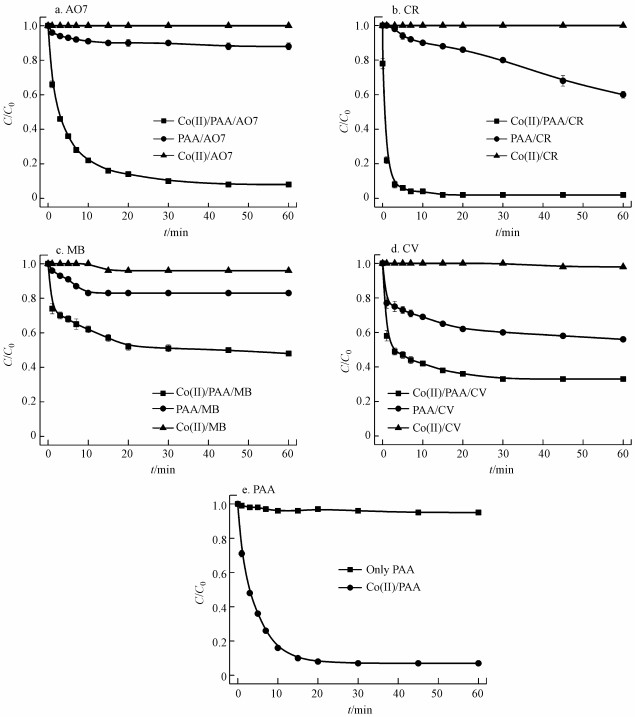 |
| 图 1 Co(Ⅱ)/PAA体系中不同染料脱色和PAA的分解情况([Dyes]0=0.05 mmol·L-1, [PAA]0/[Dyes]0=4/1, [Co(Ⅱ)]0 =0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 1 Degradation of various dyes and PAA in the Co(Ⅱ)/PAA system |
为了进一步观察Co(Ⅱ)对PAA的活化, 在Co(Ⅱ)/PAA/AO7体系中检测了每个对应时间点PAA的浓度变化.如图 1e所示, PAA单独存在时基本不分解, 而存在Co(Ⅱ)时, PAA快速分解, 这与AO7的脱色趋势一致.说明在Co(Ⅱ)/PAA体系中, Co(Ⅱ)能够分解PAA产生其他物质加速AO7的脱色.
3.2 不同氧化体系的比较为了考察PAA的氧化性能, 本研究选择其他3种含有过氧键的过氧化物(PMS、PS、HP)作对比.如图 2a所示, 单独的过氧化物对AO7脱色效果均不明显, Co(Ⅱ)的加入对PS和HP脱色AO7没有起到促进作用, 说明Co(Ⅱ)不能有效催化PS和HP, 这与Anipsitakis等(2004)曾报道的Co(Ⅱ)不能催化PS和HP降解2, 4-二氯苯酚的结论一致.然而, 在Co(Ⅱ)/PAA和Co(Ⅱ)/PMS这两个体系中, AO7的脱色速率几乎接近;甚至在前20 min内, Co(Ⅱ)/PAA体系中的脱色速率稍微快于Co(Ⅱ)/PMS体系中的脱色速率.Co(Ⅱ)/PMS体系的优异氧化性能已被证实(Hu et al., 2016), 因此, 以上现象可以表明经过Co(Ⅱ)活化后的PAA具有与PMS类似甚至更优异的氧化性能.
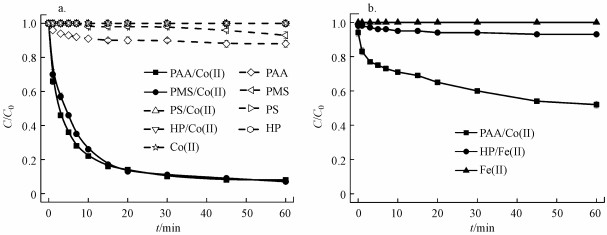 |
| 图 2 不同氧化体系对AO7的脱色效果([AO7]0 =0.05 mmol·L-1, [Oxidants]0/[AO7]0=4/1, [Co(Ⅱ)]0 =0.01 mmol·L-1, [Fe(Ⅱ)]0 =0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 2 Degradation of AO7 by different oxidation systems |
传统的Fenton法常被用于染料废水的预处理, 能有效去除废水中的难降解成分(Deng et al., 2006).相比HP, 本实验中PAA与Fe(Ⅱ)的联用效果明显优于Fe(Ⅱ)/HP体系.如图 2b所示, 在Fe(Ⅱ)/PAA体系中, AO7的脱色率为48%;而在Fe(Ⅱ)/HP体系中, 只有7%的AO7被脱色.另外, 相比Fe(Ⅱ), Co(Ⅱ)也表现出高效活化PAA的性能, 这与Anipsitakis等(2004)报道的不同金属离子对同一氧化剂或同一金属对不同氧化剂的活化效果存在差异性的结论一致.因此, 相比Fenton法, Co(Ⅱ)/PAA体系对染料AO7的脱色更有效.
3.3 PAA浓度和Co(Ⅱ)浓度对AO7脱色的影响图 3a为Co(Ⅱ)/PAA体系中, 不同PAA浓度对AO7脱色的影响.固定Co(Ⅱ)浓度为10 μmol·L-1, 当[PAA]0/[AO7]0从0增加到1/1时, 10 min时AO7的脱色率由0快速增加到46%, 并在10 min之后脱色率基本不变, 说明体系中的氧化介质已被消耗殆尽.再增加PAA的量, 如[PAA]0/[AO7]0由1/1增加到4/1, AO7的脱色率同步增加, 并且脱色幅度也同步增加.继续增大PAA的量, AO7的脱色率也继续增大, 如[PAA]0/[AO7]0由4/1增大到8/1, AO7的脱色率在30 min内由92%增加到100%, 可以实现AO7的完全脱色;当[PAA]0/[AO7]0为16/1时, 发现AO7在反应5 min内就可以实现完全去除, 并且此浓度下, 单独的PAA对AO7脱色的贡献不大.由此可见, 随着PAA浓度的增大, 氧化降解AO7的速率随之增大, 达到完全脱色的时间也随之减短, 但这也将成倍的增加氧化剂PAA的成本.由降解效果和成本两方面分析可得, 选择4/1为以下实验[PAA]0/[AO7]0的浓度比.
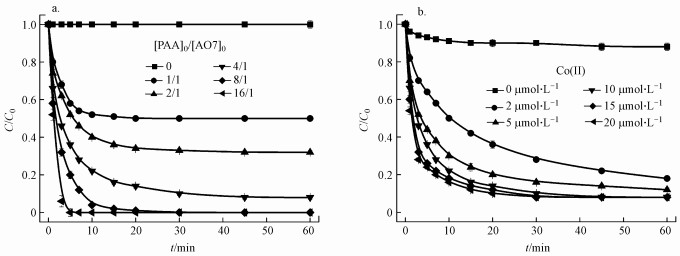 |
| 图 3 Co(Ⅱ)/PAA体系中PAA浓度(a)和Co(Ⅱ)浓度(b)对AO7脱色的影响([AO7]0 =0.05 mmol·L-1, pH=7.0, T=298 K) Fig. 3 Effect of PAA concentration(a) and Co(Ⅱ) concentration (b) on the degradation of AO7 in the Co(Ⅱ)/PAA system |
图 3b为Co(Ⅱ)/PAA体系中, 不同浓度Co(Ⅱ)对AO7脱色的影响.固定[PAA]0/[AO7]0为4/1, 当Co(Ⅱ)浓度由0 μmol·L-1增加到2 μmol·L-1, AO7的脱色率迅速从12%增加到82%, 再增加Co(Ⅱ)的量, AO7脱色率继续增加, 增长幅度却逐渐下降甚至不变, 如Co(Ⅱ)浓度从10 μmol·L-1增加到20 μmol·L-1时, 两者反应60 min后的AO7脱色率一样, 都是92%, 并且单独Co(Ⅱ)不会使AO7脱色.由此可见, 加入少量甚至微量的Co(Ⅱ)就可以达到PAA快速降解AO7脱色的效果;增大Co(Ⅱ)的量除了初期能增大AO7的脱色速率外, 并不能缩短后期达到脱色平衡的时间, 也不能达到完全去除AO7的目的.
3.4 初始pH的影响纺织工业废水水质复杂, pH范围广(Guan et al., 2011).为研究Co(Ⅱ)/PAA体系是否具有pH依赖性, 在初始pH为3.0~9.0的范围内进行了一系列实验.如图 4所示, 该体系对AO7的脱色受pH影响较大, 其中, 在弱酸或中性的条件下脱色效果最好;在强酸环境中, PAA不能被Co(Ⅱ)有效活化, 导致AO7脱色受到抑制;在碱性条件下, PAA主要以CH3COOO-的形式存在(式(2)), 活性低且Co2+在强碱中易形成Co(OH)2沉淀物(式(3)~(4))(Anipsitakis et al., 2005; Fan et al., 2017), 造成活性物种产量的减少, AO7的脱色效率随之降低.因此, 在强酸或碱性环境中, AO7在Co(Ⅱ)/PAA体系中的脱色率都会降低.

|
(2) |
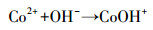
|
(3) |
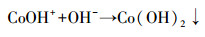
|
(4) |
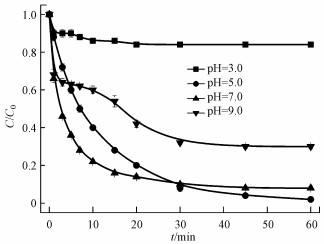 |
| 图 4 初始pH对Co(Ⅱ)/PAA体系脱色AO7的影响([AO7]0=0.05 mmol·L-1, [PAA]0/[AO7]0=4/1, [Co(Ⅱ)]0=0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 4 Effect of initial pH on the degradation of AO7 in the Co(Ⅱ)/PAA system |
为了确定Co(Ⅱ)/PAA体系为自由基反应而不是非自由基反应, 采用抗坏血酸(AA)这一典型的自由基清除剂(Liang et al., 2008; Zhou et al., 2015), 初步测试Co(Ⅱ)/PAA体系中是否产生了自由基.如图 5a所示, 随着AA浓度的增加, AO7的脱色率逐渐降低, 当AA的量足够大时, AO7的脱色率在5 min后基本不变, 这表明AA对AO7的脱色有明显的抑制作用, 说明在Co(Ⅱ)/PAA体系中确实产生了自由基.
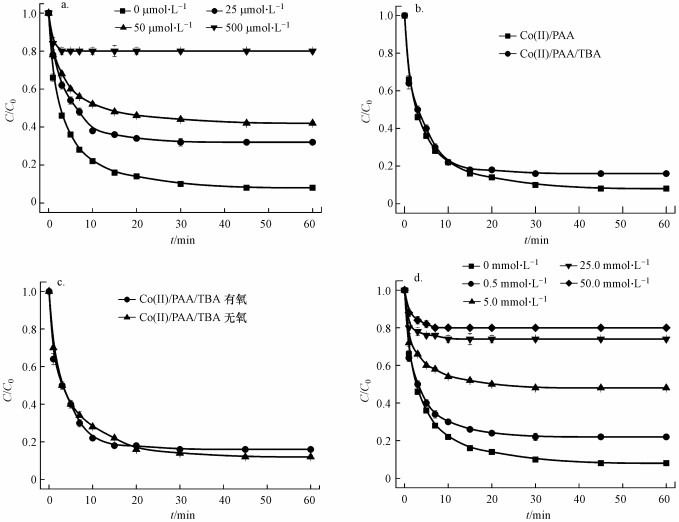 |
| 图 5 自由基抑制剂对Co(Ⅱ)/PAA体系中AO7脱色的影响(a. AA浓度, b.TBA([TBA]0/[AO7]0=1000/1,为50.0 mmol·L-1), c.溶解氧(充N2), d.MeOH浓度;[AO7]0=0.05 mmol·L-1, [PAA]0/[AO7]0=4/1, [Co(Ⅱ)]0=0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 5 Degradation of AO7 in the Co(Ⅱ)/PAA system under the presence of different radical scavengers |
此外, 在PAA体系中可能会产生HO·、CH3COO·、CH3COOO·、CH3·、CH3OO·等自由基(式(5)~(8)(蔡美全, 2016).为了进一步确认Co(Ⅱ)/PAA体系中的自由基物种, 采用加入叔丁醇(TBA)、甲醇(MeOH)及充N2脱氧的方式进行试验.TBA作为一种典型的HO·清除剂(K= 6.0×108L·mol-1·s-1)(Chen et al., 2016), 由图 5b可以发现, 高浓度TBA的存在与否对AO7脱色没有很大影响, 推测HO·在Co(Ⅱ)/PAA体系中不是唯一的自由基, 因此, 在Co(Ⅱ)/PAA/TBA中可能剩余的自由基为这些碳中心自由基:CH3COO·、CH3COOO·、CH3·、CH3OO·.由于CH3·在氧饱和环境中能够迅速与氧结合生成CH3O2·, 而CH3OO·是一种相比CH3COOO·较弱的过氧自由基, 因此, 可以在Co(Ⅱ)/PAA/TBA体系中通入N2去除反应液中的溶解氧来验证这两种自由基的作用.如图 5c所示, AO7的脱色率在无氧条件下和有氧条件下基本一致, 说明CH3·和CH3OO·在AO7脱色过程中作用不大.由此可推测, CH3COO·和CH3COOO·是Co(Ⅱ)/PAA中能与AO7反应的未知自由基.这与Zhang等(1998)提出的结论一致, 即钴离子可以通过式(9)和(10)活化PAA产生CH3COO·和CH3COOO·这两种活性自由基, 从而达到降解污染物的效果.另外, 相关研究表明, 含有α-H的甲醇对自由基有猝灭作用(Chen et al., 2018).通过加入一系列不同浓度的甲醇, 考察了甲醇是否对本体系产生的自由基有影响.由图 5d可知, AO7的脱色明显受到抑制, 当加入0.5 mmol·L-1的甲醇时, AO7的脱色率由84%降为78%;当加入5 mmol·L-1的甲醇时, AO7的脱色率降到52%.表明存在甲醇时, 确实会影响本体系自由基的产生, 进而抑制AO7的脱色, 但其抑制机理有待研究.
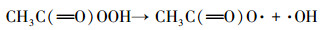
|
(5) |
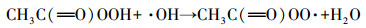
|
(6) |
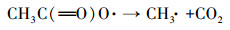
|
(7) |
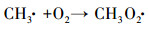
|
(8) |

|
(9) |
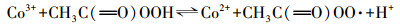
|
(10) |
为了更好地染色, 印染过程中通常加入NaCl加速染色, 导致工业废水中Cl-含量超高(Chan et al., 2009).因此, 研究Cl-对Co(Ⅱ)/PAA体系的影响至关重要.图 6a显示了在Co(Ⅱ)/PAA体系中不同Cl-浓度对AO7脱色的影响, 可以看出, 随着Cl-浓度的增加, AO7的脱色率呈下降趋势, 表明过量的Cl-不利于该体系AO7的脱色.相关研究表明, 过量的Cl-可能会与活性自由基反应, 生成反应活性较低的Cl·和Cl2· (Shah et al., 2015; Zhou et al., 2015), 从而降低AO7的脱色效果.
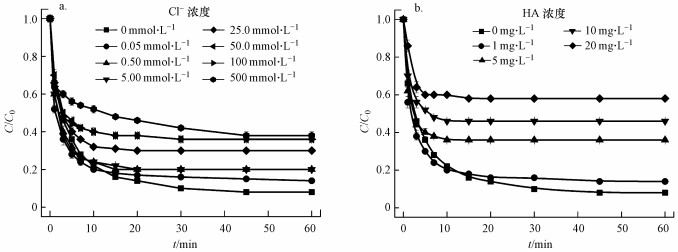 |
| 图 6 Cl-(a)及HA(b)浓度对Co(Ⅱ)/PAA体系中AO7脱色的影响([AO7]0=0.05 mmol·L-1, [PAA]0/[AO7]0=4/1, [Co(Ⅱ)]0=0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 6 Effect of Cl- (a) and HA (b) concentrations on AO7 degradation in the Co(Ⅱ)/PAA system |
采用HA作为天然有机物的代表性物质, 研究水体中的天然有机物对Co(Ⅱ)/PAA体系对AO7脱色的影响.如图 6b所示, 随着HA浓度的逐渐升高, 其对AO7的脱色影响程度逐渐增大;当HA浓度达20 mg·L-1时, AO7的脱色率由92%降为42%, 下降了50%, 表明天然有机物的存在对Co(Ⅱ)活化PAA降解AO7有一定的抑制作用.有研究报道, PAA用于水处理时, PAA投加量随水体中有机物含量的增加而增加(Koivunen et al., 2005), 因此, 推测HA会消耗部分PAA或者捕捉自由物种充当淬灭剂的作用, 从而使AO7的脱色程度降低.
3.7 AO7脱色过程分析图 7为AO7在脱色过程中的紫外可见光谱及反应体系的TOC变化情况.由光谱图可知, AO7在484 nm和310 nm处有两个特征吸收峰, 分别代表AO7的发色基团偶氮键和萘环结构.这两个特征吸收峰的波峰强度随着反应的进行不断减小并趋于消失, 表明AO7的偶氮键和萘环结构不断被氧化降解, 同时可以看到在333 nm处也逐渐形成了新的产物峰.通过观察反应0、5、10、30、60 min后体系的TOC变化, 发现TOC并未随时间变化而明显降低.这种现象在Lazarova等(1998)和Luukkonen等(2014)的研究中也曾报道过, 即采用PAA处理后的废水其TOC的量并不会大幅度降低甚至还能有所增加, 他们认为PAA作为一种有机消毒剂, 对TOC的测定有一定的干扰.蔡美全(2016)也曾提出以碳为中心的自由基为主要自由基物种时, 并不利于降解产物的进一步矿化.
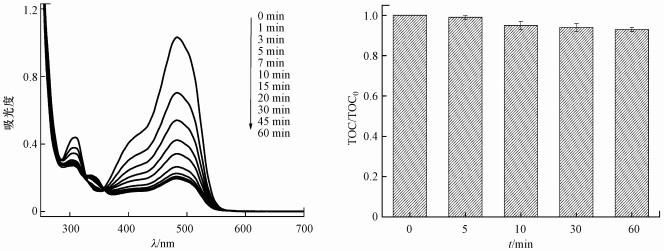 |
| 图 7 AO7脱色过程中紫外可见光谱及TOC的变化([AO7]0=0.05 mmol·L-1, [PAA]0/[AO7]0=4/1, [Co(Ⅱ)]0=0.01 mmol·L-1, pH=7.0, T=298 K) Fig. 7 UV-Vis spectra and TOC changes during AO7 degradation |
1) Co(Ⅱ)对不同过氧氧化剂的活化能力有一定的差别, 其中, 活化PAA与活化PMS的能力相当, 但对PS和HP基本不活化.
2) 相比Fenton体系, Co(Ⅱ)/PAA体系的氧化性能优于Fe(Ⅱ)/PAA体系, Fe(Ⅱ)/PAA体系的氧化性能优于Fe(Ⅱ)/HP体系.
3) Co(Ⅱ)/PAA体系对不同有机染料都有一定的脱色能力, 其脱色效果依次为:CR > AO7 > CV > MB.
4) AO7的脱色率随PAA和Co(Ⅱ)浓度的增大而增大, 弱酸和中性的环境有利于AO7的脱色, Cl-及HA的存在会抑制AO7的脱色.
5) 通过自由基推测试验发现, CH3COO·和CH3COOO·是Co(Ⅱ)/PAA体系中使AO7脱色的主要自由基.
6) 通过紫外光谱分析可知, 产生的自由基主要攻击AO7的偶氮键和萘环结构, 而这些含碳自由基也将不利于体系TOC的降低.
Anipsitakis G P, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38(13): 3705–3712.
|
Anipsitakis G P, Dionysiou D D. 2003. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science & Technology, 37(20): 4790–4797.
|
Anipsitakis G P, Stathatos E, Dionysiou D D. 2005. Heterogeneous activation of oxone using Co3O4[J]. The journal of Physical Chemistry.B, 109(27): 13052–13055.
DOI:10.1021/jp052166y
|
Baldry M G C, Cavadore A, French M S, et al. 1995. Effluent disinfection in warm climates with peracetic acid[J]. Water Science and Technology, 31(5): 161–164.
|
Bianchini R, Calucci L, Caretti C, et al. 2002. An EPR study on wastewater disinfection by peracetic acid, hydrogen peroxide and UV irradiation[J]. Annali Di Chimica, 92(9): 783–793.
|
Bianchini R, Calucci L, Lubello C, et al. 2002. Intermediate free radicals in the oxidation of wastewaters[J]. Research on Chemical Intermediates, 28(2/3): 247–256.
|
Cai M, Sun P, Zhang L, et al. 2017. UV/Peracetic acid for degradation of pharmaceuticals and reactive species evaluation[J]. Environmental Science & Technology, 51(24): 14217–14224.
|
蔡美全.2016.微量药物污染物在氯和紫外/过氧乙酸消毒过程中的降解与转化规律研究[D].北京: 北京林业大学
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3099778 |
Chan K H, Chu W. 2009. Degradation of atrazine by cobalt-mediated activation of peroxymonosulfate:Different cobalt counteranions in homogenous process and cobalt oxide catalysts in photolytic heterogeneous process[J]. Water Research, 43(9): 2513–2521.
DOI:10.1016/j.watres.2009.02.029
|
Chen J, Fang C, Xia W, et al. 2018. Selective transformation of β-Lactam antibiotics by peroxymonosulfate:Reaction kinetics and nonradical mechanism[J]. Environmental Science & Technology, 52(3): 1461–1470.
|
Chen J, Hong W, Huang T, et al. 2016. Activated carbon fiber for heterogeneous activation of persulfate:implication for the decolorization of azo dye[J]. Environmental Science & Pollution Research International, 23(18): 1–11.
|
Chen X, Qiao X, Wang D, et al. 2007. Kinetics of oxidative decolorization and mineralization of Acid Orange 7 by dark and photoassisted Co2+-catalyzed peroxymonosulfate system[J]. Chemosphere, 67(4): 802–808.
DOI:10.1016/j.chemosphere.2006.10.032
|
Chhetri R K, Thornberg D, Berner J, et al. 2014. Chemical disinfection of combined sewer overflow waters using performic acid or peracetic acids[J]. Science of the Total Environment, 490: 1065–1072.
DOI:10.1016/j.scitotenv.2014.05.079
|
De Luca G, Sacchetti R, Zanetti F, et al. 2008. Comparative study on the efficiency of peracetic acid and chlorine dioxide at low doses in the disinfection of urban wastewaters[J]. Annals of Agricultural and Environmental Medicine:AAEM, 15(2): 217–224.
|
Deng Y, Englehardt J D. 2006. Treatment of landfill leachate by the Fenton process[J]. Water Research, 40(20): 3683–3694.
DOI:10.1016/j.watres.2006.08.009
|
Fan Y, Ji Y, Zheng G, et al. 2017. Degradation of atrazine in heterogeneous Co3O4 activated peroxymonosulfate oxidation process:Kinetics, mechanisms, and reaction pathways[J]. Chemical Engineering Journal, 330: 831–839.
DOI:10.1016/j.cej.2017.08.020
|
Guan Y, Ma J, Li X, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environmental Science & Technology, 45(21): 9308–9314.
|
Hu P, Long M. 2016. Cobalt-catalyzed sulfate radical-based advanced oxidation:A review on heterogeneous catalysts and applications[J]. Applied Catalysis B:Environmental, 181: 103–117.
DOI:10.1016/j.apcatb.2015.07.024
|
Kitis M. 2004. Disinfection of wastewater with peracetic acid:a review[J]. Environment International, 30(1): 47–55.
DOI:10.1016/S0160-4120(03)00147-8
|
Koivunen J, Heinonen-Tanski H. 2005. Peracetic acid (PAA) disinfection of primary, secondary and tertiary treated municipal wastewaters[J]. Water Research, 39(18): 4445–4453.
DOI:10.1016/j.watres.2005.08.016
|
Lazarova V, Janex M L, Fiksdal L, et al. 1998. Advanced wastewater disinfection technologies:Short and long term efficiency[J]. Water Science and Technology, 38(12): 109–117.
DOI:10.2166/wst.1998.0516
|
Liang S, Zhao L, Zhang B, et al. 2008. Experimental studies on the chemiluminescence reaction mechanism of carbonate/bicarbonate and hydrogen peroxide in the presence of cobalt(Ⅱ)[J]. The Journal of Physical Chemistry.A, 112(4): 618–623.
DOI:10.1021/jp0761822
|
Luukkonen T, Pehkonen S O. 2017. Peracids in water treatment:A critical review[J]. Critical Reviews in Environmental Science and Technology, 47(1): 1–39.
DOI:10.1080/10643389.2016.1272343
|
Luukkonen T, Teeriniemi J, Prokkola H, et al. 2014. Chemical aspects of peracetic acid based wastewater disinfection[J]. Water Sa, 40(1): 73–80.
DOI:10.4314/wsa.v40i1.9
|
Rokhina E V, Makarova K, Golovina E A, et al. 2010. Free radical reaction pathway, thermochemistry of peracetic acid homolysis, and its application for phenol degradation:spectroscopic study and quantum chemistry calculations[J]. Environmental Science and Technology, 44(17): 6815–6821.
DOI:10.1021/es1009136
|
Rokhina E V, Makarova K, Lahtinen M, et al. 2013. Ultrasound-assisted MnO2 catalyzed homolysis of peracetic acid for phenol degradation:The assessment of process chemistry and kinetics[J]. Chemical Engineering Journal, 221: 476–486.
DOI:10.1016/j.cej.2013.02.018
|
Shah A D, Liu Z, Salhi E, et al. 2015. Peracetic acid oxidation of saline waters in the absence and presence of H2O2:secondary oxidant and disinfection byproduct formation[J]. Environmental Science & Technology, 49(3): 1698–1705.
|
Sun J, Li X, Feng J, et al. 2009. Oxone/Co2+ oxidation as an advanced oxidation process:Comparison with traditional Fenton oxidation for treatment of landfill leachate[J]. Water Research, 43(17): 4363–4369.
DOI:10.1016/j.watres.2009.06.043
|
USEPA.2012.Alternative Disinfection Methods Fact Sheet: Peracetic Acid[R].Washington, DC: Office of Wastewater Management
|
Zhang C, Brown P J B, Hu Z. 2018. Thermodynamic properties of an emerging chemical disinfectant, peracetic acid[J]. Science of The Total Environment, 621: 948–959.
DOI:10.1016/j.scitotenv.2017.10.195
|
Zhang K, Zhou X, Du P, et al. 2017. Oxidation of β-lactam antibiotics by peracetic acid:Reaction kinetics, product and pathway evaluation[J]. Water Research, 123: 153–161.
DOI:10.1016/j.watres.2017.06.057
|
张帅, 潘连德. 2017. 过氧乙酸在水产养殖中的应用研究进展[J]. 水产养殖, 2017(1): 7–10.
DOI:10.3969/j.issn.1004-2091.2017.01.002 |
Zhang X Z, Francis R C, Dutton D B, et al. 1998. Decomposition of peracetic acid catalyzed by cobalt(Ⅱ) and vanadium(Ⅴ)[J]. Canadian Journal of Chemistry, 76(7): 1064–1069.
|
中华人民共和国国家质量监督检验检疫总局.2008.GB 19104-2008过氧乙酸溶液[S].北京: 中国标准出版社
|
Zhou F, Lu C, Yao Y, et al. 2015. Activated carbon fibers as an effective metal-free catalyst for peracetic acid activation:Implications for the removal of organic pollutants[J]. Chemical Engineering Journal, 281: 953–960.
DOI:10.1016/j.cej.2015.07.034
|
 2018, Vol. 38
2018, Vol. 38