与可溶性物质和不溶性常规尺寸物质相比, 纳米材料具有独特的理化性质, 在改善人类生活和促进社会发展的各个方面都发挥着很大的作用(梁长华, 2010).但纳米材料的大规模使用导致释放到环境中的纳米颗粒越来越多.研究发现, 纳米材料的小尺寸效应、表面效应及宏观量子隧道效应等使其有可能穿透细胞膜, 进入细胞内与生物大分子发生反应并扰乱细胞器的运转, 从而对生态系统乃至人类健康造成潜在危害, 因而引起了人们越来越多的关注(Moreno-Garrido et al., 2015).纳米材料的元素组成和分子结构不同, 其毒性不同, 甚至元素组成和分子结构完全相同的纳米材料, 由于其大小或形状不同, 毒性也有很大差异(王利凤等, 2012), 因此, 仍需对每种新型的纳米材料进行毒性效应检测及毒性作用机理探讨.
纳米材料可借助多种途径进入水体, 因此, 研究纳米材料对水生生物的毒性是非常必要的.藻类是水环境中重要的初级生产者, 纳米颗粒对藻类的任何效应都将对整个水生环境产生深远的影响(Metzler et al., 2011).另外, 纳米材料可通过藻细胞摄入途径由食物链的低营养级向高营养级富集, 最终影响人体健康.藻类对很多毒性物质十分敏感, 且生长周期短、易于培养, 容易观察其细胞水平上的中毒情况, 因此, 常被用于评估纳米材料对生态环境的影响(程艳红等, 2014;张宁等, 2011; Chen et al., 2012). Gong等(2011)研究发现, 纳米NiO作用于微藻72 h所产生的EC50值为32.28 mg·L-1, 可使藻细胞发生质壁分离, 并导致细胞膜断裂等.刘娅琛等(2011)的研究结果表明, 纳米SiO2降低了小球藻生物量及细胞内蛋白含量, 同时也造成小球藻细胞发生形变及结构损伤, 进而抑制其正常生长.有研究表明, 纳米ZnO颗粒(20~30 nm)在低于1 mg·L-1的浓度下即可对玛氏骨条藻、假微型海链藻、球等鞭金藻、杜氏藻等4种藻产生毒性, 包括在水环境中会诱导产生活性氧, 进而影响藻细胞生长(Ma et al., 2013).由此可见, 不同纳米材料对绿藻的毒性效应存在差异.此外, 同种纳米颗粒不同粒径所产生的毒性大小也不同.例如, Xia等(2015)发现, TiO2颗粒对新月菱形藻细胞的毒性随着粒径的减小而显著增加, 而且纳米TiO2毒性的升高与其引起的活性氧物质(Reactive Oxygen Species, ROS)水平增加有关. Angel等(2015)的研究结果也表明, 纳米材料颗粒越小所产生的毒性越大, 微米级CeO对羊角月牙藻的LC50为59 mg·L-1, 而纳米CeO的LC50为7.6~28 mg·L-1. Fu等(2015)将16.2 nm锐钛矿型TiO2暴露于羊角月牙藻, 发现该纳米材料在低于诱导产生ROS的浓度即可抑制绿藻的生长, 说明ROS的生成不是纳米材料产生毒性的唯一原因.综上, 大部分纳米颗粒对绿藻均有毒性效应, 但目前有关其致毒机理尚不清楚.
纳米BiOBr(n-BiOBr)是近年发现的能在可见光区响应的光催化材料, 具有较高的光催化活性(李新玉等, 2014), 其在可见光照射下就能发生光催化反应, 产生ROS, 且光催化活性较高;而在紫外光区响应的纳米材料(如TiO2), 只有在紫外光照射下才能发生光催化反应.另外, 可见光在水体中的穿透能力比紫外光强, 紫外光在几米深处就可被水体吸收掉(毕永红等, 2005), 因此, 相较于其他紫外光响应的纳米材料, n-BiOBr对水体的影响不仅仅只局限于水体浮游污染物, 当n-BiOBr处于水中沉积物表面时, 也可发生光催化反应, 降解环境中的有机污染物.目前, 有关光催化纳米材料的研究方兴未艾, 研究人员发现并制备出多种性能良好的光催化材料, 用于解决全球环境污染、能源危机及抗菌等方面的问题.任何物质的尺度小到纳米级, 其生物效应都会发生改变.而对于n-BiOBr这样的新型光催化材料, 同时具备纳米级的尺寸和较高的光催化活性(赵阳, 2016), 势必会对生物体造成一定的危害.因此, 在该材料投入生产实践之前, 有必要充分了解其生态安全性.然而, 目前针对n-BiOBr甚至纳米卤氧化铋的毒性研究极少, 仅有极少量关于BiOCl和BiOBr纳米材料对哺乳动物细胞的毒性研究.例如, Gao等(2015a)研究表明, BiOCl片在高浓度(5~100 μg·mL-1)时, 会影响人皮肤角质细胞系(HaCaT)的细胞活性, 致使细胞形貌及内部结构发生改变, 且细胞凋亡和周期阻滞明显.表面羟基化的微米球状BiOCl和纳米片状BiOCl均可导致HaCaT细胞膜损伤, 前者为化学损伤, 后者为物理损伤(Gao et al., 2015b).薄片状BiOBr(长200 nm, 宽150 nm, 平均厚度约15 nm)可进入细胞中, 引发细胞内线粒体结构损伤, 致使细胞周期阻滞, 造成细胞晚期凋亡, 引起HaCaT细胞内ROS的生成(Gao et al., 2016).Xu等(2016)研究发现, BiOCl纳米盘和纳米片在低剂量(20 mg·L-1)和低UV剂量(2.2 mW·cm-2, 10 min)条件下, 对人乳腺癌细胞系MCF-7具有较高的毒性, 同等质量浓度和UV剂量下, TiO2的毒性不如BiOCl.然而, 目前关于卤氧化铋纳米材料对水生生物的毒性研究尚未见报道.
因此, 本文以纳米BiOBr(n-BiOBr)作为研究对象, 以羊角月牙藻(Pseudokirchneriella subcapitata)为受试生物, 通过检测n-BiOBr暴露下羊角月牙藻的生长抑制、叶绿素a、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)的含量变化, 探究n-BiOBr对羊角月牙藻的毒理学效应.以期为纳米n-BiOBr的环境风险性评估提供基本数据, 同时也为揭示纳米材料的毒性机制提供新的数据支持.
2 材料与方法(Materials and methods) 2.1 羊角月牙藻的培养羊角月牙藻(Pseudokirchneriella subcapitata)购自中科院水生生物研究所藻种库, 于光照培养箱中培养, 所用培养基为OECD(OECD, 2011).培养箱培养条件设定为:温度23 ℃, 光照强度(3500±200) lx, 每天定时摇动3~4次, 取培养至对数期的藻细胞研究n-BiOBr对其毒性效应.
2.2 n-BiOBr的制备及其悬液的配制将1.0044 g五水硝酸铋(Bi(NO3)3·5H2O)和0.238 g溴化钾(KBr)加入到40 mL乙二醇溶液中, 混合后放入超声振荡器中搅拌至均相透明溶液, 然后将其转移到50 mL的高温反应釜中, 在160 ℃条件下反应17 h, 待自然降温至室温后取出, 将所得沉淀分别用去离子水和乙醇各洗3次, 然后放入烘箱中60 ℃干燥, 将得到的产物研磨即为n-BiOBr(Zhang et al., 2008).
将制备所得的n-BiOBr加入到一定量的OECD绿藻培养基中, 配制成浓度分别为0、10、20、40 mg·L-1的悬浮液, 超声30 min后暴露于绿藻.每次实验所用的n-BiOBr悬浮液均为新鲜配制.
2.3 n-BiOBr的表征采用D8-Advance型X-射线粉末衍射仪(德国, Bruker公司), 在室温下以Cu-Kα为辐射源, 测定样品的X射线衍射图.通过日本JEM-2100(RH)透射电镜, 在200 kV的加速电压条件下获得透射电子显微镜(TEM)图像.用电感耦合等离子体质谱仪(全谱直读型ICPE-9800, 日本岛津)探讨n-BiOBr与绿藻的共培养物中Bi3+的释放量, 具体操作为:从配好的羊角月牙藻细胞与n-BiOBr的混合液中取10 mL藻液, 6000 r·min-1下离心15 min, 取上清液测定, 得到水相中Bi3+的浓度.将装有n-BiOBr悬浮液的样品池放入电位分析仪(Malvern Zetasizer Nano-ZS, 英国)中进行测定, 在25 ℃下检测3 min, 得到n-BiOBr的表面电位值.对浓度为40 mg·L-1的n-BiOBr悬浮液进行扫描电镜(SEM)检测, 分别取配制0 h和72 h的n-BiOBr悬浮液10 mL, 离心后取沉淀, 于60 ℃烘箱内干燥12 h后进行SEM(sigma 500场发射扫描电镜, ZEISS公司)分析.
2.4 羊角月牙藻的毒性试验将处于对数生长期的羊角月牙藻细胞液离心收集(4000 r·min-1, 15 min), 弃上清, 加入培养基中, 配制成浓度为4×104 cell·mL-1的藻液, 分别接种到含有0、10、20、40 mg·L-1 n-BiOBr的悬液中培养, 体积比为1:1, 得到的混合液中藻细胞初始浓度为2×104 cell·mL-1, n-BiOBr浓度分别为0、5、10和20 mg·L-1, 设置空白对照组(不含有n-BiOBr), 每组设置3个平行组, 暴露时间为72 h.
2.5 藻细胞浓度测定方法藻细胞浓度测定:每天取样, 观察藻类生长状况, 用血球计数板在显微镜下计数, 同时用紫外分光光度计(普析)在670 nm处测定吸光度值(OD670), 建立羊角月牙藻细胞浓度Y与OD670之间的线性关系(Y = 125.5OD670+0.9542, R2=0.9996), 用OD670计算出藻细胞生物量.考虑到纳米颗粒在水中的浊度会对吸光度值的测定产生影响, 因此, 需要将紫外分光光度计所测得的OD670值再减去纳米材料悬浮液的OD670值.各浓度n-BiOBr对绿藻生长的抑制率计算方法如下:

|
(1) |
式中, Iy为藻细胞产量的抑制百分数;Yc为对照组藻细胞产量平均值;Yt为处理组藻细胞的产量.在不同浓度n-BiOBr对绿藻生长抑制率的基础上, 用SPSS软件中概率单位回归法计算n-BiOBr对羊角月牙藻的72 h生长抑制EC50值(贾春生, 2006).
2.6 叶绿素含量测定经过n-BiOBr暴露后的藻类, 取3 mL藻液于6000 r·min-1下离心15 min, 弃上清, 加入80%丙酮, 于4 ℃下黑暗处提取24 h后, 6000 r·min-1下离心15 min, 取上清液用紫外分光光度计测定在波长663、646和470 nm下的吸光度(Chen et al., 2012).叶绿素a、b和类胡萝卜素含量的计算公式分别如下:

|
(2) |

|
(3) |

|
(4) |
式中, Ca、Cb分别为叶绿素a和b的浓度;Cc为类胡萝卜素的总浓度;A663、A646和A470分别为叶绿体色素提取液在波长663、646和470 nm下的吸光度.
2.7 酶活性测定取10 mL藻液于4000 r·min-1下离心15 min, 弃上清, 悬浮于磷酸缓冲液(pH=6.8)中, 冰浴下超声破碎, 破碎后用冷冻离心机在4 ℃下离心(6000 r·min-1)15 min, 取上清液做酶活性分析.超氧化物歧化酶(SOD)、丙二醛(MDA)和过氧化氢酶(CAT)酶活性采用南京建成工程研究所检测试剂盒测定(Li et al., 2012).
2.8 数据统计分析用SPSS 19.0对实验所得数据进行方差分析(one way ANOVA), 采用Tukeys检验分析不同浓度处理组与对照组的差异显著性, p < 0.05为差异显著, p < 0.01为差异极显著.
3 结果(Results) 3.1 n-BiOBr的理化性质表征鉴于纳米材料的理化性质对其毒理学研究的重要性(Pettitt et al., 2013), 本文分析了n-BiOBr的晶型、尺寸和形状等.图 1结果表明, 本文中所制备的n-BiOBr样品与标准谱库中的BiOBr(JCPDS卡:No.09-0393)晶体结构相匹配, 尖窄的衍射峰形表明该样品结晶较好, 谱图中没有其他杂质的特征峰, 说明所合成的样品为纯度较高的四方晶型BiOBr.
 |
| 图 1 n-BiOBr的XRD图谱 Fig. 1 XRD pattern of the as-prepared n-BiOBr sample |
对本研究所制备的n-BiOBr样品进行TEM分析, 图 2a表明, 该样品的晶面为{001};从图 2b可知, 该样品单个颗粒的粒径约为30 nm, 厚度约为5 nm, 形状为片层结构;图 2c和2d表明, 该材料易于形成100~500 nm的团簇体, 因此, 在每次实验之前应新鲜配制, 并用超声手段使其均匀分散于绿藻培养基中.
 |
| 图 2 n-BiOBr的TEM图像 Fig. 2 TEM images of n-BiOBr |
图 3显示了n-BiOBr混悬于绿藻培养基后水相中Bi3+的溶出情况.从图中可以看出, 不同浓度的n-BiOBr在绿藻培养基中释放的Bi3+均不超过0.5 mg·L-1, 各处理组的Bi3+释放比分别为1.1%、0.9%、0.8%、0.6%.可见n-BiOBr在培养基中释放的Bi3+较少, 且n-BiOBr浓度越高, Bi3+的释放比越低, 这可能是由于n-BiOBr在培养基中发生团聚所致.
 |
| 图 3 n-BiOBr的绿藻培养基悬浮液中Bi3+的浓度 (不同小写字母表示差异显著) Fig. 3 Concentrations of Bi3+ in the mixture of n-BiOBr and P. subcapitata in algal medium |
将浓度为40 mg·L-1的n-BiOBr混悬于绿藻培养基中, 超声混匀后分别于0 h和72 h时取样并进行SEM分析, 结果如图 4所示.结果表明, n-BiOBr混悬于绿藻培养基后可形成较稳定的球形团簇体, 在水相中存在72 h前后的状态几乎没有差异.该团簇体由片层垛叠组成, 粒径约为5 μm.浓度20 mg·L-1的n-BiOBr绿藻培养基悬浮液的Zeta电位为(-5.37±3.98) mV, 也说明n-BiOBr在绿藻培养基中存在状态较为稳定.
 |
| 图 4 浓度为40 mg·L-1的n-BiOBr混悬于绿藻培养基中0 h(a)和72 h(b)的SEM图像 Fig. 4 SEM images of 40 mg·L-1 n-BiOBr in algal medium after preparation 0 h (a) and 72 h(b) |
生长抑制实验开始后, 从0 h开始, 每隔24 h测定羊角月牙藻的细胞浓度, 不同浓度n-BiOBr对羊角月牙藻生长的影响如图 5所示.从图 5可以看出, 实验开始24 h后, 与对照组相比, 暴露于n-BiOBr的绿藻生长受到显著抑制(p < 0.05), n-BiOBr浓度越高, 抑制越明显.48 h后, 仅高浓度组(≥20 mg·L-1)表现出显著抑制生长现象, 在72 h时, 各个处理组藻细胞浓度与对照组相比, 均产生极显著性差异(p < 0.01).羊角月牙藻在浓度为40 mg·L-1的n-BiOBr作用下, 72 h的抑制率达到91.5%, n-BiOBr对羊角月牙藻在72 h的EC50值为7.407 mg·L-1(95%置信区间为5.905~8.876 mg·L-1).
 |
| 图 5 不同浓度n-BiOBr对羊角月牙藻生长的影响 Fig. 5 Effects of different concentrations of n-BiOBr on the growth of P. subcapitata |
绿藻的生长会受到多种因素的影响, 其中最重要的一个因素是光合作用, 而光合色素对藻类的光合作用起着决定性的作用, 决定着光能的吸收、传递和转化, 因此, 其含量的变化必然导致光合速率的变化, 进而影响绿藻生物量的高低(雷静静等, 2013).图 6显示了经不同浓度n-BiOBr暴露72 h后羊角月牙藻细胞内叶绿素a、叶绿素b、类胡萝卜素的含量(即每107个细胞中的叶绿素质量(mg)).随着n-BiOBr浓度的升高, 羊角月牙藻细胞内叶绿素a和类胡萝卜素含量逐渐降低, 呈现出明显的剂量-效应关系, 且20 mg·L-1高浓度组中叶绿素a和类胡萝卜素含量明显降低, 并与对照组呈现显著性差异(p < 0.05)(图 6a和6d). 5 mg·L-1的n-BiOBr暴露下, 羊角月牙藻细胞中叶绿素b的含量与对照组相比显著降低, 随着n-BiOBr浓度的升高, 叶绿素b含量增加(图 6b).单位细胞内叶绿素a与b的总量随着n-BiOBr浓度的升高而降低(图 6c).当n-BiOBr的暴露浓度分别为0、5、10和20 mg·L-1时, 叶绿素a与b的比值(叶绿素a/b)分别为14.9、13.1、10.6和5.6, 即叶绿素a/b值随着n-BiOBr浓度的升高而降低.
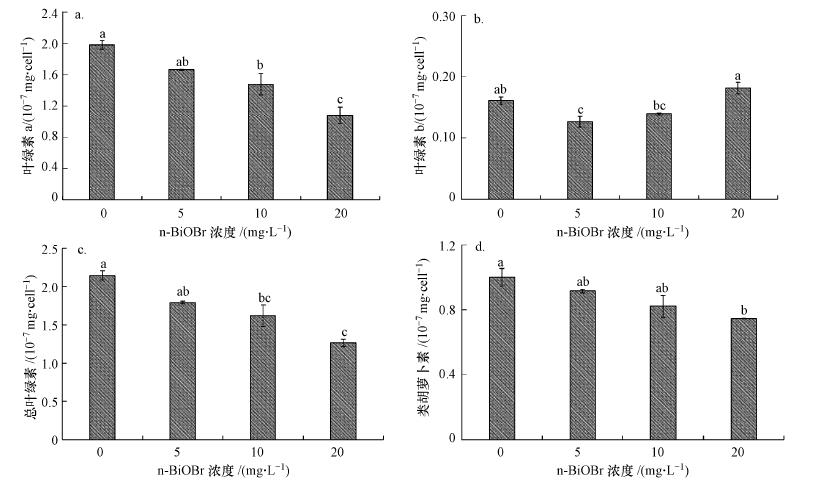 |
| 图 6 不同浓度n-BiOBr对羊角月牙藻光合色素含量的影响 (a.叶绿素a, b.叶绿素b, c.叶绿素a与b总量, d.类胡萝卜素;图中柱状数据均为平均数±SD, 不同字母代表不同浓度处理之间的显著性差异, 下同) Fig. 6 Effects of different concentrations of n-BiOBr on photonsynthetic pigment contents of P. subcapitata |
MDA是膜脂过氧化最重要的产物之一, 它的产生又进一步加剧了膜的损伤, 因此, 可通过测定MDA含量了解细胞膜脂过氧化的程度, 以间接测定膜系统受损程度.不同浓度n-BiOBr暴露72 h后, 羊角月牙藻MDA的生成量变化如图 7所示.n-BiOBr较低浓度组(5 mg·L-1)和中浓度组(10 mg·L-1)与对照组相比, MDA的生成量存在显著性差异(p < 0.05, p < 0.01).当n-BiOBr浓度升高到20 mg·L-1时, 每107个绿藻细胞所产生的MDA量显著降低, 与10 mg·L-1浓度组相比呈现极显著性差异(p < 0.01).以上结果说明, 在一定浓度范围内的n-BiOBr暴露时, 脂质过氧化程度随着n-BiOBr浓度的升高而增大, 而当n-BiOBr暴露浓度过高时, 绿藻的脂质过氧化程度反而降低.这可能是由于低浓度的n-BiOBr分散性较好, 不易形成团聚体, 与绿藻的接触面积更大, 因而氧化压力更强.
 |
| 图 7 不同浓度n-BiOBr对羊角月牙藻MDA含量的影响 Fig. 7 Effects of different concentrations of n-BiOBr on MDA contents of P. subcapitata |
SOD能歧化超氧阴离子自由基, 生成过氧化氢和分子氧, 在细胞的抗氧化保护机制中起着非常重要的作用(马旭俊等, 2003).不同浓度n-BiOBr对羊角月牙藻SOD活力的影响如图 8所示, 可以看出, 绿藻培养液中单位细胞个数(每107个细胞)所产生的SOD活力随着n-BiOBr浓度的升高先升高再降低. n-BiOBr低浓度(5 mg·L-1)和高浓度(20 mg·L-1)处理组与对照组相比, 单位细胞所产生的SOD活力无明显增强, 而10 mg·L-1的n-BiOBr处理组中, 每107个细胞所产生的SOD活性较对照组中SOD的活性显著增高(p < 0.01).在浓度为10 mg·L-1时, SOD的活性(4.071×10-7U·cell-1)是对照组SOD活性(1.448×10-7U·cell-1)的2.8倍.以上结果表明, 绿藻经过n-BiOBr暴露72 h后, 细胞中SOD活性增强, 以此来提高细胞自身对不良环境的抵抗能力.
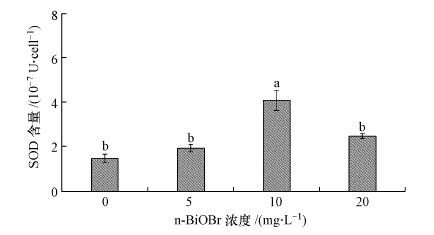 |
| 图 8 不同浓度n-BiOBr对羊角月牙藻SOD活性的影响 Fig. 8 Effects of different concentrations of n-BiOBr on SOD activaties of P. subcapitata |
CAT的作用是催化生物体内的H2O2分解为分子氧和水, 从而使细胞免于遭受H2O2的氧化损伤, 是生物体抵抗ROS的关键酶之一.不同浓度n-BiOBr对羊角月牙藻CAT活力的影响如图 9所示, 结果显示, 随着n-BiOBr暴露浓度的增加, 单位细胞个数(每107个细胞)中的CAT活性也呈现升高-降低的趋势.其中, 中浓度(10 mg·L-1)和高浓度(20 mg·L-1)处理组的CAT活性较对照组显著增强(p < 0.01, p < 0.05), 而低浓度(5 mg·L-1)处理组与对照组相比没有显著性差异.
 |
| 图 9 不同浓度n-BiOBr对羊角月牙藻CAT活性的影响 Fig. 9 Effects of different concentrations of n-BiOBr on CAT activaties of P. subcapitata |
羊角月牙藻被公认为对毒性物质较敏感(石丽娟, 2010), 此外, 由于其生长周期短, 易于培养, 容易观察其细胞水平上的中毒情况, 因此, 羊角月牙藻成为国家环保部规定的藻类毒性测试推荐使用的藻类之一.
n-BiOBr对羊角月牙藻的生长抑制作用存在时间-效应和剂量-效应关系, 随着n-BiOBr浓度的增加, 其对羊角月牙藻的毒性增大, 且随着作用时间的延长, 抑制效果越明显.此外, 在生长过程中, 可能由于培养初期藻细胞生物量低, 且鉴于对新环境的适应和生长调节, 致使细胞繁殖较慢, 之后环境条件适宜, 藻细胞生长速率加快, 呈指数生长模式, 使得各组藻细胞浓度变化明显, 所产生的胁迫效应显著.n-BiOBr对羊角月牙藻的72 h生长抑制实验表明, n-BiOBr对水生生物羊角月牙藻的毒性较高(72 h EC50为7.407 mg·L-1).因此, 作为新型高活性光催化材料, n-BiOBr的实际应用还应更加慎重.当然, 本文只研究了特定形状、尺寸和晶面的BiOBr毒性, 具有不同理化性质的材料, 毒性也会有所不同.例如, 有研究表明, 晶面的不同可导致纳米TiO2对人支气管上皮细胞(BEAS-2B)和小鼠巨噬细胞(RAW 264.7)毒性效应的不同, {001}面的毒性高于{101}面(Ning et al., 2016).因此, 如何从理化性质上降低BiOBr的毒性尚需进一步研究.
n-BiOBr混悬于绿藻培养基之后的Bi3+浓度检测结果表明, 水相中有少量Bi3+溶出. Kearns和Turner(2016)比较了Bi对3种藻类(绿藻、褐藻和红藻)的毒性, 结果表明, 与其他重金属(如Ag和Ti)相比, Bi对藻类的毒性相对较低, 在所研究的藻类中仅对红藻有较低毒性, 对其他藻类无毒.因此, n-BiOBr对绿藻的毒性可能是源于纳米颗粒本身.
羊角月牙藻经n-BiOBr作用72 h后, 单位细胞个数内叶绿素a和叶绿素b的总量随着n-BiOBr浓度的升高而降低, 说明n-BiOBr的暴露使叶绿素分子受损或阻碍其合成.BiOBr在可见光下即可响应, 产生卓越的光催化性能(Gao et al., 2015b), 而其纳米级的尺寸使其有可能进入细胞内部, 因此, 会在光照条件下催化叶绿素分子的降解.另外, 生物体内的叶绿素b是由叶绿素a演变而来(潘瑞炽, 2008), 也就是说, 叶绿素a的合成决定了叶绿素的总量, 一旦叶绿素a的合成受阻, 势必影响叶绿素的总量.本文中, 叶绿素a/b值随着n-BiOBr浓度的升高而降低. Chen等(2012)研究了纳米TiO2对莱茵衣藻的毒理学效应, 发现纳米TiO2暴露72 h后, 叶绿素a/b值随着纳米TiO2浓度的增加而降低, 与本文结果一致.这可能是由于n-BiOBr不溶于水, 因此, 在绿藻细胞表面产生遮光效应, 浓度越大, 遮光效应越强, 在遮光条件下, 叶绿素a向叶绿素b的转化加快, 叶绿素a水解形成脱植基叶绿素a, 脱植基叶绿素a再转化成脱植基叶绿素b, 最后合成叶绿素b, 使得叶绿素a含量随着n-BiOBr浓度的增大而降低, 叶绿素b则呈相反趋势, 因此, 叶绿素a/b值随着遮光效应的增强而变小, 以此来提高对光能的利用(黄建华, 2012).
类胡萝卜素作为一种光合色素, 同时也是一种抗氧化剂(Wang et al., 2010).类胡萝卜素与ROS的反应包括:接受ROS的电子转移、被ROS脱氢和与ROS发生化合反应, 后两种反应的产物易与氧分子结合生成类胡萝卜素过氧化自由基(宋雁等, 2003), 从而影响类胡萝卜素在光合作用中对光能的收集和传递.
以上光合色素的分析结果表明, 在n-BiOBr作用下, 羊角月牙藻细胞内光合色素总量减少, 而光合色素是藻类在进行光合作用时的重要物质(金星龙等, 2011), 因此, n-BiOBr的暴露会影响到绿藻光合效率, 从而对其生长产生抑制作用.
MDA的高低间接反映了机体细胞受自由基攻击的严重程度, SOD和CAT活力的高低反映了机体清除氧自由基的能力(董亮等, 2013;侯东颖等, 2012; Morelli et al., 2004;裴峰等, 2015).本研究中n-BiOBr作用于羊角月牙藻后, MDA含量、SOD和CAT活性都随着n-BiOBr浓度的增加而呈现“升高-降低”趋势.在低浓度(5 mg·L-1)处理组中, n-BiOBr含量少, 对藻细胞所造成的氧化损伤较弱, 使得MDA含量、SOD和CAT活性低.而在浓度为10 mg·L-1的n-BiOBr处理后, 藻细胞MDA含量和SOD、CAT两种酶活性最高, 甚至高于n-BiOBr高浓度(20 mg·L-1)处理组, 可能由于n-BiOBr在相对较低的浓度(如5和10 mg·L-1)下分散性好, 使其能更快地进入细胞中, 并且与胞内生物大分子的接触面积更大, 因此, 氧化损伤更强烈.绿藻细胞受到氧化压力后, 产生氧化应激反应, 从而提高自身抗氧化酶系统的活力, 这是生物体自身产生的自我保护防御机制.当n-BiOBr浓度高于一定范围时, 团簇现象更加明显, 反而使n-BiOBr暴露给生物大分子的面积变小, 从而使氧化压力减小.然而, n-BiOBr对绿藻生长的抑制并未呈现“先增强后减弱”的趋势(图 5).绿藻的生长是由多种因素决定的, 除了细胞是否受到氧化损伤之外, 还受制于光合作用.从本文关于光合色素的研究可以看出, 光合色素总量和叶绿素a/b比值均随着n-BiOBr浓度的增加而降低.因此, n-BiOBr对绿藻生长抑制的趋势未必与氧化损伤的趋势相同.
纳米颗粒对藻类造成毒性的一个最主要的机理是促成ROS的产生, 进而诱发脂质过氧化(Li et al., 2015). ROS包括超氧阴离子(·O2-)、过氧化氢(H2O2)、羟基自由基(·OH)(Fu et al. 2015). ROS在细胞内的产生主要有两个可能的来源:一个是纳米颗粒本身, 另一个是生物基底(如受损的线粒体)(Gao et al., 2015a). n-BiOBr在可见光区即可响应, 因此, 在绿藻的光照培养条件下很容易生成ROS, 进而对绿藻造成氧化损伤.而在紫外光区响应的纳米TiO2, 在可见光照射下对绿藻等生物依然存在毒性. Li等(2015)用平均粒径为5~10 nm的锐钛矿型纳米TiO2在12000 lx的冷白荧光灯下暴露于硅藻Skeletonema costatum, 发现与无纳米材料的对照组相比, ROS含量并未升高.Fu等(2015)用H2DCFDA作为探针, 发现浓度低于50 mg·L-1的16.2 nm锐钛矿型TiO2在可见光(经铝膜滤除紫外线)下不能诱导产生多于对照组的ROS, 但对羊角月牙藻的生长仍有50%以上的抑制.这些都说明ROS的生成不是纳米材料产生毒性的唯一原因.不同的纳米材料作用于不同的受试生物所产生的研究结果不同, 有关纳米材料的毒性机制仍需进一步的深入研究.
5 结论(Conclusions)1) n-BiOBr对羊角月牙藻的生长有一定的抑制作用, 随着n-BiOBr浓度的增加其对羊角月牙藻生长的抑制作用越来越明显, n-BiOBr对羊角月牙藻的72 h半数效应浓度(EC50)为7.407 mg·L-1.
2) n-BiOBr暴露降低了羊角月牙藻光合色素含量及叶绿色a/b值, 进而影响光合作用.
3) n-BiOBr胁迫下, 羊角月牙藻细胞内MDA含量、SOD和CAT活性均随着n-BiOBr浓度的增加呈现“升高-降低”的趋势, 表明羊角月牙藻受到氧化损伤, 从而产生应激反应.
Angel B M, Vallotton P, Apte S C. 2015. On the mechanism of nanoparticulate CeO2, toxicity to freshwater algae[J]. Aquatic Toxicology, 168: 90–97.
DOI:10.1016/j.aquatox.2015.09.015
|
毕永红, 胡征宇. 2005. 水色及其与藻类的关系[J]. 生态科学, 2005, 24(1): 66–68.
DOI:10.3969/j.issn.1008-8873.2005.01.019 |
Chen L, Zhou L, Liu Y, et al. 2012. Toxicological effects of nanometer titanium dioxide (nano-TiO2) on Chlamydomonas reinhardtii[J]. Ecotoxicology and Environtal Safety, 84(10): 155–162.
|
程艳红, 陈金媛, 李何荣, 等. 2014. 纳米材料的水生毒性研究进展[J]. 环境与健康杂志, 2014, 31(4): 371–376.
|
董亮, 何永志, 王远亮, 等. 2013. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报, 2013(5): 53–58.
DOI:10.3969/j.issn.1008-0864.2013.05.08 |
Fu L, Hamzeh M, Dodard S, et al. 2015. Effects of TiO2 nanoparticles on ROS production and growth inhibition using freshwater green algae pre-exposed to UV irradiation[J]. Environmental Toxicology and Pharmacology, 39: 1074–1080.
DOI:10.1016/j.etap.2015.03.015
|
Gong N, Shao K, Feng W, et al. 2011. Biotoxicity of nickel oxide nanoparticles and bio-remediation by microalgae Chlorella vulgaris[J]. Chemosphere, 83(4): 510–516.
DOI:10.1016/j.chemosphere.2010.12.059
|
Gao X, Zhang X, Wang Y, et al. 2015a. An in vitro study on the cytotoxicity of bismuth oxychloride nanosheets in human HaCaT keratinocytes[J]. Food & Chemical Toxicology, 80: 52–61.
|
Gao X, Wang Y, Peng S, et al. 2015b. Comparative toxicities of bismuth oxybromide and titanium dioxide exposure on human skin keratinocyte cells[J]. Chemosphere, 135: 83–93.
DOI:10.1016/j.chemosphere.2015.03.075
|
Gao X, Zhang X, Wang Y, et al. 2016. Effects of morphology and surface hydroxyl on the toxicity of BiOCl in human HaCaT cells[J]. Chemosphere, 163: 438–445.
DOI:10.1016/j.chemosphere.2016.08.063
|
黄建华. 2012. 遮光对植物光合特性的影响[J]. 生物学教学, 2012, 37(1): 51–53.
DOI:10.3969/j.issn.1004-7549.2012.01.026 |
侯东颖, 冯佳, 谢树莲. 2012. 纳米二氧化钛胁迫对普生轮藻的毒性效应[J]. 环境科学学报, 2012, 32(6): 1481–1486.
|
Kearns J, Turner A. 2016. An evaluation of the toxicity and bioaccumulation of bismuth in the coastal environment using three species of macroalga[J]. Environmental Pollution, Part B, 208: 435–441.
DOI:10.1016/j.envpol.2015.10.011
|
贾春生. 2006. 利用SPSS软件计算杀虫剂的LC50[J]. 昆虫知识, 2006(3): 414–417.
DOI:10.3969/j.issn.0452-8255.2006.03.035 |
金星龙, 张宁, 李晓, 等. 2011. 四种纳米氧化物对小球藻的毒性效应研究[J]. 天津理工大学学报, 2011, 27(2): 58–62.
DOI:10.3969/j.issn.1673-095X.2011.02.013 |
雷静静, 冯佳, 谢树莲. 2013. 纳米氧化镍对3种绿藻的毒性效应[J]. 中国环境科学, 2013, 33(10): 1842–1849.
|
Li F, Liang Z, Zheng X, et al. 2015. Toxicity of nano-TiO2 on algae and the site of reactive oxygen species production[J]. Aquatic Toxicology, 158: 1–13.
DOI:10.1016/j.aquatox.2014.10.014
|
李新玉, 熊世威, 方艳芬, 等. 2014. BiOBr光催化剂的制备与应用研究进展[J]. 武汉大学学报(理学版), 2014, 60(2): 182–188.
|
梁长华.2010.纳米NiO对小球藻的生物毒性及致毒机制研究[D].大连: 大连海事大学.
http://cdmd.cnki.com.cn/article/cdmd-10151-2010098557.htm |
刘娅琛, 汪静, 曲冰, 等. 2011. SiO2纳米颗粒对小球藻(Chlorella pyrenoidosa)生长活性的影响[J]. 海洋环境科学, 2011, 30(5): 646–648.
DOI:10.3969/j.issn.1007-6336.2011.05.009 |
Moreno-Garrido I, Pérez S, Blasco J. 2015. Toxicity of silver and gold nanoparticles on marine microalgae[J]. Marine Environmental Research, 111: 60–73.
DOI:10.1016/j.marenvres.2015.05.008
|
Metzler D M, Li M, Erdem A, et al. 2011. Responses of algae to photocatalytic nano-TiO2, particles with an emphasis on the effect of particle size[J]. Chemical Engineering Journal, 170(2/3): 538–546.
|
Ma H, Williams P L, Diamond S A. 2013. Ecotoxicity of manufactured ZnO nanoparticles-a review[J]. Environmental Pollution, 172(1): 76–85.
|
马旭俊, 朱大海. 2003. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传, 2003, 25(2): 225–231.
DOI:10.3321/j.issn:0253-9772.2003.02.025 |
Morelli E, Scarano G. 2004. Copper-induced changes of non-protein thiols and antioxidant enzymes in the marine microalga Phaeodactylum tricornutum[J]. Plant Science, 167(2): 289–296.
DOI:10.1016/j.plantsci.2004.04.001
|
Ning L, Kai L, Xi L, et al. 2016. Crystallographic facet-induced toxicological responses by faceted titanium dioxide nanocrystals[J]. Acs Nano, 10(6): 6062–6073.
DOI:10.1021/acsnano.6b01657
|
Organisation for Economic Co-operation and Development(OECD).2011.OECD Guidelines for the Testing of Chemicals, Freshwater Alga and Cyanobacteria, Growth Inhibition Test[S].Paris: OECD
|
Pettitt M E, Lead J R. 2013. Minimum physicochemical characterisation requirements for nanomaterial regulation[J]. Environment International, 52(1): 41–50.
|
潘瑞炽. 2008. 植物生理学((第七版))[M]. 北京: 高等教育出版社: 78.
|
裴峰, 王长海. 2015. 纳米Fe2O3对2种微藻生长的影响[J]. 烟台大学学报(自然科学与工程版), 2015, 28(3): 186–192.
|
石丽娟.2010.水环境中典型抗生素类药物的检测分析和生态毒性研究[D].上海: 上海交通大学
http://cdmd.cnki.com.cn/Article/CDMD-10248-2010206489.htm |
宋雁, 卢承前, 陈君石. 2003. 类胡萝卜素抗氧化和促氧化作用的影响因素[J]. 卫生研究, 2003, 32(4): 417–419.
DOI:10.3969/j.issn.1000-8020.2003.04.041 |
王利凤, 郭凤华, 杨卓. 2012. 纳米碳化钨对斑马鱼胚胎发育的影响[J]. 中国环境科学, 2012, 32(7): 1280–1283.
DOI:10.3969/j.issn.1000-6923.2012.07.021 |
Wang G, Hao Z, Huang Z, et al. 2010. Raman spectroscopic analysis of a desert cyanobacterium Nostoc sp.in response to UVB radiation[J]. Astrobiology, 10(8): 783–788.
DOI:10.1089/ast.2009.0407
|
Xia B, Chen B, Sun X, et al. 2015. Interaction of TiO2 nanoparticles with the marine microalga Nitzschia closterium:growth inhibition, oxidative stress and internalization[J]. Science of the Total Environment, 508(5): 525–533.
|
Xu Y, Shi Z, Zhang L, et al. 2016. Layered bismuth oxyhalide nanomaterials for highly efficient tumor photodynamic therapy[J]. Nanoscale, 8(25): 12715–12722.
DOI:10.1039/C5NR04540A
|
Zhang X, Ai Z, Falong Jia A, et al. 2008. Generalized one-pot synthesis, characterization, and photocatalytic activity of hierarchical BiOX(X=Cl, Br, I) nanoplate microspheres[J]. Journal of Physical Chemistry C, 112(3): 747–753.
DOI:10.1021/jp077471t
|
张宁, 金星龙, 李晓, 等. 2011. 人工纳米材料对藻类的毒性效应研究进展[J]. 安徽农业科学, 2011, 39(10): 6000–6003.
DOI:10.3969/j.issn.0517-6611.2011.10.126 |
赵阳.2016.BiOBr纳米光催化剂的制备、改性及其光催化性能研究[D].天津: 天津大学
http://cdmd.cnki.com.cn/Article/CDMD-10056-1017131244.htm |
 2018, Vol. 38
2018, Vol. 38


