随着我国肉类食品需求量的增加,猪肉作为最主要的肉类食品之一,使得养猪业在我国经济发展中占有越来越重要的地位,然而由此带来的环境污染问题也越来越突出.由于猪场废水中普遍含有高浓度有机物、氨氮和磷等物质,若不经有效处理排入水体后不仅会造成水体富营养化,并且渗入地下后会使地下水溶解氧含量减少,有毒成分增多,导致水质恶化(赵国华等,2015;张克强等,2004).目前,许多大型规模化猪场多采用厌氧-好氧生化联合工艺处理该类废水(韩伟铖等,2017).然而,猪场废水经过厌氧发酵处理后,虽然大部分COD被去除,但由于原废水中有机物含量很大,因此,出水中仍含有较高的COD.与此同时,经厌氧发酵后,虽然有机态氮转化为无机态氮,但氮素含量并没有减少,氨氮浓度仍然很高,这就造成了低碳高氨氮猪场沼液的产生(闫园园等,2013).虽然目前好氧工艺的发展已经成熟,但其在处理猪场沼液时由于碳源不足而导致脱氮性能较差及后续处理成本提高等实际问题.
CANON工艺(Completely autotrophic nitrogen removal over nitrite)是一种基于亚硝酸盐的全自养生物脱氮工艺.它通过氨氧化菌(Ammonia-oxidizing bacteria,AOB)的作用,将部分氨氮氧化成亚硝态氮(式(1)),再通过厌氧氨氧化细菌(ANAMMOX)的作用,将剩余的氨氮和亚硝态氮转化成氮气和少量硝态氮(式(2)),综合上述两个反应,可得到CANON工艺的整体反应方程(式(3))(Sliekers et al., 2002).
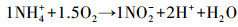
|
(1) |
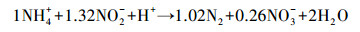
|
(2) |
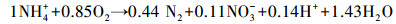
|
(3) |
相对于传统脱氮工艺而言,CANON工艺不需要碳源,可节约50%的碱度,同时减少供氧量,被认为是最为经济有效的新型脱氮工艺之一,因而成为目前研究的热点.如孙延芳等(2017)采用序批式生物反应器(SBR),分别接种15%和20% ANAMMOX颗粒污泥,在pH=7~8、温度(30±1) ℃的条件下,分别在运行的第46 d和35 d成功启动了CANON工艺,其总氮去除负荷均能维持在0.35 kg· m-3· d-1.付昆明等(2014)以模拟废水试验了陶粒CANON反应器的脱氮性能,在(30±1) ℃、HRT=9 h、pH=7~8的条件下,经过60 d成功启动了CANON反应器,TN的去除负荷达到0.79 kg· m-3· d-1.Sliekers等(2003)以人工配制的无机高氨氮废水为对象,采用SBR反应器并接种ANAMMOX颗粒污泥,在温度30 ℃、pH=7.8的情况下运行49 d后成功启动了Canon工艺,氨氮去除率达到85%.刘竹寒等(2017)同样采用人工配制的无机高氨氮废水,基于淹没式生物滤池(SBAF),在中温((30±2) ℃)条件下调节DO经过48 d对污泥微生物的驯化,成功启动了CANON工艺,氨氮(NH4+-N)和总氮(TN)最大去除率分别达到99.9%和86.5%.虽然目前关于CANON工艺处理低碳高氨氮废水的报道很多,但多集中于实验室模拟配水、序批式反应器启动运行,并且多接种特殊的具有厌氧氨氧化功能的污泥,而关于接种普通活性污泥实现猪场沼液连续流态CANON工艺成功启动的报道不多.为了进一步推进CANON工艺在实际工程中的应用,本研究以实际猪场沼液作为处理对象,在连续流态下进行CANON工艺的启动及微生物种群结构变化分析,以期为CANON工艺处理实际猪场沼液的工艺启动,以及增强CANON工艺脱氮效能提供可靠的微生物实验依据.
2 材料与方法(Materials and methods) 2.1 实验装置及启动方式实验装置如图 1所示.反应器由有机玻璃制成,有效容积为1.8 L,反应器分为两个区域:反应区和沉淀区,通过挡板隔开且底部连通,二者有效容积之比约为5:1.启动前接种普通活性污泥,接种量约为反应器有效容积的30%.同时, 反应器中添加PVC聚酯填料(填充率约为反应器有效容积的40%),填料近似为空心圆柱,外表面为齿轮状,直径约8 mm,长度约8 mm.反应器底部安装有曝气盘并通过调节转子流量计控制DO为(0.5±0.1) mg· L-1.通过逐步减小稀释实际沼液倍数来提高进水氨氮浓度启动CANON工艺, 共分为4个阶段,氨氮浓度分别为150、250、350、450 mg· L-1左右.反应器运行温度为(30±1) ℃,水力停留时间(HRT)为1.5 d.
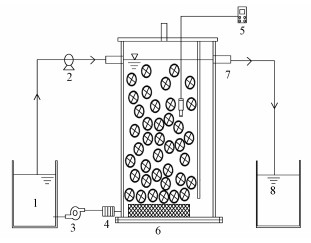 |
| 图 1 SBR实验装置流程示意图 (1.进水箱,2.进水泵,3.曝气泵,4.转子流量计,5.溶解氧仪,6.曝气盘,7.出水口,8.出水箱) Fig. 1 Schematic diagram of experiment device |
实验用水取自成都双流区某大型养猪场实际废水,其水质如表 1所示.实验过程中采用稀释实际沼液的方式调节氨氮浓度,同时添加微量元素,其中,微量元素成分为(mg· L-1):CuCl2·6 H2O 0.1、ZnSO4·7 H2O 0.1、FeCl3 0.3、H3BO4 0.1、CoCl2 0.1、EDTA 0.1.调节后的进水主要水质见表 1.
| 表 1 实验进水水质 Table 1 Key water quality of the influent |
化学需氧量(COD)、氨氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、总氮(TN)等均采用国家标准方法测定(国家环境保护总局,2002).DO和pH分别采用JPB-607A便携式溶解氧分析仪和pHTestr30型pH计测定.游离氨(FA)的计算方法参考Anthonisen平衡方程(Anthonisen et al., 1976).
2.4 污泥样品采集及测序实验流程首先,取接种污泥和CANON工艺启动成功阶段(第210 d)的污泥与生物膜的混合样品(分别编号Blank、R_AS_SD),经过高速冷冻离心去除多余水分后进行冷冻干燥,干燥后采用DNA快速提取试剂盒(离心柱型)对其进行污泥DNA的提取(王衫允,2016),详细操作步骤参考试剂盒说明书进行;之后采用0.8%(质量分数)凝胶电泳检测所提取DNA以备PCR用, 并将DNA提取物在-20 ℃条件下保存.采用对细菌16S rRNA基因具有特异性的引物对F338(ACTCCTACGGGAGGCAG)和R518(ATTACCGCGGCGCTGG)进行PCR扩增(Muyzer et al., 1993),PCR执行程序:96 ℃预变性5 min;50 ℃退火30 s,72 ℃延伸30 s,共30个循环;最后再72 ℃退火5 min.通过2%琼脂糖电泳检测混合后的同一样本的PCR产物,采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物(Yang et al., 2007).
参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量(鲁航等,2016),将各待测样的PCR产物根据测序量要求进行混合,交由Illumina Miseq系统测序(上海美吉生物医药科技有限公司).测序完毕后,采用Prinseq软件对各个样品的原始数据进行筛选,舍去引物序列、短片段、低复杂度序列、低质量序列,之后对优化后的数据进行后续分析:首先对Paired-end reads进行拼接,去除冗余得到Unique Tags;根据97%的序列相似度将所有序列进行同源比对,并进行OUT(operational taxonomic units)聚类,在数据库GreenGenes (Release 13.5 http://greengenes.Secondgenome.com/)上进行比对分析.通过观察OTU的数量和每个OTU中包含序列的条数,得到该样品中生物多样性的高低和菌种、菌属等数目比例(张楠等,2015).利用分类学统计方法,分析样本中的群落结构,获得样本中微生物phylum(门)、class(纲)、genus(属)的物种丰度.
3 结果与分析(Results and analysis) 3.1 启动过程中反应器脱氮性能 3.1.1 NH4+-N及TN的去除变化分析CANON反应器启动过程进出水NH4+-N、TN浓度及其去除率的变化情况如图 2所示,启动期间CANON工艺经历了4个阶段.
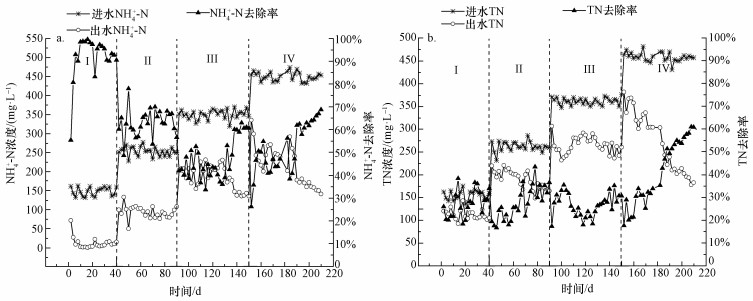 |
| 图 2 NH4+-N(a)及TN(b)去除率变化 Fig. 2 Change of NH4+-N(a) and TN(b) removal efficiency |
第Ⅰ阶段(1~40 d)将普通活性污泥接种至连续流反应器内,同时调节进水NH4+-N浓度在150 mg· L-1左右波动.该阶段反应器内NH4+-N浓度较低,NH4+-N平均去除率达到93.85%.然而,此时TN平均去除率只有27.24%,原因是接种的普通活性污泥的微生物种群不能很好地适应低碳高氨氮的猪场沼液环境,由于缺少碳源而无法将NH4+-N转化的NO3--N和NO2--N还原成气态氮,故对TN的去除率很低.
第Ⅱ阶段(40~90 d)提高进水NH4+-N至250 mg· L-1左右,NH4+-N平均出水浓度为93.21 mg· L-1,平均去除率为63.02%;TN的平均出水浓度为191.85 mg· L-1,平均去除率为26.78%.在该阶段初期相关脱氮微生物受到环境突变的影响导致活性降低,NH4+-N和TN去除率呈下降趋势,第58 d分别降低至56.95%和19.55%,60 d后,随着微生物对新环境的适应,活性恢复,NH4+-N和TN去除率开始逐渐上升,第86 d分别上升至67.07%和35.34%.因此,此阶段的目标是富集AOB菌和ANAMMOX菌,同时抑制NOB菌的活性与生长(Zhang et al., 2013).
第Ⅲ阶段(90~150 d)继续提高进水NH4+-N至350 mg· L-1左右,出水NH4+-N平均浓度为185.16 mg· L-1,平均去除率为47.16%,该阶段前期(90~128 d)反应器中FA浓度约为9 mg· L-1.有研究表明,FA浓度与NH4+-N浓度成正比,当反应器中FA浓度超过8.5 mg· L-1时,AOB菌的活性会受到抑制(Van et al., 2007;孙洪伟等,2016),故此时NH4+-N的平均去除率较低.结合图 3所示,TN去除率在此阶段前期也呈现下降趋势,第118 d下降至最低18.02%.郑照明等(2016)通过观察不同NH4+-N浓度下厌氧氨氧化过程中NO2--N浓度的变化情况,发现随着进水NH4+-N浓度的提高,CANON工艺系统中NO2--N的去除速率会呈现明显降低的趋势,且NO2--N较高会抑制AOB菌的活性.但NO2--N对CANON工艺的不利影响是可逆的,其只是对反应器有一定的抑制作用而非毒害作用(Lotti et al., 2012).因此,本阶段中,随着反应器中相关脱氮菌从适应期过渡至稳定期后,厌氧氨氧化过程加强使NO2--N浓度开始降低,AOB菌逐渐恢复活性,NH4+-N和TN去除率从第126 d开始迅速上升,第144 d分别上升至62.99%和35.28%.
第Ⅳ阶段(150 ~210 d)进水NH4+-N浓度提升至450 mg· L-1左右,NH4+-N平均去除率达到52.2%,出水中的平均NH4+-N浓度为215.15 mg· L-1;此时TN平均去除率达到40.6%,出水平均浓度为271.54 mg· L-1.该阶段随着反应器的继续运行和微生物对高氨氮环境的逐步适应后,反应器的脱氮效果明显增强,在第210 d,NH4+-N和TN去除率分别达到了69.8%和61.1%.李冬等(2017)曾采用AUSB连续流反应器,将亚硝化污泥接种至培养有厌氧氨氧化污泥的AUSB反应器内,在启动阶段以无机模拟废水为进水,通过增加进水氨氮质量浓度和缩短HRT的方式成功启动CANON工艺,在稳定阶段其最高氨氧化率达到80%,最高总氮去除率达到了69%.而本实验脱氮效率略低于前者的原因在于:第一,本实验采用的进水为实际沼液,水质变化大且其中含有的复杂成分会对相关脱氮菌造成影响;第二,反应器内接种普通活性污泥来处理高氨氮猪场沼液,驯化难度系数增加,接种污泥驯化的周期高于文献报道(李冬等, 2017);第三,由于进水氨氮浓度较高,达到450 mg· L-1,明显高于文献报道(李冬等, 2017),高浓度氨氮会对生物处理造成抑制作用导致本实验反应器脱氮效果不理想.
3.1.2 出水(NO3--N+NO2--N)/ΔNH4+-N在CANON反应的方程式中,NH4+-N理论上最后将完全转化为N2和11%的NO3--N,故可将硝态氮和亚硝态氮的产生量与氨氮变化量之比((NO3--N+NO2--N)/ΔNH4+-N)用于评价CANON工艺是否启动成功及其反应器性能(Daverey et al., 2012),且出水(NO3--N+NO2--N)/ΔNH4+-N的数值在CANON系统中应接近0.11.
CANON反应器启动过程中,出水(NO3--N+NO2--N)/ΔNH4+-N的变化情况如图 3所示.反应初期(1~40 d)出水(NO3--N+NO2--N)/ΔNH4+-N较高,平均达到了1.04,此时虽然氨氮平均去除率达到了93.85%,但总氮的平均去除率只有27.24%.原因是在反应初期由于接种普通活性污泥,大部分氨氮在亚硝化氧化细菌(NOB)的作用下被氧化成了硝态氮,导致出水硝态氮较高.由于只是将氨氮转变为硝态氮,水体中氮素的含量依然较高.第Ⅱ阶段(40~90 d)出水(NO3--N+NO2--N)/ΔNH4+-N开始逐渐降低.相关研究表明,CANON工艺在进水氨氮浓度大于200 mg· L-1的情况下有助于建立好氧和厌氧氨氧化菌共存的系统,并且能够有效抑制NOB菌(Liu et al., 2012).由于该阶段提高了氨氮浓度至250 mg· L-1,使系统能给予AOB菌和ANAMMOX菌能够较好完成协同代谢的环境,越来越多的氨氮以N2和少量硝态氮的形式去除,同时氨氮的去除负荷在该阶段没有太大变化,导致出水(NO3--N+NO2--N)/ΔNH4+-N呈下降趋势.经过了第Ⅱ阶段的驯化后,第Ⅲ阶段(90~150 d)开始时反应器中已富集了一部分AOB菌和ANAMMOX菌,经过一段时期高浓度进水的适应后脱氮性能开始提高,并且氨氮浓度的提高导致FA的提高,进而使NOB菌在竞争中更加处于劣势(Anthonisen et al. 2012),大量的氨氮在AOB菌的作用下转化为亚硝态氮,再经过ANAMMOX菌的作用转化为硝态氮和N2,因此,出水(NO3--N+NO2--N)/ΔNH4+-N呈现先稳定后下降的趋势.在第Ⅳ阶段(150~210 d),出水(NO3--N+NO2--N)/ΔNH4+-N继续降低,最后稳定在0.11左右,与理论值吻合,说明短程硝化-厌氧氨氧化途径是该反应器脱氮的主要途径,表明CANON工艺启动成功(初里冰等,2005).
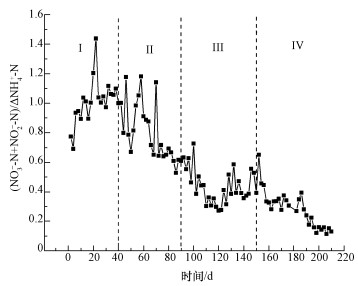 |
| 图 3 出水(NO3--N+NO2--N)/ΔNH4+-N的变化情况 Fig. 3 Effluent (NO3--N+NO2--N)/ΔNH4+-N variation |
图 4为污泥样品微生物菌群的相对丰度(门水平).接种时期污泥样品(Blank)中主要菌群为:变形菌门(Proteobacteria)(相对丰度为46.36%)、放线菌门(Actinobacteria)(12.62%)、糖化细菌门(Saccharibacteria)(10.19%)、绿弯菌门(Chloroflexi)(7.21%)、浮霉菌门(Planctomycetes)(2.42%)、酸杆菌门(Acidobacteria)(10.41%);CANON工艺启动成功污泥样品(R_AS_SD)中主要菌门有:变形菌门(Proteobacteria)(36.16%)、绿弯菌门(Chloroflexi)(14.22%)、浮霉菌门(Planctomycetes)(11.07%)、酸杆菌门(Acidobacteria)(10.41%)、绿菌门(Chlorobi)(12.82%)和放线菌门(Actinobacteria)(3.24%)等.
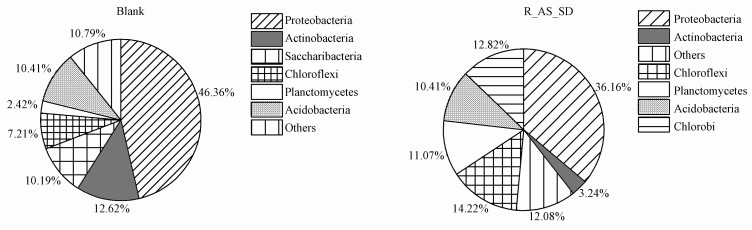 |
| 图 4 污泥样品微生物菌群结构分布 (纲水平) Fig. 4 Distribution of bacterial community structures in two samples on the phylum level |
随着CANON工艺的初步启动,污泥的种群结构发生了明显的变化.其中,变形菌门(Proteobacteria)在启动前样品(Blank)中的占比为46.36%,启动后相对丰度略有降低,在R_AS_SD中占36.16%,由于大部分硝化菌,如Nitrosococcus、Nitrosomonas等典型的AOB菌和NOB菌中的Nitrotoga、Nitrobacter、Nitrococcus都属于该菌门,故Proteobacteria是众多活性污泥系统中的主要脱氮菌群(包鹏等,2017;Zhang et al., 2012);同时,浮霉菌门(Planctomycetes)在样品Blank中的相对丰度为2.42%,在R_AS_SD中增加到了11.07%.相关研究表明,这两个菌门是CANON系统中的优势菌群(刘竹寒等,2017;Xiu et al., 2018).酸杆菌门(Acidobacteria)是新近被分出的一门细菌,相关研究表明Acidobacteria在土壤中分布广泛(刘彩霞等,2016),且在氮循环中起降低硝酸盐、亚硝酸盐和一氧化二氮的作用(Ward et al., 2009).由于CANON系统为限氧环境,启动成功后出现了绿菌门(Chlorobi)和绿弯菌门(Chloroflexi)这两种在厌氧生物脱氮系统中常见的不产氧光合细菌(刘竹寒等,2017;Yoon et al., 2010).同时,闫媛等(2015)对启动成功后的CANON系统污泥样品检测出其CANON系统中也含有Proteobacteria(49.88%)、Planctomycetes(2.71%)、Chlorobi(3.5%)、Chloroflexi(30%)、Acidobacteria(2.5%)等菌门,与该检测结果类似,说明启动成功的CANON系统中以上菌群占比较高.放线菌门(Actinobacteria)由于大部分是好氧菌,在普通好氧污泥中含量较高(龚维红等,2005),故在限氧的CANON反应器中丰度降低较为明显,未定名的Saccharibacteria在启动成功后的污泥样品中已经无法被检测出.
3.3 微生物纲水平菌群结构分析图 5为污泥样品微生物菌群的相对丰度(纲水平).接种时期污泥样品(Blank)中主要菌群为:β-变形菌纲(Betaproteobacteria)(15.41%)、γ-变形菌纲(Gammaproteobacteria)(11.4%)、α-变形菌纲(Alphaproteobacteria)(11.03%)、酸杆菌纲(Acidobacteria)(10.41%)、放线菌纲(Actinobacteria)(12.62%)、Δ-变形菌(Deltaproteobacteria)(7.7%);启动成功的污泥样品(R_AS_SD)中主要菌纲有:β-变形菌纲(Betaproteobacteria)(16.11%)、γ-变形菌纲(Gammaproteobacteria)(12.61%)、浮霉菌纲(Planctomycetacia)(9.36%)、噬纤维菌纲(Ignavibacteria)(8.04%)、装甲菌纲(Armatimonadetes-norank)(6.08%)、Δ-变形菌纲(Deltaproteobacteria)(5.76%).
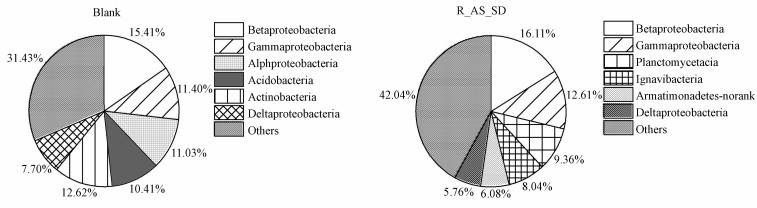 |
| 图 5 污泥样品微生物菌群结构分布 (纲水平) Fig. 5 Distribution of bacterial community structures in two samples on the class level |
由图 5可以看出,反应器启动后的样品中α-变形菌纲(Alphaproteobacteria)的相对丰度较启动前有所降低,推测原因是随着反应器的运行,系统内的NOB菌逐渐失去竞争优势被洗脱出反应器,而较多经典的NOB菌都属于Alphaproteobacteria(Daims et al., 2001),导致Alphaproteobacteria的含量下降;同时,β-变形菌纲(Betaproteobacteria)较启动前增加,有研究表明,进行亚硝化反应的AOB菌属于Betaproteobacteria(李东等,2014),菌群的变化保证了系统氨氮的转化和亚硝态氮的积累,利于反应的进行.浮霉菌纲(Planctomycetacia)相对丰度的增加最为明显,由启动时的0增加到了9.36%.研究表明,进行厌氧氨氧化反应的ANAMMOX菌主要是Planctomycetes门的Planctomycetacia纲(刘竹寒等,2017),同时,Fuerst(2010)认为Planctomycetacia纲在污水处理中起着重要作用,浮霉菌纲的丰度增加表明该反应器脱氮效果提高,以上结果表明Planctomycetacia纲为CANON系统中的典型菌种.反应器启动过程中酸杆菌纲(Acidobacteria)、放线菌纲(Actinobacteria)的相对丰度明显减少,接种时期丰度均高于10%,在启动成功后的污泥样品中均未被检测出,推测原因是环境由好氧转变为厌氧限制了其生长.
3.4 微生物属水平菌群结构分析CANON系统中的脱氮微生物属分类层面启动前后的比对如图 6所示,Proteobacteria门Betaproteobacteria纲的Nitrosomonas作为一种典型的AOB菌普遍存在于CANON反应器中(Liu et al., 2008;Liu et al., 2011).从图中可以看出,该菌在启动前丰度为1.24%,经过驯化后丰度增加,启动成功时达到了2.09%,并且Betaproteobacteria纲在反应器中占据了较大比例,表明采用实际猪场沼液启动CANON工艺反应器可以成功实现AOB菌的富集,在启动成功后,Nitrosomonas作为优势脱氮菌种完成短程硝化过程,提高了反应器去除率.在整个启动过程中变化最大的是Candidatus_Brocadia,丰度由启动前的0增加到启动后的8.71%.同时,该菌属所属的纲和门在反应器中所占比例都有较大上升,Candidatus_Brocadia是该系统检测出的唯一ANAMMOX菌,这与Hu等(2010)和Gonzalez等(2016)的研究结果一致,其认为在特定环境下启动成功的CANON系统中只有一种ANAMMOX菌会成为优势菌种.该菌丰度的巨大增长表明启动成功时反应器中厌氧氨氧化过程发生频繁,大量由短程硝化产生的NO2--N被ANAMMOX菌转化为NO3--N和N2.结合反应器去除率可以看出,此时短程硝化过程与厌氧氨氧化过程相互配合成功形成CANON工艺.
 |
| 图 6 启动前后微生物菌群结构 (属水平) Fig. 6 Microbial population pre and post launch (genus) |
Xanthomonadaceae属于反硝化菌群且能产生胞外多糖(Weissbrodt et al.,2015),在本实验中其丰度由2.14%增加至4.76%.Liu等(2015)报道的畜产污水培养的AGS中Xanthomonadaceae丰度超过40%,本实验采用猪场沼液作为进水是导致该菌在系统中占比较高的重要原因.与此同时,系统中出现了一些能够适应厌氧低碳高氨氮环境的脱氮菌群,如Comamonas、Rhodanobacter和Cupriavidus.Comamonas是一种脱氮效率较好的反硝化菌,可将硝酸盐作为电子受体来降解COD(Sadaie et al.,2007),在本实验中启动成功后丰度达到4.13%.在启动成功后发现放线菌门Actinobacteria中Rhodanobacter的丰度占比为3.14%,相关研究表明,Rhodanobacter可在厌氧条件下进行自养反硝化作用(Prakash et al., 2012).Cupriavidus的丰度由0增加至1.14%,研究表明,Cupriavidus具有反硝化作用,能将NO3--N还原为N2(孙智毅,2017),在系统中起到辅助脱氮的作用.
在接种污泥中,Arenimonas和Mycobacterium具有较高的丰度(分别为2.43%和4.31%).研究发现,Mycobacterium是典型的异养硝化菌,可将NH4+-N作为硝化底物,对脱氮起重要作用(Kuenen et al., 1994).然而在本实验启动成功后Mycobacterium已无法被检测出,可能是由于系统内大量NH4+-N被AOB菌消耗导致其得不到足够的硝化底物而被淘洗出反应器.Arenimonas在异养和自养混合条件下可以利用H2作为电子供体进行自养反硝化脱氮作用(Peng et al., 2013),但随着进水氨氮浓度的提高,至CANON工艺形成后,其丰度降低至0.实验结果表明,高氨氮浓度的环境可能不利于Arenimonas的有效富集.另外,在启动后Blastocatella的丰度由2.3%降低至1.25%,Foesel等(2013)研究发现,Blastocatella属于好氧异养菌,能将复杂有机烃类及含氮物质分解为小分子物质,推测原因是CANON工艺的限氧条件不能为其提供足够氧气作为电子受体,导致其丰度明显下降.
4 结论(Conclusions)1) 在连续流合建式反应器内接种普通活性污泥,控制低溶解氧(0.5 mg· L-1),采用逐步提高进水氨氮浓度的启动策略,经过210 d成功实现了CANON工艺处理实际猪场沼液的启动.启动成功后,进水氨氮浓度为450 mg· L-1,反应器对NH4+-N和TN的去除率分别可达69.8%和61.1%,且出水(NO3--N+NO2--N)/ΔNH4+-N接近理论值0.11.
2) 高通量测序结果表明,与接种污泥相比,系统启动前后微生物种群发生了较大变化,其中,变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)是启动成功后系统内的优势菌门.浮霉菌纲(Planctomycetacia)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)和噬纤维菌纲(Ignavibacteria)等在启动后丰度有明显增长,而α-变形菌纲(Alphaproteobacteria)、酸杆菌纲(Acidobacteria)和放线菌纲(Actinobacteria)则被淘洗出反应器.
3) 处理猪场沼液CANON工艺系统中,与脱氮功能相关的菌属为:Candidatus_Brocadia(ANAMMOX菌)、Nitrosomonas(AOB菌)、Comamonadaceae(反硝化菌)和Xanthomonadaceae(反硝化菌)等.
Ahn Y H, Choi H C. 2006. Autotrophic nitrogen removal from sludge digester liquids in upflow sludge bed reactor with external aeration[J]. Process Biochemistry, 41(9): 1945–1950.
DOI:10.1016/j.procbio.2006.04.006
|
Anthonisen A C, Loehr R C, Prakasam T B S, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal of Water Pollution Control Federation, 48(5): 835–852.
|
包鹏, 王淑莹, 高瑶远, 等. 2017. 利用高通量测序技术分析不同溶解氧条件下硝化活性污泥的菌群结构特性[J]. 北京工业大学学报, 2017, 43(5): 801–808.
|
Cardinali-Rezende J, Pereira Z L, Sanz J L, et al. 2012. Bacterial and archaeal phylogenetic diversity associated with swine sludge from an anaerobic treatment lagoon[J]. World Journal of Microbiology and Biotechnology, 28(11): 3187–3195.
DOI:10.1007/s11274-012-1129-8
|
初里冰, 张兴文, 李晓惠, 等. 2005. 一种新型生物脱氮工艺-CANON工艺[J]. 齐鲁工业大学学报, 2005, 19(1): 21–24.
|
Daims H, Nielsen J L, Nielsen P H, et al. 2001. In situ characterization of nitrospira-like nitrite-oxidizing bacteria active in wastewater treatment plants[J]. Appl Environ Microbiol, 67(11): 5273–5284.
DOI:10.1128/AEM.67.11.5273-5284.2001
|
Daverey A, Su S H, Huang Y T, et al. 2012. Nitrogen removal from optoelectronic wastewater using the simultaneous partial nitrification, anaerobic ammonium oxidation and denitrification (SNAD) in sequencing batch reactor[J]. Bioresour Technology, 113: 225–231.
DOI:10.1016/j.biortech.2011.12.004
|
Foesel B U, Rohde M, Overmann J, et al. 2013. Blastocatella fastidiosa gen.nov., sp.nov., isolated from semiari savanna soil-The first described species of Acidobacteria subdivision 4[J]. Systematic and Applied Microbiology, 36(2): 82–89.
DOI:10.1016/j.syapm.2012.11.002
|
付昆明, 左早荣, 仇付国. 2014. 陶粒CANON反应器的接种启动与运行[J]. 环境科学学报, 2014, 35(3): 995–1000.
|
Fuerst J A. 2010. Beyond prokaryotes and eukaryotes:Planctomycetes and cell organization[J]. Nature Education, 3(9): 44.
|
龚维红, 陈玮. 2005. 城市污泥好氧发酵菌种放线菌的初步筛选[J]. 生物技术, 2005, 15(2): 41–43.
|
宫正, 刘思彤, 杨凤林, 等. 2008. 启动炭管膜曝气生物膜反应器实现全程自养脱氮[J]. 环境科学, 2008, 29(5): 1221–1226.
DOI:10.3321/j.issn:0250-3301.2008.05.012 |
Gonzalez-Martinez A, Rodriguez-Sanchez A, Garcia-Ruiz M J, et al. 2016. Performance and bacterial community dynamics of a CANON bioreactor acclimated from high to low operational temperatures[J]. Chemical Engineering Journal, 287: 557–567.
DOI:10.1016/j.cej.2015.11.081
|
国家环境保护总局. 2002. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社: 258–280.
|
韩伟铖, 颜成, 周立祥. 2017. 规模化猪场废水常规生化处理的效果及原因剖析[J]. 农业环境科学学报, 2017, 36(5): 989–995.
|
Hao X, Heijnen J J, VanLoosdrecht M C. 2002. Model-base devaluation of temperature and inflow variations on a partial nitrification-ANAMMOX biofilm process[J]. Water Research, 36(19): 4839.
DOI:10.1016/S0043-1354(02)00219-1
|
Hu B L, Zheng P, Tang C J, et al. 2010. Identification and quantification of anammox bacteria in eight nitrogenremoval reactors[J]. Water Research, 44(17): 5014–5020.
DOI:10.1016/j.watres.2010.07.021
|
Hulle S W V, Volcke E I, Teruel J L, et al. 2007. Influence oftemperature and pH on the kinetics of the Sharon nitritation process[J]. Journal of Chemical Technology & Biotechnology, 82(5): 471–480.
|
Jing X, Dong L, Hai Y, et al. 2014. Performance and microbial community of completely autotrophic nitrogen removal over nitrite(CANON) process in two membrane bioreactors(MBR) fed with different substrate levels[J]. Bioresource Technology, 152: 185–191.
DOI:10.1016/j.biortech.2013.10.110
|
李东, 何永平, 张肖静, 等. 2014. MBR系统CANON工艺的快速启动及微生物种群特征[J]. 中国环境科学, 2014, 34(11): 2788–2795.
|
刘彩霞, 董玉红, 焦如珍. 2016. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17–22.
|
Liu L, You Q, Gibson V, et al. 2015. Treatment of swine wastewater in aerobic granular reactors:Comparison of different seed granules as factors[J]. Frontiers of Environmental Science & Engineering, 9(6): 1139–1148.
|
Liu S, Yang F, Gong Z, et al. 2008. Assessment of the positive effect of salinity on the nitrogen removal performance and microbial composition during the start-up of CANON process[J]. Applied Microbiology and Biotechnology, 80(2): 339–348.
DOI:10.1007/s00253-008-1536-9
|
Liu T, Dong L, Jie Z, et al. 2011. Phylogenetic and microbial community analysis based on amoA gene and 16S rDNA innitrosification biofilm reactor[J]. Environmental Biotechnologyand Materials Engineering, 183: 1051–1056.
|
Liu T, Li D, Zeng H P, et al. 2012. Biodiversity and quantification of functional bacteria in completely au.totrophic nitrogen-removal over nitrite(CANON) process[J]. Bioresource Technology, 118: 399–406.
DOI:10.1016/j.biortech.2012.05.036
|
刘竹寒, 岳秀, 于广平, 等. 2017. CANON在SBAF中的快速启动及其微生物特征[J]. 环境科学学报, 2017, 38(1): 253–259.
|
Lotti T, Star W, Kleerebezem R, et al. 2012. The effect of nitrite inhibition on the anammox process[J]. Water Research, 46(8): 2559–2569.
DOI:10.1016/j.watres.2012.02.011
|
鲁航, 信欣, 管蕾, 等. 2016. 部分半硝化AGS-SBR工艺的启动及其种群结构分析[J]. 环境科学学报, 2016, 37(12): 4741–4749.
|
Muyzer G, Dewaal E C, Uitterlinden A G. 1993. Profiling of complex microbial-populations by denaturing gradient gel-electrophoresis analysis of polymerase chain reaction-amplified genes-coding for 16s Ribosomal-Rna[J]. Applied and Environmental Microbiology, 59(3): 695–700.
|
Peng L, Wei X, Zuo J, et al. 2013. Hydrogenotrophic denitrification for tertiary nitrogen removal from municipal wastewater using membrane diffusion packed-bed bioreactor[J]. Bioresource Technology, 144(5): 452–459.
|
Prakash O, Green S J, Jasrotia P, et al. 2012. Rhodanobacter denitrificans sp.nov., isolated from nitrate-rich zones of a contaminated aquifer[J]. International Journal of Systematic and Evolutionary Microbiology, 62(10): 2457–2462.
|
Sadaie T, Sadaie A, Takada M, et al. 2007. Reducing sludge production and the domination of Comamonadaceae by reducing the oxygen supply in the wastewater treatment procedure of a food-processing factory[J]. Agricultural and Biological Chemistry, 71: 791–799.
|
Sliekers A O, Derwort N, Campos-Gomez J L, et al. 2002. Completely autotrophic nitrogen removal over nitrite in one single reactor[J]. Water Research, 36(10): 2475–2482.
DOI:10.1016/S0043-1354(01)00476-6
|
Sliekers A O, Third K A, Abma W, et al. 2003. CANON and Anammox in a gas lift reactor[J]. FEMS Microbiology Letters, 210: 339–344.
|
孙洪伟, 吕心涛, 魏雪芬, 等. 2016. 游离氨(FA)耦合曝气时间对硝化菌活性的抑制影响[J]. 环境科学, 2016, 37(3): 1075–1081.
|
孙延芳, 韩晓宇, 张树军, 等. 2017. 颗粒+絮体污泥CANON工艺的启动与SRT影响研究[J]. 环境科学学报, 2017, 38(2): 672–678.
|
孙智毅, 2017. 一株异养硝化-好氧反硝化Cupriavidus sp. S1的筛选及降解特性研究[D]. 太原: 太原理工大学
|
王明月. 2017. 猪场消毒的重要性及注意事项[J]. 现代畜牧科技, 2017, 32(8): 9–10.
|
王衫允. 2016. 低氨氮浓度厌氧氨氧化工艺强化及颗粒污泥菌群特性研究[D]. 哈尔滨: 哈尔滨工业大学
|
Ward N L, Challacombe J F, Janssen P H, et al. 2009. Three genomes from the phylum Acidobacteria provide insight into the lifestyles of these microorganisms in soils[J]. Applied and Environmental Microbiology, 75(7): 2046–2056.
DOI:10.1128/AEM.02294-08
|
Weissbrodt D G, Shani N, Holliger C, et al. 2014. Linking bacterial population dynamics and nutrient removal in the granular sludge biofilm ecosystem engineered for wastewater treatment[J]. FEMS Microbiology Ecology, 88(3): 579–595.
DOI:10.1111/fem.2014.88.issue-3
|
吴斌, 王必尊, 王丽霞, 等. 2018. 不同催花肥对莲雾根际土壤细菌群落多样性的影响[J]. 环境科学研究, 2018, 31(4): 732–741.
|
Xiu Y, Guang P Y, Yu Q L, et al. 2018. Effect of dissolved oxygen on nitrogen removal and the microbial community of the completely autotrophic nitrogen removal over nitrite process in a submerged aerated biological filter[J]. Bioresource Technology, 254: 67–74.
DOI:10.1016/j.biortech.2018.01.044
|
闫媛, 黎力, 王亚宜, 等. 2015. 采用高通量测序分析全程自养脱氮(CANON)系统不同脱氮效能下的微生物群落结构[J]. 北京工业大学学报, 2015, 41(10): 1485–1492.
DOI:10.11936/bjutxb2015010005 |
闫园园, 李子富, 程世昆, 等. 2013. 养殖场厌氧发酵沼液处理研究进展[J]. 中国沼气, 2013, 31(5): 48–52.
DOI:10.3969/j.issn.1000-1166.2013.05.011 |
Yang Z H, Xiao Y, Zeng G M, et al. 2007. Comparison of methods for total community DNA extraction and purification from compost[J]. Applied Microbiology and Biotechnology, 74(4): 918–925.
DOI:10.1007/s00253-006-0704-z
|
Yoon D N, Park S J, Kim S J, et al. 2010. Isolation, characterization, and abundance of filamentous members of caldilineae in activated sludge[J]. Journal of Microbiology, 48(3): 275–283.
DOI:10.1007/s12275-010-9366-8
|
Zhang H, Sekiguchi Y, Hanada S, et al. 2003. Gemmatimonas aurantiaca gen.nov., sp.nov., a Gram-negative, aerobic, polyphosphate-accumulating micro-organism, the first cultured representative of the new bacterial phylum Gemmatimonadetes phyl.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 53(4): 1155–1163.
DOI:10.1099/ijs.0.02520-0
|
张杰, 成朔, 李冬, 等. 2018. AUSB中置曝气启动连续流全程自养脱氮工艺[J]. 哈尔滨工业大学学报, 2018, 50(2): 1–7.
|
张克强, 高怀友. 2004. 畜禽养殖业污染物处理与处置[M]. 北京: 化学工业出版社: 26–30.
|
Zhang T, Shao M F, Ye L. 2012. 454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. The ISME Journal, 6(6): 1137–1147.
DOI:10.1038/ismej.2011.188
|
Zhang X J, Li D, Liang Y H, et al. 2013. Application of membrane bioreactor for completely autotrophic nitrogen removal over nitrite(CANON) process[J]. Chemosphere, 93(11): 2832–2838.
DOI:10.1016/j.chemosphere.2013.09.086
|
张肖静, 李冬, 马静, 等. 2016. SNAD生物膜厌氧氨氧化活性的氨氮抑制动力学研究[J]. 中国环境科学, 2016, 36(10): 2957–2963.
DOI:10.3969/j.issn.1000-6923.2016.10.015 |
赵国华, 陈贵. 2015. 养猪废水处理与资源化利用的研究进展[J]. 四川环境, 2015, 34(6): 156–161.
DOI:10.3969/j.issn.1001-3644.2015.06.028 |
郑照明, 李军, 刘常敬, 等. 2015. 城市生活污水SNAD工艺的启动研究[J]. 中国环境科学, 2015, 35(4): 1072–1081.
|
左早荣, 付昆明, 仇付国, 等. 2013. CANON工艺的研究现状及面临困难分析[J]. 水处理技术, 2013, 39(9): 15–19.
DOI:10.3969/j.issn.1000-3770.2013.09.004 |
 2018, Vol. 38
2018, Vol. 38


