2. 湿润亚热带生态-地理过程教育部重点实验室, 福州 350007;
3. 福州大学环境与资源学院, 福州 350116
2. Key Laboratory of Humid Subtropical Eco-Geographical Process, Ministry of Education, Fujian Normal University, Fuzhou 350007;
3. School of Environment and Resource, Fuzhou University, Fuzhou 350116
河口潮汐湿地因其高固碳潜力而成为全球重要的碳汇(Megonigal et al., 2009).然而大量河口潮汐湿地固定的有机碳并没有完全储存在土壤中, 有相当部分有机碳在电子受体(如O2、NO3-、Mn(Ⅳ)、Fe(Ⅲ)和SO42-等)的作用下重新矿化分解为CH4和CO2等温室气体并排放至大气中, 因此, 河口潮汐湿地有机碳矿化一直备受国内外学者的广泛关注(Gribsholt et al., 2003; Hyun et al., 2007; Luo et al., 2016).研究发现, 河口潮汐湿地土壤受潮汐水淹影响, 经常处于厌氧状态, 而且大部分O2仅能到达地面以下几毫米处, 同时该区域内Mn(Ⅳ)、NO3-和SO42-浓度普遍较低, 因此, 土壤碳矿化过程多以铁异化还原和产甲烷途径为主(Sutton-Grier et al., 2011).图 1所示为河口潮汐湿地沉积物Fe-S-C耦合循环.
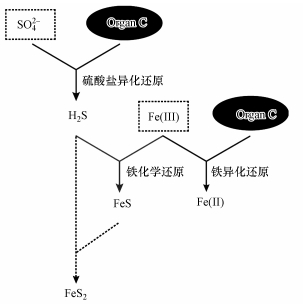 |
| 图 1 河口潮汐湿地沉积物Fe-S-C耦合循环示意图 Fig. 1 Schematic diagram of Fe-S-C coupling cycle in the sediment of estuary tidal wetland |
随着全球气候变化的不断加剧, 预计到2100年, 全球平均海平面将上升0.55 m(IPCC, 2013), 尤其是河口潮汐湿地将受海平面上升引起的盐水入侵的深刻影响.盐水入侵使河口潮汐湿地生态系统受到盐分胁迫, 其动植物群落、微生物群落也都将受到影响(Baldwin et al., 1998; Sharpe et al., 2012).同时, 盐水入侵还会对河口潮汐湿地碳的生物地球化学循环产生显著影响.在土壤碳矿化方面, 入侵海水携带的大量SO42-会增加硫酸盐异化还原速率, 并抑制甲烷产生过程, 从而影响河口潮汐湿地有机碳矿化速率和途径(Chambers et al., 2013; Marton et al., 2012).另一方面, 全球气候变化也会改变区域水热条件.以我国东部沿海地区为例, 该区域受海洋季风气候控制, 随着全球变暖, 该区域暴雨现象日益频繁(Piao et al., 2010; Zhao et al., 2010).暴雨频发会加剧区域内水土流失, 土壤中大量的Fe(Ⅲ)随着雨水输入到径流中(周国华等, 2012), 并被带到下游河口地区.Fe(Ⅲ)的大量输入亦可影响河口潮汐湿地土壤有机碳矿化的速率和途径.随着气候变化的加剧, 海平面上升诱发的盐水入侵带来大量的SO42-, 以及河流上游径流带来的大量Fe(Ⅲ)在河口区域汇聚, 将打破该区域生物地球化学循环的原有平衡, 特别是对铁异化还原、硫酸盐异化还原和产甲烷过程产生剧烈的影响(Chamber et al., 2013; Dijk et al., 2015), 并改变河口湿地沉积物及其间隙水地球化学特征.对于相关地球化学指标的分析将有助于认识河口湿地生物地球化学循环对Fe(Ⅲ)输入和盐水入侵的响应.
因此, 本研究以闽江河口塔礁洲淡水野慈姑(Sagittaria trifolia L.)湿地为研究对象, 设计原位Fe(Ⅲ)浓度增强和盐水入侵模拟实验, 通过分析春、夏两季不同施加处理组(对照、+盐、+铁、+盐+铁)下河口潮汐湿地间隙水地球化学特征、沉积物不同形态铁含量, 以明晰Fe(Ⅲ)浓度增加和盐水入侵及其交互作用对河口潮汐湿地沉积物及间隙水生物地球化学特征的影响, 以期为评估未来气候变化对河口潮汐湿地有机碳厌氧矿化途径及Fe、S的影响提供数据支撑, 并为更好地应对气候变化及保护河口潮汐湿地生态系统提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验区概况闽江河口塔礁洲(119°19′55″~119°22′45″E, 25°56′56″~25°57′36″N)是由闽江径流携带来的泥沙在河口感潮段淤积而成的洲滩, 面积约878 hm2(图 2a).闽江河口地处亚热带海洋性季风气候区, 年均气温为19.7 ℃, 年降水量约为1346 mm(Tong et al., 2012).塔礁洲受潮汐作用显著, 表现为非正规的半日浅潮.塔礁洲中部土地覆被为居民点及农田, 四周仍由沙滩和泥滩组成, 分布的主要湿地植物有短叶茳芏(Cyperus malaccensis)及野慈姑等.本研究选取位于塔礁洲南侧的淡水野慈姑湿地(盐度0.10 ‰±0.04 ‰)为研究样地(图 2b), 年平均淹水频率为24.5%, 土壤为粉砂质壤土(粘粒为9.85%~12.02%, 粉粒为46.00%~52.75%, 砂粒为36.36%~42.87%).
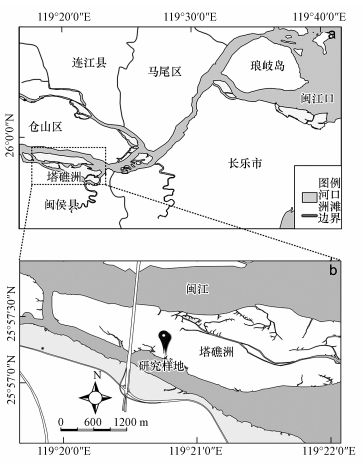 |
| 图 2 闽江河口塔礁洲淡水湿地样地地理位置图 Fig. 2 Location of study site in the Tajiaozhou of the Min River Estuary |
2015年10月在长势均匀的野慈姑群落内布置样地, 选择平行岸线方向等间距布设12个样方框(材质为PVC, 长×宽×高为35 cm×35 cm×40 cm), 将样方框压入土壤中35 cm以防止施加溶液横向流动, 露出地面5 cm.样方框设置后在样地搭建简易木桥以减少人为扰动.实验设置4组处理:①对照组(CK);②Fe(Ⅲ)增强组(+Fe);③盐水入侵组(+S);④盐水入侵+Fe(Ⅲ)增强组(+S+Fe);每组处理设置3个重复.Fe(Ⅲ)以氢氧化铁(Fe(OH)3)悬浊液的形式施加, 以塔礁洲样地0~30 cm表层可还原态铁含量的3倍为年施加量, 即年添加量约为3000 g·m-2·a-1(以Fe(OH)3计).施加的人造海水(15 g·kg-1)主要成分包括0.25 mol·L-1 Cl-、0.01 mol·L-1 SO42-、0.004 mol·L-1 Ca2+、0.02 mol·L-1 Mg2+、0.004 mol·L-1 K+和0.21 mol·L-1 Na+;CK处理仅施加等量的河流淡水.从2015年12月—2017年12月, 每月选择连续两个小潮日往各处理组样方框内分别缓慢施加2 L上述溶液, 施加时段地表出露且无潮水水淹.
2.3 沉积物和间隙水取样与处理施加实验开展1.5 a后, 分别于2017年3月(春季)和7月(夏季)用PVC沉积物采样器采集样方框内沉积物样品.取样后样品立即保存在两端装有硅胶垫的PVC管中, 并在两端加盖密封, 抽真空保证厌氧状态, 所有样品在1.5 h内带回实验室.返回实验室后, 在YQX-II厌氧培养箱(上海跃进医疗器械厂公司)中用塑料刀将沉积物柱样品按0~2、2~5、5~10、10~15、15~20和20~30 cm进行切割, 并分别放入自封袋中.利用自制的间隙水采样器(专利编号:201621472027.1)进行间隙水样品采集, 注入抽真空的西林瓶中.其中, 用于Fe2+、DOC、NO3-和NH4+分析的间隙水样品中加入10 μL 6 mol·L-1的HCl.上述沉积物和间隙水样品均在4 ℃下冷藏(Bullock et al., 2013;Morrissey et al., 2014)保存, 7 d内完成实验分析.
2.4 间隙水地球化学特征分析间隙水Fe2+和HS-的浓度分析分别采用1, 10-邻菲啰啉(APHA, 2005)和亚甲基蓝(Cline, 1969)法进行光度测定(日本岛津UV-2450紫外分光光度计).溶解性有机碳(DOC)和溶解性无机碳(DIC)的浓度利用日本岛津TOC分析仪(TOC-V CPH)测定.NO3-和NH4+浓度采用荷兰Skalar连续流动分析仪(SAN++)测定, 总溶解氮(TDN)减去NO3-和NH4+(DON=TDN-NO3- -NH4+)获得溶解性有机氮(DON).间隙水SO42-和Cl-的浓度利用美国赛默飞世尔科技离子色谱仪(ICS-2100)测定.ΔSO42-(SO42-的变化量)根据公式(1)计算.
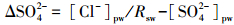
|
(1) |
式中,[Cl-]pw和[SO42-]pw分别为间隙水Cl-和SO42-的浓度(mmol·L-1);Rsw为海水中Cl-和SO42-浓度的比值(取值5.17×10-2,Wilson et al., 2015).ΔSO42-为负值,说明SO42-被消耗;反之,说明有SO42-产生.
溶解性CH4采用顶空平衡法采样(Minamikawa et al., 2010),利用日本岛津气相色谱仪(GC-2010)进行顶空气体CH4浓度的测定.溶解性CH4的浓度根据公式(2)计算.
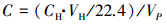
|
(2) |
式中,C为溶解性CH4的浓度(μmol·L-1);CH为玻璃瓶中顶空气体CH4的浓度(μL·L-1);VH为玻璃瓶中顶空气体的体积(mL);VP为玻璃瓶中间隙水的体积(mL).
2.5 沉积物地球化学特征分析分别利用0.5 mol·L-1 HCl溶液、0.5 mol·L-1 HCl+10 mg·L-1羟胺溶液及柠檬酸盐-碳酸氢盐-连二亚硫酸盐(CBD)提取沉积物中的非硫Fe(Ⅱ)、无定形Fe(Ⅲ)和晶质Fe(Ⅲ)(Kostka et al., 1994; 1995), 各种形态铁的含量利用1, 10-邻菲啰啉法测定.酸性挥发性硫(AVS)和铬还原性硫(CRS)分别利用0.1 mol·L-1抗坏血酸溶液+6 mol·L-1 HCl和酸性CrCl2溶液提取, 并采用冷凝吹气法收集反应中产生的H2S(Burton et al., 2008), 利用亚甲基蓝法测定S的含量.FeS和FeS2的浓度利用AVS和CRS的Fe和S化学计量比计算(AVS:Fe:S=1:1, CRS:Fe:S=1:2).
2.6 数理统计分析采用双因素方差分析(Two-way ANOVA)检验春、夏季和处理对间隙水和沉积物地球化学特性的影响.数据分析前, 先经过正态分布检验和方差齐次性检验, 对于有显著性差异的结果, 组间的差异性利用Tukey事后检验分析.ΔSO42-与间隙水地球化学特征之间的相关分析采用Pearson相关分析.以上数据分析显著性水平α均设为0.05.统计分析均在SPSS 22.0软件中进行.
3 结果与分析(Results and analysis)间隙水地球化学参数(溶解性CH4、DOC、DOC:DON、Fe2+和ΔSO42-)和各种形态Fe(非硫Fe(Ⅱ)、无定形Fe(Ⅲ)、晶质Fe(Ⅲ)、FeS和FeS2)在0~30 cm深度分布情况分别见图 3和图 4, 双因素方差分析结果见表 1, 4个处理组沉积物和间隙水指标边缘平均值及极值见表 2.
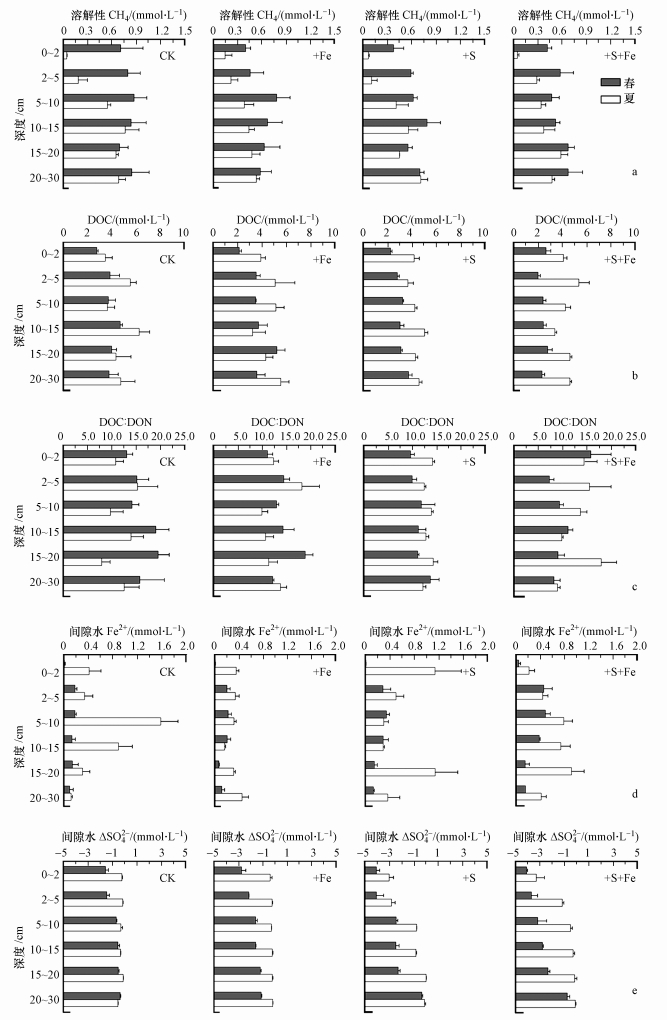 |
| 图 3 Fe(Ⅲ)浓度增强及盐水入侵情景下野慈姑湿地沉积物剖面间隙水地球化学特征(a.溶解性CH4, b.DOC, c.DOC:DON, d.间隙水Fe2+, e.间隙水ΔSO42-) Fig. 3 Porewater inventories of dissolved CH4, DOC, DOC:DON ratios, Fe2+ and ΔSO42- in the sediment profile of 0~30 cm depth in the Cyperus malaccensis wetland experiencing saltwater intrusion and increased ferric iron in the March and July 2017 |
 |
| 图 4 Fe(Ⅲ)浓度增强及盐水入侵情景下野慈姑湿地沉积物剖面不同形态铁和硫含量(a.春季,b.夏季) Fig. 4 Contents of different Fe forms in the sediment profile of 0~30 cm depth in the Cyperus malaccensis wetland experiencing saltwater intrusion and increased ferric iron in the March and July 2017 |
| 表 1 施加处理和春夏季影响下沉积物不同形态铁及间隙水化学参数的双因素方差分析 Table 1 Two-way ANOVA analysis of porewater inventories and solid Fe among the treatments and two seasons among four treatments during March and July, 2017 |
| 表 2 4种施加处理组沉积物和间隙水指标边缘平均值及极值 Table 2 Depth-integrated profile of sediment and porewater geochemistry among four treatments in March and July, 2017 |
除夏季+S+Fe组外, 春、夏两季各处理组间隙水溶解性CH4浓度多在0~15 cm处随深度增加而增大, 而在15~30 cm深度保持稳定(图 3a).施加处理和春、夏两季均对溶解性CH4的浓度有显著影响(表 1), 其中, +Fe组(0.48 mmol·L-1)溶解性CH4浓度略低于CK组(0.64 mmol·L-1)(表 2).春季溶解性CH4浓度剖面均值(0.63 mmol·L-1)显著高于夏季(0.40 mmol·L-1)(p < 0.001, 表 1).
4个处理组中, 不同深度间DOC的浓度变化不明显(图 3b).施加处理和春、夏两季均对DOC的浓度有显著影响(表 1).其中, CK组和+Fe组的DOC浓度(4.24和4.10 mmol·L-1)显著高于+S+Fe组(3.42 mmol·L-1, Tukey, p < 0.05)(表 2).夏季DOC的浓度(4.49 mmol·L-1)显著高于春季(3.22 mmol·L-1, 表 1).
夏季CK组DOC:DON比值总体上呈随深度增加先增加后减小的趋势, +S+Fe组两季DOC:DON比值均随深度增加而降低(图 3c).春、夏两季和4种处理组之间的DOC:DON比值无显著差异(表 1), 但季节和处理交互作用对DOC:DON比值具有显著影响(表 1).两组施加盐水处理(+S和+S+Fe)的DOC:DON比值从春季到夏季整体减少18%, 但不加盐处理(+CK和+Fe)的DOC:DON比值从春季到夏季整体呈增加趋势(1.3倍).
春季, 除CK组Fe2+浓度随深度增加保持稳定外, 其它3组处理的Fe2+浓度均随深度增加呈先增后减的趋势, 其中以+S+Fe组变化趋势最为明显.夏季, 除+S+Fe组与春季保持先增加后减小的相同趋势外, 其余3组均与春季趋势不同(图 3d).施加处理和春、夏季均对间隙水Fe2+浓度有显著影响(表 1), 其中, +S+Fe组间隙水Fe2+浓度(0.43 mmol·L-1)最高, 显著高于+Fe组(0.23 mmol·L-1)(表 2).夏季各处理组间隙水Fe2+浓度平均值(0.54 mmol·L-1)显著高于春季(0.18 mmol·L-1)(表 1).
春季, 加盐处理组(+S和+S+Fe)ΔSO42-均呈随深度增加而递增的趋势.夏季, CK组和+Fe组的ΔSO42-在垂直方向上变化不明显, +S+Fe组除表层偏低外其余深度相对稳定(图 3e).夏季ΔSO42-(-0.68 mmol·L-1)显著高于春季(-2.00 mmol·L-1).施加处理、春夏季及其交互作用均对ΔSO42-有显著影响(表 1).在4个处理组中, CK组(-0.56 mmol·L-1)和+Fe组(-0.99 mmol·L-1)的ΔSO42-显著高于2个加盐处理组(+S, -2.11 mmol·L-1;+S+Fe, 2.00 mmol·L-1)(表 2).
3.2 沉积物中固相铁和硫双因素方差分析结果表明, 春、夏季对非硫Fe(Ⅱ)、无定形Fe(Ⅲ)、晶质Fe(Ⅲ)、FeS和FeS2都具有显著的影响(p<0.001), 施加处理仅对非硫Fe(Ⅱ)、晶质Fe(Ⅲ)和FeS2有显著影响(p < 0.001, 表 1).非硫Fe(Ⅱ)含量最高的是+Fe组(112.3 μmol·g-1, 以干重计), 显著高于不加铁的两个处理组(CK和+S)(表 2), 而+S+Fe组则显著大于+S组.两组加铁处理(即+Fe和+S+Fe)的晶质Fe(Ⅲ)含量显著高于不加铁的两组处理(即CK和+S).各组处理间FeS含量均无差异, 而FeS2含量则表现为施加盐水的两组处理(即+S和+S+Fe)显著高于不施加盐水的两组处理(即CK和+Fe)(表 2).
从春季到夏季, 无定形Fe(Ⅲ)、晶质Fe(Ⅲ)和FeS2含量均显著增加, 分别从91.20、120.76和10.65 μmol·g-1增加到118.44、139.40和26.65 μmol·g-1(以干重计), 增加幅度分别达到30%、15%和150%.而非硫Fe(Ⅱ)和FeS的含量则分别从春季的101.57和1.46 μmol·g-1下降到夏季的63.64和0.86 μmol·g-1(以干重计), 下降幅度分别为37%和41%.其中, 沉积物固相Fe主要以非硫Fe(Ⅱ)、无定形Fe(Ⅲ)和晶质Fe(Ⅲ)的形态存在, 占固相Fe总量的90%以上(图 4).
FeS2随深度增加无明显变化.春季各处理组非硫Fe(Ⅱ)含量呈先升后降的趋势, 夏季除+S+Fe组外, 其余处理组非硫Fe(Ⅱ)含量均随深度增加先增加后趋于稳定.晶质Fe(Ⅲ)含量在垂直方向上变化较为稳定.春季2个加铁处理组(+Fe、+S+Fe)无定形Fe(Ⅲ)含量随深度增加呈先增加后减小的趋势, 2个不加铁处理组无定形Fe(Ⅲ)含量则在垂直方向上无明显变化规律.夏季各处理组无定形Fe(Ⅲ)含量均表现为先增加后趋于稳定.
3.3 间隙水指标相关分析ΔSO42-与间隙水地球化学指标相关分析(图 5)表明, DOC、溶解性CH4、间隙水Fe2+、DOC:DON与ΔSO42-呈显著正相关关系(p < 0.05).
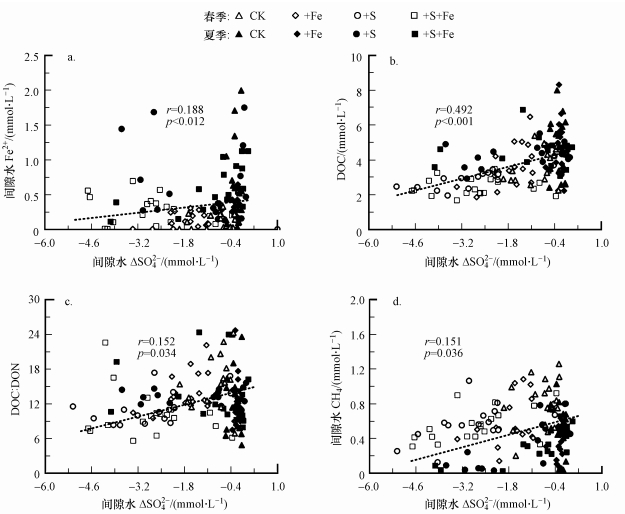 |
| 图 5 沉积物间隙水ΔSO42-与Fe2+、DOC、DOC:DON和溶解性CH4的相关分析 Fig. 5 Pearson correlation of porewater Fe2+, DOC, DOC:DON ratios, and dissolved CH4 against ΔSO42- concentrations |
Fe循环耦合河口潮汐湿地沉积物中的有机碳厌氧矿化、铁异化还原、硫酸盐异化还原和铁的氧化过程(Li et al., 2012).外源加盐和加铁均有可能诱发Fe循环发生改变.实验结果表明, 外源施加Fe(Ⅲ)不但能显著提高晶质Fe(Ⅲ)含量, 同时也显著提高了非硫Fe(Ⅱ)的含量(图 4).这可能是由于非硫Fe(Ⅱ)是铁异化还原的产物, 外源施加Fe(Ⅲ)提供大量的电子受体, 使得两组施加Fe(Ⅲ)处理组(即+Fe和+S+Fe)中铁异化还原的潜力增大.加盐处理(即+S)对晶质Fe(Ⅲ)含量和非硫Fe(Ⅱ)含量均无显著影响, 但却增加了FeS2含量(表 2).FeS2是主要的硫化铁矿物(Burton et al. 2011), 加盐处理中FeS2的累积证明施加盐水会促进硫酸盐异化还原潜力, 并产生大量的硫化物.从热力学角度来看, 铁异化还原比硫酸盐异化还原可获得更多的能量(Lovley et al., 1987).然而, 当SO42-的浓度逐渐增加, 可溶的SO42-将比固相Fe(Ⅲ)更易被微生物利用(Bonneville et al., 2009).因此, 在河口潮汐湿地沉积物中硫酸盐异化还原反而比铁异化还原更具优势(Hyun et al., 2007; Luo et al., 2016).虽然两种加盐处理沉积物中均发现高含量的FeS2, 但间隙水HS-含量却低于检测限, 这可能是由于这些间隙水HS-被沉积物中高含量的Fe(Ⅲ)捕获(Julian et al., 2016).这与Schoepfer等(2014)在美国北卡罗来纳州河口潮汐湿地中发现盐水入侵后促进Fe的硫化物大量生成的结论一致.Hopfensperger等(2014)认为盐水入侵后, 富含Fe(Ⅲ)的沉积物能捕获HS-, 这对于整个滨海生态系统具有重要意义.游离态的HS-对生物体有毒害作用, 但生成的Fe的硫化物无毒且不被生命体利用, 因此, 暂时缓冲了盐水入侵后HS-累积对滨海湿地生态系统产生的危害(Luo et al., 2017a).
两组加铁处理(+Fe和+S+Fe)中, 加盐的一组Fe2+浓度显著高于不加盐的一组(表 2), 这是因为Fe(Ⅲ)矿物表面吸附了大量间隙水中的Fe2+(Weston et al., 2006a).加盐处理后, 间隙水Fe2+浓度增加可能是因为盐水入侵增加了离子强度(Marks et al., 2016; Weston et al., 2006b), 盐水中的阳离子(如Na+、K+、Ca2+、Mg2+等)迅速取代被吸附的Fe2+, 然后被取代的Fe2+释放至间隙水中(Chambers et al., 2013).而+S组相对于CK组其Fe2+浓度并未显著增加(表 2), 可能是由于这两组处理本身Fe(Ⅲ)矿物含量不如加铁处理高, 其对间隙水Fe2+的吸附能力弱于两个加铁处理组, 因此, 在相同盐水入侵强度下, Fe2+的增加强度较弱.
与多数河口潮汐湿地沉积物类似(Kostka et al., 2002), 闽江河口潮汐湿地各种形态Fe具有剧烈的季节动态特征.在本研究中, 除晶质Fe(Ⅲ)外, 季节变化对其他形态Fe的影响大于施加处理(表 1).从春季到夏季, 无定形Fe(Ⅲ)和FeS2分别增加27.2和16.0 μmol·g-1(以干重计), 而间隙水Fe2+增加0.35 mmol·L-1.然而, 非硫Fe(Ⅱ)和FeS分别减少37.9和0.6 μmol·g-1(以干重计).非硫Fe(Ⅱ)的减少和晶质Fe(Ⅲ)的增加可能是由于沉积物-空气界面处O2的增加和扩散, 或者夏季湿地植物根系泌氧增强而导致非硫Fe(Ⅱ)再氧化的结果.本研究中各处理组沉积物中FeS的含量均远远低于FeS2(图 4), 前者容易被水解, 并生成间隙水Fe2+(Keene et al., 2011).间隙水Fe2+和ΔSO42-之间存在显著相关关系(图 5a), 也证明沉积物中存在FeS的氧化.
4.2 盐水入侵及Fe(Ⅲ)增强对河口湿地沉积物硫的影响盐水入侵给河口潮汐湿地带来大量的SO42-, 从而可能改变S循环(Chambers et al., 2014).虽然研究中没有直接测量硫酸盐异化还原速率和硫化物氧化速率, 但间隙水ΔSO42-浓度正负可以反映间隙水SO42-浓度的变化(Wilson et al., 2015).间隙水ΔSO42-与DOC显著相关(图 5b和5c), 表明硫酸盐异化还原受有机碳底物的含量和质量限制.随着DOC:DON比值的降低, 间隙水ΔSO42-显著降低(趋于负极值), 表明较高的硫酸盐异化速率对有机碳底物有选择利用.
加盐处理没有增加反而减小间隙水ΔSO42-比值, 证明加盐处理后, 促进了硫酸盐异化还原潜力, 提高了硫酸盐异化还原在有机碳厌氧矿化途径中的重要性.两组加铁处理(即+Fe和+S+Fe)下, 春季的间隙水ΔSO42-比值减小, 但夏季的比值却增加(表 1).在春季, 施加Fe(Ⅲ)可能会促进铁的化学还原, 并促进Fe的硫化物生成, 从而减小ΔSO42-.夏季, 施加Fe(Ⅲ)促进氧化环境, 生成的Fe的硫化物可能立刻被氧化并生成间隙水SO42-.Burton等(2006)发现的Fe(Ⅲ)是酸性矿区FeS主要氧化剂支持这一解释.
春季, 间隙水ΔSO42-比值为负值(图 3e), 这表示SO42-的消耗速度(主要为硫酸盐异化还原)大于硫化物的氧化速度.夏季, 间隙水ΔSO42-的数值仍为负值, 且接近零, 小部分为正值, 表示夏季硫化物的氧化速率趋近于硫酸盐异化还原速率.在美国亚拉巴马州莫比尔湾河口湿地中也发现类似的ΔSO42-在春、夏季变化结果(Wilson et al., 2015).夏季, 随着植物群落根系旺盛生长, 根系分泌的氧气可促进硫化物氧化(Hyun et al., 2007).但在其他滨海湿地沉积物中, 同时也发现随着夏季来临, 温度和有机底物浓度升高, 硫酸盐还原菌富集且硫酸盐异化还原速率增加(Beck et al. 2008b; Al-Raei et al. 2009).因此, 有可能在夏季同时存在高速的硫酸盐异化还原和硫的氧化, 而河口潮汐湿地沉积物表面被潮水间歇性淹没为沉积物氧化还原条件的变迁和高速的硫循环提供了条件.
4.3 盐水入侵及Fe(Ⅲ)增强对河口湿地沉积物碳的影响外源施加盐水会导致DOC浓度降低.DOC既是有机碳水解的产物, 又是微生物呼吸过程的底物(Beck et al., 2008a), 同时, 植物也会向湿地输入大量的DOC(Weston et al., 2006a).因此, DOC浓度随盐度升高而下降(表 2), 可能是因为渗透胁迫导致植物生理机能下降(Zhou et al., 2016), 从而降低间隙水DOC的来源, 又或因SO42-增加使得有机碳矿化潜力增加而加速DOC的消耗(Weston et al., 2011).
加盐和加铁处理均降低了溶解性CH4的浓度(表 2), 且溶解性CH4的浓度与ΔSO42-之间存在正相关关系(图 5d).这可以从以下几个方面进行解释:首先由于施加盐水后, 产甲烷菌受到Cl-胁迫, 降低了产甲烷菌的活性(Mishra et al., 2003);其次, 硫酸盐还原菌比产甲烷菌更具有竞争潜力, 从而抑制了产甲烷反应(Luo et al., 2017);最后, 甲烷能够被硫酸盐厌氧氧化(Boetius et al., 2000).与施加盐水相比, 施加Fe(Ⅲ)对间隙水CH4的影响较小.可能是因为河口潮汐湿地含有丰富的Fe(Ⅲ), 而且盐度和SO42-浓度低.因此, Fe含量变化对间隙水CH4浓度的影响在高Fe(Ⅲ)含量沉积物中有限.在对水稻田湿地的研究中也得出类似结果(Furukawa et al., 2004).盐水入侵+Fe(Ⅲ)增强(+S+Fe)并不会进一步影响间隙水中CH4的浓度, 这表明Fe(Ⅲ)和SO42-之间可能存在相互抑制作用(如发生铁的化学还原而生成铁的硫化物), 从而减少对碳循环的影响.
从春季到夏季, DOC浓度增加(图 3a), 可能是由于湿地植物处于快速生长期, 有机碳底物更加丰富, 夏季温度升高也增加了微生物的活动, 导致呼吸速度(Krauss et al., 2012)和分解速度(Kirwan et al., 2011)加快, 大量有机底物水解产生DOC, 植物的根系分泌物可以提供更多的DOC, 从而加强碳循环(Weston et al., 2006b).而与春季相比, 溶解性CH4浓度降低, 这可能是由于夏季硫酸盐还原和铁异化还原速率增强, 共同抑制夏季溶解性CH4浓度.
5 结论(Conclusions)1) 外源Fe(Ⅲ)输入可诱发河口潮汐湿地土壤Fe发生改变, 加铁处理能显著提高土壤非硫Fe(Ⅱ)和晶质Fe(Ⅲ)的含量;盐水入侵能促进湿地硫酸盐异化还原作用, 加盐处理可导致FeS2含量显著提高.相同Fe(Ⅲ)输入条件下, 盐水入侵后间隙水Fe2+浓度显著提高.除晶质Fe(Ⅲ)外, 春、夏季对固相Fe的影响大于施加处理.
2) 盐水入侵可减小间隙水ΔSO42-, 促进硫酸盐异化还原作用, 提高硫酸盐异化还原在有机厌氧碳矿化中的重要性.春季外源Fe(Ⅲ)输入可促进铁异化还原, 从而降低间隙水ΔSO42-, 但夏季反而会增加间隙水ΔSO42-.
3) 未来气候变化产生的盐水入侵和Fe(Ⅲ)输入, 可能分别加快河口潮汐湿地土壤硫酸盐异化还原速率和铁异化还原速率, 减少间隙水CH4浓度, 影响湿地土壤有机碳矿化速率及途径.
Al-Raei A M, Bosselmann K, Böttcher M E, et al. 2009. Seasonal dynamics of microbial sulfate reduction in temperate intertidal surface sediments:controls by temperature and organic matter[J]. Ocean Dynamics, 59(2): 351–370.
DOI:10.1007/s10236-009-0186-5
|
AP HA. 2005. Standard Methods for the Examination of Water and Wastewater[M]. Washington, DC: American Public Health Association.
|
Baldwin A H, Mendelssohn I A. 1998. Response of two oligohaline marsh communities to lethal and nonlethal disturbance[J]. Oecologia, 116(4): 543–555.
DOI:10.1007/s004420050620
|
Beck M, Dellwig O, Holstein J M, et al. 2008a. Sulphate, dissolved organic carbon, nutrients and terminal metabolic products in deep pore waters of an intertidal flat[J]. Biogeochemistry, 89(2): 221–238.
DOI:10.1007/s10533-008-9215-6
|
Beck M, Dellwig O, Liebezeit G, et al. 2008b. Spatial and seasonal variations of sulphate, dissolved organic carbon, and nutrients in deep pore waters of intertidal flat sediments[J]. Estuarine Coastal & Shelf Science, 79(2): 307–316.
|
Boetius A, Ravenschlag K, Schubert C J, et al. 2000. A marine microbial consortium apparently mediating anaerobic oxidation of methane[J]. Nature, 407: 623.
DOI:10.1038/35036572
|
Bonneville S, Behrends T, Cappellen P V. 2009. Solubility and dissimilatory reduction kinetics of iron(Ⅲ) oxyhydroxides:A linear free energy relationship[J]. Geochimica et cosmochimica acta, 73(18): 5273–5282.
DOI:10.1016/j.gca.2009.06.006
|
Bullock A L, Sutton-Grier A E, Megonigal J P. 2013. Anaerobic metabolism in tidal freshwater wetlands:Ⅲ.Temperature regulation of iron cycling[J]. Estuaries and Coasts, 36: 482–490.
DOI:10.1007/s12237-012-9536-5
|
Burton E D, Bush R T, Johnston S G, et al. 2011. Sulfur biogeochemical cycling and novel Fe-S mineralization pathways in a tidally re-flooded wetland[J]. Geochimica Et Cosmochimica Acta, 75(12): 3434–3451.
DOI:10.1016/j.gca.2011.03.020
|
Burton E D, Bush R T, Sullivan L A. 2006. Reduced inorganic sulfur speciation in drain sediments from acid sulfate soil landscapes[J]. Environmental Science & Technology, 40(3): 888–893.
|
Burton E D, Sullivan L A, Bush R T, et al. 2008. A simple and inexpensive chromium-reducible sulfur method for acid-sulfate soils[J]. Applied Geochemistry, 23(9): 2759–2766.
DOI:10.1016/j.apgeochem.2008.07.007
|
Chambers L G, Davis S E, Troxler T, et al. 2014. Biogeochemical effects of simulated sea level rise on carbon loss in an Everglades mangrove peat soil[J]. Hydrobiologia, 726(1): 195–211.
DOI:10.1007/s10750-013-1764-6
|
Chambers L G, Osborne T Z, Reddy K R. 2013. Effect of salinity-altering pulsing events on soil organic carbon loss along an intertidal wetland gradient:a laboratory experiment[J]. Biogeochemistry, 115(1): 363–383.
|
Cline J D. 1969. Spectrophotometric determination of hydrogen sulfide in natural waters[J]. Limnology & Oceanography, 14(3): 454–458.
|
Dijk G V, Smolders A J P, Loeb R, et al. 2015. Salinization of coastal freshwater wetlands; effects of constant versus fluctuating salinity on sediment biogeochemistry[J]. Biogeochemistry, 126(1): 71–84.
|
Furukawa Y, Inubushi K. 2004. Effect of application of iron materials on methane and nitrous oxide emissions from two types of paddy soils[J]. Soil Science & Plant Nutrition, 50(6): 917–924.
|
Gribsholt B, Kostka J E, Kristensen E. 2003. Impact of fiddler crabs and plant roots on sediment biogeochemistry in a Georgia saltmarsh[J]. Marine Ecology Progress Series, 259(1): 237–251.
|
Hopfensperger K N, Burgin A J, Schoepfer V A, et al. 2014. Impacts of saltwater incursion on plant communities, anaerobic microbial metabolism, and resulting relationships in a restored freshwater wetland[J]. Ecosystems, 17(5): 792–807.
DOI:10.1007/s10021-014-9760-x
|
Hyun J H, Smith A C, Kostka J E. 2007. Relative contributions of sulfate-and iron(Ⅲ) reduction to organic matter mineralization and process controls in contrasting habitats of the Georgia saltmarsh[J]. Applied Geochemistry, 22(12): 2637–2651.
DOI:10.1016/j.apgeochem.2007.06.005
|
IP CC. 2013. Climate Change 2013:The Physical Science Basis.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. United Kingdom and New York, NY, USA: Cambridge University Press.
|
Julian P, Chambers R, Russell T. 2016. Iron and pyritization in wetland soils of the florida coastal everglades[J]. Estuaries & Coasts, 40(3): 1–10.
|
Keene A F, Johnston S G, Bush R T, et al. 2011. Effects of hyper-enriched reactive Fe on sulfidisation in a tidally inundated acid sulfate soil wetland[J]. Biogeochemistry, 103(1/3): 263–279.
|
Kirwan M L, Blum L K. 2011. Enhanced decomposition offsets enhanced productivity and soil carbon accumulation in coastal wetlands responding to climate change[J]. Biogeosciences, 8(4): 987–993.
DOI:10.5194/bg-8-987-2011
|
Kostka J E, Luther G W I. 1994. Partitioning and speciation of solid phase iron in saltmarsh sediments[J]. Geochimica Et Cosmochimica Acta, 58(7): 1701–1710.
DOI:10.1016/0016-7037(94)90531-2
|
Kostka J E, Luther G W I. 1995. Seasonal cycling of Fe in saltmarsh sediments[J]. Biogeochemistry, 29(2): 159–181.
|
Kostka J E, Roychoudhury A, Cappellen P V. 2002. Rates and controls of anaerobic microbial respiration across spatial and temporal gradients in saltmarsh sediments[J]. Biogeochemistry, 60(1): 49–76.
DOI:10.1023/A:1016525216426
|
Krauss K W, Whitbeck J L. 2012. Soil greenhouse gas fluxes during wetland forest retreat along the lower Savannah River, Georgia (USA)[J]. Wetlands, 32(1): 73–81.
DOI:10.1007/s13157-011-0246-8
|
Li X, Liu T, Li F, et al. 2012. Reduction of structural Fe(Ⅲ) in oxyhydroxides by Shewanella decolorationis S12 and characterization of the surface properties of iron minerals[J]. Journal of Soils and Sediments, 12(2): 217–227.
DOI:10.1007/s11368-011-0433-5
|
Lovley D R, Phillips E J. 1987. Competitive mechanisms for inhibition of sulfate reduction and methane production in the zone of ferric iron reduction in sediments[J]. Applied & Environmental Microbiology, 53(11): 2636–2641.
|
Luo M, Huang J F, Zhu W F, et al. 2017. Impacts of increasing salinity and inundation on rates and pathways of organic carbon mineralization in tidal wetlands:a review[J]. Hydrobiologia, 111: 1–19.
|
Luo M, Zeng C S, Tong C, et al. 2016. Iron reduction along an inundation gradient in a tidal sedge (Cyperus malaccensis) marsh:the rates, pathways, and contributions to anaerobic organic matter mineralization[J]. Estuaries and Coasts, 39(6): 1679–1693.
DOI:10.1007/s12237-016-0094-0
|
Marks B M, Chambers L, White J R. 2016. Effect of fluctuating salinity on potential denitrification in coastal wetland soil and sediments[J]. Soil Science Society of America Journal, 80(2): 516–526.
DOI:10.2136/sssaj2015.07.0265
|
Marton J M, Herbert E R, Craft C B. 2012. Effects of salinity on denitrification and greenhouse gas production from laboratory-incubated tidal forest soils[J]. Wetlands, 32(2): 347–357.
DOI:10.1007/s13157-012-0270-3
|
Megonigal P, Neubauer S C. 2009. Coastal Wetlands:An Integrated Ecological Approach[M]. Amsterdam: Elsevier.
|
Minamikawa K, Nishimura S, Sawamoto T, et al. 2010. Annual emissions of dissolved CO2, CH4, and N2O in the subsurface drainage from three cropping systems[J]. Global Change Biology, 16(2): 796–809.
DOI:10.1111/gcb.2010.16.issue-2
|
Mishra S R, Pattnaik P, Sethunathan N, et al. 2003. Anion-mediated salinity affecting methane production in a flooded alluvial soil[J]. Geomicrobiology Journal, 20(6): 579–586.
DOI:10.1080/713851167
|
Morrissey E M, Gillespie J L, Morina J C, et al. 2014. Salinity affects microbial activity and soil organic matter content in tidal wetlands[J]. Global Change Biology, 20: 1351–1362.
DOI:10.1111/gcb.2014.20.issue-4
|
Piao S, Ciais P, Huang Y, et al. 2010. The impacts of climate change on water resources and agriculture in China[J]. Nature, 467(7311): 43–51.
DOI:10.1038/nature09364
|
Zhao P, Yang S, Yu R C. 2010. Long-term changes in rainfall over eastern China and large-scale atmospheric circulation associated with recent global warming[J]. Journal of Climate, 23(6): 1544–1562.
DOI:10.1175/2009JCLI2660.1
|
Schoepfer V A, Bernhardt E S, Burgin A J. 2014. Iron clad wetlands:Soil iron-sulfur buffering determines coastal wetland response to salt water incursion[J]. Journal of Geophysical Research Biogeosciences, 119(12): 2209–2219.
DOI:10.1002/2014JG002739
|
Sharpe P J, Baldwin A H. 2012. Tidal marsh plant community response to sea-level rise:A mesocosm study[J]. Aquatic Botany, 101(4): 34–40.
|
Sutton-grier A E, Keller J K, Koch R, et al. 2011. Electron donors and acceptors influence anaerobic soil organic matter mineralization in tidal marshes[J]. Soil Biology & Biochemistry, 43(7): 1576–1583.
|
Tong C A, Wang W Q, Huang J F, et al. 2012. Invasive alien plants increase CH4 emissions from a subtropical tidal estuarine wetland[J]. Biogeochemistry, 111(1/3): 677–693.
|
Weston N B, Dixon R E, Joye S B. 2006a. Ramifications of increased salinity in tidal freshwater sediments:Geochemistry and microbial pathways of organic matter mineralization[J]. Journal of Geophysical Research Atmospheres, 111(G1): G01009.
|
Weston N B, Porubsky W P, Samarkin V A, et al. 2006b. Porewater stoichiometry of terminal metabolic products, sulfate, and dissolved organic carbon and nitrogen in estuarine intertidal creek-bank sediments[J]. Biogeochemistry, 77(3): 375–408.
DOI:10.1007/s10533-005-1640-1
|
Weston N B, Vile M A, Neubauer S C, et al. 2011. Accelerated microbial organic matter mineralization following salt-water intrusion into tidal freshwater marsh soils[J]. Biogeochemistry, 102(1/3): 135–151.
|
Wilson B J, Mortazavi B, Kiene R P. 2015. Spatial and temporal variability in carbon dioxide and methane exchange at three coastal marshes along a salinity gradient in a northern Gulf of Mexico estuary[J]. Biogeochemistry, 123(3): 329–347.
DOI:10.1007/s10533-015-0085-4
|
Zhou M, Butterbachbahl K, Vereecken H, et al. 2016. A meta-analysis of soil salinization effects on nitrogen pools, cycles and fluxes in coastal ecosystems[J]. Global Change Biology, 23(3): 1338–1352.
|
周国华, 孙彬彬, 曾道明, 等. 2012. 中国东部主要入海河流河口区地球化学特征:理化指标与水溶态元素浓度[J]. 中国地质, 2012, 39(2): 283–294.
DOI:10.3969/j.issn.1000-3657.2012.02.002 |
 2018, Vol. 38
2018, Vol. 38


