2. 浙江师范大学体育与健康科学学院, 金华 321004;
3. 浙江师范大学行知学院, 金华 321004
2. College of Sports and Health Science, Zhejiang Normal University, Jinhua 321004;
3. College of Xing Zhi, Zhejiang Normal University, Jinhua 321004
氟(F)是机体必需的微量元素之一, 长期过量摄入氟会造成全身性生理病理改变, 称为地氟病, 不仅会损伤骨相器官(陈偲等, 2016), 还能透过血脑屏障蓄积在脑组织中, 影响大脑神经细胞的形态和功能(魏露莎等, 2015).因此, 氟致脑损伤已引起人们的高度关注, 但有关其致病机制尚不明确.
有学者认为地氟病属于“钙矛盾”疾病(李广生等, 2003), 即机体整体缺钙而细胞内钙离子超载的疾病.Ca2+是细胞内一种重要的信号分子, 参与神经细胞突触传递、突触可塑性及神经毒性等病理生理过程, 其浓度变化与细胞凋亡信号传导通路密切相关(李芸, 2016), 而突触可塑性是学习记忆的神经学基础(段雷等, 2017).研究发现, 脑海马是学习记忆的重要部位, 其对损伤非常敏感, 具有一定的神经再生功能和可塑性(李建平等, 2017).氟中毒会导致细胞内Ca2+超载, 引起钙信号转导系统中一些与学习记忆功能相关的基因/蛋白表达异常, 从而引起钙离子信号通路的失调紊乱.目前, 针对氟中毒致机体非骨相器官——脑影响的研究受到广泛关注(官志忠, 2010;邓成敏等, 2016;郑祥仁等, 2016), 但有关氟致机体损伤的分子机制尚不明确.为探讨亚慢性氟中毒致小鼠海马损伤及分子机制, 本文拟以小鼠饮用不同浓度(自来水、5、30 mg·L-1)的NaF水溶液, 在氟暴露的基础上, 给予小鼠腹腔注射生理盐水、钙离子通道拮抗剂、钙离子通道激动剂处理;在行为水平上检测小鼠学习记忆能力, 在组织水平上检测脑组织氧化应激变化, 在细胞水平上检测海马CA1区细胞凋亡情况, 在分子水平上检测海马内与凋亡相关的分子CaMKⅡ、Bax、Bcl-2基因和蛋白表达水平的变化.从而分析氟致脑损伤的机制, 为氟中毒的研究提供基础资料.
2 材料与方法(Materials and methods) 2.1 实验动物健康初断乳ICR雄性小鼠140只, 由浙江省实验动物中心(SCYK(浙)2003-0001)提供, 实验前适应7 d.
2.2 实验试剂与器材器材:底面16等分的开场行为观测箱(长50 cm×宽50 cm×高50 cm), 中间4等分为中央区域, 其余12等分为周围区域;Morris水迷宫系统(VideoMot2-BWM302050, 德国);倒置显微镜(ix73+DP80, 日本);梯度PCR仪(analy-tikjena, 德国);酶标仪(MULTISKAN GO, 中国);组织切片机(Shandon Finesse ME+, 美国).
试剂:超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶活性(GSH-PX)试剂盒、丙二醛(MDA)试剂盒购自南京建成生物工程研究所;Anti-Bax Antibody(db819)、Anti-Bcl-2 Antibody(db2374)、Anti-CaMKⅡ Antibody(EP1829Y)辣根过氧化物酶标记的山羊抗兔抗体购自上海博蕴生物科技有限公司;L钙离子通道激动剂FPL64176(Sigma, 美国)、拮抗剂Nifedipine(BOME)等.
2.3 实验方法 2.3.1 动物处理健康初断乳雄性ICR小鼠140只, 适应7 d后随机分为对照(C)、低氟(LF)、低氟+激动剂(LF+FPL64176)(LF+FPL)、低氟+抑制剂(LF+Nifedipine)(LF+NIF)、高氟(HF)、高氟+激动剂(HF+FPL64176) (HF+FPL)、高氟+抑制剂(HF+Nifedipine)(HF+NIF)7组.C组饮用自来水, LF、LF+FPL、LF+NIF组饮用氟含量为5 mg·L-1的NaF水溶液, HF、HF+FPL、HF+NIF组饮用氟含量为30 mg·L-1的NaF水溶液, 分别饮用90 d;染毒第84 d, C、LF、HF组小鼠腹腔注射生理盐水, LF+FPL、HF+FPL组小鼠注射L钙离子通道激动剂(FPL64176, 0.5 mg·L-1), LF+NIF、HF+NIF组小鼠注射L型钙离子通道拮抗剂(Nifedipine, 0.5 mg·L-1), 分别注射7 d, 每天定时注射5 mg·kg-1.饲养室采用空调和自动排风装置保持通风, 室温为15~25 ℃, 湿度为40%~70%, 以刨花为垫料, 小鼠自由采食和饮水.
2.3.2 相关指标的检测亚慢性氟暴露90 d, 小鼠进行开场行为检测(Crawley, 1985), 指标包括1 min和5 min内跑动穿越格数站立(悬空和扶壁站立)次数、理毛频率.通过水迷宫实验观测各组小鼠的空间学习记忆力(龚梦鹃等, 2005).接尿24 h后, 颈椎脱臼致死, 去眼球取血, 采用氟电极法检测小鼠尿/血氟含量(柳月珍等, 2010).采用半定量法检测小鼠尿/血钙含量.根据Dean氏法诊断各组小鼠氟斑牙症状(王连方, 2007).冰上快速取脑, 部分固定并经(HE)染色后进行脑海马组织形态学观察(王东旭等, 2011);另一部分取脑海马, 液氮快速冷冻并于超低温冰箱保存备用.根据试剂盒说明完成脑海马组织GSH-Px、SOD酶活性、MDA含量检测.采用RT-PCR和Western Blot分别检测小鼠海马上L-型钙离子通道下游Bcl-2、Bax、CaMK Ⅱ基因和蛋白表达水平, 分析Bcl-2/Bax的比值.RT-PCR主要步骤包括RNA提取、反转录、cDNA扩增琼脂糖凝胶电泳、凝胶电泳仪扫描及目的基因分析.Western Blot主要实验步骤包括总蛋白提取、蛋白上样、电泳、转膜、封闭、一抗孵育、洗膜、二抗孵育、洗膜、显影、定影、扫描仪扫描, 蛋白条带用Quantity One软件分析, 扫描目的蛋白灰度值与内参蛋白灰度值, 内参调整值为目的蛋白灰度值与β-actin灰度值之比, 计算每一组内参调整值与对照组内参调整值的比值, 用以表征该孔样品蛋白表达量.
2.4 统计分析采用Quantity One软件进行半定量分析.数据用SPSS19.0进行分析, 结果以平均值±标准差(±SD)表示, 并进行单因素方差分析(One-way ANOVA)和两两比较LSD检验.以p < 0.05表示具有统计显著性, p < 0.01表示具有统计极显著性.
3 结果与分析(Results and analysis) 3.1 氟暴露期间小鼠状况及体重实验过程发现, 各组小鼠饮食和饮水均正常, C组和HF+NIF组小鼠毛发光滑鲜亮, HF组、LF+FPL组和HF+FPL组小鼠毛发粗糙, 暴躁不安.各组小鼠体重统计结果见表 1, 与对照组比, 各组小鼠体重在30、60、90 d均无显著差异(p>0.05).
| 表 1 各组小鼠体重统计结果(n=20) Table 1 Statistical of body weight of mice in each group |
亚慢性氟暴露对小鼠牙齿的影响见图 1.由图 1可知, 对照组小鼠上切齿呈均匀的淡黄色且表面光滑, 未出现氟斑牙症状;LF组小鼠切齿表面有黄白相间的条纹, 呈现较轻的氟斑牙症状;HF组小鼠切齿表面白垩色条纹清晰, 氟斑牙症状明显;与染氟组比, 注射激动剂组小鼠上切齿氟斑牙症状加重, 注射拮抗剂组, 小鼠上切齿氟斑牙症状有所缓解.
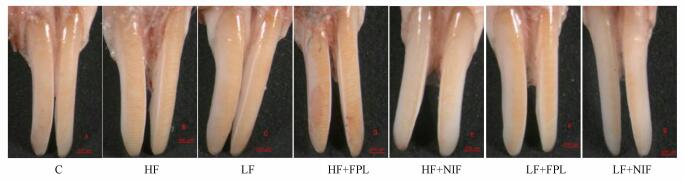 |
| 图 1 各组小鼠上切齿氟斑牙观察结果 Fig. 1 The observation results of dental fluorosis teeth of mice |
亚慢性氟暴露对小鼠尿/血氟、尿/血钙含量的影响见表 2.由表 2可知, 与对照组比, 各染氟组尿氟含量均极显著升高(p < 0.01);HF组、LF组、LF+NIF组尿钙含量均显著下降(p < 0.05).与HF组比, HF+NIF组尿钙含量显著升高(p < 0.05);与LF组比, LF+FPL组尿钙含量显著升高(p < 0.05), LF+NIF组尿氟含量显著升高(p < 0.05), 尿钙含量极显著升高(p < 0.01).以上小鼠氟斑牙和尿氟检测结果表明, 本实验ICR小鼠亚慢性氟中毒模型复制成功.
| 表 2 亚慢性氟暴露对小鼠尿/血氟、尿/血钙含量的影响(n=10) Table 2 Effect of subchronic fluorine exposure on urine / blood fluorine, urine / blood calcium content in mice |
开场行为的跑动格数可反映动物的兴奋性, 扶壁/悬空站立频率可反映其在新异环境中的探究行为, 理毛次数可反映其对新异环境的满意程度(章子贵等, 2015).水迷宫实验主要通过检测小鼠在水环境中寻找水中平台的各项指标, 分析和推断动物的学习、记忆、空间定向和认知功能等方面的能力.
开场行为及水迷宫检测结果见表 3.由表 3可知, 与对照组比, HF组小鼠1 min、5 min跑动格数和扶壁站立次数显著下降(p < 0.05);与HF组比, HF+FPL组小鼠5 min跑动格数、理毛次数显著下降(p < 0.05), HF+NIF组小鼠扶壁站立次数显著升高(p < 0.05);与LF组比, LF+FPL组小鼠理毛次数显著下降(p < 0.05), LF+NIF组小鼠1 min、5 min跑动格数显著上升(p < 0.05).
| 表 3 亚慢性氟暴露对小鼠学习记忆相关指标的影响(n=10) Table 3 The effect of subchronic fluorine exposure on learning and memory related indexes |
从图 2中小鼠水迷宫逃避潜伏期检测结果中可以看出, 与对照组比, HF组、HF+FPL组、LF+FPL组小鼠逃避潜伏期极显著升高(p < 0.01);与HF组比, HF+NIF组小鼠潜伏期显著下降(p < 0.05).
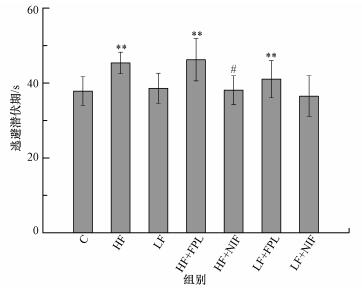 |
| 图 2 小鼠Morris水迷宫逃避潜伏期检测结果(*p < 0.05, **p < 0.01, 与C组相比;#p < 0.05, 与HF组相比;n=10) Fig. 2 The escape latency detection results of Morris water maze in mice |
亚慢性氟暴露小鼠脑海马组织HE切片光镜结构见图 3.从图中可以看出, 对照组海马神经细胞#排列密集整齐, 形态规则, 细胞界限清晰, 胞质丰富;HF组细胞排列稀疏, 细胞界限不清晰, 细胞层次及数量减少明显;LF组细胞结构较HF组明显, 但细胞排列厚度小于对照组, 即细胞数量发生程度不等的减少;HF+FPL组细胞之间结构较模糊, 细胞数量明显减少;HF+NIF组细胞间隙较宽, 细胞数目与对照组无明显差异;LF+FPL组细胞染色较浅, 细胞数目减少;LF+NIF组细胞与LF组相比, 细胞数目增加, 与对照组相比, 细胞之间间隙较宽, 其余与对照组差异不明显.
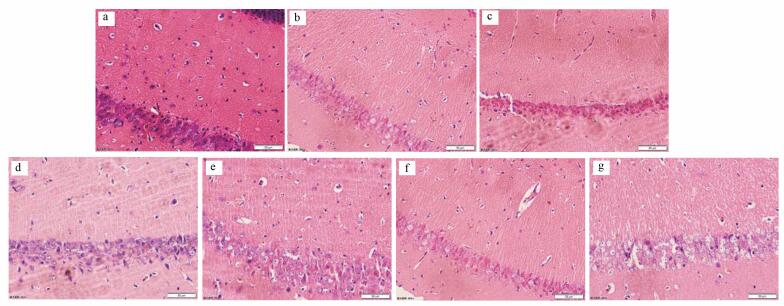 |
| 图 3 脑海马CA1区细胞形态结构(a.C组, b.HF组, c.LF组, d.HF+FPL组, e. HF+NIF组, f. LF+FPL组, g.LF+NIF组) Fig. 3 The cell morphology and structure in the CA1 region of the hippocampus |
亚慢性氟暴露对小鼠脑海马部分抗氧化酶活力和脂质过氧化产物的影响见图 4.由图 4可知, 与对照组比, HF组、HF+FPL组、LF+FPL组GSH-PX和SOD活性呈一致性的显著(p < 0.05)或极显著(p < 0.01)下降, MDA含量在各组之间并没有显著差异.
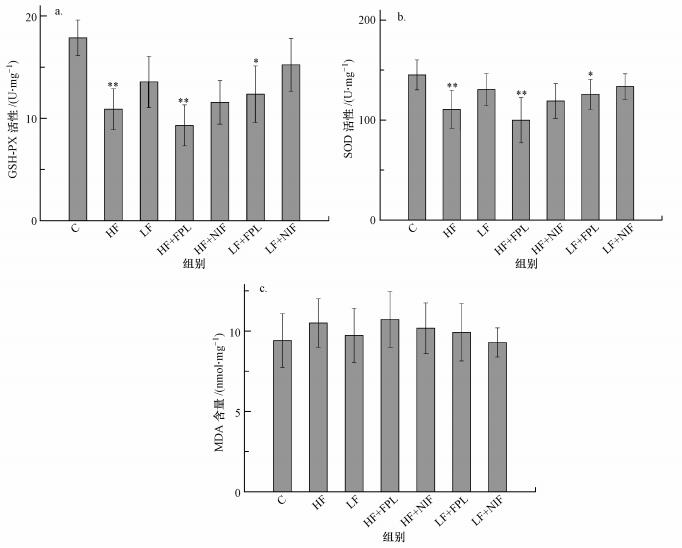 |
| 图 4 小鼠脑组织抗氧化酶活力和脂质过氧化产物检测结果(a.GSH-PX活性, b.SOD活性, c.MDA含量;*p < 0.05, **p < 0.01, 与C组相比;n=10) Fig. 4 The detection results of antioxidant enzyme activity and lipid peroxidation products in brain tissue of mice |
由图 5中小鼠脑海马CaMKⅡ、Bax、Bcl-2基因表达水平检测结果可见, 与C组比, HF+FPL/NIF组、LF+FPL/NIF组CaMKⅡ基因表达水平显著(p < 0.05)或极显著(p < 0.01)下降, HF组、LF组、HF+FPL/NIF组、LF+FPL组Bax基因表达水平显著(p < 0.05)或极显著(p < 0.01)升高, HF组、LF组、HF+FPL/NIF组、LF+FPL/NIF组Bcl-2基因表达水平显著(p < 0.05)或极显著(p < 0.01)下降, HF组、HF+FPL组、LF+FPL组Bax/Bcl-2比值极显著(p < 0.01)升高, HF+NIF组Bax/Bcl-2比值极显著(p < 0.01)下降.与HF组比, HF+FPL/NIF组CaMKⅡ基因表达水平显著(p < 0.05)或极显著(p < 0.01)下降;与LF组比, LF+FPL/NIF组CaMKⅡ基因表达水平显著(p < 0.05)或极显著(p < 0.01)下降, LF+NIF组Bcl-2基因表达水平显著(p < 0.05)升高, LF+FPL组Bax/Bcl-2比值极显著(p < 0.01)升高.
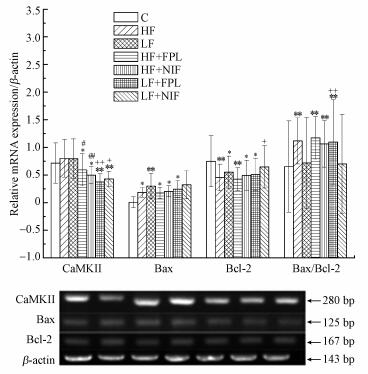 |
| 图 5 小鼠脑海马CaMKⅡ、Bax、Bcl-2基因表达水平检测结果(*p < 0.05, **p < 0.01, 与C组相比;#p < 0.05, ##p < 0.01, 与HF组相比;+p < 0.05, ++p < 0.01, 与LF组相比;n=10) Fig. 5 The detection results of CaMKⅡ, Bax, Bcl-2 gene expression in the hippocampus of mice |
各组小鼠脑海马CaMKⅡ、Bax、Bcl-2蛋白表达水平检测结果见图 6.与C组比, HF组、LF组CaMKⅡ蛋白表达水平显著(p < 0.05)或极显著(p < 0.01)升高, HF+FPL/NIF组、LF+FPL/NIF组CaMKⅡ蛋白表达水平显著(p < 0.05)或极显著(p < 0.01)下降;HF组、LF组、HF+FPL组、LF+FPL/NIF组Bax蛋白表达水平极显著(p < 0.01)升高;HF组、LF组、HF+FPL/NIF组、LF+FPL/NIF组Bcl-2蛋白表达水平显著(p < 0.05)或极显著(p < 0.01)下降;HF组、LF组、HF+FPL/NIF组、LF+FPL组Bax/Bcl-2比值极显著(p < 0.01)升高.与HF组比, HF+NIF组CaMKⅡ蛋白表达水平极显著(p < 0.01)下降, Bcl-2蛋白表达水平显著(p < 0.05)升高, Bax/Bcl-2比值极显著(p < 0.01)下降;与LF组比, LF+NIF组CaMKⅡ蛋白表达水平极显著(p < 0.01)下降, LF+FPL组Bcl-2蛋白表达水平显著(p < 0.05)下降, LF+NIF组Bcl-2蛋白表达水平极显著(p < 0.01)升高, LF+NIF组Bax/Bcl-2比值极显著(p < 0.01)下降.
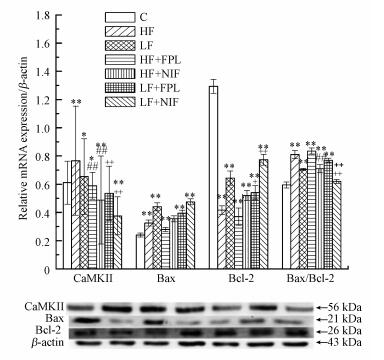 |
| 图 6 小鼠脑海马CaMKⅡ、Bax、Bcl-2蛋白表达水平检测结果(*p < 0.05, **p < 0.01, 与C组相比;#p < 0.05, ##p < 0.01, 与HF组相比;+p < 0.05, ++p < 0.01, 与LF组相比;n=10) Fig. 6 The detection results of CaMKⅡ, Bax, Bcl-2 protein expression in the hippocampus of mice |
氟中毒可导致氟斑牙、氟骨症等骨相器官及脑、肾等非骨相器官的损伤(段依敏等, 2017), 目前较为公认的损伤机制为自由基学说(官志忠等, 2011;王飞清等, 2017a;2017b;Zhang et al., 2015).本实验结果显示, 氟染毒组小鼠脑组织SOD、GSH-Px活性下降, 表明氟暴露削弱了小鼠脑组织的抗氧化防御能力, 对脑造成氧化性损伤, 再次证明了自由基学说.同时, 海马组织结构的改变也证明氟中毒导致脑组织损伤, 进而导致脑功能的改变, 而小鼠学习记忆行为变化观测结果也表明, 氟中毒能引起脑功能损伤(Liu et al., 2010;吴晓玲等, 2017;邱志伟等, 2016), 但氟致海马损伤的具体分子机制尚待阐明.
已有研究结果显示, 慢性氟中毒可导致细胞的坏死与细胞凋亡, 如Sun等(2017)研究表明, 慢性氟中毒可导致SD大鼠海马组织中Bcl-2、JNK、Caspase-12基因的表达改变, 并与机体中氟蓄积量存在相关关系, 并且可以逐渐降低抗凋亡因子Bcl-2的表达.Bcl-2家族成员在细胞凋亡中具有重要作用, 根据其不同的结构和功能特征可分为以下两类:抗凋亡和促凋亡蛋白.抗凋亡蛋白Bcl-2可能通过抑制DNA的转录抑制凋亡相关基因的激活机制(贾丽玲等, 2010).Bax高表达时, Bax与Bcl-2形成异二聚体, Bcl-2蛋白失活, 细胞凋亡.Bax/Bcl-2的表达率可用于测定细胞凋亡过程(王长松等, 2003).其他学者(Jia et al., 2014; Sun et al., 2017;王长松等, 2003)的研究表明, Bax与Bcl-2蛋白表达比值升高, 会引起细胞凋亡数量增加.
地氟病属于“钙矛盾”疾病, 即机体整体缺钙而细胞内Ca2+超载的疾病.研究显示, 慢性氟中毒能导致肝、肾、脑等组织细胞内的Ca2+升高, 过量氟对机体的损伤主要是通过使体液Ca2+降低和细胞Ca2+内流增多介导的(李广生等, 2003).CaMKⅡ是钙/钙调蛋白激酶(Ca2+/calmodulin-dependent protein kinase, CaMK)成员之一, 钙调蛋白(calmodulin, CaM)与Ca2+结合后被激活, 结合于CaMKⅡ调节域中的CaM结合区激活CaMKⅡ.激活的CaMKⅡ通过多种途径调节细胞内Ca2+平衡, 具有广泛的生物学活性, 且与神经损伤、凋亡及其他细胞的功能密切相关(Liu et al., 2007;张璟, 2010).已有研究表明, 氟中毒导致脑海马突触体内Ca2+超载(张璟, 2010);对PC12细胞的氟中毒的研究结果也显示, 钙调基因激酶CaMKⅡ、Bcl-2和Bax基因(Liao et al., 2017)和蛋白表达异常(Teng et al., 2017;Zhang et al., 2013), 进而引起钙信号通路的失调和紊乱, 诱导细胞凋亡.本研究结果显示, 氟暴露可上调小鼠海马CaMKⅡ、Bax基因和蛋白表达水平, 下调Bcl-2基因和蛋白表达水平, Bax/Bcl-2基因和蛋白表达水平比值升高, 其与文献中报道的结果一致(贾丽玲等, 2010;Zhang et al., 2013).而腹腔注射钙离子通道拮抗剂Nifedipine后, CaMKⅡ基因和蛋白表达水平极显著下调, Bax/Bcl-2基因和蛋白表达比值极显著下调.设想摄入不同浓度氟后, 导致小鼠海马组织细胞内Ca2+超载, 导致相关凋亡分子基因和蛋白表达异常;而腹腔注射Nifedipine的作用可能是通过抑制Ca2+内流, 降低细胞内钙离子浓度, 使Bcl-2基因和蛋白表达水平上调, 并通过抑制DNA的转录抑制凋亡相关基因Bax的激活, 致使Bax基因和蛋白表达水平下调, 达到抑制细胞凋亡的目的, 进而对亚慢性氟中毒致细胞内钙离子超载后的海马损伤起保护作用, 其抗氟机理还有待进一步研究.
5 结论(Conclusions)ICR小鼠亚慢性氟暴露后, 开场行为各指标和水迷宫逃避潜伏期检测结果均产生显著变化;抗氧化能力检测结果显示, 亚慢性氟暴露小鼠脑组织SOD酶活性及非酶抗氧化剂GSH-PX活性显著或极显著降低;海马组织HE染色结果显示, 神经细胞界限不清晰, 细胞层次及数量发生程度不等的减少.以上结果提示亚慢性氟暴露可导致探究行为及空间学习记忆力显著下降, 削弱小鼠脑组织抗氧化防御能力, 对海马造成氧化性损伤.进一步对氟暴露小鼠海马内CaMKⅡ、Bax、Bcl-2基因及蛋白表达水平进行检测, 结果显示, CaMKⅡ、Bax、Bcl-2基因和蛋白表达水平显著或极显著变化, 提示亚慢性氟暴露致海马损伤与细胞凋亡及CaMKⅡ、Bax、Bcl-2基因和蛋白异常表达相关.而腹腔注射L-型钙离子通道抑制剂(Nifedipine)后, 小鼠探究行为及空间学习记忆力显著改善, 同时减轻氟中毒致海马组织损伤, 下调CaMKⅡ基因和蛋白表达水平, 下调Bax与Bcl-2基因和蛋白表达比值.
总之, 亚慢性氟暴露可致小鼠海马损伤, 损伤程度与暴露浓度相关, 且氧化损伤及凋亡可能是亚慢性氟暴露致小鼠海马损伤的机制.同时, 腹腔注射L-型钙离子通道拮抗剂(Nifedipine)不仅在行为和组织结构上能显著改善氟致脑损伤程度, 而且在分子水平上能逆转氟致海马内L-型钙离子通道下游相关分子表达异常.
Berger S M, Bartsch D. 2014. The role of L-type voltage-gated calcium channels Ca v 1.2 and Ca v 1.3 in normal and pathological brain function[J]. Cell & Tissue Research, 357(2): 463–476.
|
陈偲, 张爱华, 潘雪莉. 2016. 氟化钠对大鼠成骨细胞p16基因甲基化、mRNA转录及蛋白表达的影响[J]. 中华地方病学杂志, 2016, 35(2): 89–93.
DOI:10.3760/cma.j.issn.2095-4255.2016.02.003 |
Crawley J N. 1985. Exploratory behavior models of anxiety in mice[J]. Neuroscience & Biobehavioral Reviews, 9(1): 37–44.
|
邓成敏, 谭龙春, 邓婕, 等. 2016. 慢性氟中毒对大鼠脑组织蛋白激酶Cβ/衔接蛋白通路的影响[J]. 中华地方病学杂志, 2016, 35(5): 333–337.
DOI:10.3760/cma.j.issn.2095-4255.2016.05.006 |
段雷, 胡文彬, 袁畅. 2017. 突触可塑性与学习记忆关系研究进展[J]. 包头医学院学报, 2017, 33(8): 128–130.
|
段依敏, 蒲丹, 王琛琛, 等. 2017. 慢性氟中毒大鼠肾脏过氧化损伤与细胞凋亡、自噬的相关性[J]. 海南医学院学报, 2017, 23(11): 1449–1451.
|
龚梦鹃, 王立为, 刘新民. 2005. 大小鼠游泳实验方法的研究概况[J]. 中国比较医学杂志, 2005, 15(5): 311–314.
DOI:10.3969/j.issn.1671-7856.2005.05.016 |
官志忠. 2010. 慢性氟中毒所致脑损伤研究进展[J]. 中华地方病学杂志, 2010, 29(2): 228–230.
|
官志忠, 高勤, 桂传枝, 等. 2011. 慢性氟中毒脑损伤机制探讨[J]. 中国地方病学杂志, 2011, 30(3): 352–354.
DOI:10.3760/cma.j.issn.1000-4955.2011.03.036 |
贾丽玲, 曹定睿, 张维智, 等. 2010. 瑞芬太尼预处理对大鼠脑缺血再灌注后神经细胞凋亡及Bcl-2 Bax表达的影响[J]. 中国药物与临床, 2010, 10(2): 171–173.
DOI:10.3969/j.issn.1671-2560.2010.02.019 |
Jia M M, Chao S N. 2014. Effects of CDNF on 6-OHDA-induced apoptosis in PC12 cells via modulation of Bcl-2/Bax and caspase-3 activation[J]. Neurological Sciences, 35(8): 1275–1280.
DOI:10.1007/s10072-014-1700-1
|
李广生, 张文岚, 华坤, 等. 2003. 地氟病属于"钙矛盾疾病"[J]. 矿物岩石地球化学通报, 2003, 22(2): 93–95.
DOI:10.3969/j.issn.1007-2802.2003.02.001 |
李建平, 卢巍, 杨琳, 等. 2017. 脑海马神经元接受化疗与未化疗的差异[J]. 中国组织工程研究, 2017, 21(28): 4523–4528.
DOI:10.3969/j.issn.2095-4344.2017.28.016 |
李芸.2016.内质网钙离子释放和CaMKⅡ/MAPK信号通路在臭氧脊髓神经元神经毒性的作用机制及XBP1预防靶点的研究[D].济南: 山东大学
http://cdmd.cnki.com.cn/Article/CDMD-10422-1016164655.htm |
Liao Q X, Zhang R, Wang X Y, et al. 2017. Effect of fluoride exposure on mRNA expression of cav1.2 and calcium signal pathway apoptosis regulators in PC12 cells[J]. Environmental Toxicology and Pharmacology, 54: 74–79.
DOI:10.1016/j.etap.2017.06.018
|
Liu Y, Templeton D M. 2007. Cadmium activates CaMK-Ⅱ and initiates CaM-Ⅱ-dependent apoptosis in mesangial cells[J]. Febs Letters, 581(7): 1481.
DOI:10.1016/j.febslet.2007.03.003
|
Liu Y J, Gao Q, Wu C X, et al. 2010. Alterations of nAChRs and ERK1/2 in the brains of rats with chronic fluorosis and their connections with the decreased capacity of learning and memory[J]. Toxicology Letters, 192(3): 324–329.
DOI:10.1016/j.toxlet.2009.11.002
|
柳月珍, 陈寿权, 李章平. 2016. 急性有机氟吸人中毒患者血尿氟浓度变化及临床应用价值[J]. 中华急诊医学杂志, 2016, 19(10): 1078–1081.
|
邱志伟, 刘艳洁, 冯江龙, 等. 2016. 细胞外信号调节蛋白激酶5在慢性氟中毒大鼠大脑中的免疫组织改变[J]. 中国地方病防治杂志, 2016, 31(7): 724–725.
|
Song J S, Lee H Y, Lee E, et al. 2002. Cytotoxicity and apoptosis induction of sodium fluoride in human promyelocytic leukemia (HL-60) cells[J]. Environmental Toxicology & Pharmacology, 11(2): 85–91.
|
Sun Y, Ke L L, Zhang Z G, et al. 2017. Effects of different levels of calcium intake on brain cell apoptosis in fluorosis rat offspring andits molecularmechanism[J]. Biological Trace Element Research, 176: 355–366.
DOI:10.1007/s12011-016-0850-9
|
Teng Y, Zhang J, Zhang Z G, et al. 2017. The effect of chronic fluorosis on calcium ions and CaMKⅡⅡ, and c-fos expression in the rat hippocampus[J]. Biological Trace Element Research, 6: 1–8.
|
王东旭, 林超, 万家余, 等. 2011. SPRN转基因小鼠感染Scraipe鼠适应性病毒后动物行为与脑组织形态比较[J]. 吉林农业大学学报, 2011, 33(4): 433–438.
|
王长松, 刘家骝, 于燕妮, 等. 2003. 氟化物对细胞凋亡的影响及其分子机制[J]. 国外医学医学地理分册, 2003, 24(4): 145–151.
|
王飞清, 李艳菊, 王宁, 等. 2017a. 天门冬对氟中毒大鼠机体氧化应激的影响[J]. 时珍国医国药, 2017a, 28(8): 1862–1863.
|
王飞清, 李艳菊, 王宁, 等. 2017b. 氧化应激-炎性因子对氟中毒卵巢早衰的影响[J]. 现代预防医学, 2017b, 44(12): 2296–2299.
|
王连方. 2007. 氟斑牙的几种"Dean氏分类法"浅析[J]. 地方病通报, 2007, 22(1): 71–73.
DOI:10.3969/j.issn.1000-3711.2007.01.025 |
魏露莎, 禹文峰, 詹赞琳, 等. 2015. 凋亡诱导因子在慢性氟中毒大鼠脑组织神经细胞凋亡中的作用[J]. 中华地方病学杂志, 2015, 34(9): 655–659.
|
吴晓玲, 张贵锋, 刘其礼, 等. 2017. 二苯乙烯苷对慢性氟中毒致脑损伤大鼠学习记忆能力、氧化应激的影响[J]. 中国医学创新, 2017, 14(2): 21–24.
DOI:10.3969/j.issn.1674-4985.2017.02.006 |
Zhang J, Zhang Z G. 2013. Effect of chronic fluorosis on camkⅡα, c-fos, bax, and bcl-2 channel signalling in the hippocampus of rats[J]. Fluoride, 46(3): 135–141.
|
张璟.2010.慢性氟中毒对大鼠脑海马钙离子信号通路的影响[D].金华: 浙江师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10345-2010241383.htm |
Zhang S M, Zheng X R, Zhang Z G, et al. 2015. Alterations in oxidative stress and apoptosis in culturedpc12 cells exposed to fluoride[J]. Research Report Fluoride, 48(3): 213–222.
|
章子贵, 孙岩, 郑祥仁. 2015. 慢性氟中毒致学习记忆损伤的脑内突触机制[J]. 浙江师范大学学报, 2015, 38(1): 1–8.
|
郑祥仁.2016.饮水型氟中毒致脑损伤的神经机制及硒的干预作用[D].金华: 浙江师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10345-1016289500.htm |
 2018, Vol. 38
2018, Vol. 38


