2. 嘉兴市联合污水处理有限责任公司, 嘉兴 314001;
3. 郑州大学水利与环境学院, 郑州 450001
2. Jiaxing United Sewage Treatment Co. Ltd., Jiaxing 314001;
3. College of Water Conservancy and Environmental Engineering, Zhengzhou University, Zhengzhou 450001
随着工农业的快速发展, 我国氮、磷等富营养化物质的排放量也急剧增加.据统计, 2003年我国富营养化物质平均排放达到了10.61 t·km-2(以NO3-计)(王寿兵等, 2003).长期以来, 为了控制水体富营养化, 国内科研人员一直致力于污水脱氮除磷工艺的开发, 如A/O、A/A/O、UASB等(肖文涛, 2010).但这些废水处理工艺无法很好地对废水中的氮、磷等营养元素进行再利用.磷作为一种不可再生且在工农业发展中不可或缺的资源, 目前储备量已急剧减少.迄今, 我国的磷资源已不能满足经济发展的需求(刘颐华, 2005).面对当前磷资源紧缺的现状, 污水处理技术的发展方向已经从脱氮除磷转向回收污水中氮、磷元素并将其资源化.
目前, 污水氮、磷资源化的技术主要有吸附法(Zhang et al., 2013)、离子交换法(Johir et al., 2011)、化学沉淀法(Yigit et al., 2007)等.其中, 吸附法效率较低, 大多用于处理低氮磷的废水, 对于一些高氮磷废水(如猪场原水中NH3-N约为900~1400 mg·L-1, TP约为10~40 mg·L-1)的处理效果较差;离子交换法效率较高, 但存在投资大、装置维护困难、费用高等不足, 因而推广也较为困难(梅翔等, 2013);化学沉淀法, 包括磷酸钙沉淀法(宋永会等, 2011)及鸟粪石结晶法(Tansel et al., 2018), 因具有费用低、效率高等优点, 在废水氮、磷资源化上极具潜力.鸟粪石结晶法, 即利用镁离子与铵根离子、磷酸根离子结合, 从而生成MgNH4PO4·6H2O沉淀(也即鸟粪石), 进而达到氮、磷共回收的目的.由于鸟粪石同时可作为优质缓释肥施用于土壤(Yetilmezsoy et al., 2009), 因此, 鸟粪石法成为废水氮、磷资源化的较优选择.
传统鸟粪石结晶法处理氮、磷废水的过程中, 不仅存在镁盐投加过量、需外加碱源、运行成本高、产生二次污染等问题(Stratful et al., 2001), 且生成的鸟粪石晶体极其分散, 回收困难.为解决上述问题, 很多研究者致力于开发新型载镁多孔复合材料.例如, 夏鹏等利用硅藻土作载体复合MgO, 发现该材料对磷的吸附量可提升至160.94 mg·g-1(Xia et al., 2016);王浩等(2017)研究发现, 镁盐改性的硅镁土对氮、磷有良好的吸附效果;成雪君等(2017)的研究表明, 载镁沸石对磷的吸附量可达119.2 mg·g-1.生物质炭作为一种多孔吸附剂, 不仅可以促进氮、磷的吸附沉淀(Taghizadeh-Toosi et al., 2012), 同时可作为晶种(Liu et al., 2011), 促进鸟粪石的沉淀结晶, 是一种优质载体材料.因此, 本研究拟以生物质炭作为载体, 通过直接沉淀-热改性法将纳米片状Mg(OH)2负载于生物质炭上, 以制备一种具有氮、磷同步回收固定、镁靶向供给及自碱性作用的新型载镁生物质炭复合吸附剂, 并探究基于该吸附剂的吸附-鸟粪石结晶沉淀耦合技术对模拟废水中氮、磷资源化回收的效果及机理.
2 材料与方法(Materials and methods) 2.1 实验药剂试验所用生物质炭(BC)由竹炭磨碎、过100目筛后制备而成, 该材料的比表面积为61.714 m2·g-1, 平均孔径为2.318 nm;试验所用模拟氮、磷废水由KH2PO4、NH4Cl与去离子水配置而成, 该模拟氮、磷废水中氨氮及总磷浓度分别为120 mg·L-1及60 mg·L-1.配置0.1 mol·L-1的HCl溶液及NaOH溶液用于调节溶液pH.试验采用的所有药剂皆为分析纯(AR), 试验用水为去离子水.
2.2 镁盐改性生物质炭的制备将10 g BC加入到100 mL 1.25 mol·L-1的MgCl2·6H2O溶液中, 搅拌均匀, 混合液置于超声波振荡器中超声30 min, 以使镁离子均匀结合在生物质炭的表面及孔洞内部.配置2.5 mg·L-1的NaOH溶液100 mL, 并缓缓加入混合液中, 混合物用磁力搅拌器搅拌12 h后于25 ℃下老化24 h.混合液用孔径为0.22 μm的滤纸过滤后, 沉淀物用去离子水清洗3次.清洗后的沉淀物置于电热恒温鼓风干燥箱在80 ℃下烘干48 h.之后用马弗炉在450 ℃下焙烧2 h, 即得到镁盐改性生物质炭Mg(OH)2-BC.
2.3 试验方法下列批量试验均在DHG-9140型电热恒温振荡培养箱中进行, 反应条件为:温度25 ℃, 转速150 r·min-1.反应后溶液经0.22 μm聚醚砜滤膜过滤后, 测定滤液中氮、磷浓度.氮、磷吸附量采用以下公式计算:
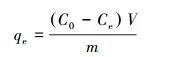
|
(1) |
式中, qe为平衡吸附量(mg·g-1), C0为初始氮、磷浓度(mg·L-1), Ce为吸附平衡时的氮、磷浓度(mg·L-1), V为参与反应的溶液体积(L), m为投加的吸附剂质量(g).
2.3.1 剂量优化将模拟废水的初始pH调节至8, 取9份50 mL模拟废水加入具塞锥形瓶中, 分别投加Mg(OH)2-BC 0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 g·L-1, 反应时长12 h, 取滤后上清液测定其氮、磷浓度.
2.3.2 pH对氮磷回收的影响取5份50 mL模拟废水于具塞锥形瓶中, 调节其初始pH分别至4、5、6、7、8、9, Mg(OH)2-BC投加量为0.3 g·L-1, 反应时长12 h, 取滤后上清液测定其氮、磷浓度.
2.3.3 动力学模拟取模拟废水50 mL于多个具塞锥形瓶中, 调节其初始pH为8, 设置Mg(OH)2-BC投加量为0.3 g·L-1, 反应时长分别为1、5、10、20、30、60、120、240、360、480 min, 取滤后上清液测定其氮、磷浓度.
2.4 分析及表征方法根据《水质氨氮的测定纳氏试剂分光光度法(HJ 535—2009)》及《水质总磷的测定钼酸铵分光光度法(GB 11893—1989)》, 溶液中氨氮及总正磷酸盐采用UV-2550紫外可见分光光度计测定.溶液的pH采用FE20型pH计来测定.
BC、Mg(OH)2-BC及回收氮、磷后回收产物(MAP-BC)的表面形态用Ultra55型场发射扫描电子显微镜(FE-SEM)测定;Mg(OH)2-BC、MAP-BC的晶型及化学组分采用Bruker D8 Advance型X射线衍射仪(XRD)测定;BC、Mg(OH)2-BC的表面官能团采用Nicolet 5700型傅里叶红外变换光谱仪(FTIR)测定.
3 结果与讨论(Results and discussion) 3.1 Mg(OH)2-BC的特性从图 1a和1b可以看出, 改性前的生物质炭是一种多孔的、类蜂窝煤质地的材料, 经过镁盐改性后, 片状的纳米氢氧化镁晶体均匀地负载在生物质炭的表面及孔径内部.图 1c给出了改性前后材料的XRD衍射图谱.从图中可见, 较原材料BC而言, 改性材料在2θ=18.53°(001)、32.88°(100)、37.98°(101)、50.79°(102)、58.67°(110)、62.11°(111)、72.07°(201)处出现了多个代表Mg(OH)2(PDF 44-1482)的高强度衍射峰, 说明改性后Mg(OH)2已经成功地负载在原材料上.图 1d给出了原材料BC与改性材料Mg(OH)2-BC的红外图谱, Mg(OH)2-BC的谱图在波数为3695.0 cm-1处存在极明显的Mg(OH)2特征吸收峰, 这也说明经改性的生物质炭中含有Mg(OH)2.
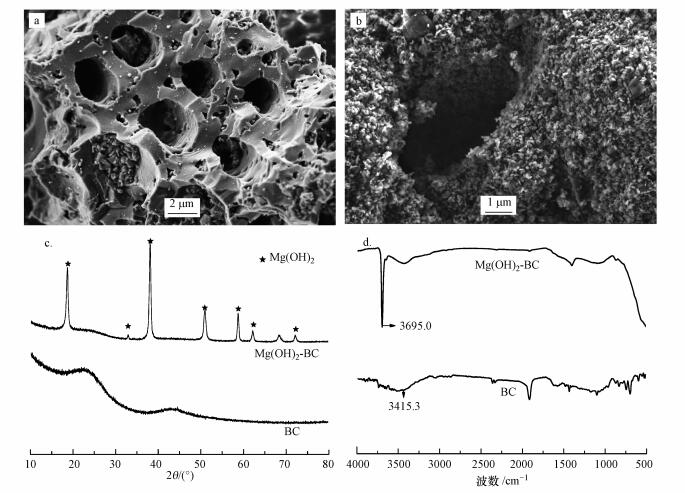 |
| 图 1 原材料(BC)(a)和改性材料(Mg(OH)2-BC)(b)的SEM图及XRD图谱(c)和FTIR图谱(d) Fig. 1 The SEM images of BC(a) and Mg(OH)2-BC(b), the XRD patterns(c) and FTIR images(d) of BC and Mg(OH)2-BC(c) |
图 2显示了不同Mg(OH)2-BC投加量对模拟废水中氮、磷回收效果的影响.从图中可以看出, 改性材料对氨氮(NH3-N)、总正磷酸盐(TP)的吸附量随投加量的增加先增大后减小, 在投加量为0.3 g·L-1时, 改性材料对NH3-N、TP的吸附量达到最大值, 分别为59.28、129.57 mg·g-1.当投加量超过0.3 g·L-1时, 改性材料对NH3-N、TP的吸附量都有所下降, 因此, 利用Mg(OH)2-BC回收氮、磷时, 其最优投加量为0.3 g·L-1.除此之外, 反应溶液的终点pH值随投加量的增加而增加, 在投加量超过0.45 g·L-1时, 溶液的pH已经超过9, 说明反应中生成鸟粪石的动力下降有可能与投加量过多导致的反应体系pH过高有关.
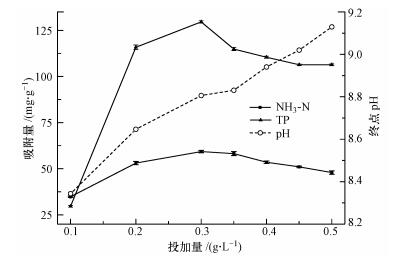 |
| 图 2 Mg(OH)2-BC投加量对模拟废水氮、磷吸附量的影响 Fig. 2 Effect of Mg(OH)2-BC dosage on the removal of TP and NH3-N |
溶液pH值对鸟粪石结晶沉淀的速率、鸟粪石产量及产物的形态、结构、种类等有极大影响(Rl et al., 2003).从图 3中可以看出, 改性材料对NH3-N、TP的吸附量先随溶液初始pH的增加而增大, 在初始pH为8时达到最大值, 此时改性材料对NH3-N、TP的吸附量可分别达到58.3、130.0 mg·g-1, 此时溶液的终点pH接近于9.当溶液的初始pH值大于8时, 其终点pH随之升高, 改性材料对NH3-N、TP的吸附量都下降.这说明Mg(OH)2-BC吸附NH3-N、TP的最佳反应pH在9左右, 这与Buchanan等(1994)及杨明珍等(2011)的结论一致.值得注意的是, 即使溶液的初始pH很低, 其终点pH也一直稳定在8.0以上.这说明改性材料Mg(OH)2-BC是一种自碱性很强的材料, 对废水的pH有较强的调节作用.
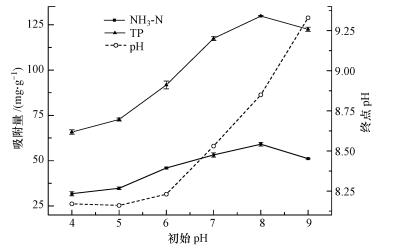 |
| 图 3 溶液初始pH对模拟废水氮、磷固定的影响 Fig. 3 Effect of initial solution pH on NH3-N and TP removal by Mg(OH)2-BC |
绉安华等(2005)指出, 含有NH4+、PO43-和Mg2+的溶液在不同pH下会生成Mg(OH)2、MgNH4PO4、Mg3(PO4)2沉淀, 其Ksp分别为1.8×10-11、2.5×10-13和6.0×10-28, 生成沉淀时的最低pH分别为10.5、5.5和8.0.因此, Mg(OH)2-BC在高pH下对氮、磷固定效率降低可能是由以下两方面原因导致:①pH过高时, 正磷酸盐的主要存在形式由H2PO4-转化为PO43-, 并与Mg2+形成结合溶度积更小的Mg3(PO4)2沉淀, 在投加量不变的情况下, 同等质量的Mg(OH)2-BC对TP的吸附量变小;②NH4+在高pH的溶液中会电离出NH3及H+, 相对于NH4+, NH3难以与PO43-和Mg2+生成鸟粪石, Mg(OH)2-BC对NH3-N的吸附量变小.
3.4 反应动力学图 4a给出了接触时间对Mg(OH)2-BC固定氮、磷效果的影响.从图中可以看出, Mg(OH)2-BC在与氮、磷混合溶液接触的前30 min, 其对氮、磷的吸附容量急剧上升, 反应开始仅1 h时, Mg(OH)2-BC对氮、磷的吸附量就已接近饱和.与此同时, 溶液pH值在反应前期急剧升高, 在第10 min时就已攀升至8.66.说明Mg(OH)2-BC可以快速释放碱度及Mg2+, 使溶液pH维持在最佳鸟粪石生成的pH值区间内, 促使鸟粪石结晶反应的快速进行.当接触时间超过240 min后, 反应达到平衡, Mg(OH)2-BC对NH3-N、TP的吸附容量分别达到57.13、129.03 mg·g-1.
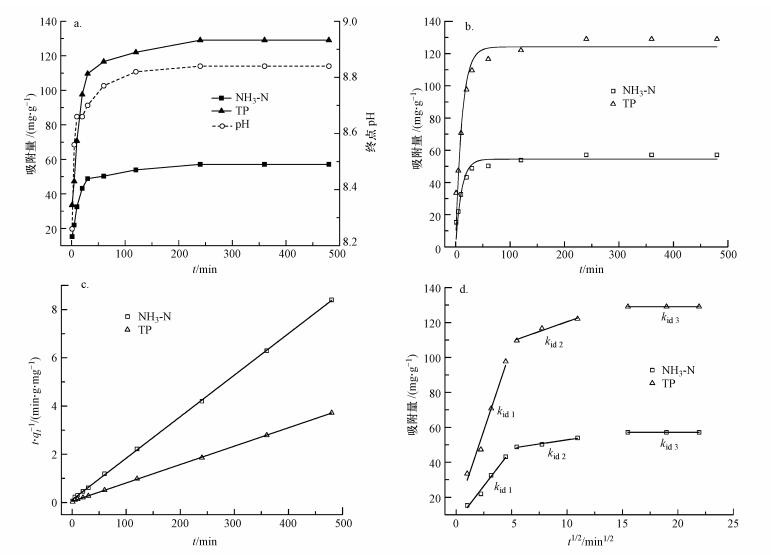 |
| 图 4 接触时间对氮、磷固定效果的影响(a)及准一级动力学模型(b)、准二级动力学模型(c)、颗粒内扩散模型(d)的拟合结果 Fig. 4 Effect of contact time on NH3-N and TP removal by Mg(OH)2-BC(a) and fitting results of pseudo-first order kinetic model(b), pseudo-second order kinetic model (c) and Weber-Morris kinetic model (d) |
建立反应动力学模型可以从理论上分析该反应的反应速率及反应步骤, 并对其进行预测, 在实际工程应用中有重要意义.本文采用准一级动力学模型(式(1))、准二级动力学模型(式(2))、颗粒内扩散模型(式(3))3种反应动力学模型分别对实验数据进行拟合.
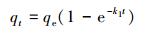
|
(1) |
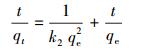
|
(2) |
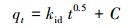
|
(3) |
式中, qe和qt分别为平衡吸附量(mg·g-1)和接触时间t(min)时的吸附量(mg·g-1);k1、k2和kid分别为准一级动力学模型(min-1)、准二级动力学模型(g·mg-1·min-1)和颗粒内扩散模型(mg·g-1·min-0.5)的吸附速率常数, C为截距(mg·g-1), 代表颗粒内扩散模型中边界层的厚度.
图 4b~d及表 1、表 2分别给出了上述3种模型对实验数据的拟合结果.从图 4b、4c中可以看出, 准二级动力学模型对实际数据的拟合度要优于准一级动力学模型.从表 1可以看出, 准二级动力学模型对NH3-N、TP拟合的R2分别为0.9998、0.9999, 要高于准一级动力学模型拟合的R2;准二级动力学模型对NH3-N、TP平衡吸附量的拟合值分别为58.0720、131.2336 mg·g-1, 该值与二者的实际平衡吸附量较准一级动力学模型而言也更为接近.总的来说, 准二级动力学模型的拟合结果与实验数据更接近, 说明Mg(OH)2-BC对NH3-N、TP的吸附过程中存在由固溶体界面上电子共用或电子转移产生的强化学力, 吸附过程受化学吸附机理的控制, 反应速率的限制因素为吸附剂表面活性位点的数量.从图 4d中可以看出, 所有的曲线都是分段的, 且所有拟合的直线都不经过原点, 说明粒子内扩散并不是唯一的限速步骤.Mg(OH)2-BC对NH3-N、TP的吸附过程可分为3个阶段, 从表 2可以看出, NH3-N及TP在3个阶段的吸附速率常数排序为:kid, 1>kid, 2>kid, 3.第1阶段的高吸附速率是因为NH3-N及TP通过边界层扩散至Mg(OH)2-BC的表面, 并与材料表面负载的镁离子发生鸟粪石结晶沉淀反应, 该阶段即表面吸附阶段;在第2阶段, 也即孔内扩散阶段, 吸附速率则由孔内扩散控制;在第3阶段, 吸附达到平衡.
| 表 1 准一级动力学模型和准二级动力学模型拟合结果 Table 1 Kinetic parameters of pseudo-first order kinetic model and pseudo-second order kinetic model for NH3-N and TP removal by Mg(OH)2-BC |
| 表 2 颗粒内扩散模型拟合结果 Table 2 Kinetic parameters of Weber-Morris kinetic model for NH3-N and TP removal by Mg(OH)2-BC |
针对生物质炭对氮、磷的吸附机制早有研究, Mukherjee等(2013)指出, 生物质炭吸附磷酸盐的机理是PO43-可以与生物质炭中的某些金属阳离子通过静电吸附或配体键合作用键合;而NH3-N的吸附则机制包括NH4+通过离子交换作用与生物炭表面的阳离子交换(Mukherjee et al., 2013)和物理吸附(如NH3-N在生物质炭空隙内部的嵌合)(Jansen et al., 1994).本文对生物质炭进行镁改性后, 氮磷混合溶液中会发生如下反应:
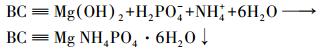
|
(4) |
反应溶液的pH可以影响鸟粪石在溶液中的溶解度和溶液的过饱和状态, 进而影响鸟粪石的生成.当反应溶液的pH值较低时, 鸟粪石的溶解度较高, 混合溶液中发生如下反应:
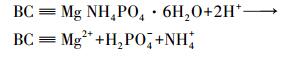
|
(5) |
根据Ronteltap等(2007)论述的条件溶度积的概念, 当溶液pH过高时, 生物质炭上负载的Mg(OH)2在溶液中的条件溶度积变小, 混合溶液发生反应(6)~(8).这也是反应溶液的平衡pH过高时, Mg(OH)2-BC对氨氮的吸附效果变差的主要原因.
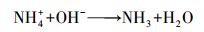
|
(6) |
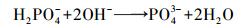
|
(7) |

|
(8) |
为了更好地分析Mg(OH)2-BC固定氮、磷的机理, 本文拍摄了在最优条件下(溶液初始pH=8, 投加量0.3 g·L-1)Mg(OH)2-BC回收氮、磷后的反应产物MAP-BC的电镜图像, 并分析了回收产物的XRD衍射图谱.从图 5a及5b中可以看出, 改性材料表面上附着的纳米片状Mg(OH)2基本消失, 产物中可见有六棱柱状的鸟粪石结晶生成并附着在生物质炭上.由图 5c可知, 与鸟粪石标准XRD谱图(PDF#15-0762)对比, 二者特征衍射峰的位置具有高度的一致性, 在2θ为14.99°(110)、15.81°(020)、16.47°(011)、20.85°(111)、21.45°(021)、25.61°(200)、27.09°(130)、30.60°(211)、31.91°(040)、33.28°(022)、33.67°(221)处出现的多个强衍射峰, 都表明Mg(OH)2-BC上负载的Mg(OH)2晶体与模拟废水中的NH3-N、TP结合生成了鸟粪石结晶, 该改性材料固定废水氮、磷的主要机理为鸟粪石结晶沉淀.
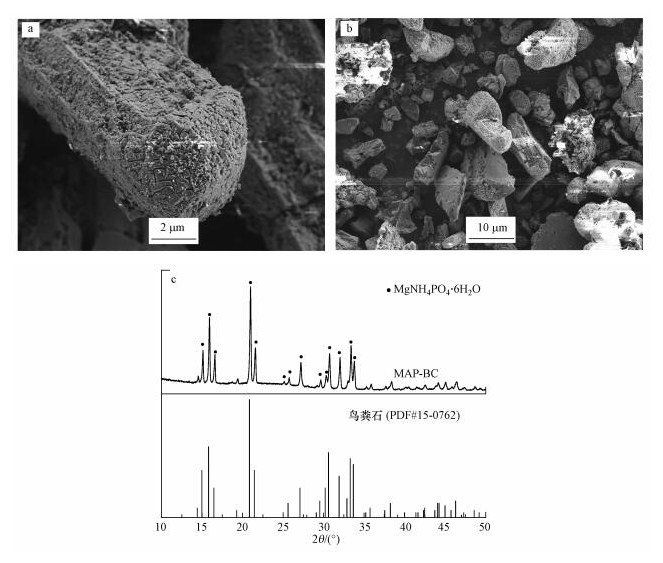 |
| 图 5 回收产物MAP-BC的图像(a.高倍, b.低倍)及XRD图谱(c) Fig. 5 SEM image(a.high magnification, b.low magnification) and XRD patterns(c) of MAP-BC |
综上所述, Mg(OH)2-BC固定模拟废水中氮、磷的机理可能包括物理吸附、静电吸附、离子交换、化学沉淀, 而在其中起主要作用的是鸟粪石结晶沉淀, 也即化学沉淀作用.
4 结论(Conclusions)1) 改性材料Mg(OH)2-BC固定NH3-N和TP的最优条件为:投加量0.3 g·L-1, 溶液初始pH=8, 反应时间≥240 min.在该条件下, Mg(OH)2-BC对NH3-N、TP的吸附量达到最大, 分别为59.28、129.57 mg·g-1.
2) Mg(OH)2-BC对NH3-N和TP的吸附过程符合准二级动力学模型, 吸附受化学吸附控制, 限制反应速率的因素主要是吸附剂表面活性位点的数量.
3) Mg(OH)2-BC固定NH3-N和TP的机理包括物理吸附、静电吸附、离子交换和化学沉淀, 其中, 起主要作用的是化学沉淀, 也即鸟粪石结晶沉淀作用.
Buchanan J R, Mote C R, Robinson R B. 1994. Struvite control by chemical treatment[J]. Transactions of the ASAE, 37(4): 1301–1308.
DOI:10.13031/2013.28211
|
成雪君, 王学江, 王浩, 等. 2017. 载镁天然沸石复合材料对污水中氮磷的同步回收[J]. 环境科学, 2017, 38(12): 5139–5145.
|
Jansen R J J, Van Bekkum H. 1994. Amination and ammoxidation of activated carbons[J]. Carbon, 32(8): 1507–1516.
DOI:10.1016/0008-6223(94)90146-5
|
Johir M A H, George J, Vigneswaran S, et al. 2011. Removal and recovery of nutrients by ion exchange from high rate membrane bio[J]. Desalination, 275(1/3): 197–202.
|
Liu Z, Zhao Q, Wei L, et al. 2011. Effect of struvite seed crystal on MAP crystallization[J]. Journal of Chemical Technology and Biotechnology, 86(11): 1394–1398.
DOI:10.1002/jctb.v86.11
|
刘颐华. 2005. 我国与世界磷资源及开发利用现状(续)[J]. 磷肥与复肥, 2005, 20(5): 9–12.
|
梅翔, 成慧灵, 张寅丞, 等. 2013. 离子交换法选择性回收污泥厌氧消化液中的磷[J]. 环境工程学报, 2013, 7(9): 3319–3326.
|
Mukherjee A, Zimmerman A R. 2013. Organic carbon and nutrient release from a range of laboratory-produced biochars and biochar-soil mixtures[J]. Geoderma, 193: 122–130.
|
Rl N N M, Hesterberg D L. 2003. Struvite precipitation in anaerobic swine lagoon liquid:effect of pH and Mg:P ratio and determination of rate constant[J]. Bioresource Technology, 89(3): 229–236.
DOI:10.1016/S0960-8524(03)00076-2
|
Ronteltap M, Maurer M, Gujer E. 2007. Struvite precipitation thermodynamics in source-separated urine[J]. Water Research, 41(5): 977–984.
DOI:10.1016/j.watres.2006.11.046
|
Stratful I, Scrimshaw M D, Lester J N. 2001. Conditions influencing the precipitation of magnesium ammonium phosphate[J]. Water Research, 35(17): 4191–4199.
DOI:10.1016/S0043-1354(01)00143-9
|
宋永会, 钱锋, 向连城. 2011. 磷酸钙沉淀法去除猪场废水中磷的实验研究[J]. 环境科学, 2011, 32(6): 1679–1686.
|
Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. 2012. Biochar adsorbed ammonia is bioavailable[J]. Plant & Soil, 350(1/2): 57–69.
|
Tansel B, Lunn G, Monje O. 2018. Struvite formation and decomposition characteristics for ammonia and phosphorus recovery:A review of magnesium-ammonia-phosphate interactions[J]. Chemosphere, 194: 504.
DOI:10.1016/j.chemosphere.2017.12.004
|
Wang H, Wang X, Ma J, et al. 2017. Removal of cadmium(Ⅱ) from aqueous solution:A comparative study of raw attapulgite clay and a reusable waste-struvite/attapulgite obtained from nutrient-rich wastewater[J]. Journal of Hazardous Materials, 329: 66–76.
DOI:10.1016/j.jhazmat.2017.01.025
|
王寿兵, 陶林森. 2003. 中国大陆富营养化物质排放量及排放强度[J]. 复旦学报(自然科学版), 2003, 42(3): 476–480.
DOI:10.3969/j.issn.0427-7104.2003.03.053 |
肖文涛. 2010. 污水生物脱氮除磷工艺的现状与发展[J]. 环境保护与循环经济, 2010, 30(11): 59–62.
DOI:10.3969/j.issn.1674-1021.2010.11.021 |
杨明珍, 包震宇, 师晓春, 等. 2011. 鸟粪石沉淀法处理沼液实验研究[J]. 工业安全与环保, 2011, 37(3): 31–32.
DOI:10.3969/j.issn.1001-425X.2011.03.014 |
Xia P, Wang X, Wang X, et al. 2016. Struvite crystallization combined adsorption of phosphate and ammonium from aqueous solutions by mesoporous MgO-loaded diatomite[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 506: 220–227.
|
Yetilmezsoy K, Sapci-Zengin Z. 2009. Recovery of ammonium nitrogen from the effluent of UASB treating poultry manure wastewater by MAP precipitation as a slow release fertilizer[J]. Journal of Hazardous Materials, 166(1): 260–269.
DOI:10.1016/j.jhazmat.2008.11.025
|
Yigit N O, Mazlum S. 2007. Phosphate recovery potential from wastewater by chemical precipitation at batch conditions[J]. Environmental Technology Letters, 28(1): 83–93.
DOI:10.1080/09593332808618768
|
Zhang T, Fang C, Li P, et al. 2013. Application of biochar for phosphate adsorption and recovery from wastewater[J]. Advanced Materials Research, 750-752: 1389–1392.
DOI:10.4028/www.scientific.net/AMR.750-752
|
邹安华, 孙体昌, 邢奕, 等. 2005. pH对MAP沉淀法去除废水中氨氮的影响[J]. 环境与可持续发展, 2005(4): 4–6.
DOI:10.3969/j.issn.1673-288X.2005.04.002 |
 2018, Vol. 38
2018, Vol. 38


