2. 西安建筑科技大学环境与市政工程学院, 西安 710055
2. School of Environment and Municipal Engineering, Xi'an University of Architecture and Technology, Xi'an 710055
Pb2+是一种广泛存在于工业废水中的高毒性重金属污染物,Pb2+与Hg2+、Cd2+、As3+和Cr6+被国家环保部列为5种水体中优先控制排放的重金属污染物(Gautam et al., 2013).由于Pb2+能够通过食物链进行生物累积,即使是自然水体中低浓度的铅也会对人体健康和生态环境造成极大危害(Dong et al., 2010),因此含铅废水在排放前必须进行有效处理.目前处理含铅废水的方法主要有化学沉淀法(Saleh et al., 2012)、离子交换法(Rivas et al., 2012)、电化学法(Shinzato et al., 2012)、膜分离法(马春芳等,2015)和吸附法等(Oh et al., 2016).其中吸附法具有操作简单、成本低廉等特点而被普遍使用.
近年来,由废弃生物质在高温限氧条件下热解产生的生物炭,因其价格低廉、制备过程简单、前驱体来源广泛等优势得到了广泛的研究(Inyang et al., 2013; 王彬斌等,2017).但单一的生物炭吸附能力较差,且存在固液分离困难等问题.因此,目前已有部分学者关注生物炭与其他材料的组合使用,利用物理、化学方法将生物炭与其他材料组合制备成具有新性能、新结构的材料,如磁性生物炭(Mohan et al., 2014)、生物炭/石墨烯(Zhang et al., 2012)、生物炭/碳纳米管(Inyang et al., 2014)、生物炭/纳米零价铁(Devi et al., 2014)、生物炭/锰氧化物(Song et al., 2014)等,已广泛用于水溶液中吸附Pb2+的研究.纳米羟基磷灰石(nano-Hydroxyapatite, nHAP)分子式为Ca10(PO4)6(OH)2,由于比表面积巨大,其结构中的Ca2+易被二价重金属离子替换,已被研究者广泛认为是低成本、环境友好的替代吸附剂(安良等,2016; Sun et al., 2013).纳米羟基磷灰石作为活性物质能够有效地提升原生生物炭对铅的吸附容量和吸附选择性,而生物炭的存在又可有效地分散纳米羟基磷灰石颗粒,避免羟基磷灰石颗粒易团聚现象,提高吸附性能.另外,为解决吸附剂因粒径较小,在实际应用中存在固液分离困难、易流失等问题,将吸附剂与磁性物质结合赋予磁性后,势必同时具有良好的重金属吸附性能及磁分离性能(Muliwa et al., 2016).
本研究采用浸蘸法制备了一种磁性羟基磷灰石/生物炭复合材料(HAP/γ-Fe2O3/BC),经过一步煅烧完成对生物炭负载羟基磷灰石及复合材料磁化过程,与常规生物炭复合材料的制备大多经过原材料热解碳化及复合两步完成相比,本制备方法有效缩减了其制备环节,制备方法更简便.利用带能谱的扫描电子显微镜(SEM-EDS)、X射线衍射仪(XRD)、傅里叶变换红外光谱仪(FTIR)、振动样品磁强计(VSM)等手段对HAP/γ-Fe2O3/BC进行了表征,同时研究了其对Pb2+的吸附性能,以期为含Pb2+废水的处理提供参考.
2 材料与方法(Materials and methods) 2.1 试剂与仪器原料与试剂:硝酸钙、磷酸、六水合氯化铁(FeCl3·6H2O)、聚乙二醇(PEG)、氢氧化钠、硝酸,分析纯,天津市化学试剂三厂;硝酸铅,分析纯,国药集团化学试剂有限公司;实验所用水为去离子水;玉米秸秆取自包头市周边农田,用去离子水清洗,去除表面粘附物后,置于80 ℃烘箱中烘干至恒重;经破碎机破碎,过100目筛.
仪器:原子吸收分光光度计(美国PE公司,AA800型),带能谱的扫描电子显微镜(日本,JSM-5900LV型),马弗炉(北京独创科技有限公司,DC-H8/11型),恒温培养振荡器(上海智城分析仪器有限公司,ZWYR-2102C型),X射线衍射仪(德国,Bruker D8型),pH测定仪(上海雷磁,PHSJ-3C型),傅里叶变换红外光谱仪(美国,Nicolet-5700型),磁力搅拌加热锅(巩义市予华仪器有限公司,ZNCL-G型),磁强计(美国,Lake Shore 7410型).
2.2 磁性羟基磷灰石/生物炭复合材料的制备将50 mL 0.025 mol·L-1的Ca(NO3)2·4H2O加入三颈烧瓶中,用水浴维持体系的温度为45 ℃,在持续搅拌作用下按Ca/P=1.67的摩尔比例,将0.3 mol·L-1的H3PO4缓慢加入三颈烧瓶中,并用氨水调节体系的pH为10,滴加完毕后,加热30 min,将产物陈化一定的时间.用去离子水洗涤3次,抽滤后80 ℃烘干,将烘干样品置于坩埚中,盖上盖子,置于氮气保护的马弗炉中(氮气流速80 mL· min-1),以10 ℃· min-1的升温速率在300 ℃下焙烧1 h,得到羟基磷灰石(Hydroxyapatite, 英文缩写HAP)样品.称取一定量的HAP置于100 mL烧杯中超声30 min制得HAP悬浮液待用.
称取10 g玉米秸秆,粉碎至粒径小于2 mm,将其完全浸没在100 mL HAP悬浮液中,HAP与玉米秸秆质量比为1:1,磁力搅拌1 h,待秸秆与HAP悬浮液充分混合后,再缓慢加入5.4 g FeCl3·6H2O和8 mL PEG.将混合液倒入三颈烧瓶中,水浴加热到60 ℃后,迅速加入20 mL 25%的NaOH,恒温搅拌30 min.沉淀抽滤,在烘箱中于80 ℃干燥6 h.将烘干后样品置于氮气保护的马弗炉中在600 ℃下焙烧3 h,制得HAP/γ-Fe2O3/BC样品.
2.3 材料的表征与测试条件材料的表面形貌特征采用带能谱的扫描电子显微镜(日本,JSM-5900LV型)进行观察;HAP/γ-Fe2O3/BC颗粒的晶形采用X射线衍射仪(德国,Bruker D8)测定,测试条件为:Cu靶和Kα射线,操作电压40 kV,电流40 mA,扫描范围2θ为10°~80°;表面官能团采用傅里叶变换红外光谱仪(美国,Nicolet-5700型)分析,扫描波数范围为400~4000 cm-1;磁滞回线采用振动样品磁强计(美国,Lake Shore 7410型)检测.溶液中Pb2+的浓度采用原子吸收分光光度计测定.HAP/γ-Fe2O3/BC复合材料中钙与磷摩尔比测定方法为:称取0.05 g样品,用0.1 mol· L-1的盐酸溶液溶解后用去离子水定容,采用钼锑抗分光光度法测定溶液中磷浓度,采用原子吸收分光光度计测定溶液中钙浓度,计算钙磷比.
2.4 吸附实验取50 mL一定浓度的Pb2+溶液于锥形瓶中,用0.1 mol· L-1 HNO3和NaOH溶液调节pH,准确称取并加入一定量的HAP/γ-Fe2O3/BC后迅速放入恒温振荡器中于设定温度下以150 r· min-1振荡一定时间,离心,上清液用0.22 μm玻璃纤维滤膜过滤,测定滤液中Pb2+浓度.每个样品重复3次.用式(1)和式(2)分别计算对Pb2+的去除率R和吸附量qe(mg·g-1).
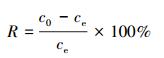
|
(1) |
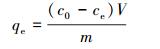
|
(2) |
式中, qe为平衡吸附量(mg·g-1);c0和ce分别为初始时刻和平衡时溶液中Pb2+的质量浓度(mg· L-1);R为去除率;V为溶液的体积(L);m为吸附剂投加量(g).
2.5 解吸实验室温下将Pb2+溶液(c0为100 mg· L-1、pH=5)与吸附剂HAP/γ-Fe2O3/BC(m/V=1 g· L-1)按照上述吸附实验步骤进行吸附反应,吸附实验结束后通过磁分离方法收集吸附Pb2+的HAP/γ-Fe2O3/BC.将得到的固体残渣用去离子水彻底清洗,烘干,最后将吸附剂与50 mL 0.01 moI· L-1 EDTA溶液混合后以150 r· min-1振荡12 h,然后洗至中性,烘干后连续进行5次吸附、解吸实验,分别计算每次解吸后HAP/γ-Fe2O3/BC的吸附量.
3 结果与讨论(Results and discussion) 3.1 SEM分析图 1a、1b分别为BC和HAP/γ-Fe2O3/BC的SEM照片.对比可知,BC表面光滑,纵剖面呈鱼骨状,表面孔隙结构丰富,且排列有序,大部分生物质结构得以基本保留,这种多孔结构有利于Pb2+的吸附(Parmar et al., 2014).而复合后的HAP/γ-Fe2O3/BC表面明显粗糙,表面上附着很多白色微小颗粒,通过对图 1b中放大的微小颗粒进行EDS能谱分析,其中主要的峰有C、O、Ca、P、Fe等元素,是BC、HAP和γ-Fe2O3的主要成分,由XRD结果可知为磁性HAP/γ-Fe2O3颗粒.经实验测定,复合材料的钙磷摩尔比为1.69,与HAP的特征化学计量比(1.667)基本一致,证实了本研究所制备的HAP/γ-Fe2O3/BC含HAP.
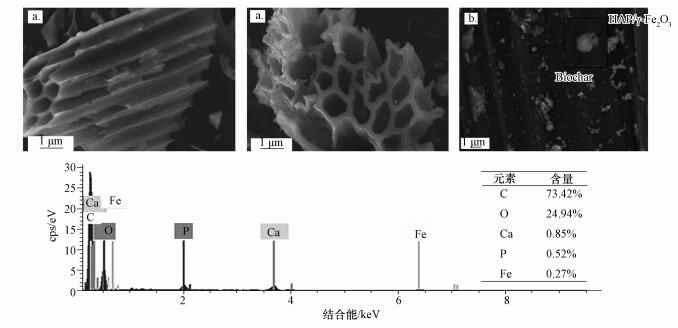 |
| 图 1 BC的SEM图(a)和HAP/γ-Fe2O3/BC复合材料SEM-EDS图(b) Fig. 1 The SEM images of BC (a) and the SEM-EDS images ofHAP/γ-Fe2O3/BC (b) |
HAP、HAP/γ-Fe2O3和HAP/γ-Fe2O3/BC复合材料的XRD图谱见图 2.对比可知,HAP/γ-Fe2O3和HAP/γ-Fe2O3/BC复合材料的XRD图谱中均出现了HAP的衍射峰(2θ=25.9°、31.7°、39.8°、46.6°、49.5°与标准衍射卡片JCPDS standard no.01-072-1243比对一致(Yang et al., 2016))和γ-Fe2O3的特征峰(2θ=30.5°、36.5°、43.5°、58.5°、63°与标准衍射卡片JCPDS no.39-1346比对一致(Guivar et al., 2016)).再一次证实了本研究所制备的复合材料含HAP和γ-Fe2O3.由图还可知,HAP/γ-Fe2O3/BC复合材料的XRD图谱中出现了BC的特征峰(2θ=27.6°),而HAP/γ-Fe2O3复合材料于2θ=27.6°处则没有XRD特征峰,这说明HAP/γ-Fe2O3/BC复合材料含BC.HAP/γ-Fe2O3/BC中的衍射峰强度变弱,表明HAP/γ-Fe2O3颗粒可能分散在BC的孔隙中,该结果与Mouse等(2016)先前的报道一致.
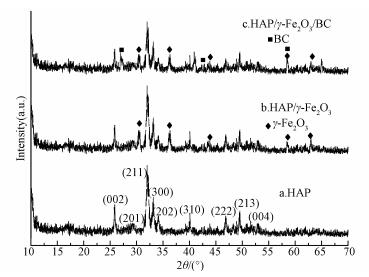 |
| 图 2 HAP、HAP/γ-Fe2O3和HAP/γ-Fe2O3/BC的XRD图 Fig. 2 XRD spectra of HAP, HAP/γ-Fe2O3 and HAP/γ-Fe2O3/BC |
图 3为γ-Fe2O3、HAP/γ-Fe2O3和HAP/γ-Fe2O3/BC的FTIR图谱.由图 3可知,HAP/γ-Fe2O3/BC和HAP/γ-Fe2O3两个样品的主要官能团吸收峰基本相同.3567 cm-1处的峰是O—H的伸缩振动,3448 cm-1、1658 cm-1对应吸附水的伸缩和弯曲振动吸收峰,1416、1460 cm-1为CH2或—COO的吸收峰,1087、1035、962、607、565 cm-1分别对应PO43-不同υ型的振动吸收峰(Wei et al., 2012),PO43-和O—H反映出了羟基磷灰石的典型结构.与HAP/γ-Fe2O3相比较,HAP/γ-Fe2O3/BC图谱中出现了其它吸收峰,2922、2360 cm-1是脂肪性—CH2不对称伸缩振动(Wang et al., 2013; Yuan et al., 2013),1574 cm-1处为C=O键伸缩振动(Reyesgasga et al., 2013).此外,γ-Fe2O3的红外吸收峰与PO43-、HPO43-引起的两个吸收峰发生了重叠(Abbasi et al., 2017),在图中表现为于607、565 cm-1处峰的增强.因此,结合XRD和FTIR分析表明,HAP/γ-Fe2O3和HAP/γ-Fe2O3/BC两种复合材料的主要晶相为HAP、HAP/γ-Fe2O3/BC复合材料还含有BC,这与本文材料成分的设计是一致的.
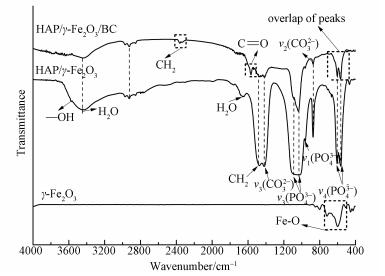 |
| 图 3 HAP、HAP/γ-Fe2O3、HAP/γ-Fe2O3/BC的FTIR图谱 Fig. 3 The FTIR spectra of HAP, HAP/γ-Fe2O3 and HAP/γ-Fe2O3/BC |
图 4为HAP/γ-Fe2O3/BC复合材料的磁滞回线,从图中可知,HAP/γ-Fe2O3/BC的磁饱和强度达到19.18 emu· g-1.说明本研究所制备的复合材料具备较高的磁饱和强度,对外加磁场的响应能力较强,可以通过外加磁场的作用使复合材料从溶液中迅速分离.
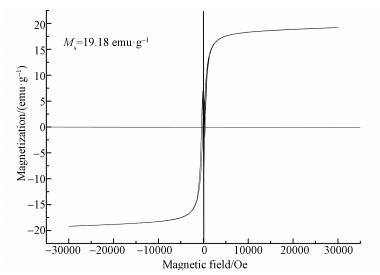 |
| 图 4 HAP/γ-Fe2O3/BC复合材料的磁滞回线 Fig. 4 The magnetic hysteresis loops of HAP/γ-Fe2O3/BC |
溶液pH是影响吸附效果的重要因素,它不仅影响重金属离子的存在形式,而且决定吸附剂的表面电荷.本研究pH选择1~5的100 mg· L-1 Pb2+溶液来研究pH的影响(吸附剂投加量1 g· L-1、温度25 ℃).由图 5可知,HAP/γ-Fe2O3/BC对Pb2+的平衡吸附量随溶液pH值的增大而增大.当pH>4时曲线变化趋势趋于平缓,平衡吸附量达到98.93 mg·g-1以上;进一步增大溶液pH值,平衡吸附量增加幅度较小.另外,在相同pH下,HAP/γ-Fe2O3/BC对水中Pb2+的吸附能力明显强于BC,这说明复合材料HAP/γ-Fe2O3/BC中HAP对去除水中Pb2+起到了主导作用.根据之前研究发现,HAP在强酸性范围时会发生溶解(Liao et al., 2010)(式(3)),HAP表面≡PO-与≡CaOH质子化(式(4)、(5)),≡POH与≡CaOH2+使得HAP表面带正电荷,H+与Pb2+竞争表面吸附位点,导致Pb2+的吸附量较低(Yang et al., 2014).因此,在低pH条件下,HAP/γ-Fe2O3/BC对Pb2+的吸附明显受到抑制,随着pH升高HAP溶解度降低,H+的竞争能力下降(Sitko et al., 2012),Pb2+和Ca2+进行离子交换产生Pb10(PO4)6(OH)2沉淀(式(6)~(7)).同时,HAP/γ-Fe2O3/BC表面上的羟基、羧基等官能团的化学吸附与静电作用吸附Pb2+,使得HAP/γ-Fe2O3/BC对Pb2+吸附量显著增加.室温条件下Pb(OH)2的溶度积为1.43×10-15(杨宏孝等, 2010),在本实验条件下可计算出开始生成Pb(OH)2沉淀的理论pH为6.73,当溶液初始pH为5时,BC及HAP/γ-Fe2O3/BC两种材料的吸附平衡pH分别升高至5.4和5.3,均低于临界pH.表明在本研究pH范围内,不会由于吸附过程中pH升高而产生Pb(OH)2沉淀.
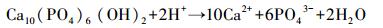
|
(3) |
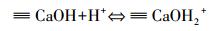
|
(4) |
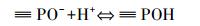
|
(5) |
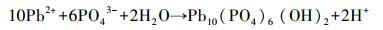
|
(6) |
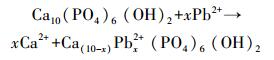
|
(7) |
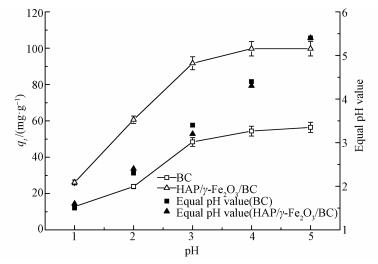 |
| 图 5 pH对BC、HAP/γ-Fe2O3/BC吸附Pb2+的影响 Fig. 5 Effect of pH on the adsorption of Pb2+ by BC and HAP/γ-Fe2O3/BC |
图 6为HAP/γ-Fe2O3/BC投加量对Pb2+的吸附影响曲线(溶液pH为5,温度25 ℃).由图可知,HAP/γ-Fe2O3/BC对Pb2+的去除率随投加量的增加而增大,并最终趋于平衡,但HAP/γ-Fe2O3/BC的单位吸附量逐渐减小,这主要是因为当溶液体积和Pb2+初始浓度一定时,随着吸附剂投加量增加,吸附剂上未被利用的空余活性位点增加,活性部位聚集和重叠导致吸附作用的表面积减少,从而导致HAP/γ-Fe2O3/BC对水中Pb2+单位吸附量的下降(Rao et al., 2006).当HAP/γ-Fe2O3/BC的投加量为1 g· L-1时吸附达到平衡,去除率达99%,吸附量99.62 mg·g-1.
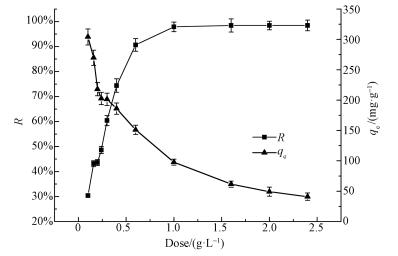 |
| 图 6 HAP/γ-Fe2O3/BC投加量对吸附Pb2+的影响 Fig. 6 Effect of HAP/γ-Fe2O3/BC dosages on Pb2+ removal |
HAP/γ-Fe2O3/BC对Pb2+的吸附动力学如图 7a所示.从图中可知,HAP/γ-Fe2O3/BC对Pb2+的吸附可分为两个阶段:快速阶段(0~30 min)和慢速阶段(30~300 min).在初始阶段,Pb2+吸附量随时间迅速增加,吸附速率较快;随着时间的延长,吸附速率逐渐减小,吸附进入慢速阶段,在120 min基本达到平衡状态.分别采用准一级(式(8))和准二级动力学模型(式(9))和粒子内扩散模型(式(10))对Pb2+吸附过程进行拟合.
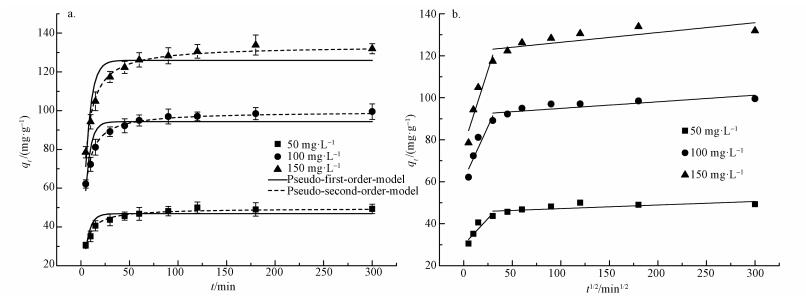 |
| 图 7 HAP/γ-Fe2O3/BC对Pb2+的吸附动力学(a)及粒子内扩散模型(b)拟合结果 Fig. 7 Adsorption kinetic modeling (a) and adsorption data fitted by intra-particle diffusion model (b) |
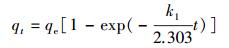
|
(8) |
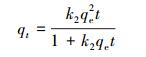
|
(9) |
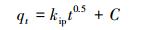
|
(10) |
式中,qe和qt分别为吸附平衡及时间t时的吸附量(mg·g-1);t为吸附时间(min);k1为准一级吸附速率常数(min-1);k2为准二级吸附速率常数(g· mg-1· min-1);kip为颗粒内扩散速率常数(mg·g-1· min-1/2).
动力学参数拟合结果如表 1所示.结果表明,与准一级相比,准二级动力学方程拟合的可决系数R2高,线性相关性显著,且准二级动力学方程得到的吸附量理论值qe, cal和实验值qe, exp非常接近.因此,HAP/γ-Fe2O3/BC对Pb2+的吸附符合准二级动力学模型,表明HAP/γ-Fe2O3/BC对Pb2+的吸附速率主要受表面化学反应所控制.粒子内扩散模型用来分步描述吸附剂对重金属离子的吸附动力学规律,拟合结果见图 7b和表 2.由图可知HAP/γ-Fe2O3/BC对Pb2+的吸附过程分为粒子膜扩散、粒子内扩散两个阶段.图中斜率较大的部分代表吸附质Pb2+通过溶液扩散进入吸附剂表面的过程,斜率较小的部分代表吸附质通过吸附剂表面的微孔进入吸附剂内部进行扩散的过程(Zhao et al., 2014; Tan et al., 2015).kip1>kip2及c1<c2表明HAP/γ-Fe2O3/BC对溶液中大量Pb2+的吸附发生在吸附的初始阶段,当接近吸附平衡后,才由粒子内扩散控制吸附速率.拟合曲线未过原点,说明粒子内扩散并不是唯一控制吸附速率的步骤(Javanbakht et al., 2016),吸附速率还受到如离子交换、沉淀等反应的影响.
| 表 1 HAP/γ-Fe2O3/BC对Pb2+吸附动力学模型参数 Table 1 Adsorption kinetics parameters of HAP/γ-Fe2O3/BC for Pb2+ |
| 表 2 HAP/γ-Fe2O3/BC吸附Pb2+的粒子内扩散动力学参数 Table 2 Intra-particle diffusion model fitting parameters for the adsorption of Pb2+ by HAP/γ-Fe2O3/BC |
在pH为5,投加量为1 g· L-1时,HAP/γ-Fe2O3/BC对Pb2+的吸附等温线如图 8所示.分别利用Langmuir方程(11)和Freundlich方程(12)对吸附等温数据进行拟合,结果见图 8和表 3.
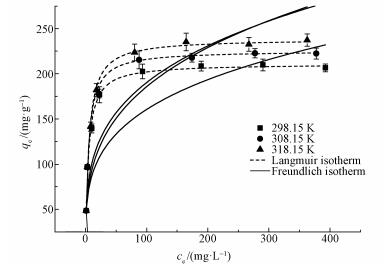 |
| 图 8 HAP/γ-Fe2O3/BC对Pb2+的吸附等温线 Fig. 8 Isotherms for Pb2+ adsorption on HAP/γ-Fe2O3/BC |
| 表 3 HAP/γ-Fe2O3/BC对Pb2+的吸附等温参数 Table 3 Isotherm parameters for Pb2+ adsorption onto HAP/γ-Fe2O3/BC |
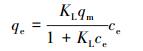
|
(11) |
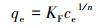
|
(12) |
式中,qm为吸附剂最大吸附量(mg·g-1);KL为Langmuir常数(L· mg-1);KF为表征吸附能力的常数(L· g-1);n是表示吸附趋势大小的常数.
由表 3可知,Langmuir模型拟合的R2更接近于1,最大吸附量为237.733 mg·g-1与实际值接近.这说明吸附剂表面具有很多能量无差别的吸附位点,Langmuir模型更适合用来描述整个吸附过程.另外Langmuir等温吸附还可以用无量纲的平衡参数特征分离系数RL来分析(Mohan et al., 2013):
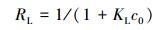
|
(13) |
一般地,当RL>1时,表明为非优惠吸附;当RL=1时,为线性吸附;当0<RL<1时,为优惠吸附;当RL=0时,为不可逆吸附(Gao et al., 2013).由图 9可知RL介于0和1之间趋近于0,说明HAP/γ-Fe2O3/BC对Pb2+的吸附为优惠吸附.
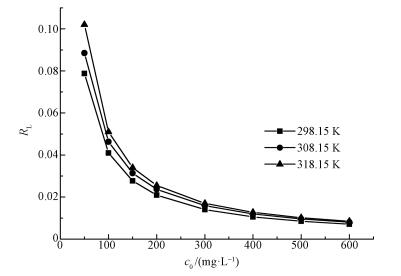 |
| 图 9 分离因子与初始浓度的关系曲线 Fig. 9 Relationship of separation factor and initial concentration |
将HAP/γ-Fe2O3/BC与已报道的其他几种吸附剂对Pb2+的吸附性能进行对比,结果如表 4所示.通过吸附平衡时间的对比发现,HAP/γ-Fe2O3/BC吸附Pb2+的平衡时间较短.对Pb2+的吸附容量对比可见,除羟基磷灰石/海藻酸钠外,本研究中HAP/γ-Fe2O3/BC对Pb2+的吸附量较大.由此可见,HAP/γ-Fe2O3/BC对Pb2+的吸附有一定优势,较短的时间内即可达到较高的吸附量,是较具潜力的吸附材料.
| 表 4 HAP/γ-Fe2O3/BC与其他几种吸附剂对Pb2+的吸附性能对比 Table 4 Performance of Pb2+ adsorption by HAP/γ-Fe2O3/BC compared with several other adsorbents |
为了分析HAP/γ-Fe2O3/BC对Pb2+的吸附热力学行为,热力学参数吉布斯自由能变化(△G0)、焓变(△H0)和熵变(△S0)可以通过公式(14)和(15)计算得到.
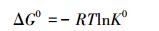
|
(14) |
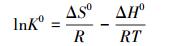
|
(15) |
式中,T为热力学温度;R是气体常数,8.314 J· mol-1· K-1;吸附平衡常数K0是由不同温度下的ln(qe/ce)对ce作图后的截距得到.通过斜率和截距计算出△H0和△S0的值,计算得到的热力学参数如表 5所示.△G0为负值,表明HAP/γ-Fe2O3/BC吸附Pb2+的过程是一个自发的过程,温度越高,△G0值越小,表明升高温度有助于吸附.△H0>0,表明吸附过程为吸热过程,升高温度有利于吸附的进行,△S0>0,说明吸附过程体系混乱自由度增大.
| 表 5 HAP/γ-Fe2O3/BC对Pb2+的吸附热力学参数 Table 5 Thermodynamic parameters for adsorption of Pb2+ on HAP/γ-Fe2O3/BC |
实际应用中选用吸附剂,不仅取决于吸附剂对重金属离子的吸附能力,还取决于其能否解吸再生和重复利用的经济性(金兰淑等,2012).由解吸实验得到HAP/γ-Fe2O3/BC解吸次数与吸附量以及质量损失率的关系,如图 10所示.由图 10a可知,经0.01 mol· L-1 EDTA溶液4次解吸处理后,HAP/γ-Fe2O3/BC对Pb2+的吸附能力有所下降,吸附量从96.46 mg·g-1下降为61.84 mg·g-1,但仍然具有较高的吸附能力.由图 10b可知,每次解吸后,吸附剂质量都有一定减少,4次循环后质量损失7.6%.由此说明,这种造粒方式有很强的可回收性,HAP/γ-Fe2O3/BC作为吸附剂处理含Pb2+废水具有良好的循环利用性能.
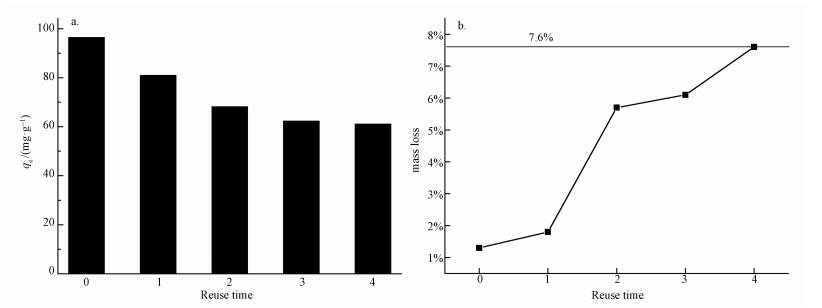 |
| 图 10 解吸次数与吸附量(a)和质量损失率(b)的关系 Fig. 10 The relation between the number of desorption and the adsorption capacity (a) and the loss of mass (b) |
为更深入探讨HAP/γ-Fe2O3/BC吸附Pb2+的机理,本研究将吸附Pb2+前后的复合材料进行了XRD和FTIR分析,得到的XRD和FTIR图谱如图 11所示.由图 11a可知,HAP/γ-Fe2O3/BC吸附Pb2+以后,HAP/γ-Fe2O3/BC中有新的物相生成,根据先前的研究分析认为形成了稳定的羟基铅磷石(Pb10(PO4)6(OH)2,Hydroxypyromorphite,简写为HPY)(Yang et al., 2015).HAP/γ-Fe2O3/BC除铅过程与HAP的溶解及随后产生的HPY沉淀有关,证实了HAP/γ-Fe2O3/BC除铅过程中的溶解-沉淀作用(Zhang et al., 2013).对比复合材料吸附前后FTIR图谱的变化可以得出,HAP/γ-Fe2O3/BC含氧官能团特征峰发生明显变化,主要是峰强降低,振幅下降,波峰变宽.其中3448.61、2925.92、2360.79、1558.50 cm-1等分别对应的—OH、—CH2及C=O的吸收峰被明显削弱并发生迁移,可能是Pb2+与O—H中的H+发生了离子交换,羰基与Pb2+发生络合反应(徐楠楠等,2014),同时在605.63 cm-1处γ-Fe2O3与HAP重叠峰的峰强减弱,说明Fe—O可能也参与了反应.这表明HAP/γ-Fe2O3/BC对Pb2+的吸附是一个复杂的过程,主要机制包含溶解-沉淀、离子交换及复合材料表面—OH和—COOH等含氧官能团的络合作用.
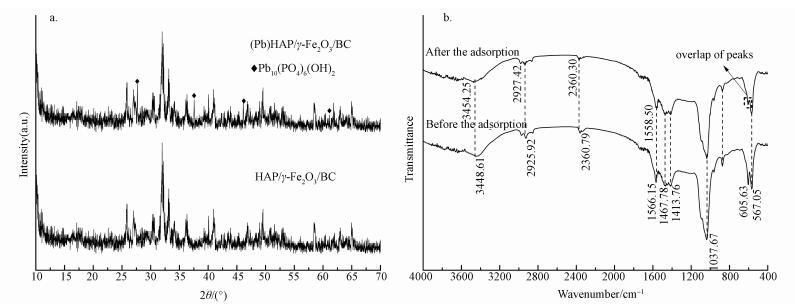 |
| 图 11 HAP/γ-Fe2O3/BC吸附Pb2+前后的XRD图谱(a)及FITR图谱(b) Fig. 11 XRD (a) and FTIR(b)spectra of HAP/γ-Fe2O3/BC before and after adsorption |
1) SEM-EDS、XRD、FTIR、VSM等表征结果表明羟基磷灰石和γ-Fe2O3均已负载到生物炭上,在外加磁场条件下能够快速固液分离.
2) 相比于BC,复合材料HAP/γ-Fe2O3/BC对Pb2+具有更好的吸附效果,在pH 4~5,吸附效果最好,最佳投加量为1 g· L-1;HAP/γ-Fe2O3/BC吸附Pb2+在120 min内可达到吸附平衡,吸附动力学符合准二级动力学模型,吸附速率主要受表面化学反应所控制,粒子内扩散并不是唯一控制吸附速率的步骤,吸附速率还受到如离子交换、沉淀等反应的影响;等温吸附方程符合Langmuir等温模型,298.15 K时的最大吸附量达到210.85 mg·g-1;热力学结果表明,复合材料吸附Pb2+的过程是一个自发的吸热过程,其体系混乱度增加.
3) HAP/γ-Fe2O3/BC对Pb2+的吸附机理主要包括溶解-沉淀、离子交换以及复合材料表面—OH和—COOH等含氧官能团的络合作用.
Abbasi Z, Rezayati S, Bagheri M, et al. 2017. Preparation of a novel, efficient, and recyclable magnetic catalyst, γ-Fe2O3@HAp-Ag nanoparticles, and a solvent- and halogen-free protocol for the synthesis of coumarin derivatives[J]. Chinese Chemical Letters, 28(1): 75–82.
DOI:10.1016/j.cclet.2016.06.022
|
安良. 2016.磁性羟基磷灰石微球的可控制备及其负载Ag3PO4后光催化性能的研究[D].武汉: 武汉科技大学
|
曹纬, 周航, 邓贵友, 等. 2017. 改性谷壳生物炭负载磁性Fe去除废水中Pb2+的效果及机制[J]. 环境工程学报, 2017, 11(3): 1437–1444.
|
Devi P, Ssraha A K. 2014. Synthesis of the magnetic biochar composites for use as an adsorbent for the removal of pentachlorophenol from the effluent[J]. Bioresource Technology, 169: 525–531.
DOI:10.1016/j.biortech.2014.07.062
|
Dong L J, Zhu Z L, Qiu Y L, et al. 2010. Removal of lead from aqueous solution by hydroxyapatite/magnetite composite adsorbent[J]. Chemical Engineering Journal, 165(3): 827–834.
DOI:10.1016/j.cej.2010.10.027
|
Gao Y, Yue Q, Gao B, et al. 2013. Comparisons of porous, surface chemistry and adsorption properties of carbon derived from Enteromorpha prolifera activated by H4P2O7 and KOH[J]. Chemical Engineering Journal, 232(9): 582–590.
|
Gautam R K, Mudhoo A, Lofrano G, et al. 2013. Biomass-derived biosorbents for metal ions sequestration:adsorbent modification and activation methods and adsorbent regeneration[J]. Journal of Environmental Chemical, 2(1): 239–259.
|
Guivar J A R, Sanches E A, Bruns F, et al. 2016. Vacancy ordered γ-Fe2O3 nanoparticles functionalized with nanohydroxyapatite:XRD, FTIR, TEM, XPS and Mössbauer studies[J]. Applied Surface Science, 389: 721–734.
DOI:10.1016/j.apsusc.2016.07.157
|
黄明, 李绍峰, 鲁秀国, 等. 2016. 磁性高岭土的制备及对铅离子的吸附[J]. 环境工程学报, 2016, 10(11): 6439–6445.
DOI:10.12030/j.cjee.201506169 |
Inyang M I, Gao B, Yao Y, et al. 2016. A review of biochar as a low-cost adsorbent for aqueous heavy metal removal[J]. Critical Reviews in Environmental Science & Technology, 46(4): 406–433.
|
Inyang M, Gao B, Zimmerman A, et al. 2014. Synthesis, characterization, and dye sorption ability of carbon nanotube biochar nanocomposites[J]. Chemical Engineering Journal, 236: 39–46.
DOI:10.1016/j.cej.2013.09.074
|
金兰淑, 高湘骐, 刘洋, 等. 2012. 4A沸石对复合污染水体中Pb2+、Cu2+和Cd2+的去除[J]. 环境工程学报, 2012, 6(5): 1599–1603.
|
Javanbakht V, Ghoreishi S M, Habibi N, et al. 2016. A novel magnetic chitosan/clinoptilolite/magnetite nanocomposite for highly efficient removal of Pb(Ⅱ) ions from aqueous solution[J]. Powder Technology, 302: 372–383.
DOI:10.1016/j.powtec.2016.08.069
|
Liao D, Wei Z, Li X, et al. 2010. Removal of lead(Ⅱ) from aqueous solutions using carbonate hydroxyapatite extracted from eggshell waste[J]. Journal of Hazardous Materials, 177(1): 126.
|
李瑞月, 陈德, 李恋卿, 等. 2015. 不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J]. 农业环境科学学报, 2015, 34(5): 1001–1008.
|
隆佳.2014.羟基磷灰石中空微球及其与Fe3O4磁性复合材料的可控制备与吸附性能研究[D].青岛: 青岛科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10426-1015542113.htm |
马春芳, 施洋, 刘建平, 等. 2015. 硫酸改性甘草废渣生物吸附剂对Pb2+的吸附[J]. 高校化学工程学报, 2015, 29(3): 716–723.
|
Mohan D, Kumar H, Sarswat A, et al. 2014. Cadmium and lead remediation using magnetic oak wood and oak fast pyrolysis bio-chars[J]. Chemical Engineering Journal, 236: 513–528.
DOI:10.1016/j.cej.2013.09.057
|
Moheb A, Googerdchian F, Emadi R, et al. 2015. Lead sorption properties of nanohtdroxyapatite-alginate composite adsorbents[J]. Chemical Engineering Journal, 201(16): 471–479.
|
Mousa S M, Ammar N S, Ibrahim H A, et al. 2016. Removal of lead ions using hydroxyapatite nano-material prepared from phosphogypsum waste[J]. Journal of Saudi Chemical Society, 20(3): 357–365.
DOI:10.1016/j.jscs.2014.12.006
|
Muliwa A M, Leswifi T Y, Onyango M S, et al. 2016. Magnetic adsorption separation(MAS) process:an alternative method of extracting Cr(Ⅵ) from aqueous solution using polypyrrole coated Fe3O4 nanocomposites[J]. Separation and Purification Technology, 158: 250–258.
DOI:10.1016/j.seppur.2015.12.021
|
Oh C, Han Y S, Park J H, et al. 2016. Field application of selective precipitation for recovering Cu2+ and Zn2+ in drainage discharged from an operating mine[J]. Science of the Total Environment, 557: 212–220.
|
Parmar A, Nema P K, Agarwal T, et al. 2014. Biochar production from agro-food industry residues:a sustainable approach for soil and environmental management[J]. Current Science, 107(25): 1673–1682.
|
Rao M, Ramesh A, Rao P, et al. 2006. Removal of copper and cadmium from the aqueous solutions by activated carbon derived from Ceiba pentandra hulls[J]. Journal of Hazardous Materials, 37: 22–31.
|
Reyesgasga J, Martínezpiñeiro L, Rodríguezálvarez G, et al. 2013. XRD and FTIR crystallinity indices in sound human tooth enamel and synthetic hydroxyapatite[J]. Materials Science& Engineering C Materials for Biological Applications, 33(8): 4568.
|
Rivas B L, Urbano B, Pooley S A, et al. 2012. Mercury and lead sorption properties of poly(ethylene mine) coated onto silica gel[J]. Polymer Bulletin, 68: 1577–1588.
DOI:10.1007/s00289-011-0636-3
|
Saleh T A, Gupta V K. 2012. Column with CNT/magnesium oxide composite for lead (Ⅱ) removal from water[J]. Environmental Science and Pollution Research International, 19: 1224–1228.
DOI:10.1007/s11356-011-0670-6
|
Shinzato M C, Montanheiro T J, Janasi V A, et al. 2012. Removal of Pb2+ from aqueous solutions using two Brazilian rocks containing zeolites[J]. Environmental Earth Sciences, 66: 363–370.
DOI:10.1007/s12665-011-1245-z
|
Sitko R, Zawisza B, Malicka E, et al. Modification of carbon nanotubes for preconcentration, separation and deternimation of trace-meral ions[J]. Trac Trends in Analytical Chemisty, 37: 22–31.
|
Song Z G, Lian F, Yu Z H, et al. 2014. Synthesis and characterization of a novel MnOx-loaded biochar and its adsorption properties for Cu2+ in aqueous solution[J]. Chemical Engineering Journal, 242: 36–42.
DOI:10.1016/j.cej.2013.12.061
|
Sun R, Chen K, Xu L, et al. 2013. Preparation and characterization of hydroxyapatite/gamma-Fe2O3 hybrid; nanostructur[J]. Journal Wuhan University of Technology Materials Science Edition, 28(2): 215–219.
DOI:10.1007/s11595-013-0667-8
|
Tan P, Sun J, Hu Y, et al. 2015. Adsorption of Cu2+, Cd2+, and Ni2+ from aqueous single metal solutions on graphene oxide membranes[J]. Journal of Hazardous Materials, 297: 251–260.
DOI:10.1016/j.jhazmat.2015.04.068
|
Wang X S, Tang Y P, Tao S R, et al. 2008. Removal of Cr (VI) from aqueous solutions by the nonliving biomass of Alligator weed:kinetics and equilibrium[J]. Adsorption-journal of the International Adsorption Society, 14(6): 823–830.
DOI:10.1007/s10450-008-9145-6
|
Wei Q, Lu J, Ai H, et al. 2012. Novel method for the fabrication of multiscale structure collagen/hydroxyapatite-microsphere composites based on CaCO3 microparticle templates[J]. Materials Letters, 80: 91–94.
DOI:10.1016/j.matlet.2012.04.069
|
王彬斌, 林景东, 万顺利, 等. 2017. 氧化镁基生物质炭高效去除水体中磷的特性[J]. 环境科学, 2017, 38(7): 2859–2867.
|
徐楠楠, 林大松, 徐应明, 等. 2014. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报, 2014, 33(5): 958–964.
|
杨宏孝, 颜秀茹, 崔建中, 等. 2010. 无机化学(第四版)[M]. 北京: 高等教育出版社.
|
Yang H H, Liu Q, Sylvie M, et al. 2015. Hierarchically-organized, well-dispersed hydroxyapatite-coated magnetic carbon with combined organics and inorganis removel properties[J]. Chemical Engineering Journal, 275: 152–159.
DOI:10.1016/j.cej.2015.04.026
|
Yang Z, Fang Z, Zheng L, et al. 2016. Remediation of lead contaminated soil by biochar-supported nano-hydroxyapatite[J]. Ecotoxicology & Environmental Safety, 132: 224.
|
Ya ng, Wang Y P, Sun X, et al. 2014. Optimizing production of hydroxyapatite from alkaline residue for removal of Pb2+ from wastewater[J]. Applied Surface Science, 317: 946–954.
DOI:10.1016/j.apsusc.2014.09.016
|
Yuan J H, Xu R K, Zhang H, et al. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3): 3488.
DOI:10.1016/j.biortech.2010.11.018
|
Zhang M, Gao B, Yao Y, et al. 2012. Synthesis, characterization, and environmental implications of grapheme-coated biochar[J]. The Science of the Total Environment, 435/436: 567–572.
DOI:10.1016/j.scitotenv.2012.07.038
|
Zhang Z Z, Li M Y, Chen W, et al. 2010. Immobilization of lead and cadmium from aqueous solution and contaminated sediment using nano-hydroxyapatite[J]. Environmental Pollution, 158(2): 514.
DOI:10.1016/j.envpol.2009.08.024
|
Zhao F, Tang Z, Zhao D, et al. 2014. Adsorption kinetics, isotherms and mechanisms of Cd(Ⅱ), Pb(Ⅱ), Co(Ⅱ) and Ni(Ⅱ) by a modified magnetic polylamide microcomposite adsorbent[J]. Journal of Water Process Engineering, 4(4): 47–57.
|
张晓蕾, 陈静, 韩京龙, 等. 2013. 壳核结构Fe3O4/MnO2磁性吸附剂的制备、表征及铅去除研究[J]. 环境科学学报, 2013, 33(10): 2730–2736.
|
 2018, Vol. 38
2018, Vol. 38


