由于具有矿化彻底、高效且可无选择性降解有机物的优势, 以TiO2为代表的多相光催化技术成为目前处理高毒性、低浓度有机物最具潜力的高级氧化技术之一(莫壮洪等, 2016; Wang et al., 2017; Cui et al., 2017).但TiO2多相光催化技术应用过程中还存在如下问题:首先TiO2的粒子粒径越小其光催化活性越高, 尤其当TiO2粒子粒径在10 nm以下时, 其光催化活性最优异(Pang et al., 2013).如此小粒径的粒子具有极大的表面能, 在制备和使用过程中极易团聚使其光催化性能降低甚至丧失(Chen et al., 2012).几十年来, 即使科研人员进行了大量研究工作也难以获得稳定高效且具有工业化前景的TiO2光催化剂.目前, 最成功的工业化TiO2纳米材料为德固赛公司的P25光催化剂.虽然P25光催化剂的平均粒子粒径在25 nm左右, 但其混晶结构(~80%锐钛矿晶型和~20%金红石晶型)形成的载流子捕获中心, 可以非常有效地分离光生电子和空穴, 从而获得稳定高效的光催化活性(Mino et al., 2016; Xu et al., 2017).
但单一TiO2纳米粒子的能带带隙较宽(锐钛矿TiO2约为3.2 eV, 金红石TiO2约为3.0 eV), 仅能被紫外光激发光降解污染物, 而实际环境体系中能利用的光源大多属于可见光(Pan et al., 2015; Dong et al., 2016).关于TiO2可见光响应的拓展已有大量研究, 如非金属元素掺杂(Fang et al., 2017)、窄带隙半导体耦合(Nolan et al., 2012)及贵金属沉积(Yurdakal et al., 2016; Linic et al., 2011)等, 并取得了非常显著的成果.其中, 贵金属沉积能在TiO2表面引入晶格交错结构, 并形成表面等离子体共振(SPR)效应, 因而成为制备可见光驱动高性能光催化剂的热点方向之一.由于具有高稳定性、低毒及低成本的优势, Ag成为研究最广泛的贵金属粒子之一.目前, Ag-TiO2复合材料已被应用于可见光下降解有机染料、水解制氢及二氧化碳还原等领域, 这些研究发现, 除了TiO2的形貌, Ag粒子粒径也是提升SPR效应和可见光催化活性的关键因素(Linic et al., 2011; Grabowska et al., 2013; Yu et al., 2016; Tobaldi et al., 2016).当Ag粒子粒径小于10 nm(量子尺寸)时, 其构建的复合材料表现出优异的可见光催化性能.因此, 如何在制备和应用过程中保持复合催化剂中量子尺寸Ag粒子的稳定性, 成为Ag-TiO2复合催化剂推广的难点.另外, 针对负载型催化剂, 如何将Ag粒子沉积在其活性组分TiO2上而不是载体上, 也是复合催化剂设计所面临的难以解决的问题.在前期工作基础上(许智勇等, 2017), 本课题组通过Ag粒子沉积来拓展负载于还原石墨烯表面的TiO2的可见光响应, 发现难以保证Ag纳米粒子与TiO2的有效结合, 得到的催化剂没有可见光响应.
全球化亟待解决的环境问题的出现也给光催化剂的开发提出了全新要求, 如海洋中多种低浓度酚类等有机污染物的长期相互作用, 导致人们已在多个深海海域中甚至深海鱼体内都发现了其产物强致癌物多环芳烃的存在(邓敏杰等, 2017; 卢冰等, 2005).海水中有机污染具有毒性较高、浓度非常低的特点, 而多相光催化技术非常适合去除该体系中的有机物.另外, 多相光催化技术也适用于深度处理盐浓度10%以上的高盐废水, 可从源头上减轻危险固体废弃物的排放压力.但海水或高盐废水中都有大量的盐离子, 这不仅会干扰光催化过程, 同时也会导致光催化剂的腐蚀和不稳定(Shaban et al., 2016; Li et al., 2016).因此, 要将多相光催化技术应用于高盐废水中有机物的降解, 就要求催化剂在具有稳定结构的同时, 还必须具有非常高的催化活性以避免盐离子的干扰.基于此, 本文在前期工作(Wang et al., 2008; 2010)的基础上, 提出以商用P25为载体, 通过吸附相反应技术在其表面沉积量子尺寸的Ag纳米粒子.一方面通过SPR效应和P25混晶结构来保证复合催化剂高效的可见光降解活性;另一方面, 利用吸附相反应技术得到的复合催化剂中Ag粒子与载体TiO2之间的强结合作用, 在制备和应用过程中可保障复合催化剂的稳定性.
2 实验部分(Materials and methods) 2.1 试剂与仪器试剂:商用光催化剂TiO2 (P25, 平均粒径为25 nm, 比表面积为50 m2·g-1)购自德国Degussa公司;钛酸丁酯(化学纯)购自国药集团化学试剂有限公司;无水乙醇、苯酚、硝酸银和氢氧化钠均为分析纯, 购自国药集团化学试剂有限公司.
样品的XRD分析在日本Rigaku公司的D/max-rA转靶X射线多晶衍射仪上进行, 采用Cu Kα(λ=0.15406 nm), 功率为1600 W(40 kV×40 mA).样品的高分辨透射电子显微镜(HRTEM)分析在美国FEI公司的FEI-Tecnai-G20上进行.样品的X射线光电子能谱(XPS)分析在Thermo ESCALAB 250X射线光电子能谱(XPS)仪上进行.X射线激发源:单色Al Kα(hv =1486.6 eV), 功率150 W, X射线束斑500 μm能量分析器固定透过能为30 eV.
利用公式XA=1/(1+IR/(K·IA))计算锐钛矿相的质量分数, 其中, XA为锐钛矿相的质量分数, IA为锐钛矿相的最强衍射峰(101晶面)强度, IR为金红石相的最强衍射峰(110晶面)强度, K为常数.
2.2 吸附相反应技术制备Ag-TiO2催化剂以亲水的P25粉末作为载体, 利用吸附相反应技术制备Ag纳米粒子的详细过程参见前期工作(Wang et al., 2008; 2010).将200 mL无水乙醇、1.5 mL去离子水和不同量的NaOH(加入量见表 1)置于三口烧瓶中形成均匀体系后, 加入0.5 g P25粉末, 在30 ℃下搅拌吸附直至平衡(5 h).另取不同量硝酸银(加入量见表 1)溶解于50 mL乙醇中, 而后将该乙醇溶液滴加到已经达到吸附平衡的体系中, 滴加速度为5 mL·min-1.Ag+通过扩散作用到达P25表面富含NaOH的吸附水层中反应首先生成Ag2O粒子, 而后被乙醇还原生成Ag纳米粒子.反应5 h后离心分离, 得到不同的Ag-TiO2复合光催化剂.
| 表 1 吸附相反应制备Ag-TiO2过程中AgNO3和NaOH的加入量 Table 1 Addition contents of AgNO3 and NaOH in preparation of Ag-TiO2 via ANS |
为了减少实验过程误差, 本文中根据文献和前期工作(Yamada et al., 2013; 许智勇等, 2017)配置模拟海水, 其组分为:2.5%NaCl、1.1%MgCl2、0.40%Na2SO4、0.16%CaCl2.光降解实验详细操作过程参见前期工作(许智勇等, 2017).本文利用氙灯(配有滤光片过滤波长小于400 nm和大于700 nm的光, 100 W)作为可见光激发光源.另外, 10%NaCl溶液、10%Na2SO4溶液和20%Na2SO4溶液3种溶液作为高含盐水体系.
称取0.5 g制备的复合光催化剂, 均匀混合于800 mL含苯酚的模拟海水溶液或高盐水体系(苯酚浓度为10 mg·L-1), 置于带磁力搅拌的反应器中, 控制水浴温度为30 ℃, 吸附0.5 h.吸附平衡后, 在可见光源照射下, 每隔0.5 h进行取样.离心分离, 取上层清液, 利用可见光分光光度仪(4-氨基安替比林分光光度法, 测定波长510 nm) (Norwitz et al., 1981)测定苯酚的吸光度并求出其浓度变化(反应5 h).通过空白实验发现, 无催化剂加入时, 仅在可见光照射下海水中苯酚不会发生降解.
3 结果和讨论(Results and discussion) 3.1 P25表面吸附水和NaOH的过程测定首先测定吸附过程乙醇体相中水含量的变化, 来验证P25表面对水的选择性吸附性能.测定步骤参考以SiO2为载体的前期工作(Wang et al., 2008; 2010), 通过带热导检测器的气相色谱进行测定, 水含量变化曲线见图 1.可以看出, 当吸附时间超过200 min时, 体相中的水含量就不再发生变化, 即吸附体系达到了平衡.从图 1还可知, 吸附平衡后体相中水含量从1.95%减少至1.04%, 也就是吸附于P25表面的水为0.075 mL, 体系中0.50 g的P25比表面积为25 m2·g-1.如果吸附水层全部由水组成, 其厚度约为0.3 nm, 考虑到吸附层中也有乙醇存在, 估算P25表面的吸附水层厚度在0.5~1.0 nm之间, 这与前期以SiO2为载体的研究工作结果一致(Wang et al., 2010).
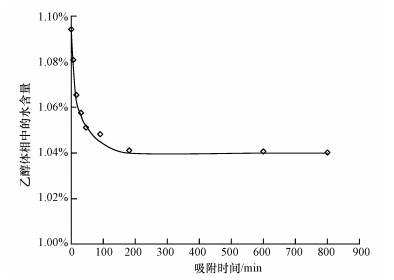 |
| 图 1 乙醇体相中水含量随吸附时间的变化曲线 Fig. 1 Dependences of mass percent of water in the alcohol bulk on adsorption time |
在此基础上, 测定了不同条件下乙醇体相中NaOH含量的变化, 在不同吸附时间取样, 离心分离后取上层清液5 mL与等体积的水进行混合, 搅拌均匀后测量其电导率(Wang et al., 2008; 2010).根据电导率与NaOH浓度的标准曲线, 得到上层清液中残余NaOH的含量, 结果如图 2所示.可以看出, NaOH加入量较少(低于17.39 mg)时, 200 min之后乙醇体相中NaOH含量不再发生变化, 说明此时也达到了吸附平衡, 这与P25表面吸附水的平衡时间一致.达到吸附平衡时P25表面的NaOH量都在20%以上, 而吸附水层厚度仅为0.5~1.0 nm.因此, 吸附水层中NaOH浓度远高于乙醇体相, 从而表面吸附层能够满足纳米反应器的条件.当NaOH加入量超过17.39 mg时, 两条含量变化曲线都呈现开始迅速下降但难以达到平衡的特点, 即使吸附了20 h曲线仍在缓慢下降.这是因为较大量NaOH加入后, 首先迅速被P25表面吸附, 但吸附水层中NaOH浓度过高会与TiO2发生缓慢的腐蚀反应, 因而NaOH含量曲线一直呈缓慢下降的趋势.
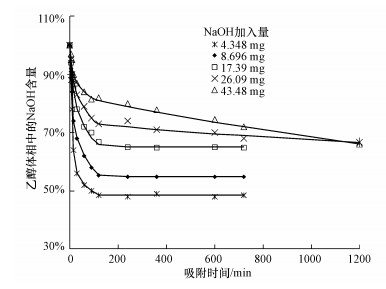 |
| 图 2 不同条件下乙醇体相中NaOH含量随吸附时间的变化曲线 Fig. 2 Dependences of mass percent of NaOH in the alcohol bulk on adsorption time |
利用紫外-可见分光光度计对反应过程进行全波段紫外可见光谱扫描分析, 从AgNO3的乙醇溶液滴加完成(10 min)后开始取样, 离心分离乙醇体相测定其光谱图, 结果如图 3所示.可以看出, 各个紫外吸收图谱中均出现了Ag+的吸收峰(218 nm左右), 而且随着反应时间增加Ag+吸收峰显著减少.当Ag加入量小于3.0%时, 在120 min后Ag+的吸收峰就消失了, 说明此时Ag+全部反应完成.而当Ag加入量在3.0%以上时, 由于高浓度NaOH与TiO2之间的反应导致少量NaOH损失, 从而使得部分Ag+不能与NaOH反应, 因而图 3c显示反应240 min之后乙醇体系中还存在微弱的Ag+吸收峰, 说明有极少量Ag+没有反应完.
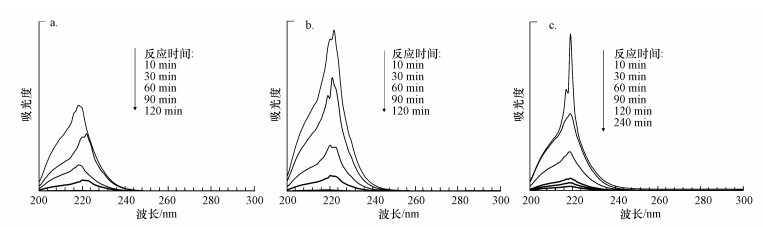 |
| 图 3 不同条件下反应体系的全波段扫描紫外光谱图(a. Ag加入量0.5%, b. Ag加入量2.0%, c. Ag加入量3.0%) Fig. 3 Evolution of UV-Vis adsorption spectra of system with reaction time under different condition |
各个催化剂的Ag3d的XPS图谱(图 4a)中仅出现了对应着Ag的Ag3d3/2和Ag3d5/2的两个信号峰, 而且Ag3d3/2和Ag3d5/2之间的间距为6 eV, 与标准的Ag3d3/2和Ag3d5/2能谱峰间距一致, 说明各个催化剂中的Ag都是以单质Ag的形式存在(Yu et al., 2010).对比还发现, 5.0-Ag-P25催化剂图谱中Ag3d3/2和Ag3d5/2的两个信号峰向低结合能方向轻微移动, 这说明5.0-Ag-P25催化剂中Ag纳米粒子与其他催化剂的形貌可能有一定差异, 这验证了该条件下Ag+反应过程与其他催化剂不同的结论.图 4b是催化剂中Ti2p的XPS图谱, 可以看出各个催化剂的图谱中都存在结合能以459.5 eV和465.2 eV为中心的两个信号峰, 它们分别归因于Ti4+化学价态的Ti2p3/2和Ti2p1/2(Kaspar et al., 2010).对比各个图谱还发现, Ag沉积后Ti2p峰的强度基本不变, 但其峰位随掺杂量的改变而呈现向低结合能方向轻微移动的趋势, 这可能归因于Ag在TiO2表面沉积后对Ti周边电子状态的影响.
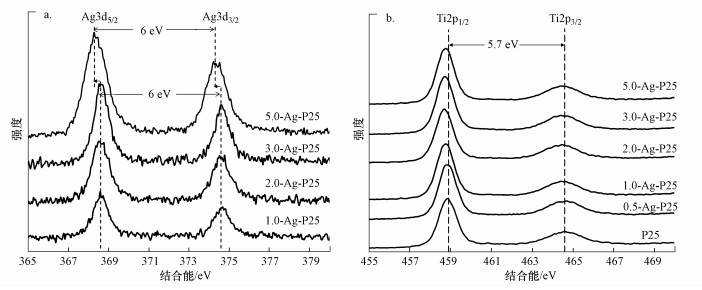 |
| 图 4 不同催化剂中Ag3d(a)及Ti2p(b)的XPS图谱 Fig. 4 High-resolution XPS spectra of Ag3d(a) and Ti2p(b) in different Ag-TiO2 catalysts |
各个催化剂的TEM照片(图 5)中的黑点对应于Ag粒子的形貌(如箭头所示).由于表面吸附层作为纳米反应器和粒子生长场所, 因而生成的Ag粒子粒径要小于10 nm, 并且均匀紧密地分布在TiO2表面上, 这与前期工作的结果一致(Wang et al., 2008; 2010).随着Ag加入量的增加, 吸附水层中反应物浓度增加, 更多小粒径的Ag粒子生成, 因而TiO2表面Ag粒子的黑点也增多.但当Ag加入量增至5.0%时, 催化剂中还出现了很明显的大粒子, 这是因为过多的NaOH在乙醇体相中时, 乙醇在碱性条件下会直接还原Ag+生成Ag粒子.由于没有吸附水层的限制, 乙醇体相中生成的Ag粒子粒径较大(Wang et al., 2008).
 |
| 图 5 不同催化剂的TEM照片(a.P25, b.1.0-Ag-P25, c.2.0-Ag-P25, d.5.0-Ag-P25) Fig. 5 TEM images of different Ag-TiO2 catalysts(a.P25, b.1.0-Ag-P25, c.2.0-Ag-P25, d.5.0-Ag-P25) |
各个催化剂的HRTEM照片(图 6)更清晰地显示, 吸附层中形成的Ag粒子与TiO2表面结合的非常紧密, 这让部分Ag与TiO2晶格结构发生交错而产生晶格畸变和异质结结构.随着TiO2表面Ag粒子数量增多, 在催化剂中引入的异质结和晶格畸变结构也越来越多.而5.0-Ag-P25催化剂的HRTEM照片显示, TiO2表面的晶格条纹变得非常模糊, 呈无定形的特征.这是由于过量NaOH对TiO2表面的腐蚀作用, 破坏了其表面有序的晶格状态.
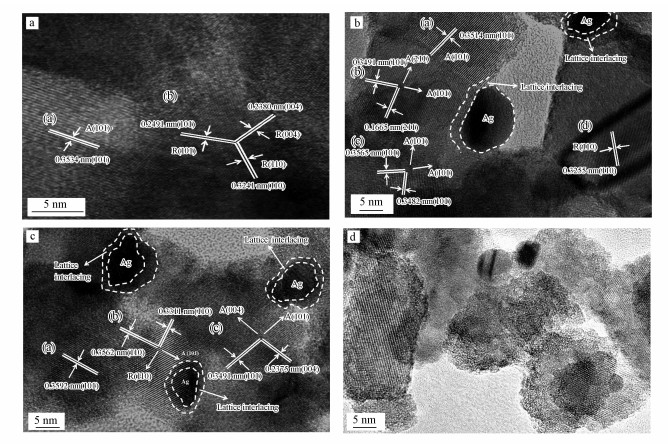 |
| 图 6 不同Ag-TiO2催化剂的HRTEM照片(a.P25, b.1.0-Ag-P25, c.2.0-Ag-P25, d.5.0-Ag-P25) Fig. 6 HRTEM images of different Ag-TiO2 catalysts(a.P25, b.1.0-Ag-P25, c.2.0-Ag-P25, d.5.0-Ag-P25) |
图 7显示, 各个催化剂在2θ=45°左右都出现了微弱的结晶峰, 它归属于Ag单质晶体结构中的200晶面(标准卡JCPDS #00-001-1164), 进一步说明了Ag纳米粒子的生成.该结晶峰强度较弱则是因为Ag的掺杂量相对较少, 在XRD分析中响应值不高的缘故.除此之外, 催化剂中的其他峰都对应TiO2的锐钛矿型(标准卡JCPDS No.21-1272)和金红石型(标准卡JCPDS No.21-1276)的各个晶面的衍射峰.为了更深入地探索Ag沉积对TiO2晶型微结构的影响, 本文利用JADE5.0软件计算得到了各个催化剂中TiO2两种晶型的比例、锐钛矿TiO2的晶粒粒径及锐钛矿101晶面(衍射角约25.8°)的晶格条纹间距d, 结果如表 2所示.
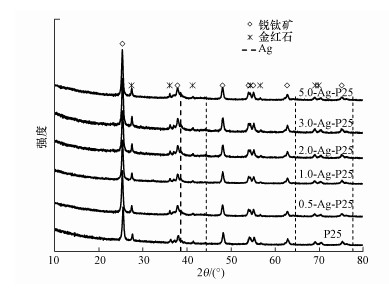 |
| 图 7 P25和不同Ag-TiO2催化剂的XRD图谱 Fig. 7 XRD patterns of P25和different Ag-TiO2 composite catalysts |
| 表 2 各个催化剂中TiO2锐钛矿晶型含量、晶粒粒径及晶格条纹间距 Table 2 Ratio of anatase and rutile TiO2, the grain size and the lattice fringe spacing (d) of anatase TiO2 |
从表 2可以看出, Ag沉积对TiO2两种晶型的比例和晶粒粒径的影响都不大, 仅由于高浓度NaOH对TiO2的表面腐蚀, 严重破坏了晶格结构而产生差异.但Ag沉积后锐钛矿TiO2(101)的晶格条纹间距(d)有少许增加, 说明催化剂中产生了晶格畸变结构, 这与HRTEM的结论一致.
3.4 不同Ag-TiO2催化剂的性能 3.4.1 催化剂的紫外可见漫反射光谱分析图 8a和8b是紫外漫反射光谱及其得到的(αhν)1/2与光子能量关系图.从图中可以看出, Ag沉积后与TiO2表面紧密结合, 产生表面等离子体共振(SPR)效应, 使复合催化剂能够捕获可见光光子, 显著拓展了其可见光响应(Linic et al., 2011; Yu et al., 2016).更多Ag粒子沉积后, 复合催化剂中引入更多的Ag-TiO2晶格交错结构, 从而形成更强的SPR效应, 催化剂的带隙能从3.00 eV一直降低到2.54 eV.本文进一步利用XPS分析了P25和2.0-Ag-P25催化剂的价带谱图, 并通过处理得到了其价带能, 结果如图 8c所示.当Ag沉积于TiO2表面时, 催化剂的价带能从2.85 eV降低至2.37 eV.这再次说明Ag沉积之后的复合催化剂具有可见光响应.
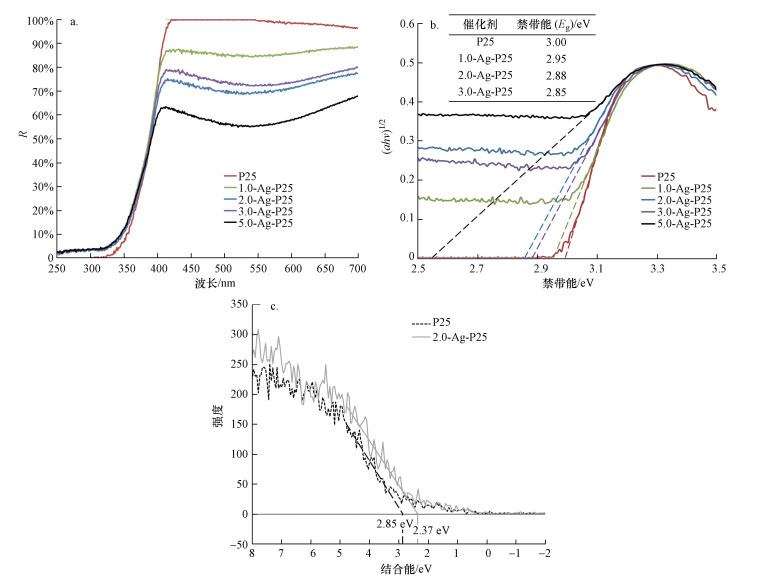 |
| 图 8 Ag沉积对催化剂禁带能的影响(a.紫外漫反射光谱, b.对应得到的(αhν)1/2与光子能量关系图, c.价带XPS图谱) Fig. 8 The effect of Ag deposition on the band gaps of different catalysts |
图 9是在可见光激发下各个催化剂光降解海水中苯酚的曲线.作为对比, 本文利用物理混合制备了Ag-P25(2.0% Ag含量)催化剂, 并在同样条件下得到了其光降解海水中苯酚曲线.可以看出, 各个催化剂对苯酚的吸附能力都较弱但吸附速率较快, 所有催化剂在10 min左右就可以达到吸附平衡.除P25之外, 物理混合形成的Ag-P25在可见光照射下也不能降解苯酚, 两者降解曲线呈现一条直线.这是因为仅通过缺乏载体保护的Ag粒子非常容易团聚生成大粒子(Wang et al., 2008), 仅物理混合与TiO2之间也几乎不产生结合作用, 因而无法形成SPR效应, 不具有可见光响应.吸附相反应技术沉积Ag纳米粒子后拓展了复合催化剂的可见光响应, 所有Ag-TiO2催化剂对海水中苯酚都具有较好的降解效果, 说明催化剂都在一定程度上克服了海水中盐离子的干扰(Shaban et al., 2016; Li et al., 2016; 许智勇等, 2017).各个催化剂光降解苯酚过程都遵循一级反应动力学, 这与文献中的结果一致(Grabowska et al., 2012).
 |
| 图 9 可见光激发下不同催化剂对海水中苯酚的光降解曲线 Fig. 9 Photodegradation for phenol in seawater using different composite catalysts under visible light irradiation |
表 3列出了各个催化剂光降解反应的一级反应速率常数和2 h的去除率.可以看出, 随着Ag沉积量的增加, 催化剂的可见光活性先增加后略有减弱.2.0-Ag-P25催化剂的可见光降解活性最高, 2 h去除率约为80%左右, 光降解反应速率常数达到了0.01317 min-1.其可见光下的催化活性接近或优于部分可见光降解纯水中苯酚研究中的催化剂活性(Xu et al., 2016; Grabowska et al., 2012), 甚至与紫外光激发下P25降解海水中苯酚活性接近(许智勇等, 2017).催化剂表面量子尺寸Ag数目增加提升了Ag与TiO2之间的SPR效应, 导致催化剂的可见光响应增强且载流子分离效率提高.因此, 复合催化剂的可见光催化活性增强.而当Ag沉积量在5.0%时, 光催化活性的下降是由于高浓度的NaOH腐蚀TiO2部分表面及大粒子Ag生成都削弱了Ag与TiO2之间的SPR效应.
| 表 3 不同催化剂降解海水中苯酚的反应速率常数和去除率 Table 3 The photodegradation rate constants and removal rate of phenol in seawater by different catalysts |
光催化剂的稳定性是将光催化剂推向实际应用的关键因素, 尤其是在海水体系中有大量无机离子干扰的情况下.本文选择具有最佳催化活性的2.0-Ag-P25光催化剂, 通过3次重复光降解苯酚(每次催化剂粉末都用去离子水洗涤并在下一次测试前干燥)来考察复合催化剂的稳定性.在相同条件下在海水中重复3次光降解苯酚的实验中, 发现该催化剂几乎没有活性损失(图 10), 说明本文得到的Ag-TiO2光催化剂具有良好的稳定性和可重复使用性.这归因于P25本身的稳定性和吸附相反应技术得到的复合催化剂形貌的稳定性.图 11为3次重复实验之后催化剂的TEM形貌照片, 可以看出, 无论是载体TiO2粒子还是其表面Ag粒子形貌都没有明显变化, 本文进一步利用XPS分析重复光降解实验前后催化剂中的Ag3d, 发现催化剂中的Ag量没有明显变化, 而且都以Ag单质形式存在.
 |
| 图 10 催化剂2.0-Ag-P25降解海水中苯酚的3次重复实验 Fig. 10 The photodegradation for phenol in seawater for three cycles using 2.0-Ag-P25 catalyst |
 |
| 图 11 3次重复光降解实验后催化剂2.0-Ag-P25的TEM照片 Fig. 11 TEM image of 2.0-Ag-P25 catalyst after photodegradation for three cycles |
为了进一步拓展Ag-P25催化剂处理含盐废水的应用, 本文进一步研究了2.0-Ag-P25催化剂在可见光激发下分别降解纯水、3.5%NaCl溶液、10% NaCl溶液、10% Na2SO4溶液和20% Na2SO4溶液5种体系中的苯酚, 其降解曲线如图 12所示.
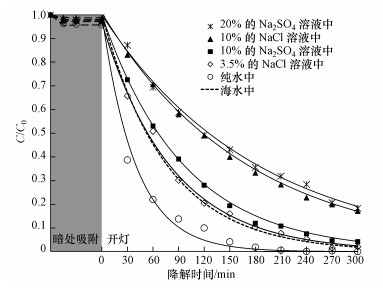 |
| 图 12 可见光激发下2.0-Ag-P25催化剂降解各种水体系中苯酚的光降解曲线 Fig. 12 Photodegradation for phenol in different wastewater using 2.0-Ag-P25 catalyst under visible light irradiation |
图 12中光降解曲线显示, 在含盐废水中催化剂活性都要弱于纯水中的光催化活性, 这是由于盐离子的干扰而引起的.对比各个高盐水体系中的降解曲线还发现, 不同盐离子种类(包括阴阳离子)对光催化降解过程的影响较小, 这可能是因为高含盐水体系中盐离子浓度都较高, 不同离子种类的影响并不显著.而体系中盐离子物质的量浓度(数量)是影响可见光下催化剂光降解苯酚过程的主要因素.
进一步将各个水体系中盐离子物质的量浓度和苯酚的光降解反应速率常数列于表 4.表中的数据再次说明了在高含盐废水体系中, 盐离子浓度对苯酚光降解反应速率的关键影响.4个含盐废水体系中模拟海水的盐离子数量最少(Mg2+、Na+、Ca2+、Cl-、SO42-分别为0.0541、0.484、0.0144、0.565、0.0282 mol·L-1), 催化剂在该体系中的降解活性也最高.
| 表 4 不同水体系中盐离子物质的量浓度和对应体系的苯酚光降解反应速率常数 Table 4 The salt concentration in different wastewater and the corresponding photodegradation rate constants |
1) 吸附相反应制备过程中, 亲水的TiO2纳米粒子(P25)表面形成了数纳米厚度的吸附层, 同时还可以富集NaOH, 从而使该吸附层成为纳米反应器和Ag粒子生长的场所.具有量子尺寸(10 nm以下粒径)的Ag与TiO2表面紧密相互作用不仅引起Ag与TiO2之间的强表面等离子体共振, 而且还引入了晶格交错结构并引起了TiO2晶体的晶格畸变.等离子共振效应可以捕获大量可见光光子, 从而显著提升复合催化剂的可见光响应, 而催化剂中晶格交错结构和晶格畸变都能提高光降解反应中光生电荷的分离效率, 两者的共同作用提升了催化剂在可见光激发下降解海水中苯酚的光催化活性.性能最佳的Ag-TiO2光催化剂在可见光下的降解活性与前期工作中紫外激发下TiO2其他催化剂的活性相当.
2) 当Ag沉积量达到5.0%时, 高浓度的NaOH会腐蚀TiO2表面, 从而破坏部分TiO2的晶体结构, 而且高浓度NaOH作用下体相中乙醇可以直接还原Ag+生成大粒径的Ag粒子, 从而降低催化剂的可见光降解活性.由于P25本身的稳定性和吸附相反应技术得到Ag粒子的稳定性, 该催化剂降解海水中苯酚的过程中具有较高的稳定性和良好的重复使用性.对于不同的含盐废水体系, 盐离子种类对苯酚的降解过程影响不大, 但盐离子数量是干扰苯酚降解过程的主要因素.盐离子数量越多, 催化剂在可见光下降解苯酚的过程受到的干扰越大.
Chen H H, Nanayakkara C E, Grassian V H. 2012. Titanium dioxide photocatalysis in atmospheric chemistry[J]. Chemical Reviews, 112(11): 5919–5948.
DOI:10.1021/cr3002092
|
Cui Y Q, Ma Q L, Deng X Y, et al. 2017. Fabrication of Ag-Ag2O/reduced TiO2 nanophotocatalyst and its enhanced visible light driven photocatalytic performance for fegradation of diclofenac dolution[J]. Applied Catalysis B Environmenta, 206: 136–145.
DOI:10.1016/j.apcatb.2017.01.014
|
邓敏杰, 陈硕, 全燮, 等. 2017. 天然/模拟海水中2, 4, 6-三溴苯酚的光化学行为研究[J]. 环境科学学报, 2017, 37(9): 3427–3433.
|
Dong C B, Eldawud R, Wagner A, et al. 2016. Hybrid nanocomposites with enhanced visible light photocatalyticability for next generation of clean energy systems[J]. Applied Catalysis A General, 524: 77–84.
DOI:10.1016/j.apcata.2016.06.009
|
Fang W Z, Xing M Y, Zhang J L. 2017. Modifications on reduced titanium dioxide photocatalysts:A review[J]. Journal of Photochemistry & Photobiology C Photochemistry Reviews, 32: 21–39.
|
Grabowska E, Reszczynska J, Zaleska A. 2012. Mechanism of phenol photodegradation in the presence of pure and aodified-TiO2:A review[J]. Water Research, 46(17): 5453–5471.
DOI:10.1016/j.watres.2012.07.048
|
Grabowska E, Zaleska A, Sorgues S, et al. 2013. Modification of titanium (IV) dioxide with small silver nanoparticles:Application in photocatalysis[J]. Journal of Physical Chemistry C, 117(4): 1955–1962.
DOI:10.1021/jp3112183
|
Kaspar T C, Droubay T, Chambers S A, et al. 2010. Spectroscopic evidence for Ag(Ⅲ) in highly oxidized silver films by X-ray photoelectron spectroscopy[J]. Journal of Physical Chemistry C, 114(49): 21562–21571.
DOI:10.1021/jp107914e
|
Li S X, Liang W J, Zheng F Y, et al. 2016. Lysine surface modified Fe3O4@SiO2@TiO2 microspheres-based preconcentration and photocatalysis for in situ selective determination of nanomolar dissolved organic and inorganic phosphorus in seawater[J]. Sensors & Actuators B Chemical, 224: 48–54.
|
Linic S, Christopher P, Ingram D B. 2011. Plasmonic-metal nanostructures for efficient conversion of solar to chemical energy[J]. Nature Materials, 10(12): 911–921.
DOI:10.1038/nmat3151
|
卢冰, 陈荣华, 王自磐, 等. 2005. 北极海洋沉积物中持久性有机污染物分布特征及分子地层学记录的研究[J]. 海洋学报, 2005, 27(4): 167–173.
|
Mino L, Zecchina A, Martra G, et al. 2016. A surface science approach to TiO2 P25 photocatalysis:An in situ FTIR study of phenol photodegradation at controlled water coverages from sub-monolayer to nultilayer[J]. Applied Catalysis B Environmental, 196: 135–141.
DOI:10.1016/j.apcatb.2016.05.029
|
莫壮洪, 黄冬根, 全水清, 等. 2016. RGO/TiO2光催化降解2, 4-二氯苯氧乙酸研究[J]. 环境科学学报, 2016, 36(1): 178–184.
|
Nolan N T, Synnott D W, Seery M K, et al. 2012. Effect of N-doping on the photocatalytic activity of sol-gel TiO2[J]. Journal of Hazardous Materials, 211-212(2): 88–94.
|
Norwitz G, Bardsley A H, Keliher P N. 1981. Determination of phenolin the presence of sulfite (sulfur dioxide) by the 4-aminoantipyrinespectro-photometric method[J]. Analytica Chimica Acta, 128(1): 251–256.
|
Pan Y X, Cong H P, Men Y L, et al. 2015. Peptide self-assembled biofilm with unique electron transfer flexibility for highly efficient visible-light-driven photocatalysis[J]. ACS Nano, 9(11): 11258–11265.
DOI:10.1021/acsnano.5b04884
|
Pang C L, Lindsay R, Thornton G. 2013. Structure of clean and adsorbate-covered single-crystal rutile TiO2 surfaces[J]. Chemical Reviews, 113(6): 3887–3948.
DOI:10.1021/cr300409r
|
Shaban Y A, El Maradny A A, Al Farawati R K. 2016. Photo-catalytic reduction of nitrate in seawater using C/TiO2 nanoparticles[J]. J Photochem Photobiol A, 328: 114–121.
DOI:10.1016/j.jphotochem.2016.05.018
|
Tobaldi D M, Leonardi S G, Pullar R C, et al. 2016. Sensing properties and photochromism of Ag-TiO2 nano-heterostructures[J]. Journal of Materials Chemistry A, 4(24): 9600–9613.
DOI:10.1039/C6TA03760G
|
Wang F F, Ge W, Shen T, et al. 2017. The effect of bulk/surface defects ratio change on the photocatalysis of TiO2 nanosheet film[J]. Applied Surface Science, 410: 513–518.
DOI:10.1016/j.apsusc.2017.03.142
|
Wang T, Jiang X, Mao C W. 2008. Influence of an adsorption layer and its evolvement on the formation of Ag[J]. Langmuir, 24(24): 14042–14047.
DOI:10.1021/la802240c
|
Wang T, Jiang X, Wang J. 2010. Adsorption phase synthesis:Preparation of nanoparticles and the effects of reactant distribution[J]. Journal of Colloid & Interface Science, 350(1): 69–74.
|
Xu Y X, Luo Y J, Qian Q R, et al. 2017. Simple fabrication of BiOCl/Bi/P25 composite with enhanced visible light photocatalytic activity[J]. Optical Materials, 72(10): 691–696.
|
许智勇, 李冰蕊, 潘家豪, 等. 2017. TiO2复合催化剂弱光催化降解模拟海水中苯酚及其催化活性的影响[J]. 环境科学学报, 2017, 37(12): 4593–4601.
|
Yamada N, Suzumura M, Koiwa F, et al. 2013. Differences in elimination efficiencies of Escherichia coli in freshwater and seawater as a result of TiO2 photocatalysis[J]. Water Research, 47(8): 2770–2776.
DOI:10.1016/j.watres.2013.02.023
|
Yu B, Zhou Y, Li P, et al. 2016. Photocatalytic reduction of CO2 over Ag/TiO2 nanocomposites prepared with a simple and rapid silver mirror method[J]. Nanoscale, 8(23): 11870–11874.
DOI:10.1039/C6NR02547A
|
Yu J G, Dai G P, Cheng B. 2010. Effect of crystallization methods on morphology and photocatalytic activity of anodized TiO2 nanotube array films[J]. Journal of Physical Chemistry C, 114(45): 19378–19385.
DOI:10.1021/jp106324x
|
Yurdakal S, Tek B S, Děgirmenci C, et al. 2016. Selective photocatalytic oxidation of aromatic alcohols in solar-irradiated aqueous suspensions of Pt, Au, Pd and Ag loaded TiO2 catalysts[J]. Catalysis Today, 281: 53–59.
|
 2018, Vol. 38
2018, Vol. 38


