2. 长春大学园林学院, 长春 130022;
3. 中国科学院高能物理研究所, 北京 100049
2. College of Landscape Architecture, Changchun University, Changchun 130022;
3. Institute of High Energy Physics, Chinese Academy of Sciences, Beijing 100049
腐殖物质是土壤、沉积物和水体中广泛存在的天然高分子有机化合物, 约占土壤、沉积物有机质的60%~80%和水体溶解性有机质的0.7%~90%(Lipczynska-Kochany, 2018).腐殖物质分子中含有羧基、羟基、羰基等多种活性官能团, 对于环境中污染物质的累积、迁移、转化和生物有效性起着重要的作用(Stevenson, 1994).
按照传统的分组方法, 可将腐殖物质分为胡敏酸、富里酸和胡敏素3个组分, 其中胡敏酸溶于碱但不溶于酸, 富里酸既溶于碱也溶于酸, 而胡敏素既不溶于碱也不溶于酸.从已有的文献来看, 关于腐殖物质的研究主要集中于胡敏酸和富里酸, 针对胡敏素的研究则较少(Hayes et al., 2017).而实际上, 土壤胡敏素占总有机碳的50%以上, 其本身具有的非溶解性使得该组分在环境污染物的累积和固定方面起着关键的作用.以往土壤胡敏素与环境污染物相互作用的研究主要关注了其对于有机污染物的固持作用(张晋京等, 2008).近年的研究发现, 土壤胡敏素对于金属离子的吸附量较低但吸附可逆性较高, 因此, 对于环境中金属离子的行为和归宿也有着重要的影响(Zhang et al., 2013), 这促使人们开始关注土壤胡敏素与金属离子的相互作用关系(Andreas et al., 2014;Jacundino et al., 2015;Wang et al., 2016;王雅辉等, 2017;Zhang et al., 2018).但目前关于土壤胡敏素对金属离子的吸附机理, 仍缺乏深入的分子水平研究.
本研究中, 以暗棕壤为供试土壤, 将经典的批量平衡法与现代分析测试技术(SEM、EDS、FTIR、XPS、EXAFS等)相结合, 探讨胡敏素对Cu2+的吸附作用及其微观机理, 为阐明Cu2+在土壤环境中的累积、迁移和转化过程及Cu2+污染土壤的修复提供理论依据.
2 材料与方法(Materials and methods) 2.1 土壤样品供试土壤为暗棕壤, 采自吉林省通化市(41°44′22.6″N, 126°01′19.8″E, 海拔569 m), 采样深度为表层0~20 cm(去除枯枝落叶层).土样经风干后, 过2 mm尼龙筛, 放在密封的塑料袋中保存.该土壤的基本理化性质如下:pH值6.46, 有机碳53.1 g·kg-1, 全氮4.42 g·kg-1, 胡敏素碳38.2 g·kg-1.
2.2 胡敏素的制备胡敏素按Zhang等(2013)的方法进行提取和纯化, 简要步骤如下:土样分别用蒸馏水和稀盐酸(0.05 mol·L-1)去除水浮物和碳酸盐, 然后加入0.1 mol·L-1 NaOH + 0.1 mol·L-1 Na4P2O7混合液反复提取至溶液颜色很淡时为止, 得到的碱不溶物(即粗胡敏素)经10% HF-HCl混合液处理后, 用蒸馏水洗至无Cl-反应(AgNO3检验).将纯化后的胡敏素冻干, 磨细过0.15 mm尼龙筛, 保存在密封的玻璃瓶中.经测定, 所制备胡敏素的C、H、N、S和灰分含量分别为50.1%、3.76%、2.03%、0.20%和16.0%(Zhang et al., 2013).
2.3 吸附试验吸附试验采用批量平衡法, 将胡敏素样品、支持电解质(NaNO3)溶液和金属离子(Cu2+)溶液加入塑料离心管中, 使得吸附体系的固液(m/v)比为1:5、NaNO3浓度为0.01~1.00 mol·L-1、Cu2+浓度为10~100 mg·L-1, 用0.1 mol·L-1 HNO3和0.1 mol·L-1 NaOH调节体系的pH值在2~8之间.将离心管放在恒温水浴振荡器上, 在不同的反应温度(298、308、318 K)和接触时间(5、10、30、60、120、240、360、480、720、1440 min)条件下进行吸附试验.到达规定时间后, 取下离心管并高速(12000 r·min-1)离心, 上清液中Cu2+浓度用TAS-990型原子吸收分光光度计测定;离心管内固体样品经烘干(50 ℃)后, 用于表面形貌、元素分布、官能团组成及Cu2+局域配位结构的测定.
2.4 胡敏素/胡敏素-Cu2+复合物的表征胡敏素及其Cu2+复合物的表面形貌和元素分布用XL-30 ESEM FEG型扫描电子显微镜(SEM)和X-max型X-射线能量色散谱(EDS)仪测定, 表面官能团组成用Vertex 70型傅立叶变换红外光谱(FTIR)仪和Thermo ESCALAB 250型光电子能谱(XPS)仪测定;胡敏素表面吸附态Cu2+的局域配位结构在北京同步辐射装置(BSRF)1W1B光束线的XAFS实验站进行测定, 数据分析采用Demeter 0.9.25软件包.
2.5 数据计算吸附活化参数即活化能(Ea)、活化自由能(ΔG#)、活化焓(ΔH#)和活化熵(ΔS#)按以下公式计算(Chowdhury et al., 2011).
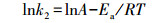
|
(1) |
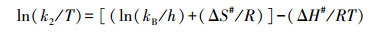
|
(2) |
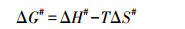
|
(3) |
式中, k2为准二级吸附动力学方程的速率常数, T为反应温度, A、R、kB和h分别为Arrhenius常数、普适气体常数、Boltzman常数和Plank常数.根据lnk2-1/T线性图的斜率, 可得到Ea值;根据ln(k2/T)-1/T线性图的斜率和截距, 可分别得到ΔH#和ΔS#值.
吸附热力学参数即标准Gibbs自由能变(ΔG°)、标准焓变(ΔH°)和标准熵变(ΔS°)按以下公式计算(Won et al., 2006).
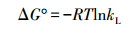
|
(4) |
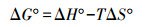
|
(5) |
式中, R为理想气体常数, T为反应温度, kL为Langmuir常数.根据ΔG°-T线性图的斜率和截距, 可分别得到ΔH°和ΔS°值.
3 结果与讨论(Results and discussion) 3.1 土壤胡敏素对Cu2+的吸附作用 3.1.1 pH值和离子强度的影响由图 1a可知, 吸附Cu2+之后, 体系的最终pH值较初始pH值有所降低, 说明吸附过程伴随着氢离子(H+)的释放, 即Cu2+在胡敏素表面的吸附包含离子交换作用.在供试pH范围内(2~8), 随体系pH值的增加, 胡敏素对Cu2+的吸附量逐渐增加.低pH(pH < 3)条件下, 溶液中H+的浓度较高, 其对于胡敏素表面活性吸附点位的强烈竞争作用导致Cu2+的吸附量较低(Jacundino et al., 2015).随pH值的增加(pH 3~7), 溶液中H+浓度逐渐降低, 其对于Cu2+的竞争吸附作用减弱;同时, 胡敏素表面官能团(如羧基)的解离作用逐渐增强, 使得表面负电荷的数量增加, 从而导致Cu2+在胡敏素表面的吸附量逐渐增加(Alvarez-Puebla et al., 2004;Havelcová et al., 2009).在更高的pH(pH > 7)条件下, Cu2+主要以Cu(OH)2沉淀的形式存在, 因此其在胡敏素表面的吸附量达到最大值并趋于稳定(Havelcová et al., 2009;王雅辉等, 2017).
 |
| 图 1 pH(a)和离子强度(b)对土壤胡敏素吸附Cu2+的影响 Fig. 1 Effects of pH (a) and ionic strength (b) on Cu2+ adsorption onto soil humin |
由图 1b可知, 在供试离子强度范围内(0.01~1.0 mol·L-1), 随溶液离子强度的增加, 胡敏素对Cu2+的吸附量逐渐降低, 这主要源于钠离子(Na+)的竞争吸附及对于固-液界面双电层的压缩作用(Wang et al., 2009;Liang et al., 2013).当离子强度 < 0.6 mol·L-1时, Cu2+的吸附量降低幅度较大;离子强度>0.6 mol·L-1时, Na+在胡敏素表面的吸附已趋于饱和, 因此Cu2+吸附量变缓并趋于稳定.
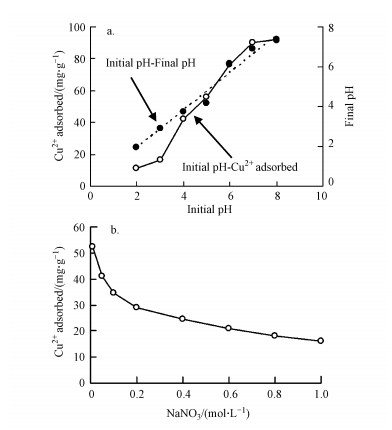
3.1.2 吸附动力学由图 2可知, 胡敏素对Cu2+的吸附动力学过程可分为两个阶段, 即初始的快速吸附阶段和随后的慢速吸附阶段, 达到吸附平衡的时间约为120 min.随反应温度的增加, 胡敏素对Cu2+的吸附量也增加, 说明温度升高促进Cu2+的吸附, 即吸附过程为吸热反应.
 |
| 图 2 土壤胡敏素对Cu2+的吸附动力学曲线(pH=5.0) Fig. 2 Kinetic curves of Cu2+ adsorption onto soil humin (pH=5.0) |
利用准一级和准二级动力学方程, 对得到的吸附动力学数据进行了拟合.由表 1可知, 准二级动力学方程的拟合效果优于准一级动力学方程, 可决系数(R2)在0.99以上;同时, 准二级动力学方程拟合得到的平衡吸附量(qe)与试验结果也是吻合的.以往的研究也发现, 土壤或泥炭胡敏素对金属离子的吸附动力学符合准二级动力学方程(Goveia et al., 2013;Jacundino et al., 2015;Wang et al., 2016).随反应温度的增加, 准二级吸附速率常数(k2)增加, 表明温度升高能够缩短达到吸附平衡的时间(Malais et al., 2013).
| 表 1 土壤胡敏素吸附Cu2+的动力学及活化参数 Table 1 Kinetic and activation parameters for Cu2+ adsorption onto soil humin |
根据lnk2-1/T和ln(k2/T)-1/T线性图(图略), 得到的吸附活化参数如表 1所示.由表 1可见, Ea值在15 kJ·mol-1以下, 说明胡敏素对Cu2+的吸附以物理过程为主(Shaker et al., 2014).ΔG# > 0、ΔH# > 0和ΔS# < 0, 说明Cu2+在胡敏素表面的吸附是需要能量(Chowdhury et al., 2011)的吸热反应(Doǧan et al., 2009), 从机制而言属于缔合反应(Doǧan et al., 2009).
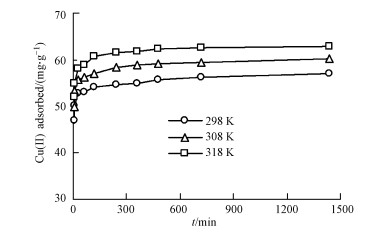
3.1.3 吸附等温线由图 3可知, 随溶液中浓度的增加, 胡敏素对Cu2+的吸附量也逐渐增加.此外, Cu2+在胡敏素上的吸附量也随温度的增加而增加, 这与吸附动力学所揭示的规律性是一致的.
 |
| 图 3 土壤胡敏素对Cu2+的吸附等温线(pH=5.0) Fig. 3 Isotherms of Cu2+ adsorption onto soil humin (pH=5.0) |
利用Langmuir和Freundlich方程, 对得到的吸附等温线数据进行了拟合.由表 2可知, Langmuir和Freundlich方程对都能够用来拟合胡敏素对Cu2+的吸附等温线(R2 > 0.93), 其中又以Langmuir方程的拟合效果更好(R2 > 0.99), 这与Wang等(2016)在泥炭土胡敏素上的研究结果是一致的.根据Langmuir方程, 不同温度下胡敏素对Cu2+的最大吸附量(qm)分别为67.6、76.9和82.0 mg·g-1.Freundlich方程的常数n > 1, 说明吸附过程容易进行(Zhang et al., 2013).随着反应温度的增加, Langmuir和Freundlich等温线参数均有所增加, 也说明温度升高促进Cu2+的吸附.
| 表 2 土壤胡敏素吸附Cu2+的等温线及热力学参数 Table 2 Parameters of isotherms and apparent thermodynamics for Cu2+ adsorption onto soil humin |
根据ΔG°-T线性图(图略), 得到的吸附热力学参数如表 2所示.由表 2可见, ΔG°值为负, 说明吸附反应是易于进行的、自发的过程;同时, 温度增加ΔG°值的绝对值增大, 指出升温有利于吸附过程的进行(Li et al., 2008), 这与前述吸附动力学和吸附等温线参数所揭示的规律性是一致的.ΔH°值为正, 表明吸附反应为吸热过程, 这可能来自于界面水分子的破坏以及吸附剂表面水分子的释放(Hu et al., 2017).ΔS°值为正, 说明吸附过程导致固-液界面的无序度和自由度增加(Yang et al., 2018).
3.2 土壤胡敏素对Cu2+的吸附机理 3.2.1 SEM-EDS分析通过扫描电子显微镜的观察发现, 吸附Cu2+之前, 胡敏素呈不规则的颗粒状结构, 具有蓬松、粗糙和多孔的表面(图 4a);吸附Cu2+之后, 胡敏素表面结构发生改变, 颗粒状结构产生了团聚现象, 小颗粒沉积在大颗粒孔隙之间, 颗粒变得紧密(图 4b).上述现象与王雅辉等(2017)在泥炭土上的观察结果是基本一致的, 说明Cu2+在胡敏素表面可能存在物理吸附行为.推测表面团聚现象出现的原因, 可能是由于Cu2+吸附减少了胡敏素表面负电荷的数量, 从而降低了其分子间的排斥力所引起.
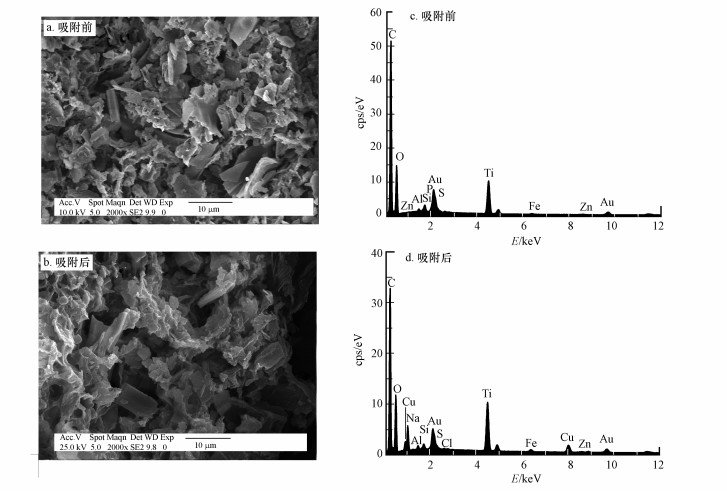 |
| 图 4 土壤胡敏素吸附Cu2+前后的扫描电镜图(a, b)和X-射线能量色散谱图(c, d) (pH 5.0, NaNO3浓度0.1 mol·L-1, Cu2+浓度20 mg·L-1, 接触时间24 h, 反应温度298 K) Fig. 4 SEM images (a, b) and EDS spectra (c, d) of soil humin before and after Cu2+ adsorption (pH=5.0, NaNO3 concentration=0.1 mol·L-1, Cu2+ concentration=20 mg·L-1, contact time=24 h, reaction temperature=298 K) |
从元素特征来看, 胡敏素表面的主要组成元素是C、O、Si、Al、P、S、Ti、Fe和Zn(图 4c), 吸附后观察到了Cu的吸收峰(图 4d), 表明Cu2+结合到了胡敏素表面.半定量分析结果(表 3)表明, 吸附后C、O、P、S的质量百分比和原子百分比有所降低, 说明含这些元素的官能团参与了Cu2+的吸附反应;另一方面, Al、Ti、Fe、Zn的质量百分比和原子百分比增加, 说明这些金属元素与胡敏素的有机成分紧密结合而难于被交换到溶液中, 推测它们可能是胡敏素灰分的主要组成元素.
| 表 3 土壤胡敏素吸附Cu2+前后表面元素的分布 Table 3 Elemental distribution of soil humin surface before and after Cu2+ adsorption |
胡敏素的FTIR谱图(图 5)中, 观察到的主要吸收峰及其归属如下:3286 cm-1为羧基和羟基的O—H伸缩, 2918和2850 cm-1为脂族的C—H伸缩、1713 cm-1为羧基的C=O伸缩, 1627 cm-1为芳香族的C=C伸缩, 1517 cm-1为羧酸盐的对称伸缩, 1375 cm-1为CH2和CH3的C—H变形, 1237 cm-1为羧基的C—O伸缩和O—H变形, 1162和1037 cm-1为多糖或类多糖物质的C—O伸缩及硅杂质的Si—O(Stevenson, 1994;Andreas et al., 2014;Rodríguez et al., 2016).吸附Cu2+之后, 3286、1713、1517和1237 cm-1吸收峰的强度明显降低, 同时3286和1237 cm-1吸收峰分别移动至3281和1229 cm-1, 这说明胡敏素表面的羧基和羟基参与了Cu2+的吸附反应.以往的研究也表明, 腐殖物质中的羧基和羟基在结合金属离子方面起着重要的作用(Gardea-Torresdey et al., 1996;Andreas et al., 2014;Shi et al., 2018;Yang et al., 2018).
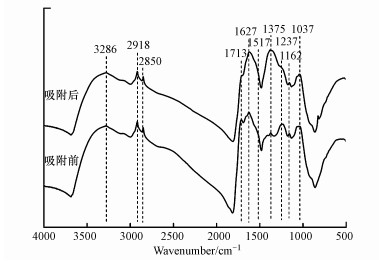 |
| 图 5 土壤胡敏素吸附Cu2+前后的红外光谱图 (pH 5.0, NaNO3浓度0.1 mol·L-1, Cu2+浓度20 mg·L-1, 接触时间24 h, 反应温度298 K) Fig. 5 FTIR spectra of soil humin before and after Cu2+ adsorption (pH=5.0, NaNO3 concentration=0.1 mol·L-1, Cu2+ concentration=20 mg·L-1, contact time=24 h, reaction temperature=298 K) |
吸附Cu2+前后, 胡敏素的XPS谱及半定量分析结果分别见图 6和表 4.从XPS全谱扫描图(图 6a)中, 可以明显地分辨出C、N和O元素的特征峰, 同时吸附后观察到了Cu元素的特征峰, 再次证实Cu2+结合到了胡敏素表面.为了进一步分析与Cu2+结合的有机官能团类型, 对C1s、N1s和O1s轨道进行了窄谱分析.胡敏素的高分辨C1s XPS谱(图 6b)中, 284.4、285.1、286.0、286.7、287.8和288.7 eV处的特征峰分别归属为芳香C、脂族C、羟基C、酮C、羰基C和羧基C(Chen et al., 2017;Guo et al., 2017;Doskočil et al., 2018);吸附Cu2+之后, 羟基C和羧基C的百分含量分别减少了7.01%和34.7%(表 4), 说明它们参与了Cu2+的吸附反应, 这与FTIR分析的结果是一致的.胡敏素的高分辨N1s XPS谱(图 6c)中, 在398.0、399.8和402.0 eV处出现了特征峰, 分别对应吡啶N、吡咯N和N—O基团(Cerqueira et al., 2012;Zhou et al., 2015);吸附Cu2+之后, 吡啶N和N—O基团的百分含量分别减少了52.1%和52.6%(表 4), 表明这些含N官能团参与了Cu2+吸附.以往的研究指出, 吡啶N的供电子特性使其具有较强的金属离子结合能力(Zhou et al., 2015).胡敏素的高分辨O1s XPS谱(图 6d)中, 531.9、532.9和536.2 eV处的特征峰分别归属为羰基、羟基和羧基(Guo et al., 2017), 吸附后羟基和羧基的百分含量分别减少了6.79%和47.9%(表 4), 再次说明Cu2+主要吸附在胡敏素表面的羟基和羧基官能团上.
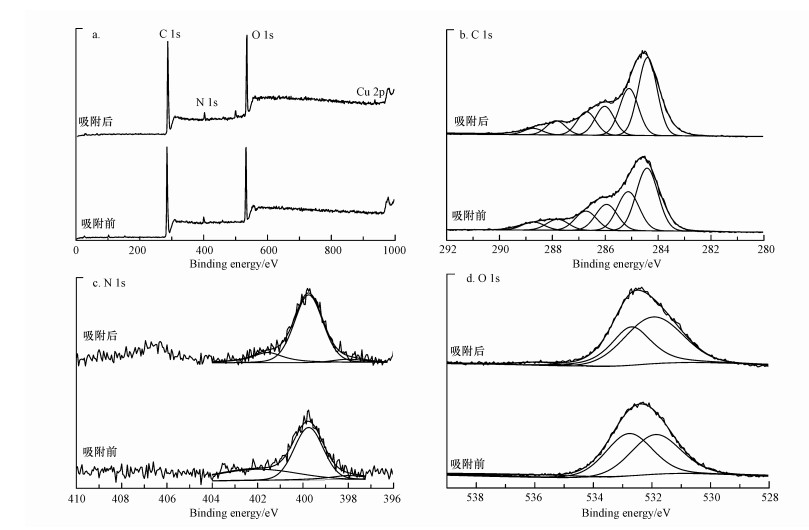 |
| 图 6 土壤胡敏素吸附Cu2+前后的X-射线光电子能谱图 (pH 5.0, NaNO3浓度0.1 mol·L-1, Cu2+浓度20 mg·L-1, 接触时间24 h, 反应温度298 K) Fig. 6 XPS spectra of soil humin before and after Cu2+ adsorption (pH=5.0, NaNO3 concentration=0.1 mol·L-1, Cu2+ concentration=20 mg·L-1, contact time=24 h, reaction temperature=298 K) |
| 表 4 土壤胡敏素吸附Cu2+前后表面碳、氮和氧官能团的分布 Table 4 Distribution of carbon-, nitrogen- and oxygen-containing functional groups in soil humin surface before and after Cu2+ adsorption |
为了确定胡敏素表面吸附态Cu2+的局域配位结构, 我们利用同步辐射EXAFS技术, 对不同溶液pH值(2、3、4、5)、离子强度(0.1、0.2、0.8 mol·L-1)、接触时间(30、1440 min)和Cu2+浓度(5、10、15、20、40 mg·L-1)条件下获得的胡敏素-Cu2+复合物样品进行了分析.由图 7可知, 所有样品的归一化k3权重EXAFS谱图(图 7a)及其径向结构函数图(图 7b)的形状相似, 说明Cu2+在胡敏素表面具有相似的配位结构;同时, 可以看到拟合结果与试验曲线的吻合程度较好, 得到的残差因子(Rf)值均在0.02以下(表 5).吸附样品的径向结构函数图(图 7b)中, 最强的信号峰出现在1.5 Å附近, 为Cu原子最近邻第一配位层的O或N原子的信号(EXAFS不能区分O和N原子的信号);另外, 在2.1 Å附近出现的信号峰, 为第二配位层的C原子的信号(Li et al., 2015).
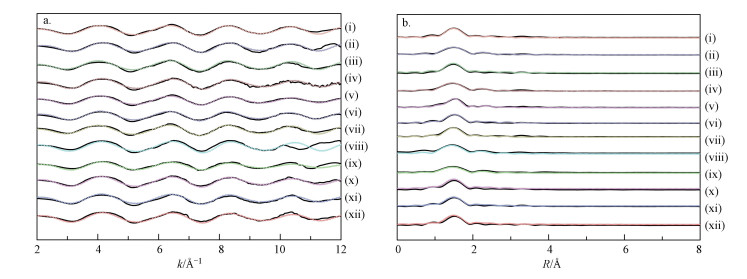 |
| 图 7 土壤胡敏素表面吸附态Cu2+的归一化k3权重EXAFS谱(a)及其径向结构函数(b) (实线和圆圈分别代表试验曲线和拟合结果, ⅰ~ⅹⅱ对应表 3中的样品号) Fig. 7 Normalized k3-weighted EXAFS spectra (a) and corresponding radial structure functions (b) for Cu2+ adsorbed onto soil humin surface (solid lines and open circles represent the experimental curves and fitted results, respectively. From ⅰ to ⅹⅱ correspond to sample numbers listed in Table 3) |
| 表 5 土壤胡敏素表面吸附态Cu2+的EXAFS结构参数 Table 5 EXAFS structural parameters for Cu2+ adsorbed onto soil humin surface |
经拟合的EXAFS结构参数(表 5)指出, 在供试的溶液pH值、离子强度、接触时间和Cu2+浓度条件下, Cu2+在胡敏素表面的局域配位结构相似.由表 5可知, 所有样品的第一配位层(Cu-O/N)中, 与中心Cu原子配位的O或N原子数约为4, 原子间距在1.92~1.96 Å之间;第二配位层(Cu-C)中, 与Cu原子配位的C原子数约为2, 原子间距在2.79~2.84 Å之间.上述结果说明, Cu2+主要以内层复合物形式吸附在胡敏素表面的有机C、N、O官能团上.基于前述的EDS、FTIR和XPS分析, 这些有机官能团主要为羧基、羟基、吡啶氮和N-O基团.另一方面, 从表 5可以看到, 不同吸附条件下, 无序度(即Debye-Waller)因子和能量位移(即ΔE0)值没有表现出规律性的变化.
以往的研究发现, Cu2+与土壤或有机物料来源的溶解性腐殖物质组分结合后, Cu原子最近邻第一配位层的Cu-O/N原子间距为1.94~1.95 Å, 第二配位层的Cu-C原子间距为2.75~2.81 Å(Korshin et al., 1998;Strawn et al., 2009;Li et al., 2015), 这些与我们的研究结果基本一致.此外, 已有的研究指出, 改变吸附体系的pH值, 不会导致Cu2+在溶解性腐殖物质组分表面局域配位结构发生显著变化(Xia et al., 1997), 这与我们的研究结果也是一致的.
4 结论(Conclusions)随溶液pH值、接触时间、反应温度和Cu2+浓度的增加, 胡敏素对Cu2+的吸附量增加;而随离子强度的增加, 胡敏素对Cu2+的吸附量下降.吸附动力学符合准二级动力学方程, 而吸附等温线用Langmuir方程的拟合效果优于Freundlich方程.吸附过程需要能量, 是自发、吸热和自由度增加的缔合反应.吸附Cu2+之后, 胡敏素的片状结构产生了轻微的团聚现象, 表面羧基、羟基、吡啶氮和N—O基团参与了Cu2+的吸附作用, 同时吸附态Cu2+是以内层配位形式与胡敏素表面的O/N和C原子结合.
王雅辉, 吕文英, 邹雪刚, 等. 2017. 响应面法优化胡敏素对Cu2+的吸附及机理研究[J]. 环境科学学报, 2017, 37(2): 624–632.
|
张晋京, 窦森. 2008. 土壤胡敏素研究进展[J]. 生态学报, 2008, 28(3): 1229–1239.
DOI:10.3321/j.issn:1000-0933.2008.03.039 |
Alvarez-Puebla R A, Valenzuela-Calahorro C, Garrido J J. 2004. Cu(Ⅱ) retention on a humic substance[J]. Journal of Colloid and Interface Science, 270(1): 47–55.
DOI:10.1016/j.jcis.2003.08.068
|
Andreas R, Zhang J. 2014. Characteristics of adsorption interactions of cadmium(Ⅱ) onto humin from peat soil in freshwater and seawater media[J]. Bulletin of Environmental Contamination and Toxicology, 92(3): 352–357.
DOI:10.1007/s00128-014-1205-x
|
Cerqueira S da C A, Romão L P C, Lucas S C O, et al. 2012. Spectroscopic characterization of the reduction and removal of chromium (Ⅵ) by tropical peat and humin[J]. Fuel, 91: 141–146.
DOI:10.1016/j.fuel.2011.06.023
|
Chen W, Wang H, Gao Q, et al. 2017. Association of 16 priority polycyclic aromatic hydrocarbons with humic acid and humin fractions in a peat soil and implications for their long-term retention[J]. Environmental Pollution, 230: 882–890.
DOI:10.1016/j.envpol.2017.07.038
|
Chowdhury S, Mishra R, Saha P, et al. 2011. Adsorption thermodynamics, kinetics and isosteric heat of adsorption of malachite green onto chemically modified rice husk[J]. Desalination, 265(1/3): 159–168.
|
Doǧan M, Abak H, Alkan M. 2009. Adsorption of methylene blue onto hazelnut shell:Kinetics, mechanism and activation parameters[J]. Journal of Hazardous Materials, 164(1): 172–181.
DOI:10.1016/j.jhazmat.2008.07.155
|
Doskočil L, Burdíková-Szewieczková J, Enev V, et al. 2018. Spectral characterization and comparison of humic acids isolated from some European lignites[J]. Fuel, 213: 123–132.
DOI:10.1016/j.fuel.2017.10.114
|
Gardea-Torresdey J L, Tang L, Salvador J M. 1996. Copper adsorption by esterified and unesterified fractions of Sphagnum peat moss and its different humic substances[J]. Journal of Hazardous Materials, 48(1/3): 191–206.
|
Goveia D, de A Melo C, de Oliveira L K, et al. 2013. Adsorption and release of micronutrients by humin extracted from peat samples[J]. Journal of the Brazilian Chemical Society, 24(24): 721–730.
|
Guo Z, Zhang J, Kang Y, et al. 2017. Rapid and efficient removal of Pb(Ⅱ) from aqueous solutions using biomass-derived activated carbon with humic acid in-situ modification[J]. Ecotoxicology and Environmental Safety, 145: 442–448.
DOI:10.1016/j.ecoenv.2017.07.061
|
Havelcová M, Mizera J, Sýkorová I, et al. 2009. Sorption of metal ions on lignite and the derived humic substances[J]. Journal of Hazardous Materials, 161(1): 559–564.
DOI:10.1016/j.jhazmat.2008.03.136
|
Hayes M H B, Mylotte R, Swift R S. 2017. Humin:its composition and importance in soil organic matter[J]. Advances in Agronomy, 143: 47–138.
DOI:10.1016/bs.agron.2017.01.001
|
Hu B, Hu Q, Xu D, et al. 2017. The adsorption of U(Ⅵ) on carbonaceous nanofibers:A combined batch, EXAFS and modeling techniques[J]. Seperation and Purification Technology, 175: 140–146.
DOI:10.1016/j.seppur.2016.11.025
|
Jacundino J S, Santos O S, Santos J C C, et al. 2015. Interactions between humin and potentially toxic metals:Prospects for its utilization as an environmental repair agent[J]. Journal of Environmental Chemical Engineering, 3(2): 708–715.
DOI:10.1016/j.jece.2015.03.032
|
Korshin G V, Frenkel A I, Stern E A. 1998. EXAFS study of the inner shell structure in copper(Ⅱ) complexes with humic substances[J]. Environmental Science and Technology, 32(18): 2699–2705.
DOI:10.1021/es980016d
|
Li C, Ji F, Wang S, et al. 2015. Adsorption of Cu(Ⅱ) on humic acids derived from different organic materials[J]. Journal of Integrative Agriculture, 14(1): 168–177.
DOI:10.1016/S2095-3119(13)60682-6
|
Li Y, Yue Q, Gao B, et al. 2008. Adsorption thermodynamic and kinetic studies of dissolved chromium onto humic acids[J]. Colloids and Surfaces B:Biointerfaces, 65(1): 25–29.
DOI:10.1016/j.colsurfb.2008.02.014
|
Lipczynska-Kochany E. 2018. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil:A review[J]. Chemosphere, 202: 420–437.
DOI:10.1016/j.chemosphere.2018.03.104
|
Rodríguez F J, Schlenger P, García-Valverde M. 2016. Monitoring changes in the structure and properties of humic substances following ozonation using UV-Vis, FTIR and 1H NMR techniques[J]. Science of the Total Environment, 541: 623–637.
DOI:10.1016/j.scitotenv.2015.09.127
|
Shaker M A, albishri H M. 2014. Dynamics and thermodynamics of toxic metals adsorption onto soil-extracted humic acid[J]. Chemosphere, 111(111C): 587–595.
|
Shi W, Lü C, He J, et al. 2018. Nature differences of humic acids fractions induced by extracted sequence as explanatory factors for binding characteristics of heavy metals[J]. Ecotoxicology and Environmental Safety, 154: 59–68.
DOI:10.1016/j.ecoenv.2018.02.013
|
Stevenson F J. 1994. Humus chemistry:genesis, composition, reactions.2nd Edition[M]. New York: Wiley & Sons Ltd.
|
Strawn D G, Baker L L. 2009. Molecular characterization of copper in soils using X-ray absorption spectroscopy[J]. Environmental Pollution, 157(10): 2813–2821.
DOI:10.1016/j.envpol.2009.04.018
|
Wang Y, Li L, Zou X, et al. 2016. Impact of humin on soil adsorption and remediation of Cd(Ⅱ), Pb(Ⅱ), and Cu(Ⅱ)[J]. Soil and Sediment Contamination, 25(6): 700–715.
DOI:10.1080/15320383.2016.1191426
|
Won S W, Kim H J, Choi S H, et al. 2006. Performance, kinetics and equilibrium in biosorption of anionic dye Reactive Black 5 by the waste biomass of Corynebacterium glutamicum as a low-cost biosorbent[J]. Chemical Engineering Journal, 121(1): 37–43.
DOI:10.1016/j.cej.2006.04.005
|
Xia K, Bleam W, Helmke P A. 1997. Studies of the nature of Cu2+ and Pb2+ binding sites in soil humic substances using X-ray absorption spectroscopy[J]. Geochimica et Cosmochimica Acta, 61(11): 2211–2221.
DOI:10.1016/S0016-7037(97)00079-3
|
Yang T, Hodson M E. 2018. Investigating the potential of synthetic humic-like acid to remove metal ions from contaminated water[J]. Science of the Total Environment, 635: 1036–1046.
DOI:10.1016/j.scitotenv.2018.04.176
|
Zhang J, Wang S, Wang Q, et al. 2013. First determination of Cu adsorption on soil humin[J]. Environmental Chemistry Letters, 11(1): 41–46.
DOI:10.1007/s10311-012-0375-1
|
Zhang J, Yin H, Wang H, et al. 2018. Reduction mechanism of hexavalent chromium by functional groups of undissolved humic acid and humin fractions of typical black soil from Northeast China[J]. Environemtnal Science and Pollution Research.
DOI:10.1007/s11356-018-1878-5
|
Zhou S, Chen S, Yuan Y, et al. 2015. Influence of humic acid complexation with metal ions on extracellular electron transfer activity[J]. Scientific Reports, 5(6): 17067.
|
 2018, Vol. 38
2018, Vol. 38


