随着工业经济的发展, 染料废水的排放量日益增多, 尤其含有偶氮染料(—N=N—)的废水, 具有含量高、难降解且毒性强等特点(Ji et al., 2009; Xu et al., 2010), 而传统的吸附等方法难以降解和矿化(Gupta et al., 2011; And et al., 2017).与此相比, 高级氧化能够产生多种活性自由基从而对偶氮染料进行降解, 同时具有反应速度快、处理完全等优点(Wang, 2008).非均相催化是一种效果稳定且几乎不会产生二次污染的高级氧化技术, 在此基础上与其他技术联用能够进一步有效提高体系的氧化性能, 比如, 其中主要包括与超声、微波、电化学、生物法等联用(Stock et al., 2000; He et al., 2002; Parra et al., 2002).尽管这些方法能够一定程度上提高催化剂的催化活性, 但在实际应用方面这些方法仍然存在缺陷, 如能耗较高、操作复杂及潜在的生态毒性等.近年来的研究发现, 利用弱磁场能够明显改善部分催化剂的反应活性(Liang et al., 2014; Liang et al., 2015; He et al., 2016), 且该方法具有高效、低成本、操作简单、适用广泛、无二次污染等特点, 因而弱磁场与非均相催化联用去除水中污染物是一种应用前景广阔的水处理技术.在此基础上, 课题组进行了前期的探索研究, 发现外加弱磁场能够有效增强磁性催化剂ZnO@Fe3O4激活PMS的能力(Zhao et al., 2018).
此外, 有文献提出利用预磁化的方法替代直接外加磁场(Li et al., 2015a; 2015b).铁磁性催化剂在磁场条件下被磁化, 当撤除外加磁场时仍能保持剩磁, 这个剩磁亦能够起到弱磁场的作用, 这一“磁记忆效应”称为预磁化(鲍倩倩等,2017).以预磁化替代直接外加磁场能够克服一些如可能存在由直接外加磁场引起催化剂颗粒团聚从而对反应体系形成负面影响, 以及构建弱磁场反应器可能会带来成本的增加等的局限性(鲍倩倩等,2017).为进一步研究预磁化对ZnO@Fe3O4催化活性的作用, 本文以酸性橙7(AO7)为目标污染物, 考察了预磁化对ZnO@Fe3O4激活过一硫酸盐(PMS)的强化作用, 探讨分析了预磁化驱动ZnO@Fe3O4激活PMS去除水中AO7的各种影响因素, 并推测了预磁化强化催化剂去除污染物的作用机制.
2 材料与方法(Materials and methods) 2.1 材料试剂与实验设备Zn(Ac)2·2H2O、FeCl3· 6H2O、FeCl2·4H2O、酸性橙7(AO7)购于成都科龙化学试剂有限公司; 过一硫酸盐(HKSO5·0.5KHSO4·0.5K2SO4, PMS)、NH3·H2O购于Sigma-Aldrich; 实验室用水为去离子水.实验用搅拌装置购于上海标本模型厂(JB50-D型).
2.2 ZnO@Fe3O4的制备ZnO@Fe3O4按照文献(宋伟明等, 2015)的方法改进后制备.磁力搅拌下将乙酸锌Zn(Ac)2· 2H2O溶解在去离子水中形成透明溶液, 随后向上述溶液中缓慢滴加氨水直至溶液澄清, 室温下充分搅拌一定时间.按照Fe与Zn比例0.36:1称取合适量的FeCl3·6H2O和FeCl2·4H2O, 将其分别溶解于去离子水中形成黄色溶液.在快速搅拌下将混合溶液逐滴加入到上述乙酸锌溶液中, 滴加完毕之后搅拌一定时间, 再转移到水热反应釜内在120 ℃保温24 h.反应结束后降至室温, 将釜内沉淀物离心分离并清洗3次后干燥, 最后置于马弗炉内于煅烧一段时间, 即得到ZnO@Fe3O4复合材料.
2.3 实验方法反应开始前, 将催化剂ZnO@Fe3O4放置于25 mL干净玻璃烧杯中, 改变不同磁场强度, 隔着烧杯对催化剂进行预磁化, 预磁化时间为1 min, 经过预磁化后的催化剂记为Mag-ZnO@Fe3O4.在一定温度下, 将200 mL AO7溶液注入250 mL烧杯, 并保持AO7浓度为7 mg·L-1, 用稀H2SO4或NaOH调节pH值, 随后同时加入一定量的PMS和Mag-ZnO@Fe3O4(或ZnO@Fe3O4)到反应烧杯中并启动搅拌器(转速300 r·min-1), 记为反应开始时间.在预定的反应时间内间隔快速取样5 mL, 用0.45 μm滤膜过滤留待后续测量.
2.4 分析方法AO7浓度利用紫外可见分光光度计(UV-1800型)测定, 于AO7最大吸收波长484 nm处测量其吸光度, 代入标准曲线求得对应染料浓度. ZnO@Fe3O4的磁滞回线通过振动样品磁强计(VSM, Lake Shore 735型)测得, 其表面ζ电位与等电点由Zeta电位仪(JS94HM)测得.
3 结果与讨论(Results and discussion) 3.1 预磁化对ZnO@Fe3O4/PMS去除AO7性能的影响图 1显示了不同体系下AO7的脱色效果, 结果表明PMS单独存在时, AO7几乎不降解; 反应体系中仅有ZnO@Fe3O4进行吸附时, 20 min内AO7浓度减小了约10%;经过预磁化处理后的Mag-ZnO@Fe3O4对于AO7的吸附去除并无明显变化; 用ZnO@Fe3O4活化PMS时, 20 min内AO7降解了约65%;而经过预磁化后的Mag-ZnO@Fe3O4活化PMS时, 在反应进行到9 min时, AO7的去除率达到了76.5%, 反应20 min后去除率可达92%, 较未经过预磁化处理的ZnO@Fe3O4/PMS体系, 去除率提升了27%.表明ZnO@Fe3O4经过预磁化后活化PMS的效果有显著提升.
 |
| 图 1 预磁化对ZnO@Fe3O4/PMS去除AO7性能的影响([PMS]0=5×10-4 mol·L-1或0 mol·L-1, [AO7]0=0.02 mmol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1, pH=6.0) Fig. 1 Influence of the pre-magnetization on AO7 removal by ZnO@Fe3O4/PMS system ([PMS]0=5×10-4 mol·L-1 or 0 mol·L-1, [AO7]0=0.02 mmol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1, pH=6.0) |
为进一步地量化比较Mag-ZnO@Fe3O4/PMS和ZnO@Fe3O4/PMS体系中AO7去除速率的不同, 利用假一级动力学模型针对两个体系中AO7降解的反应动力学数据进行拟合, 如式(1)所示.

|
(1) |
式中, kobs为假一级反应速率常数(min-1).由图 1可以得出, 预磁化能够将去除染料的反应速率常数从0.0463 min-1提高至0.1832 min-1, 反应速率约是原来的4倍.
3.2 影响因素的研究 3.2.1 催化剂用量的影响ZnO@Fe3O4投加量对AO7降解效果的影响如图 2所示.从图中可知, 在Mag-ZnO@Fe3O4/PMS体系中, 随着催化剂投加量从0.25 g·L-1增大至0.75 g·L-1, AO7的降解速率逐渐加快; 然而, 当催化剂投量增加至1.0 g·L-1时, AO7的降解速率并没有进一步明显增加.从图 2可以看出, 催化剂投加量为0.75与1.0 g·L-1时, AO7的降解速率基本上是一样的.这主要是因为随着ZnO@Fe3O4投加量增大, 有更多的活化点位活化PMS, 产生更多的自由基降解偶氮染料.但随着催化剂投量进一步增加, 作用已经不明显.这可能是因为浓度过高时, 具备高活性的ZnO@Fe3O4粒子在水中发生团聚, 导致催化剂比表面积减小, 其表面的活性点位数也随之减少, 所以催化剂的投量过多并不利于体系氧化反应的进行(Ren et al., 2012).本实验选取0.75 g·L-1作为催化剂的最佳投量.
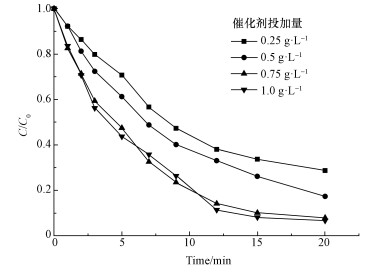 |
| 图 2 催化剂投量对AO7去除率的影响([PMS]0=5×10-4 mol·L-1, [AO7]0=0.02 mmol·L-1, pH=6.0) Fig. 2 Effects of ρ(ZnO@Fe3O4) on degradation of AO7 |
PMS浓度对AO7降解的影响如图 3所示.从图中可知, 在Mag-ZnO@Fe3O4/PMS体系中, 当PMS浓度由0.1 mol·L-1增加至0.5 mol·L-1时, AO7降解速度显著加快, 这说明反应过程中PMS浓度对AO7的降解反应有明显的作用.同时, 在一定PMS浓度范围内, 随着PMS浓度增大, 活化降解AO7速率越快.但当PMS浓度过高时(本实验中取PMS浓度为0.7 mol·L-1), 反应速率并没有进一步增大, 且与PMS浓度为0.5 mol·L-1时相比有稍许的抑制作用, 原因可能是当PMS浓度过高时, 会产生大量的自由基相互猝灭, 使AO7降解速率减缓(Waldemer et al., 2007).所以应将PMS投量控制, 在适当范围内, 本实验拟用0.5 mol·L-1作为PMS最佳投量.
 |
| 图 3 PMS浓度对AO7去除率的影响([AO7]0=0.02 mmol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1, pH=6.0) Fig. 3 Effects of ρ(PMS)0 on degradation of AO7 |
为了研究初始pH对Mag-ZnO@Fe3O4/PMS体系氧化降解AO7的影响, 通过0.1 mol·L-1的NaOH和稀硫酸调节反应初始pH, 结果如图 4所示.从图中可知, 在pH为6和8时反应速率最快, 在pH分别为2、4、10时, 反应速率都有不同程度的降低.这一现象可能与催化剂的表面零电荷点以及PMS在不同pH的活化能力有关.经Zeta电位仪分析Mag-ZnO@Fe3O4表面的等电点为6.8.由于AO7是阴性染料, 当pH < 6.8时, 催化剂表面带正电荷, 对AO7的静电吸附会增强, 但酸性的环境可能同时对催化剂活化PMS的性能产生了影响, 导致催化剂活性下降, 特别是pH为2时最为明显; 当pH>6.8时, 催化剂表面带负电荷, 与AO7相互排斥, 使得表面反应不容易进行, 但同时碱性的环境会激活PMS产生自由基(Zhou et al., 2015), 这两者影响因素之间应该有一个平衡的区间使得催化反应速率最高, 根据实验数据推测应该在pH为6~8之间.
 |
| 图 4 不同初始pH对AO7去除率的影响([PMS]0=5×10-4 mol·L-1, [AO7]0=0.02 mol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1) Fig. 4 Effects of intial pH on degradation of AO7 |
预磁化对催化剂除污染性能改善的作用机制, 是与外置磁场作用于反应体系无本质区别的.考虑到ZnO@Fe3O4可能在不同磁场强度环境下其“记忆”的磁场强度不同, 进而能影响其除污染活性, 因此, 本文系统考察了不同预磁化强度对ZnO@Fe3O4/PMS去除水中AO7反应动力学的影响, 如图 5所示.
 |
| 图 5 ZnO@Fe3O4磁滞回线图(内插图为磁滞回线放大图)(a)及不同预磁化强度下ZnO@Fe3O4的剩磁与AO7的去除表观速率常数(内插图为剩磁与其AO7表观速率常数的相关性)(b)([PMS]0=5×10-4 mol·L-1, [AO7]0=0.02 mmol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1, pH=6.0) Fig. 5 Magnetic hysteresis loops of the ZnO@Fe3O4 measured with different maximal external magnetic fields at 300 K (The magnetic hysteresis loops are enlarged in the inset) (a), and the remanence of Mag-ZnO@Fe3O4 and the rate constants of AO7 removal under different maximal external magnetic fields (Dependence of the rate constants of AO7 removal on the remanence of Mag-ZnO@Fe3O4 is represented in the inset) (b) |
如图 5a所示, 随着预磁化强度的提高, 预磁化后的ZnO@Fe3O4剩磁也随之增大, 即预磁化强度由500 mT增大至2000 mT, Mag-ZnO@Fe3O4的剩磁由0.202 emu·g-1增加至0.976 emu·g-1.随着预磁化强度的提高, Mag-ZnO@Fe3O4/PMS对AO7的反应活性显著提高, 根据假一级动力学对反应动力学数据进行模拟, 如图 5b所示, 当预磁化强度由0 T逐渐增大至2 T时, 催化剂去除AO7的表观速率常数由0.0463 min-1逐渐增大至0.1832 min-1, 反应速率提高至未预磁化处理的1.4~4.0倍.将Mag-ZnO@Fe3O4的剩磁与AO7的去除表观速率常数进行相关性分析, 如图 5内插图所示, Mag-ZnO@Fe3O4去除AO7的表观速率常数与其剩磁呈线性正相关, 这一定程度上说明预磁化对ZnO@Fe3O4除污染活性的强化作用主要与催化剂颗粒剩磁有关.剩磁的存在使得催化剂颗粒形成一个磁体, 由于其较大的颗粒粒径, 故存在一个较大的表面积, 使得磁化后的催化剂是一种多畴态, 即对外不显示磁性, 但其颗粒表面某一区域存在磁性(鲍倩倩等,2017).颗粒表面磁场强度的存在会使得ZnO@Fe3O4产生感应磁场, 最终通过磁场影响体系的反应速率.
3.3 机理讨论 3.3.1 体系中的自由基分析相关文献报道(Agustina et al., 2005), 非均相催化体系的降解效果与自由基的产生密切相关, 故有必要对体系中的自由基进行分析.从图 6可知, 在Mag-ZnO@Fe3O4/PMS体系中, 加入叔丁醇(TBA)作为·OH抑制剂时, AO7的降解效果略有下降; 而加入甲醇(MA)作为SO4-·/SO5-·抑制剂时, 体系的反应被明显的抑制; 特别是加入苯醌(BQ)作为O2-·抑制剂时, 体系的反应被抑制得更加明显.这说明反应体系中存在少量OH·、部分SO4-·/SO5-·和大量的O2-·.为了进一步验证自由基在反应体系中的重要作用, 本实验加入糠醇(FA)作为各种自由基的抑制剂, 此时体系的反应几乎被完全抑制.此时的降解率与图 1的吸附效果相比是较为接近的, 这说明除了约10%的吸附作用以外, 各种自由基在反应体系中起了主要的作用.
 |
| 图 6 自由基抑制剂对AO7降解率的影响([PMS]0=5×10-4 mol·L-1, [AO7]0=0.02 mmol·L-1, [ZnO@Fe3O4]0=0.75 g·L-1, pH=6.0) Fig. 6 Effect of radical scavengers on AO7 removal |
该体系中AO7的去除与自由基密切相关, 分析预磁化处理的体系中AO7去除率提高的原因可能与反应体系中的自由基有关.在课题组之前的研究中, 发现ZnO@Fe3O4/PMS体系中的自由基产率在外加弱磁场的条件下得以增加(Zhao et al., 2018).
而经过预磁化的催化剂颗粒表面磁场强度的存在会使得其产生感应磁场, 这个感应磁场的强度是比较小的(小于0.976 emu·g-1), 它代替了弱磁场从而对反应体系产生影响.现有文献普遍认为对于磁场影响化学反应的机理主要是自由基对机理(Burlakova, 1975; Brocklehurst, 2002), 化学反应中产生自由基对后, 其自旋状态就会以一定形式被极化, 自由基对的两个自旋矢量的不同取向构成了自由基对的不同状态, 通常是以单线态S或三线态T0、T+和T-的状态存在; 在一定条件下, 不同状态的自由基可以相互转换, 完成自由基的复合; 未施加磁场时, 三线态自由基处于简并状态, 当同一自由基对的2个自旋矢量的旋进速度有所不同时, 就会发生单线态与三线态自由基之间的转化, 完成“系间跃迁”; 而当施加磁场时, 三线态的自由基会发生“塞曼分裂”, 此时T+态自由基能量增大, T-态自由基能量减小, 仅能量不变的T0态自由基能与单线态S转化, 大大减小了自由基的复合概率.所以此时, 体系中的自由基能够更好的发挥氧化污染物的功能.
该体系中AO7的降解主要来源于自由基的氧化作用, 结合文献推测, 经过预磁化后的ZnO@Fe3O4表面产生了感应磁场, 在此磁场条件下, 自由基的复合减少, 用于氧化AO7的自由基增多最终导致AO7的去除率提高.
同时,为了进一步分析预磁化是否会影响ZnO@Fe3O4表面的静电吸附性能,实验测定了催化剂在预磁化前后表面的ζ电位.在pH=6时,预磁化后的Mag-ZnO@Fe3O4表面ζ电位为+2.06,与未预磁化处理时的ZnO@Fe3O4表面ζ电位(+1.98)相近.且实验测得预磁化处理前后催化剂表面的等电点皆为6.8.故说明预磁化对该催化剂的静电吸附性能影响不大,这与图 1中得出的结论一致.故可以认为是由于自由基复合减少,更多的自由基用于氧化污染物得以消耗,从而使整个催化反应的正向反应加速,进而使催化剂与PMS的反应增强.
综上所述,预磁化提升污染物去除率可能的机理可以总结为:预磁化后的ZnO@Fe3O4表面产生了感应磁场, 从而影响自由基的复合减少, 使得污染物被自由基氧化的速率提高.
 |
| 图 7 预磁化提升污染物去除率可能的机理 Fig. 7 A possible mechanism of pre-magnetization for enhancing the activation of peroxymonosulfate by ZnO@Fe3O4 to decolorize AO7 |
1) 相比于简单的催化剂系统, 预磁化后的Mag-ZnO@Fe3O4能够显著提升活化PMS从而降解AO7的能力.根据假一级动力学对反应动力学数据进行模拟, 可以得出, 当预磁化强度由0 T逐渐增大至2 T时, 去除AO7的表观速率常数由0.0463 min-1逐渐增大至0.1832 min-1, 反应速率达到原来的1.4~4.0倍.
2) AO7降解效果在一定范围内随预磁化强度、PMS浓度、催化剂投加量增大而得到提高.初始pH对降解有较大的影响, 在pH=6~8的条件下有利于反应进行.
3) Mag-ZnO@Fe3O4活化PMS降解AO7的过程是体系中的少量·OH、部分SO4-·/SO5-·和大量的O2-·共同作用的结果, 经过预磁化处理后的催化剂产生感应磁场, 从而影响了反应体系中自由基的复合概率, 使得污染物被自由基氧化的速率提高.
Agustina T E, Ang H M, Vareek V K. 2005. A review of synergistic effect of photocatalysis and ozonation on wastewater treatment[J]. Journal of Photochemistry & Photobiology C Photochemistry Reviews, 6(4): 264–273.
|
And G P A, Dionysiou D D. 2017. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science & Technology, 37(20): 4790.
|
鲍倩倩, 李锦祥, 关小红. 2017. 预磁化强化零价铁除偶氮染料的性能研究[J]. 环境化学, 2017, 36(7): 1467–1473.
|
Brocklehurst B. 2002. Magnetic fields and radical reactions:Recent developments and their role in nature[J]. Chemical Society Reviews, 33(47): 301–311.
|
Burlakova E B. 1975. Bioantioxidants and synthetic inhibitors of radical processes[J]. Russian Chemical Reviews, 44(10): 871.
DOI:10.1070/RC1975v044n10ABEH002383
|
Gupta V K, Gupta B, Rastogi A, et al. 2011. A comparative investigation on adsorption performances of mesoporous activated carbon prepared from waste rubber tire and activated carbon for a hazardous azo dye-Acid Blue 113[J]. Journal of Hazardous Materials, 186(1): 891–901.
DOI:10.1016/j.jhazmat.2010.11.091
|
He C, Liu X, Ji W, et al. 2016. Coupling of photoactive TiO2 and impressed magnetic field for phenol highly efficient degradation[J]. Water Air & Soil Pollution, 227(4): 1–12.
|
He C, Xiong Y, Zhu X. 2002. A novel method for improving photocatalytic activity of TiO2 film:the combination of Ag deposition with application of external electric field[J]. Thin Solid Films, 422(1): 235–238.
|
Ji P, Zhang J, Chen F, et al. 2009. Study of adsorption and degradation of acid orange 7 on the surface of CeO2 under visible light irradiation[J]. Applied Catalysis B Environmental, 85(3): 148–154.
|
Liang L, Guan X, Huang Y, et al. 2015. Efficient selenate removal by zero-valent iron in the presence of weak magnetic field[J]. Separation & Purification Technology, 156: 1064–1072.
|
Liang L, Sun W, Guan X, et al. 2014. Weak magnetic field significantly enhances selenite removal kinetics by zero valent iron[J]. Water Research, 49(1): 371.
|
Li J, Qin H, Guan X. 2015. Premagnetization for enhancing the reactivity of multiple zerovalent iron samples toward various contaminants[J]. Environmental Science & Technology, 49(24): 14401–14408.
|
Li J, Shi Z, Ma B, et al. 2015. Improving the reactivity of zerovalent iron by taking advantage of its magnetic memory:Implications for arsenite removal[J]. Environmental Science & Technology, 49(17): 10581–10588.
|
Parra S, Malato S, Pulgarin C. 2002. New integrated photocatalytic-biological flow system using supported TiO and fixed bacteria for the mineralization of isoproturon[J]. Applied Catalysis B Environmental, 36(2): 131–144.
DOI:10.1016/S0926-3373(01)00293-4
|
Ren Y, Dong Q, Feng J, et al. 2012. Magnetic porous ferrospinel NiFe2O4:A novel ozonation catalyst with strong catalytic property for degradation of di-n-butyl phthalate and convenient separation from water[J]. Journal of Colloid Interface Science, 382(1): 90–96.
DOI:10.1016/j.jcis.2012.05.053
|
宋伟明, 孙晶晶, 孙立, 等. 2015. 三维花状复合材料Fe3O4-ZnO的制备与性能研究[J]. 人工晶体学报, 2015, 44(6): 1630–1636.
|
Stock N L, Peller J, Vinodgopal K, et al. 2000. Combinative sonolysis and photocatalysis for textile dye degradation[J]. Environmental Science & Technology, 34(9): 1747–1750.
|
Waldemer R H, Tratnyek P G, Johnson R L, et al. 2007. Oxidation of chlorinated ethenes by heat-activated persulfate:Kinetics and products[J]. Environmental Science & Technology, 41(3): 1010–1015.
|
Wang S. 2008. A comparative study of Fenton and Fenton-like reaction kinetics in decolourisation of wastewater[J]. Dyes & Pigments, 76(3): 714–720.
|
Xu X R, Li X Z. 2010. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation & Purification Technology, 72(1): 105–111.
|
Zhao H, Zhang J, Ye Q, et al. 2018. Weak magnetic field enhances the activation of peroxymonosulfate by ZnO@Fe3O4[J]. RSC Advances, 8(31): 17462–17470.
DOI:10.1039/C8RA03108H
|
Zhou J, Xiao J, Xiao D, et al. 2015. Transformations of chloro and nitro groups during the peroxymonosulfate-based oxidation of 4-chloro-2-nitrophenol[J]. Chemosphere, 134: 446–451.
DOI:10.1016/j.chemosphere.2015.05.027
|
 2018, Vol. 38
2018, Vol. 38


