近年来, 为控制阔叶杂草的生长, 农业上大规模地使用除草剂(Song, 2014).在众多除草剂中, 2, 4-D由于具有较低的成本和良好的选择性而被广泛使用(Chaparadza et al., 2011;Nejati et al., 2013), 但2, 4-D的降解性差、水溶性低, 进入环境后会产生一定的积累, 从而造成水体和土壤的污染, 进而危害人类健康及环境安全.同时, 2, 4-D作为一种内分泌干扰物, 具有生物毒性, 对人类和动物都有胚胎毒性、致畸性和神经毒性, 属于目前世界上使用的十大危害杀虫剂之一(Wang et al., 2013).
铁是地壳中含量第二高的金属元素, 其电极电位E0(Fe2+/Fe)= -0.44 V, 因此, 具有较强的还原能力, 可有效降解多种污染物, 如含氯有机物(Zhou et al., 2010)、重金属(Leupin et al., 2005)、偶氮染料(Nam et al., 2000)及硝酸盐(Guo et al., 2015)等, 被广泛应用于水环境污染治理.但由于零价铁自身的理化性质, 致使零价铁对某些难降解污染物的处理效率较低, 反应速率慢;而且随着反应的进行, 零价铁表面会形成钝化层, 导致反应活性降低, 从而限制了零价铁的广泛使用.
Wang等(1997)利用硼氢化钠(NaBH4)还原铁离子(Fe3+)制得纳米级零价铁, 研究表明, 该方法制得的纳米级零价铁粒径为1~100 nm, 比表面积高达33.5 m2·g-1, 有效地提高了零价铁对于污染物的吸附能力, 促进了污染物与零价铁的接触, 提高了零价铁的反应速率和反应活性.纳米零价铁(nZVI), 可有效还原多种污染物, 如卤代烃、卤代芳烃、金属、偶氮染料及硝酸盐等, 应用于水环境污染治理.但纳米零价铁因其超微颗粒的表面效应及磁力, 在应用中易发生团聚现象;同时, 纳米零价铁的化学性质活泼, 表面易被氧化成铁氧化物及氢氧化物, 阻碍反应进行, 失去活性位点;并且纳米零价铁颗粒粒径小, 达到纳米级, 使其难以回收和重复使用.为了推动纳米零价铁还原技术在污染物治理中的应用, 多种改进技术应运而生(Guan et al., 2015).
为提高零价铁的反应活性, 人们将一小部分具有更高还原电位的贵金属负载到纳米零价铁颗粒表面从而构成双金属(Harendra et al., 2008).引入的贵金属可以通过吸附铁在水中腐蚀产生的H2, 并将其嵌入晶格形成强还原性[H], 从而促进纳米零价铁表面腐蚀反应的进行(Bransfield et al., 2007;徐新华等, 2004).钯、镍、银、铜、铂、钴等(O′Carroll et al., 2013;黄园英等, 2007)常作为掺杂金属, 可使纳米零价铁铁得到更有效的利用.采用壳聚糖(Kustov et al., 2011)、硅土(Kustov et al., 2014)、膨润土(Su et al., 2011)、活性炭(Choi et al., 2008)等为载体使纳米铁有效地分散在载体表面, 可防止纳米铁的聚集沉降, 提高纳米颗粒的稳定性及反应活性.Kakavandi等(2014)将纳米Ag/Fe负载在活性炭上制备成复合材料并用于Cr(Ⅵ)的吸附还原, 结果表明, 由于活性炭的吸附作用, 水中的Cr(Ⅵ)能够快速地吸附到材料表面被零价铁还原.Choi等(2008)以粒状活性炭为载体, 制得负载型纳米Pd/Fe复合材料, 并用于多氯联苯的去除, 结果发现, 粒状活性炭的介孔抑制了铁晶体的成长, 使得复合材料粒径可保持在20 nm以内;活性炭的引入加强了复合材料对多氯联苯的吸附能力, 使得物理吸附和还原脱氯同时进行, 大大提升了反应效率.此外, 将双金属纳米颗粒负载在聚偏氟乙烯微滤膜(Parshetti et al., 2009)、尼龙(Parshetti et al., 2009)、纤维素乙酸酯薄膜(Wu et al., 2008)、聚丙烯酸/聚乙烯醇纳米纤维(Hui et al., 2012)等微滤膜的膜孔内, 也能稳定纳米颗粒.Parshetti等(2009)用亲水尼龙66薄膜固定Ni/Fe纳米颗粒, 该颗粒多次循环使用后痕量的Ni/Fe仍能快速完全脱氯三氯乙烯, 表明亲水尼龙66薄膜固定可以提高双金属纳米颗粒的反应活性和使用寿命.
Fe3O4纳米粒子常被用作环境污染治理中的吸附剂(Parsons et al., 2014).Fe3O4具有一定的导电性及磁性, 将其包覆在纳米Pd/Fe表面, 可为污染物与纳米Pd/Fe之间的电子转移提供电子通道;还可通过磁性作用分散纳米Pd/Fe颗粒, 吸附铁氧化物, 减少纳米Pd/Fe颗粒表面钝化层的生成, 从而提高纳米Pd/Fe的还原活性, 促进纳米Pd/Fe对含氯有机物的催化脱氯作用, 提高含氯有机物的去除效率.因此, 本研究以2, 4-D为目标污染物, 制备纳米级Fe3O4-Pd/Fe复合材料并进行催化还原脱氯研究, 探究其脱氯效果.同时, 考察纳米Fe3O4投加量、pH、钯化率、温度等因素对催化脱氯效果的影响, 分析nFe3O4-Pd/Fe复合材料对2, 4-D的脱氯作用, 并探讨其催化脱氯机制, 以期为零价铁还原脱氯技术的实际应用提供理论支持.
2 材料与方法(Materials and methods) 2.1 实验试剂2, 4-二氯苯氧乙酸(2, 4-D, C8H6Cl2O3, 纯度98%)、2-氯苯氧乙酸(2-CPA, C8H7ClO3, 纯度98%)、4-氯苯氧乙酸(4-CPA, 纯度98%)、苯氧乙酸(PA, C8H8O3, 纯度98%)均购自Alfa Aesar公司, 氯钯酸钾(K2PdCl6, 含量99%)购自Sigma-Aldrich, 高效液相色谱(HPLC)所用甲醇为色谱纯, 硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)及其它试剂均为分析纯, 实验用水为通氮去离子水.
2.2 实验方法 2.2.1 纳米Pd/Fe颗粒制备称取一定量的FeSO4·7H2O, 溶解后倒入三口烧瓶中, 逐滴滴入NaBH4溶液, 反应一段时间后, 加入配好的K2PdCl6溶液, 制备得纳米Pd/Fe.
2.2.2 纳米Fe3O4颗粒制备采用共沉淀法制备纳米级Fe3O4, 首先称取一定量的FeSO4·7H2O和FeCl3, 溶解并转移至三口烧瓶, 待混合液搅拌均匀后, 以恒流泵加入一定量的沉淀剂NH3·H2O, 制备得到纳米Fe3O4颗粒.
2.2.3 nFe3O4-Pd/Fe复合材料的制备称取一定量的FeSO4·7H2O, 用通氮去离子水溶解后转移至装有新制备的纳米Fe3O4的三口烧瓶中, 在氮气保护下, 逐滴滴加NaBH4溶液, 反应一段时间后, 加配好的K2PdCl6溶液, 制得nFe3O4-Pd/Fe颗粒.
2.2.4 nFe3O4-Pd/Fe复合材料还原脱氯实验将制备好的nFe3O4-Pd/Fe颗粒放入三口烧瓶, 将反应瓶置于恒温水槽中, 随后加入2, 4-D溶液, 开启搅拌器进行反应.反应进行180 min, 不同时间间隔取样.实验过程中持续往反应瓶中通N2以维持厌氧环境.
2.3 分析方法2, 4-D用高效液相色谱(Agilent 1200)进行分析, 色谱操作条件:ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×150 mm, 5 μm), 柱温30.0 ℃, 流速1.0 mL·min-1, 流动相为甲醇水溶液(V甲醇:V水= 60:40, 磷酸调节甲醇的pH约为3.2), 紫外检测波长为210 nm, 进样量为5.0 μL.
3 结果与讨论(Results and discussion) 3.1 nFe3O4-Pd/Fe复合材料催化脱氯2, 4-D图 1所示为还原脱氯过程中各有机物浓度的变化情况.由图可知, 反应初期, 2, 4-D浓度快速降低, 反应90 min后, 去除率达到100%, 最终产物苯氧乙酸(PA)的生成率达99.8%.在整个反应过程中, 2, 4-D主要先被还原为2-CPA, 而4-CPA基本检测不到, 继而再被还原为最终产物PA.2-CPA仅作为中间产物出现, 浓度一直维持在较低水平, 在反应20 min时达到最大值0.04 mmol·L-1.图 1中“总碳”变化曲线显示, 反应前20 min, 总碳量略有下降, 主要是由于nFe3O4-Pd/Fe对2, 4-D的吸附作用.随着反应的进行, 总碳量逐渐恢复并维持在97.0%~99.0%, 存在少量的碳损失.可能是部分有机物被nPd/Fe表面钝化层吸附并覆盖, 而nPd/Fe表面的非反应活性位也可能吸附了一部分有机物(Clark et al., 2003;Shin et al., 2008).
 |
| 图 1 nFe3O4-Pd/Fe对2, 4-D的还原脱氯过程 (nFe3O4 1.0 g·L-1, nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1(0.18 mmol·L-1), T=25.0 ℃, 钯化率0.15%, 转速200 r·min-1, pH=7.0) Fig. 1 Dechlorination process of 2, 4-D by Fe3O4-Pd/Fe nanoparticles |
纳米Fe3O4投加量对nFe3O4-Pd/Fe去除2, 4-D的影响见图 2.由图可知, 不同的Fe3O4/Fe质量比会造成nFe3O4-Pd/Fe复合材料还原性能的差异.控制纳米Fe投加量为1.0 g·L-1, 通过调节纳米Fe3O4的投加量, 可与Fe构成不同质量比的nFe3O4-Pd/Fe复合材料.从图 2a中可以看出, 当纳米Fe3O4投加量为0 g·L-1 (Pd/Fe体系)时, 反应180 min后2, 4-D的去除率仅为35.9%;纳米Fe3O4投加量为0.5 g·L-1(m(Fe3O4):m(Fe)=1:2)时, 反应180 min后2, 4-D的去除率达到90.4%.随着纳米Fe3O4投加量从1.0、1.5、2.0、2.5 g·L-1提高到3.0 g·L-1, 反应速率逐渐加快, 反应180 min后, 2, 4-D的去除率均达到100%.当纳米Fe3O4投加量为3.5 g·L-1(m(Fe3O4):m(Fe)=7:2), 反应180 min后, 2, 4-D去除率仅为49.9%, 比投加量为2.5 g·L-1时降低了50.1%.适当提高nFe3O4-Pd/Fe中Fe3O4/Fe质量比, 可有效增强复合材料对2, 4-D的去除效果.从图 2b中可看出, PA生成率的趋势与2, 4-D的去除趋势相近.但纳米Fe3O4投加量对PA生成的影响更大, 较少或过量的纳米Fe3O4不仅会引起PA生成率的显著下降, 还会造成部分中间产物无法还原, 致使PA生成率远低于2, 4-D最终去除率.如0.5 g·L-1纳米Fe3O4投加量下(m(Fe3O4):m(Fe)=1:2), 90.4%的2, 4-D被去除, 却只有78.9%的PA生成;而3.5 g·L-1纳米Fe3O4投加量下(m(Fe3O4):m(Fe)=7:2), 2, 4-D去除率为49.9%, PA生成率仅为24.9%.
 |
| 图 2 纳米Fe3O4投加量对nFe3O4-Pd/Fe催化脱氯2, 4-D的影响(a.2, 4-D, b.PA) (nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1, T=25.0 ℃, 钯化率0.15%, pH=7.0, 转速200 r·min-1) Fig. 2 Effect of Fe3O4 dosage on 2, 4-D dechlorination by Fe3O4-Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
适当提高纳米Fe3O4投加量, 增大其在nFe3O4-Pd/Fe中的比率, 不仅可以有效增强其对2, 4-D的去除效果, 还可以提高反应速率, 缩短反应时间.纳米Fe3O4的引入对于Pd/Fe还原脱氯活性的增强由多方面的综合影响导致, 其主要原因有以下几点:①Fe3O4具有一定的磁性, 利用其包覆于纳米Pd/Fe表面, 使纳米颗粒保持分散, 能够起到较好的稳定作用;②Fe3O4可能吸引Pd/Fe颗粒表面由铁腐蚀氧化生成的氧化物, 在一定程度上阻碍钝化层的形成, 保留较多的反应活性位, 从而提高反应速率;③Fe3O4是一种带隙很窄的半导体, 具有一定的导电性质, 它的电阻为10-3 Ω·cm, 位于Fe和Fe2O3之间(Pascual et al., 2004), 可作为良好的电子通道为Pd/Fe颗粒传递电子, 促进还原反应的进行.但过量的Fe3O4容易紧密堆积于纳米Pd/Fe表面, 阻碍污染物分子与纳米颗粒表面的活性位点接触, 降低反应效率(Bae et al., 2010;Lv et al., 2012).单位体积中过多的Fe3O4意味着颗粒间碰撞几率的增加, 容易引起nFe3O4-Pd/Fe团聚, 降低反应活性.
3.3 初始pH对2, 4-D催化脱氯的影响初始pH对纳米Fe3O4-Pd/Fe复合材料催化脱氯2, 4-D的影响如图 3所示.从图 3可以看出, 2, 4-D去除率与PA生成率趋势相近, 但PA的生成存在一定的滞后.较高或较低的初始pH均不利于2, 4-D的催化脱氯.当初始pH分别为6.0、7.0、8.0时, 在nFe3O4-Pd/Fe的作用下, 反应180 min后, 2, 4-D的去除率可达到100%, 产物PA生成率分别达到99.5%、100%、95.6%.随着pH提高(pH=9.0、10.0), 2, 4-D的去除效果显著下降, 反应180 min后, 去除率分别为73.3%和26.3%, 产物PA生成率分别为32.0%、3.6%.当初始pH降至5.0时, 2, 4-D的去除率也有所下降, 反应180 min后, 去除率仅为63.3%, 产物PA生成率为29.1%.
 |
| 图 3 初始pH对nFe3O4-Pd/Fe催化脱氯2, 4-D的影响(a.2, 4-D, b.PA) (nFe3O4 1.0 g·L-1, nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1, T=25.0 ℃, 钯化率0.15%, 转速200 r·min-1) Fig. 3 Effect of initial pH on 2, 4-D dechlorination by Fe3O4-Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
在纳米Pd/Fe体系中, Fe-H2O腐蚀生成H2, 催化剂Pd对2, 4-D还原进行催化加氢, 推动脱氯反应进行.pH值增高不利于Fe0表面腐蚀产生H2(Liu et al., 2001), 且易形成铁的氢氧化物沉淀附着在Fe0颗粒表面, 形成钝化层, 阻碍反应进行(Shih et al., 2011).当然, 在较低pH值条件下, 溶液中大量存在的H+引起Fe0的快速消耗, 产生的过量H2以气泡形式吸附于纳米铁颗粒表面, 阻碍了污染物接近纳米铁表面活性反应位(Graham et al., 1999).此外, 过低的pH还会溶解复合材料中的一部分Fe3O4, 通过破坏复合材料组成, 降低了整个催化剂的反应活性.因此, 弱酸性及中性条件有利于nFe3O4-Pd/Fe催化脱氯2, 4-D.
3.4 钯化率对2, 4-D还原脱氯的影响钯化率对纳米Fe3O4-Pd/Fe去除2, 4-D的影响如图 4所示.图 4a显示, 随着钯化率从0.05%、0.10%、0.15%增加到0.20%, 反应180 min后, 2, 4-D的去除率分别为36.0%、98.4%、100%和100%.由图 4b可知, PA生成率随钯化率的增加而提高, 钯化率为0.15%和0.20%时, 反应120 min后, PA的生成率均达到100%.
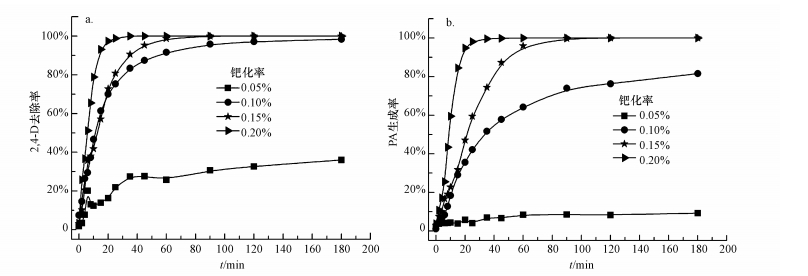 |
| 图 4 钯化率对nFe3O4-Pd/Fe还原脱氯2, 4-D的影响(a.2, 4-D, b.PA) (nFe3O4 1.0 g·L-1, nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1, T=25.0 ℃, pH=7.0, 转速200 r·min-1) Fig. 4 Effect of Pd loading on 2, 4-D dechlorination by Fe3O4-Pd/Fe nanoparticles (a. 2, 4-D, b. PA) |
作为高氧化还原电位金属, 金属钯可促进nFe3O4-Pd/Fe对2, 4-D的去除, 增大其在体系中的比例, 可有效提高纳米复合材料的还原能力.金属钯的引入能够产生诱导腐蚀效应, 加快零价铁的腐蚀, 产生足量H2;同时, 金属钯具有较好的吸氢作用, 其吸氢量是自身含量的900倍(Zhang et al., 2010), 可将H2转化为还原性更强的活性氢H, 大大提高2, 4-D的还原效率.金属钯可作为阴极(Yang et al., 2007)与零价铁构成原电池, 通过两者间的电子传递有效提高2, 4-D的还原效率.
3.5 温度对2, 4-D催化脱氯的影响反应温度对2, 4-D催化脱氯的影响如图 5所示.从图 5可以看出, 在实验考察的20.0~40.0 ℃温度范围内, 2, 4-D均能得到较好的去除, 反应180 min后, 2, 4-D的最终去除率维持在98.0%~100%.温度对2, 4-D去除的影响主要体现在反应前35 min, 当温度为20.0、25.0、30.0 ℃时, 反应35 min, 2, 4-D的去除率逐步提高, 分别达到87.0%、90.2%、100%, 相应的, PA生成率分别为70.5%、84.7%、100%.随着温度升高至35.0、40.0 ℃, 2, 4-D的去除率又呈下降趋势, 反应35 min后, 去除率分别为97.9%和84.5%, PA生成率也分别降至92.0%、69.6%.出现这种现象的原因可能是多方面的综合影响:在一定范围内(20.0~30.0 ℃)适当提高反应温度, 能够提高污染物2, 4-D的溶解度和分子平均动能, 有利于其向纳米Fe3O4-Pd/Fe颗粒表面扩散, 增大接触几率, 随着温度的提高, 反应中的活化分子数也会明显增加, 从而加快了反应速率(Xu et al., 2012).但温度对于反应的促进作用也是有限的, 在较高温度(35.0、40.0 ℃)下, 分子运动急剧加速, nFe3O4-Pd/Fe更容易团聚成大颗粒, 导致颗粒表面活性位减少.此外, 高温还会加速零价铁的氧化, 加快表面钝化层形成, 使得零价铁反应活性降低.当高温所带来的抑制作用超出其对反应的促进作用时, 也就导致了2, 4-D去除效率的降低.
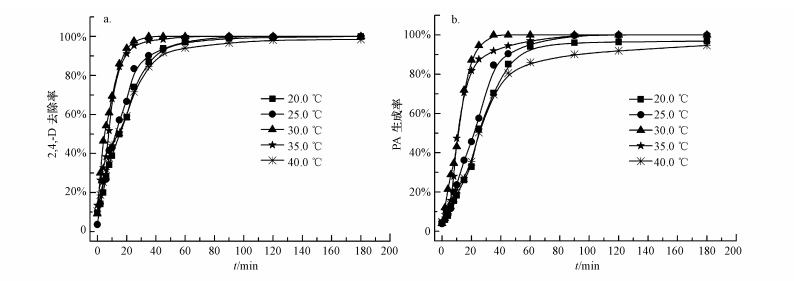 |
| 图 5 温度对nFe3O4-Pd/Fe还原脱氯2, 4-D的影响(a.2, 4-D, b.PA) (nFe3O4 1.0 g·L-1, nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1, pH=7.0, 钯化率0.15%, 转速200 r·min-1) Fig. 5 Effect of temperature on 2, 4-D dechlorination by Fe3O4-Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
图 6分别显示了nPd/Fe和nFe3O4-Pd/Fe反应前、后的透射电镜图.由图 6a、6c可看出, nPd/Fe颗粒粒径较nFe3O4大, nFe3O4包覆于nPd/Fe颗粒外围, 结构紧密, 颗粒分散良好.比较图 6各子图可以看出, nPd/Fe和nFe3O4-Pd/Fe在还原脱氯过程中氧化是不可避免的, 经过还原脱氯反应后, nFe3O4-Pd/Fe纳米颗粒稍有团聚, 颗粒粒径有所增大, 结构较松散, 但程度较轻, 视野范围内仍清晰可见较多单颗分散的nFe3O4-Pd/Fe.纳米Fe3O4包覆于Pd/Fe颗粒外围, 能在一定程度分散Pd/Fe颗粒, 防止其团聚, Fe3O4作为一种磁性材料亦可吸收一部分磁性铁氧化物, 抑制氧化层的持续增厚.
 |
| 图 6 反应前(a)、后(b)nPd/Fe和反应前(c)、后(d)nFe3O4-Pd/Fe的透射电镜图 Fig. 6 TEM images of nPd/Fe(a, b) and nFe3O4-Pd/Fe(c, d) nanoparticles before and after reaction |
图 7为相同放大倍率下的nFe3O4-Pd/Fe复合材料反应前后的扫描电镜图.从图 7a中可以看出, 反应前颗粒为均匀球形且表面光滑, 亮度统一.反应后颗粒与反应前颗粒相比, 表面光滑程度虽有少许差异但大致呈光滑均匀小球, 且反应后颗粒间仍保持较好的分散性(图 7b).说明nFe3O4-Pd/Fe复合材料颗粒保持相对稳定, 颗粒表面钝化层的形成减缓, 使其反应活性维持在较高的水平.
 |
| 图 7 nFe3O4-Pd/Fe扫描电镜图 (a.反应前, b.反应后) Fig. 7 SEM images of Fe3O4-Pd/Fe nanoparticles before(a) and after(b) reaction |
实验基准条件下, 采用原位连续实验, 对nFe3O4-Pd/Fe进行3轮循环利用, 循环利用过程中各物质浓度变化情况如图 8所示.由图 8a可知, 随着循环次数的增加, nFe3O4-Pd/Fe还原活性逐渐下降, 3轮循环中2, 4-D最终去除率分别为100%、83.0%和60.3%.由图 8b可知, 2-CPA作为一个中间产物, 在每轮实验中都呈先上升后下降趋势.在第一轮反应中, 2-CPA达到最高浓度所需的时间及持续存在的时间最短, 随后逐渐增长.由此说明, nFe3O4-Pd/Fe反应活性对2, 4-D二级脱氯反应的影响明显高于一级脱氯.由图 8c可知, 溶液中的最终产物PA浓度持续增大, 增加速率随着时间显著降低.其原因一方面是经过多次循环利用, 颗粒表面氧化及相互间的团聚逐渐会加重, 造成nFe3O4-Pd/Fe反应活性降低; 另一方面, 溶液中大量的PA、2-CPA会占据颗粒表面反应活性位, 阻碍反应的进一步进行.但经过多次循环利用的nFe3O4-Pd/Fe仍可去除溶液中大部分2, 4-D.通过调整反应条件及对颗粒进行酸洗等手段还可进一步增强其回收利用效率.
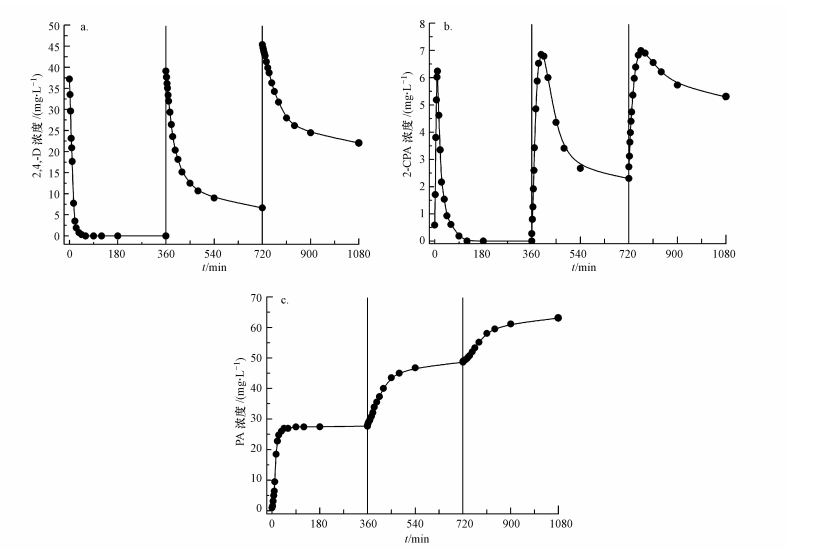 |
| 图 8 纳米Fe3O4-Pd/Fe还原脱氯2, 4-D循环利用结果 (nFe3O4 1.0 g·L-1, nFe 1.0 g·L-1, C02, 4-D=40.0 mg·L-1, T=25.0 ℃, 钯化率0.15%, pH=7.0, 转速200 r·min-1) Fig. 8 Three consecutive dechlorination of 2, 4-D by Fe3O4-Pd/Fe nanoparticles |
由2, 4-D还原脱氯过程中各物质随反应时间的变化(图 1)及相关文献(Sun et al., 2006)可知, nFe3O4-Pd/Fe对2, 4-D的还原脱氯存在以下过程.①活性H的生成:在无氧反应过程中, 当铁进入水环境时会与水发生反应, 零价铁腐蚀产生H2(式(1)).钯是优良的加氢催化剂, 对氢的转移起了重大作用, 钯吸附H2, 将其转化为还原性更强的活性H (式(2)).②加氢还原:活性H攻击2, 4-D并取代氯原子生成脱氯产物PA (式(3)).③形成钝化层:铁进入水环境时生成亚铁离子被氧化生成铁的氧化物, 在铁表面生成一层氧/氢氧化铁(FeOOH)钝化层(式(4)), 在铁表面阻止零价铁再次氧化, 形成壳-核结构.

|
(1) |
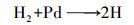
|
(2) |

|
(3) |

|
(4) |
由图 2可知, 纳米Pd/Fe对2, 4-D的去除率最高为35.9%, 而同等条件下, nFe3O4-Pd/Fe体系中2, 4-D去除率随纳米Fe3O4投加量的增加而提高.当m(Fe3O4):m(Fe)为5:2时, 2, 4-D的去除率最高达到100%, 是无Fe3O4体系的近3倍.这是由于纳米Fe3O4附着于Pd/Fe颗粒外围, 不仅在一定程度上分散纳米Pd/Fe颗粒, 防止其团聚, 还作为电子通道为零价铁传递电子, 相当于增加了纳米Pd/Fe颗粒总反应面积, 为污染物与催化材料的接触提供了更多机会.Fe3O4作为一种磁性材料可以吸引一部分磁性铁氧化物, 阻碍钝化层形成, 抑制氧化层的持续增厚.与未引入Fe3O4的纳米Pd/Fe体系相比, 变薄的氧化层可减弱其对零价铁表面反应活性位的覆盖, 保持零价铁的高还原活性.另外, 具有磁性的Fe3O4负载在零价铁的表面, 为复合材料在外加磁场下的分离回收提供了便利.
4 结论(Conclusions)1) 纳米Fe3O4-Pd/Fe复合材料体系比纳米Pd/Fe体系具有更高的反应活性.Fe3O4作为电子通道能有效促进污染物与Pd/Fe之间的电子转移;还可通过磁性作用分散Pd/Fe颗粒, 吸附铁氧化物质, 减缓Pd/Fe纳米颗粒表面钝化层的生成, 从而提高纳米Pd/Fe还原活性.
2) 纳米Fe3O4-Pd/Fe复合材料催化脱氯2, 4-D的主要影响因素为:初始pH、钯化率、反应温度及纳米Fe3O4投加量(Fe3O4/Fe质量比)等.结果表明, 较高的钯化率、反应温度、Fe3O4/Fe质量比及中性pH条件均有利于2, 4-D催化还原脱氯的进行.
3) 纳米Fe投加量为1.0 g·L-1, Fe3O4:Fe质量比为1:1, 初始pH为7.0, 反应温度为25.0 ℃, 钯化率为0.15%的条件下, 2, 4-D初始浓度为40.0 mg·L-1, 反应90 min后, 2, 4-D的去除率达到100%, PA的生成率为99.8%.
4) TEM、SEM表征结果显示, Fe3O4包覆于Pd/Fe颗粒外围, 结构紧密, 颗粒分散良好, 反应后nFe3O4-Pd/Fe颗粒表面钝化层较薄且团聚程度较轻, 视野范围内仍清晰可见较多单颗分散的nFe3O4-Pd/Fe.颗粒间仍保持较好的分散性, 体系保持相对稳定.
Bransfield S J, Cwiertny D M, Livi K, et al. 2007. Influence of transition metal additives and temperature on the rate of organohalide reduction by granular iron:Implications for reaction mechanisms[J]. Applied Catalysis B Environmental, 76(3/4): 348–356.
|
Bae S, Lee W. 2010. Inhibition of nZVI reactivity by magnetite during the reductive degradation of 1, 1, 1-TAC in n ZVI/magnetite suspension[J]. Applied Catalysis B:Environmental, 96(1/2): 10–17.
|
Chaparadza A, Hossenlopp J M. 2011. Removal of 2, 4-dichlorophenoxyacetic acid by calcined Zn-Al-Zr layered double hydroxide[J]. Journal of Colloid & Interface Science, 363(1): 92–97.
|
Choi H, Al-abed S R, Agarwa S, et al. 2008. Synthesis of reactive nano-Fe/Pd bimetallic system-impregnated activated carbon for the simultaneous adsorption and dechlorination of PCBs[J]. Chemistry of Materials, 20(11): 3649–3655.
DOI:10.1021/cm8003613
|
Clark C J, Rao P S C, Annable M D. 2003. Degradation of perchloroethylene in cosolvent solutions by zero-valent iron[J]. Journal of Hazardous Materials, 96(1/3): 65–78.
|
Guo X, Yang Z, Liu H, et al. 2015. Common oxidants activate the reactivity of zero-valent iron (ZVI) and hence remarkably enhance nitrate reduction from water[J]. Separation & Purification Technology, 146: 227–234.
|
Guan X, Sun Y, Qin H, et al. 2015. The limitations of applying zero-valent iron technology in contaminants sequestration and the corresponding countermeasures:The development in zero-valent iron technology in the last two decades (1994-2014)[J]. Water Research, 75: 224–248.
DOI:10.1016/j.watres.2015.02.034
|
Graham L J, Jovanovic G. 1999. Dechlorination of p-chlorophenol on a Pd/Fe catalyst in a magnetically stabilized fluidized bed; Implications for sludge and liquid remediation[J]. Chemical Engineering Science, 54(15/16): 3085–3093.
|
Harendra S, Vipulanandan C. 2008. Degradation of high concentrations of PCE solubilized in SDS and biosurfactant with Fe/Ni bi-metallic particles[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 322(1/3): 6–13.
|
Hui M, Huang Y, Shen M, et al. 2012. Enhanced dechlorination of trichloroethylene using electrospun polymer nanofibrous mats immobilized with iron/palladium bimetallic nanoparticles[J]. Journal of Hazardous Materials, 211(2): 349–356.
|
黄园英, 刘菲, 汤鸣臬, 等. 2007. 纳米镍/铁和铜/铁双金属对四氯乙烯脱氯研究[J]. 环境科学学报, 2007, 27(1): 80–85.
|
Kustov L M, Finashina E D, Shuvalova E V, et al. 2011. Pd-Fe nanoparticles stabilized by chitosan derivatives for perchloroethene dechlorination[J]. Environmental International, 37(6): 1044–1052.
DOI:10.1016/j.envint.2011.05.003
|
Kustov L M, Al-Abed S R, Virkutyte J, et al. 2014. Novel Fe-Pd/SiO2 catalytic materials for degradation of chlorinated organic compounds in water[J]. Pure & Applied Chemistry, 86(7): 1141–1158.
|
Kakavandi B, Kalantary R R, Farzadkia M, et al. 2014. Enhanced chromium(Ⅵ) removal using activated carbon modified by zero valent iron and silver bimetallic nanoparticles[J]. Journal of Environmental Health Science and Engineering, 12(1): 115–124.
DOI:10.1186/s40201-014-0115-5
|
Leupin O X, Hug S J. 2005. Oxidation and removal of arsenic (Ⅲ) from aerated groundwater by filtration through sand and zero-valent iron[J]. Water Research, 39(9): 1729–1740.
DOI:10.1016/j.watres.2005.02.012
|
Lv X S, Xu J, Jiang G M, et al. 2012. Highly active nanoscale zero-valent iron (nZVI)-Fe3O4 nanocomposites for the removal of chromium(Ⅵ) from aqueous solutions[J]. Journal of Colloid Interface Science, 369(1): 460–469.
DOI:10.1016/j.jcis.2011.11.049
|
Liu Y H, Yang F L, Chen G H, et al. 2001. Catalytic dechlorination of chlorophenols in water by palladium/iron[J]. Water Research, 35(8): 1887–1890.
DOI:10.1016/S0043-1354(00)00463-2
|
Nam S, Tratnyek P G. 2000. Reduction of azo dyes with zero-valent iron[J]. Water Research, 34(6): 1837–1845.
DOI:10.1016/S0043-1354(99)00331-0
|
Nejati K, Davary S, Saati M. 2013. Study of 2, 4-dichlorophenoxyacetic acid (2, 4-D) removal by Cu-Fe-layered double hydroxide from aqueous solution[J]. Applied Surface Science, 280(9): 67–73.
|
O'Carroll D, Sleep B, Krol M, et al. 2013. Nanoscale zero valent iron and bimetallic particles for contaminated site remediation[J]. Advances in Water Resources, 51(1): 104–122.
|
Parshetti G K, Doong R. 2009. Dechlorination of trichloroethylene by Ni/Fe nanoparticles immobilized in PEG/PVDF and PEG/nylon 66 membranes[J]. Water Research, 43(12): 3086–3094.
DOI:10.1016/j.watres.2009.04.037
|
Parsons J G, Hernandez J, Gonzalez C M, et al. 2014. Sorption of Cr(Ⅲ) and Cr(Ⅵ) to high and low pressure synthetic nano-magnetite (Fe3O4) particles[J]. Chemical Engineering Journal, 254(7): 171–180.
|
Pascual A, Ares J R, Ferrer I J, et al. 2004. Electrical resistance evolution of thin films during their sulphuration process[J]. Applied Surface Science, 234(1/4): 355–361.
|
Song Y. 2014. Insight into the mode of action of 2, 4-dichlorophenoxyacetic acid (2, 4-D) as an herbicide[J]. Journal of Integrative Plant Biology, 56(2): 106–113.
DOI:10.1111/jipb.v56.2
|
Su J, Lin S, Chen Z L, et al. 2011. Dechlorination of p-chlorophenol from aqueous solution using bentonite supported Fe/Pd nanoparticles:synthesis, characterization and kinetics[J]. Desalination, 280(1/3): 167–173.
|
Shin M, Choi H, Kim D, et al. 2008. Effect of surfactant on reductive dechlorination of trichloroethylene by zero-valent iron[J]. Desalination, 223(1/3): 299–307.
|
Shih Y H, Hsu C Y, Su Y F. 2011. Reduction of hexachlorobenzene by nanoscale zero-valent iron:Kinetics, pH effect, and degradation mechanism[J]. Separation and Purification Technology, 76(3): 268–274.
DOI:10.1016/j.seppur.2010.10.015
|
Sun Y P, Li X Q, Cao J, et al. 2006. Characterization of zero-valent iron nanoparticles[J]. Advances in Colloid & Interface Science, 120(1/3): 47–56.
|
Wang S, Ge L, Li L, et al. 2013. Molecularly imprinted polymer grafted paper-based multi-disk micro-disk plate for chemiluminescence detection of pesticide[J]. Biosensors & Bioelectronics, 50(23): 262–268.
|
Wang C B, Zhang W X. 1997. Synthesizing Nanoscale iron particles for rapid and complete dechlorination of TCE and PCBs[J]. Environmental Science Technology, 31(7): 2154–2156.
DOI:10.1021/es970039c
|
Wu L, Ritchie S M C. 2008. Enhanced dechlorination of trichloroethylene by membrane-supported Pd-coated iron nanoparticles[J]. Environmental Progress, 27(2): 218–224.
DOI:10.1002/ep.v27:2
|
Xu L J, Wang J L. 2012. Fenton-like degradation of 2, 4-dichlorophenol using Fe3O4 magnetic nanoparticles[J]. Applied Catalysis B:Environmental, 123: 117–126.
|
徐新华, 金剑, 卫建军, 等. 2004. 纳米Pd/Fe双金属对2, 4-二氯酚的脱氯机理及动力学[J]. 环境科学学报, 2004, 24(4): 561–567.
|
Yang B, Yu G, Liu X. 2007. Electrochemical hydrodechlorination of 4-chlorobiphenyl in aqueous solution with the optimization of palladium-loaded cathode materials[J]. Electrochimica Acta, 52(3): 1075–1081.
|
Zhou H Y, Wang S C, Sheng G D. 2010. Catalytic dechlorination and detoxification of 1-(2-chlorophenyl) ethanol by Pd/Fe[J]. Journal of Zhejiang University-Science A, 11(5): 356–362.
DOI:10.1631/jzus.A0900469
|
Zhang Z, Shen Q, Cissoko N, et al. 2010. Catalyticdechlorination of 2, 4-dichlorophenol by Pd/Fe bimetallic nanoparticles in the presence of humic acid[J]. Journal of Hazardous Materials, 182(1/3): 252–258.
|
 2018, Vol. 38
2018, Vol. 38


