2. 山西省生态环境研究中心, 太原 030009
2. The Research Center for Eco-Environmental Science in Shanxi, Taiyuan 030009
生物膜是由附着于固体载体表面的微生物和其自身分泌的胞外聚合物(EPS)所形成的结构性微生物群落(Costerton et al., 1999).有害生物膜的形成会给很多领域带来不利影响, 如医疗器械表面的生物膜会造成病人感染(Zodrow et al., 2012), 饮用水管网污染生物膜会造成管道腐蚀及水污染(Percival et al., 1999;Shaw et al., 2014), 生物膜还会造成净水设备膜材料表面污染(Yu et al., 2012), 因此, 如何有效抑制有害生物膜的形成成为很多领域面临的严峻挑战.
以往人们采用传统的杀菌/抗菌剂通过杀死微生物细胞来抑制生物膜的形成(夏金兰等, 2004).在这些传统的抗菌剂中, 氯是目前世界上使用最广泛的饮用水消毒剂, 广泛用于饮用水处理和输配系统中(Kim et al., 2009).银离子和纳米银是应用广泛、杀菌效果优异的无机非金属杀菌剂(Rai et al., 2009).然而, 长期使用这些传统杀菌/抑菌剂往往会造成细菌耐药性的增加.
近年来有研究发现, 一些信号小分子物质参与生物膜形成与解体过程的调控(张志刚等, 2011).这些小分子通过非杀菌机制抑制生物膜, 因此, 不会产生细菌耐药性的问题.例如, 双(3-氨基丙基)胺能够直接地、特异性地和EPS中的胞外多糖发生反应, 从而抑制生物膜的形成(Si et al., 2014).香兰素通过抑制N-酰基-高丝氨酸内酯(N-acyl-homoserine lactone, AHL, acyl-HSL)来干扰细菌的群体感应(Quorum sensing, QS)系统, 从而抑制生物膜的形成(Ponnusamy et al., 2009).溴代呋喃酮通过和AHLs竞争受体蛋白, 或干扰呋喃酰硼酸二酯(Furan acyl boric acid ester, autoinducer-2, AI-2)来干扰细菌的QS系统, 从而抑制生物膜的形成(Jang et al., 2013; Shetye et al., 2013).
目前, 利用传统杀菌剂抑制单一纯菌生物膜形成的研究比较多, 而针对污水处理系统混合菌形成的复杂生物膜, 传统杀菌剂及小分子物质对其抑制效果尚不明确, 有待于深入研究.因此, 本研究选用银和氯作为传统抗菌剂, 选用双(3-氨基丙基)胺、香兰素和(Z-)-4-溴-5-(溴乙烯)-2(5H)-呋喃酮(BBF)作为小分子物质, 比较这些传统抗菌剂和小分子对污水处理系统中混合菌生物膜形成的抑制效应, 筛选效果较好的传统抗菌剂和小分子物质, 并通过测定传统抗菌剂和小分子物质对微生物生长的影响, 分析其抑制混合菌生物膜形成的可能机理, 以期为生物膜污染控制方法提供一定的理论基础.
2 材料与方法(Materials and methods) 2.1 化学试剂和微生物双(3-氨基丙基)胺和BBF购于Sigma Aldrich (St. Louis, MO), 香兰素购自生工生物工程上海(股份)有限公司.双(3-氨基丙基)胺、香兰素和BBF的化学结构见图 1.双(3-氨基丙基)胺和香兰素溶于超纯水, 实验过程中所用的超纯水(电导率为18.2 MΩ·cm)由Milli-Q梯度系统(Millipore, Bedford, MA)生产.BBF溶于纯乙醇(99%)制得40 mg·L-1的BBF储备液.
 |
| 图 1 双(3-氨基丙基)胺(a)、香兰素(b)和BBF (c)的化学结构 Fig. 1 Chemical structures of norspermidine(a), vanillin (b) and BBF (c) |
混合菌取自北京清河污水处理厂的活性污泥.活性污泥首先用磷酸盐缓冲溶液(PBS)冲洗3遍, 然后通过离心(5000 r·min-1)收集, 将收集的活性污泥重悬于配置的模拟废水中, 制备混合菌菌悬液(100 mg·L-1, 大约108 CFU·mL-1).模拟废水成分为(mg·L-1):COD(以葡萄糖计算) 825, NH4Cl 192, KH2PO4 35.1, NaCl 100, MgSO4 100, CaCl2 10.
2.2 不同传统抗菌剂和小分子物质对混合菌生物膜形成的抑制作用为研究不同传统抗菌剂和小分子对生物膜形成的抑制作用, 选择银和氯作为传统抗菌剂, 双(3-氨基丙基)胺、香兰素和BBF作为小分子.首先在12孔板的每个孔内加入3 mL上述制备好的混合菌菌悬液, 混合菌菌悬液中分别含有不同浓度的上述抗菌剂和小分子.其中, Ag+的最终浓度分别为0.01、0.05、0.1、1、10 mg·L-1, 有效氯的最终浓度分别为0.01、0.1、1、10、20 mg·L-1, 双(3-氨基丙基)胺的最终浓度分别为100、500、1000、2000 μmol·L-1, 香兰素的最终浓度分别为0.1、1、10、100、200 mg·L-1, BBF的最终浓度分别为1、10、20 mg·L-1.Ag+、氯、双(3-氨基丙基)胺和香兰素的对照组加入等量的超纯水, BBF的对照组加入等量的纯乙醇.然后将12孔板置于30 ℃的培养箱内静止培养24 h.培养结束后, 将12孔板从培养箱内取出, 上面附着的生物膜量采用结晶紫染色法进行定量, 方法参考Xiong等(2013)的结晶紫染色法:首先将12孔板用PBS溶液冲洗3遍去除上面松散结合的浮游细菌, 然后通过干燥固定上面的生物膜, 生物膜固定后用500 μL、0.1%的结晶紫染色30 min, 然后用PBS将多余的未与生物膜结合的结晶紫洗干净.最后, 用1 mL纯乙醇将与生物膜结合的结晶紫洗脱30 min.取200 μL洗脱液加入到96孔板内通过酶标仪(Tecan Infinite M200, 瑞士)测定OD600.实验组的相对生物膜量为与对照组相比的百分数(对照组为100%).
2.3 银和双(3-氨基丙基)胺对混合菌生长曲线的影响为了研究不同浓度的银和双(3-氨基丙基)胺对微生物生长的影响, 将3 mL包含不同浓度的Ag+和双(3-氨基丙基)胺的混合菌菌悬液加入10 mL离心管内, 然后将离心管置于30 ℃、180 r·min-1的条件下培养, 在不同时间内测定悬浮态混合菌的OD600.
2.4 统计分析所有实验均有3组平行数据.数据进行方差分析(ANOVA), p<0.05被认为具有显著性, 具有显著性差异的数据用*表示.
3 结果与讨论(Results and discussion) 3.1 不同传统抗菌剂对混合菌生物膜形成的抑制效率银对混合菌生物膜形成的抑制效应见图 2a.由图可知, 0.01 mg·L-1的Ag+不能抑制混合菌生物膜的形成, 与对照相比, 0.05 mg·L-1的Ag+对混合菌生物膜形成的抑制率为23%.当Ag+浓度继续从0.1 mg·L-1增加到10 mg·L-1时, 生物膜抑制率增加到70%左右, 并稳定在该水平, 不再随Ag+浓度的增加而增加.由图 2b可知, 与对照相比, 0.01 mg·L-1的氯对生物膜抑制效率为23%;0.1 mg·L-1的氯对生物膜抑制效率为40%, 远低于该浓度下Ag+的抑制率(70%);当氯浓度从0.1 mg·L-1增加到20 mg·L-1时, 混合菌生物膜形成的抑制率在40%~53%之间, 没有随着氯浓度的增加而显著性地增加.当银和氯的浓度增加到一定程度时, 其对生物膜形成的抑制率都不再继续增加, 保持相对稳定.这可能是由于微生物以聚集形式存在的生物膜会对其内部的细菌起保护作用, 相比悬浮态微生物具有更强的杀菌剂耐性;另外, 混合菌中一些耐银和耐氯微生物的存在也增强了其对杀菌剂的抗性(Silver et al., 2006; Zhang et al., 2013).
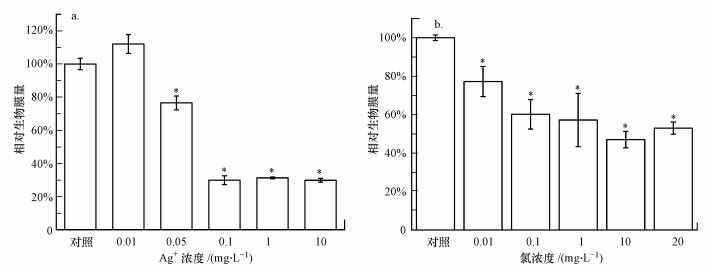 |
| 图 2 不同浓度的银(a)和氯(b)对混合菌生物膜形成(24 h)的影响(*表示与对照相比具有显著性差异(p<0.05), 误差棒代表 3组平行数据之间的标准偏差, 下同) Fig. 2 Effects of different concentrations of silver ion(a) and chlorine(b) on multi-speciesbiofilm formation |
总体来看, 同等浓度下Ag+对混合菌生物膜形成的抑制率要高于氯, Ag+对混合菌生物膜形成的最高抑制率可达到70%, 优于氯的抑制作用(53%).因此, 相比于氯, Ag+对本研究中所采用的活性污泥混合菌生物膜形成的抑制效率更高.
3.2 不同小分子物质对混合菌生物膜形成的抑制效率双(3-氨基丙基)胺是一种聚胺类小分子物质, 其对生物膜形成的抑制作用与目标菌种有着密切关系(Nesse et al., 2015).关于双(3-氨基丙基)胺抑制生物膜形成的相关机理, 有研究发现其能直接地、特异性地与微生物聚集体中的胞外多糖发生反应, 通过不同于传统抑菌/杀菌剂生物膜抑制机制, 抑制活性污泥生物膜的形成(Si et al., 2014).也有研究表明, 双(3-氨基丙基)胺能够干扰S. mutans的群体感应系统, 从而改变其生物膜中胞外多糖的结构(Ou et al., 2017).本研究中不同浓度的双(3-氨基丙基)胺对生物膜形成抑制的效应见图 3a, 随着双(3-氨基丙基)胺浓度的升高, 混合菌生物膜的附着量逐渐降低.与对照组相比, 100 μmol·L-1的双(3-氨基丙基)胺不会抑制混合菌生物膜形成, 当其浓度增加到500 μmol·L-1时, 生物膜抑制率达到16%.当双(3-氨基丙基)胺的浓度增加到1000和2000 μmol·L-1时, 生物膜的抑制率显著增加到60%和68%.表明双(3-氨基丙基)胺能够有效抑制混合菌生物膜的形成, 在高浓度条件下的抑制效果更好.
 |
| 图 3 不同浓度的双(3-氨基丙基)胺(a)、香兰素(b)和BBF (c)对混合菌生物膜形成(24 h)的影响 Fig. 3 Effects of different concentrations of norspermidine(a), vanillin(b) and BBF(c) on multi-species biofilm formation |
香兰素(4-羟基-3-甲氧苯甲醛)是一种小分子物质, 它可以作为信号分子抑制剂(Quorum sensing inhibitor, QSI)调控微生物聚集过程.香兰素对混合菌生物膜形成的影响见图 3b.当香兰素浓度从0.1 mg·L-1增加到1 mg·L-1时, 生物膜抑制率维持在20%左右(p>0.05).当香兰素的浓度增加到1~100 mg·L-1时, 生物膜的形成随着香兰素浓度的增加而逐步减少, 100 mg·L-1的香兰素可以抑制37%混合菌生物膜的形成.当香兰素的浓度继续增加到200 mg·L-1时, 生物膜的形成量不再显著性减少(p<0.05), 达到相对稳定的状态.香兰素作为一种QSI, 可以显著抑制短链(C4-HSL和3-Oxo-C8-HSL)和长链AHL的活性, 从而阻碍细菌在基底表面的粘附及生物膜的形成(Ponnusamy et al., 2009).有研究报道, 香兰素能够显著减少反渗透膜上生物膜的厚度、生物量和总蛋白量(Kappachery et al., 2010).也有研究表明, 香兰素能够减少活性污泥生物膜EPS中的多糖和蛋白, 但对eDNA不起作用(Si et al., 2017).本研究结果说明香兰素可以显著抑制混合菌生物膜的形成, 但其抑菌效果不如双(3-氨基丙基)胺.
BBF作为一种溴代呋喃酮, 由于其结构和AHLs相似, 可以通过和AHLs竞争受体蛋白(LuxR家族蛋白)来干扰细菌的QS系统(Shetye et al., 2013).另外, 一些溴代呋喃酮还能够通过干扰广泛存在于革兰氏阳性细菌和革兰氏阴性细菌中的AI-2来抑制生物膜的形成(Jang et al., 2013).相关研究还发现, 溴化呋喃酮能够抑制牙龈卟啉单胞菌生物膜的形成, 而且不会影响浮游细菌的生长(张利平等, 2011).因此, 选择BBF来研究其对混合菌生物膜形成的抑制作用.由图 3c可知, 当BBF的浓度在1~20 mg·L-1之间时, 其对混合菌生物膜形成的抑制率稳定在11%~18%, 且各处理间没有显著性差异(p>0.05).虽然与对照组相比, 1~20 mg·L-1的BBF能够显著抑制混合菌生物膜的形成(p<0.05), 但得到的抑制率相比于双(3-氨基丙基)胺和香兰素较低.因此, 需要进一步探讨BBF在混合菌生物膜控制中的应用方式, 以提高其对混合菌生物膜的抑制效率.
3.3 银和双(3-氨基丙基)胺对微生物生长的影响上述研究表明, 在传统抗菌剂中, 银对混合菌生物膜形成的抑制效果优于氯, 而在小分子中, 双(3-氨基丙基)胺的抑制效果最好.因此, 本文研究了不同浓度的银和双(3-氨基丙基)胺对混合菌生长曲线的影响, 探讨其抑制混合菌生物膜形成的可能机理.由图 4可知, 银和双(3-氨基丙基)胺对混合菌生长曲线的影响与其浓度有关, 低浓度的银(0.01 mg·L-1)可以促进混合菌的生长, 0.05 mg·L-1的Ag+对混合菌的生长没有显著影响, 高浓度的银(0.1、1和10 mg·L-1)会显著抑制混合菌的生长, 而且浓度越高, 抑制效果越显著.1000 μmol·L-1以下的双(3-氨基丙基)胺基本不会抑制悬浮状态混合菌的生长, 所以其对混合菌生物膜的抑制是通过非杀菌机制来实现的.但高浓度(2000 μmol·L-1)的双(3-氨基丙基)胺会显著抑制混合菌的生长曲线, 表明高浓度的双(3-氨基丙基)胺能够杀灭微生物, 可以通过杀菌机制来抑制生物膜的形成.
 |
| 图 4 不同浓度的银(a)和双(3-氨基丙基)胺(b)对混合菌生长曲线的影响 Fig. 4 Effects of different concentrations of silver ion(a) and norspermidine(b) on multi-speciesgrowth curve |
1) 两种传统抗菌剂中, 银对废水处理系统混合菌形成生物膜的抑制效率要高于氯;高浓度的银离子(>0.1 mg·L-1)通过杀菌机制抑制混合菌生物膜的形成, 可能会导致细菌产生耐药性.
2)在3种小分子物质中, 双(3-氨基丙基)胺对生物膜形成的抑制效果最好, 明显优于香兰素和(Z-)-4-溴-5-(溴乙烯)-2(5H)-呋喃酮(BBF).
3) 低浓度(<1000 μmol·L-1)的双(3-氨基丙基)胺通过非杀菌机制抑制混合菌生物膜的形成, 可以避免传统杀菌剂产生抗药性的问题.如何将小分子物质和传统抗菌剂有效耦合, 或者改变其作用方式, 进一步提高生物膜抑制率, 有待于进一步研究.
Costerton J, Stewart P S, Greenberg E. 1999. Bacterial biofilms:a common cause of persistent infections[J]. Science, 284: 1318–1322.
DOI:10.1126/science.284.5418.1318
|
Jang Y J, Sim J, Jun H K, et al. 2013. Differential effect of autoinducer 2 of Fusobacterium nucleatum on oral streptococci[J]. Archives of Oral Biology, 58: 1594–1602.
DOI:10.1016/j.archoralbio.2013.08.006
|
Kappachery S, Paul D, Yoon J, et al. 2010. Vanillin, a potential agent to prevent biofouling of reverse osmosis membrane[J]. Biofouling, 26(6): 667–672.
DOI:10.1080/08927014.2010.506573
|
Kim D, Jung S, Sohn J, et al. 2009. Biocide application for controlling biofouling of SWRO membranes-an overview[J]. Desalination, 238: 43–52.
DOI:10.1016/j.desal.2008.01.034
|
Nesse L L, Berg K, Vestby L K. 2015. Effects of norspermidine and spermidine on biofilm formation by potentially pathogenic Escherichia coli and Salmonella enterica wild-type strains[J]. Applied and Environmental Microbiology, 81(6): 2226–2232.
DOI:10.1128/AEM.03518-14
|
Ou M, Ling J. 2017. Norspermidine changes the basic structure of S.mutan s biofilm[J]. Molecular Medicine Reports, 15(1): 210–220.
DOI:10.3892/mmr.2016.5979
|
Percival S L, Walker J T. 1999. Potable water and biofilms:a review of the public health implications[J]. Biofouling, 14(2): 99–115.
DOI:10.1080/08927019909378402
|
Ponnusamy K, Paul D, Kweon J H. 2009. Inhibition of quorum sensing mechanism and Aeromonas hydrophila biofilm formation by vanillin[J]. Environmental Engineering Science, 26: 1359–1363.
DOI:10.1089/ees.2008.0415
|
Rai M, Yadav A, Gade A. 2009. Silver nanoparticles as a new generation of antimicrobials[J]. Biotechnology Advances, 27: 76–83.
DOI:10.1016/j.biotechadv.2008.09.002
|
Shaw J L A, Monis P, Fabris R, et al. 2014. Assessing the impact of water treatment on bacterial biofilms in drinking water distribution systems using high-throughput DNA sequencing[J]. Chemosphere, 117: 185–192.
DOI:10.1016/j.chemosphere.2014.06.077
|
Shetye G S, Singh N, Gao X, et al. 2013. Structures and biofilm inhibition activities of brominated furanones for Escherichia coli and Pseudomonas aeruginosa[J]. Medicinal Chemistry Communications, 4: 1079–1084.
DOI:10.1039/c3md00059a
|
Si X, Quan X, Li Q, et al. 2014. Effects of D-amino acids and norspermidine on the disassembly of large, old-aged microbial aggregates[J]. Water Research, 54: 247–253.
DOI:10.1016/j.watres.2014.02.007
|
Si X, Quan X. 2017. Prevention of multi-species wastewater biofilm formation using vanillin and EPS disruptors through non-microbicidal mechanisms[J]. International Biodeterioration & Biodegradation, 116: 211–218.
|
Silver S, Phung L T, Silver G. 2006. Silver as biocides in burn and wound dressings and bacterial resistance to silver compounds[J]. Journal of Industrial Microbiology and Biotechnology, 33: 627–634.
DOI:10.1007/s10295-006-0139-7
|
夏金兰, 王春, 刘新星. 2004. 抗菌剂及其抗菌机理[J]. 中南大学学报(自然科学版), 2004, 35(1): 31–38.
|
Xiong Y, Liu Y. 2013. Importance of extracellular proteins in maintaining structural integrity of aerobic granules[J]. Colloids and Surfaces B-Biointerfaces, 112: 435–440.
DOI:10.1016/j.colsurfb.2013.07.060
|
Yu C, Wu J, Contreras A E, et al. 2012. Control of nanofiltration membrane biofouling by Pseudomonas aeruginosa using d-tyrosine[J]. Journalof Membrane Science, 423: 487–494.
|
张利平, 王爽, 周向葛, 等. 2011. 群体感应抑制剂溴化呋喃酮对牙龈卟啉单胞菌生物膜形成影响的研究[J]. 华西口腔医学杂志, 2011, 29: 469–472.
DOI:10.3969/j.issn.1000-1182.2011.05.005 |
张志刚, 任静. 2011. 群体感应及群体感应淬灭酶拮抗细菌耐药性的研究进展[J]. 中国医师杂志, 2011, 13(5): 568–570.
|
Zhang Y, Hu Z. 2013. Combined treatment of Pseudomonas aeruginosa biofilms with bacteriophages and chlorine[J]. Biotechnology and Bioengineering, 110: 286–295.
DOI:10.1002/bit.24630
|
Zodrow K R, Schiffman J D, Elimelech M. 2012. Biodegradable polymer (PLGA) coatings featuring cinnamaldehyde and carvacrol mitigate biofilm formation[J]. Langmuir, 28(39): 13993–13999.
DOI:10.1021/la303286v
|
 2018, Vol. 38
2018, Vol. 38


