2. 深圳市水务(集团)有限公司, 深圳 518031
2. Shenzhen Water Affairs(Group) Co. Ltd., Shenzhen 518031
饮用水中消毒副产物(Disinfection by-products, DBPs)对人体有致癌、致畸、致突变等不利影响(Graves et al., 2001;Ballmaier et al., 2006;Sadiq et al., 2007), 其中卤乙醛含量仅次于三卤甲烷(Trihalomethanes, THMs)和卤乙酸(Haloacetic acids, HAAs), 为第三大类DBPs(Wei et al., 2010;Richardson et al., 2011), 且卤乙醛对人体的危害性远远超过THMs和HAAs(Jeong et al., 2015).三氯乙醛(Chloral hydrate, CH)是卤乙醛中含量最高的DBPs(Postigo et al., 2015;Mao et al., 2016;Koudjonou et al., 2006), 我国《生活饮用水卫生标准》(GB5749—2006)(卫生部和国家标准化管理委员会, 2006)规定CH的限值是10 μg·L-1, 相比于澳大利亚(CH限值为100 μg·L-1)和日本(CH限值为20 μg·L-1), 我国对饮用水中CH提出了更高更严格的要求.
作为饮用水处理的一种消毒剂, 二氧化氯可以有效灭活病毒、细菌和原生动物病原体, 而且也经常被用于色度及藻类的去除、嗅味的控制.二氧化氯与有机污染物反应过程中具有高度的选择性, 其与富里酸和腐殖酸主要以氧化反应为主, 基本没有氯化反应.相关研究(Lykins et al., 1986;Linder et al., 2006)表明, 在氯化之前进行二氧化氯预氧化能够减少THMs和总有机卤素(Total organic halogen, TOX)的生成.此外, Yang等(Yang et al., 2013)研究亦发现, 二氧化氯预氧化能够降低后续氯化过程中THMs、HAAs、卤代乙腈(Haloacetonitriles, HANs)和CH的生成量.且最近的研究(Chu et al., 2017)也发现, 二氧化氯在去除藻毒素的同时, 可以控制氯化消毒时THMs、卤代醛和HANs的形成.
本文以我国南方某水源水为研究对象, 研究不同二氧化氯投加量下CH前体物的去除情况, 并对其去除机制进行分析, 从而明确二氧化氯预氧化对CH的控制作用, 为水厂改造提供科学依据和技术指导, 以保障饮用水供水安全.
2 实验材料与方法(Experimental materials and methods) 2.1 实验材料实验过程中所用试剂均采用优级纯化学试剂, 所用水(18.2 MΩ·cm-1)来自于NANOpure超纯水系统(Thermo Scientific 7146).氯的储备液(约1000 mg·L-1, 以Cl2计)采用有效氯大于5%的次氯酸钠(NaOCl)溶液配制而成, 使用前用碘量法标定其浓度.二氧化氯储备液采用100 mg·L-1的二氧化氯标样.0.01 mol·L-1(以磷酸根离子计)的pH = 7的磷酸盐缓冲液采用磷酸二氢钾和磷酸氢二钾配制而成.
2.2 预氧化工艺模拟实验方法将1 L原水倒入六联搅拌器中, 投加不同浓度的二氧化氯(0、0.2、0.4、0.6、0.8、1.2、1.6 mg·L-1), 常温下在六联搅拌器上以70 r·min-1反应20 min后, 取上层溶液, 测相关水质指标及三氯乙醛生成势(Chloral hydrate formation potential, CHFP).
2.3 三氯乙醛生成势实验方法参考USEPA的消毒副产物生成势(Disinfection by-products formation potential, DBPFP)测定标准方法(Clescerl, 1998), 氯化前进行耗氯量预实验, 将反应7 d后余氯为3~5 mg·L-1的加氯量作为初始加氯量.用HCl和NaOH调节各水样pH值为7.0(±0.2), 并加入0.01 mol·L-1的磷酸盐缓冲液维持pH稳定, 将水样置于250 mL带有聚四氟乙烯螺旋瓶盖的琥珀色玻璃瓶中, 250 mL·瓶-1, (25±2)℃条件下避光氯化培养7 d, 最后采用亚硫酸钠(Na2SO3)作为终止剂进行脱氯.每个水样均在7 d的氯化培养前后检测CH浓度, 二者之差即为CHFP.CHFP与相应DOC的比值得到比CH生成势(Special chloral hydrate formation potential, SCHFP), 表征单位DOC的CH生成能力.
2.4 三维荧光光谱分析方法本文采用三维激发-发射矩阵(3D-EEM)荧光光谱技术对水样中溶解性有机物(Dissolved organic matter, DOM)进行表征, 所使用的仪器型号为日立F-7000的荧光光谱仪.仪器参数设置如下:激发波长(Excitation wavelength, Ex)扫描范围为200~400 nm, 间隔为5 nm, 发射波长(Emission wavelength, Em)扫描范围280~500 nm, 间隔为2 nm, 扫描速度为1200 nm·min-1.
根据Chen等(Chen et al., 2003)的研究成果, 将三维荧光谱图分为5个区, 其中Ⅰ区为λEm < 330 nm, λEx < 250 nm, Ⅱ区为330 nm < λEm < 380 nm, λEx < 250 nm, Ⅰ区和Ⅱ区代表芳香性蛋白质类有机物;Ⅲ区为λEm > 380 nm, λEx < 250 nm, 代表富里酸类有机物;Ⅳ区为λEm < 380 nm, λEx > 250 nm, 代表微生物代谢产物类有机物;Ⅴ区为λEm > 380 nm, λEx > 250 nm, 代表腐殖酸类有机物.并采用荧光体积积分法(FRI法)对各区物质的含量进行定量积分计算.具体计算方法如下:
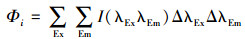
|
(1) |
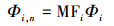
|
(2) |
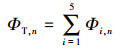
|
(3) |
式中, I(λExλEm)为每一个激发-发射波长对所对应的荧光强度(AU);Φi为区域"i"的荧光体积(AU·nm2);Φi, n为标准化后的区域"i"荧光体积(AU·nm2);ΦT, n为5个区域总荧光体积(AU·nm2);MFi为区域"i"的多重复性因子;ΔλEx为激发波长间隔, 5 nm;ΔλEm为发射波长间隔, 2 nm.
Φi和ΦT, i单位为AU·nm2, AU即arbitrary unit, 为任意单位;由于不同仪器的荧光测定及表示方法的不同, 不同的仪器测定的值之间没有可比性, 因此一般以相对值表示.
2.5 极性分离方法本文采用Amberlite XAD-4及Amberlite XAD-8两种树脂将水中DOM分成亲水性、强疏水性、弱疏水性3部分有机物.两种树脂使用前需用甲醇在70~80 ℃条件下索氏提取24 h后, 装填到直径为3 cm, 高为30 cm的层析柱中, 再用0.1 mol·L-1 NaOH、超纯水、0.1 mol·L-1 HCl、超纯水依次反复清洗, 直至出水的TOC与超纯水的基本一致, 方可用于水样分离实验.
水中DOM分离过程如下:首先将水样经过0.45 μm的滤膜进行抽滤, 然后采用HCl将滤后水的pH调至2.0(±0.2), 接着将调好pH的水样依次经过分别装填Amberlite XAD-8、Amberlite XAD-4树脂的层析柱, 得到的出水中有机物即为亲水性有机物.接着用与水样同等体积的0.1 mol·L-1的NaOH分别对Amberlite XAD-8、Amberlite XAD-4树脂进行洗脱, 得到的出水中有机物分别是强疏水性有机物和弱疏水性有机物.然后用HCl和NaOH将分离后的水样pH调至7.0(±0.2), 用于后续实验分析.
2.6 分析方法 2.6.1 水质指标的分析pH采用Mettler Toledo-SG68便携式pH计检测;浊度采用型号为2100AN的浊度计检测;UV254采用VARIAN CARY50型号紫外-可见分光光度计检测;TOC/DOC采用Sievers 5310C总有机碳测定仪测定;CODMn采用《水和废水监测分析方法》(第4版)中的酸性高锰酸钾法检测;余氯采用HACH PC Ⅱ 58700-00便携式余氯仪检测;荧光表征采用日立F-7000的荧光光谱仪.
2.6.2 三氯乙醛浓度分析参照GB/T5750-2006分析方法, 使用型号为HP6890的GC进行检测, 检测器为MS, 其型号为5975C, 色谱柱型号为HP-5(30 m × 0.25 mm × 0.25 μm), 柱箱温度:30 ℃保持5 min之后10 ℃·min-1升温到200 ℃保持2 min;进样口温度为220 ℃;离子源是EI, 温度为230 ℃;四级杆温度为150 ℃;接口温度为250 ℃;采用SIM模式, 质核比为83;进样量为500 μL;载气柱流量为1 mL·min-1(仪器设定为恒压, 10 psi), 顶空条件为50 ℃, 振荡40 min.
每个样品均先分析两个平行样, 若两者的偏差小于10%, 则结果取二者的平均值, 否则, 再分析第3个平行样, 结果取三者的平均值.
3 实验结果与讨论(Experimental results and discussion) 3.1 二氧化氯预氧化对CH前体物的去除不同二氧化氯投加量下对CHFP和SCHFP去除效果如图 1~2所示.
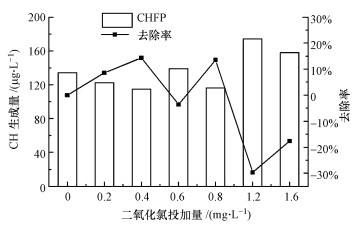 |
| 图 1 二氧化氯预氧化对CHFP的去除效果 Fig. 1 Removal of CHFP by chlorine dioxide preoxidation |
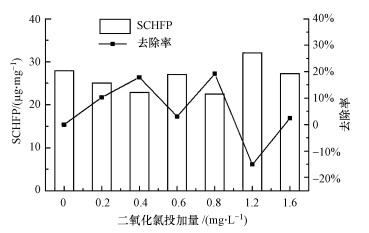 |
| 图 2 二氧化氯预氧化对SCHFP的去除效果 Fig. 2 Removal of SCHFP by chlorine dioxide preoxidation |
由图 1分析可知, 在较低浓度的二氧化氯投加量下, CH的前体物有所降低, 当投加量为0.4 mg·L-1时, CH的前体物去除率最高, 为14.3%;当投加量为1.2~1.6 mg·L-1时, CH前体物的量反而增多.傅学敏(2014)研究亦发现, 当二氧化氯的投加量较低时, 对CH的前体物有一定的去除效果, 当投加量为0.5 mg·L-1时, 对CH前体物的去除效果最好, 去除率为21.86%;当投加量为1.5~2.5 mg·L-1时, CHFP升高, 这与本文的研究结果基本一致.
由图 2分析可知, 二氧化氯投加量在0.4 mg·L-1和0.8 mg·L-1条件下, SCHFP基本相同, 且均低于其它投加量, 可见, 0.4 mg·L-1投加量时, 二氧化氯不仅对CHFP有最高的去除作用, 同时对CH的生成能力亦有较高的削减, 这可能是二氧化氯预氧化使水样中的有机物结构或组成分布发生了变化.
3.2 二氧化氯预氧化对相关水质指标的影响分析二氧化氯预氧化对浊度、CODMn、UV254、DOC、SUVA254等水指标的影响, 结果如表 1所示.
| 表 1 不同二氧化氯投加量下各相关水质指标的情况 Table 1 The different water quality indicators under the different chlorine dioxide dosages |
由表 1分析可知, 随着二氧化氯投加量的增大, 浊度的去除效果较为明显, 这可能是因为二氧化氯预氧化可从一定程度上破坏原水的胶体, 使胶体脱稳也可使其分散, 致使小颗粒增多, 从而使原水浊度得到明显的去除(王丽坤等, 2009);CODMn有微弱的去除, 可能是因为二氧化氯氧化能力不够, 不能完全矿化有机物, 故对CODMn的去除贡献较小;而DOC、UV254随着二氧化氯投加量的增大反而有微弱的上升, 这可能是二氧化氯能将水中较大的颗粒性有机物氧化形成较多可溶性小分子有机物所致.王丽坤等(2009)在文献中指出, 二氧化氯预氧化后, 2~6 kDa和 < 2 kDa的小分子有机物增多, 且在200~260 nm之间, 二氧化氯氧化后水样的吸光度反而比原水的略有升高, 这与本文研究成果较为一致.且DOC的变化趋势并没有与CHFP的变化趋势保持一致, 可见CHFP并不是完全取决于DOC总量, 还可能与水样中有机物的特定性质有关.另外, 在二氧化氯投加量较低时, SUVA254有一定的去除效果, 与水样在低二氧化氯投加量时, SCHFP均有所下降一致, 由此推断含C=C双键和C=O双键的不饱和有机物或芳香族化合物含量的降低有利于CH生成量的减少, 且在不同二氧化氯投加量下的SUVA254值均小于3 L·mg-1·m-1(Matilainen et al., 2011), 可见, 经不同浓度的二氧化氯预氧化后水样中的有机物均以亲水性物质为主.
3.3 二氧化氯预氧化对CH前体物的去除机制研究 3.3.1 不同二氧化氯投加量下水样中溶解性有机物荧光光谱不同二氧化氯投加量下水样中DOM荧光光谱如图 3所示.
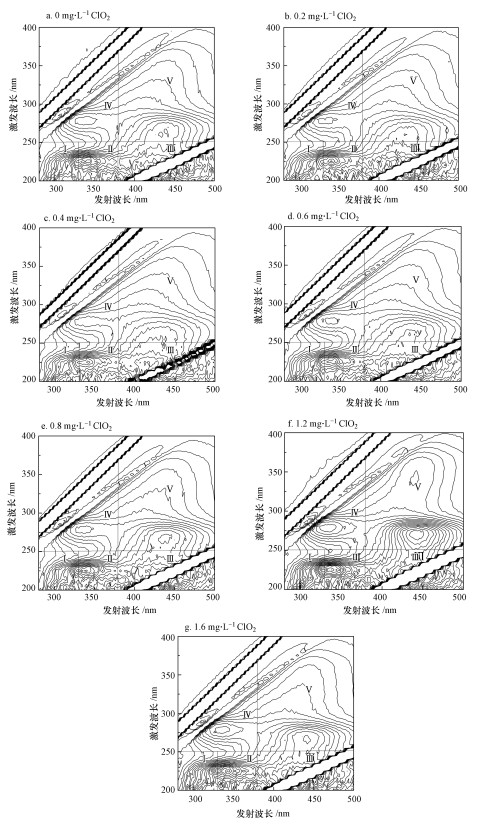 |
| 图 3 不同二氧化氯投加量下DOM荧光谱图 Fig. 3 Fluorescence spectrum of DOM under the different chlorine dioxide dosages |
从图 3分析可知, 该水样原水在区域Ⅱ、Ⅳ中存在明显的特征峰, 可见原水中DOM主要以芳香性蛋白质类及微生物代谢产物类有机物为主;在不同二氧化氯投加量下, 区域Ⅱ中均有明显的特征峰出现, 且当投加量为1.2~1.6 mg·L-1时, 特征峰愈加明显;而区域Ⅰ、Ⅲ中始终没有出现明显的特征峰;当投加量为0.2~0.8 mg·L-1时, 区域Ⅳ中特征峰的强度相比原水有一定程度的削减, 而当投加量为1.2~1.6 mg·L-1时, 区域Ⅳ中特征峰的强度又增大;区域Ⅴ在二氧化氯投加量为0.8~1.6 mg·L-1时, 有明显的特征峰出现, 且特征峰发生了红移.由此说明, 二氧化氯预氧化后, 原水中的有机物结构和组成分布发生了变化, 这也印证了上述不同二氧化氯投加量下的SCHFP是不同的.王丽莎等(2007)研究发现, 二氧化氯消毒后, 水样中DOM荧光峰的位置会发生偏移.可见, 二氧化氯氧化会使水样中有机物的结构发生变化, 这与本文的研究结论较为一致.
通过FRI法对各区域进行定量积分计算, 得到不同二氧化氯投加量下各区的荧光体积分布及去除情况, 如表 2所示.
| 表 2 不同二氧化氯投加量下水样中DOM各区荧光值含量及去除情况 Table 2 Fluorescence content and removal of each region under the different chlorine dioxide dosages |
由表 2分析可知, 当二氧化氯投加量在0.2~0.8 mg·L-1时, Ⅰ区、Ⅱ区、Ⅳ区荧光值都有所降低, 尤其Ⅱ区、Ⅳ区荧光值降低明显, Ⅲ区荧光值反而有一定程度上升;当二氧化氯投加量在1.2~1.6 mg·L-1时, Ⅰ区、Ⅱ区、Ⅳ区荧光值都有所升高, 这与二氧化氯投加量在0.2~0.8 mg·L-1时CHFP降低、在1.2~1.6 mg·L-1时CHFP上升较为一致, 且通过相关性分析发现, CHFP与ΦⅠ, n、ΦⅡ, n、ΦⅣ, n之间的相关系数rs为0.821, 显著水平(双侧)p为0.023, 在0.05水平(双侧)上显著相关, 可见芳香性蛋白质类物质和微生物代谢产物类物质与CH的生成有很大的相关性, 即芳香性蛋白质类物质及微生物代谢产物类物质是CH生成的主要前体物, 这与相关文献的研究结论较为一致(蔡广强, 2014).由此推测二氧化氯去除CH前体物的机制可能是通过将芳香性蛋白质类物质及微生物代谢产物类物质氧化降解或转化为其他非CH前体物的物质, 从而使CH的生成量减少.
3.3.2 不同二氧化氯投加量下水样DOM极性分离不同二氧化氯投加量下水样DOM极性分离各组分的DOC、CHFP及SCHFP如表 3所示.
| 表 3 不同二氧化氯投加量下水样DOM分离各组分DOC、CHFP及SCHFP变化情况 Table 3 DOC, CHFP and SCHFP of each component separated under the different chlorine dioxide dosages |
由表 3分析可知, 不同二氧化氯投加量下, 各水样中亲水性有机物生成CH的量都是最大的, 与各水样中亲水性有机物的量最大一致, 且各水样中亲水性有机物的SCHFP基本上都大于强疏水性、弱疏水性有机物的SCHFP, 可见亲水性有机物不仅是CH生成的主要前体物, 而且具有最大的CH生成能力.相关研究(蔡广强, 2014)亦发现CH的主要前体物是亲水性有机物, 且亲水性有机物具有最大的CH生成能力, 与本文的研究结论较为一致.且通过分析发现, 当二氧化氯的投加量较低时, 预氧化后各水样中亲水性有机物的量相比原水均有所下降, 这与低二氧化氯投加量时, 水样的CHFP下降较为一致, 由此推断二氧化氯去除CH前体物的机制可能是通过将亲水性有机物氧化降解或转化成其他种类物质, 从而使CH的生成量减少.
综合荧光光谱、极性分离分析结果可以推断, 二氧化氯去除CH前体物的机制是通过将含C=C双键和C=O双键的不饱和芳香性蛋白质类及微生物代谢产物类亲水性物质氧化降解或转化为其他非CH前体物的物质, 从而使CH的生成量减少.
4 结论(Conclusion)1) 投加量为0.4 mg·L-1时, CHFP去除率最高, 为14.3%, 同时SCHFP亦有大幅削减.
2) 二氧化氯预氧化对浊度和SUVA254有较好的去除效果, 对CODMn去除效果不明显, DOC、UV254则有小幅上升.
3) 二氧化氯去除CH前体物的机制是通过将含C=C双键和C=O双键的不饱和芳香性蛋白质类及微生物代谢产物类亲水性物质氧化降解或转化为其他非CH前体物的物质, 从而使CH的生成量减少.
Ballmaier D, Epe B. 2006. DNA damage by bromate:mechanism and consequences[J]. Toxicology, 221(2): 166–171.
|
蔡广强. 2014. 河库型水源三氯乙醛前体物分析与水质风险评估[D]. 哈尔滨: 哈尔滨工业大学. 36-40
|
Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701–5710.
|
Chu W, Yao D, Deng Y, et al. 2017. Production of trihalomethanes, haloacetaldehydes and haloacetonitriles during chlorination of microcystin-LR and impacts of pre-oxidation on their formation[J]. Journal of Hazardous Materials, 327: 153–160.
DOI:10.1016/j.jhazmat.2016.12.058
|
Clescerl L S. 1998. Standard Methods for the Examination of Water and Wastewater 20th Ed[M]. Washington: American Public Health Association: 113.
|
傅学敏. 2014. 净水工艺过程中三氯乙醛控制技术研究[D]. 哈尔滨: 哈尔滨工业大学. 39-40
|
Graves C G, Matanoski G M, Tardiff R G. 2001. Weight of evidence for an association between adverse reproductive and developmental effects and exposure to disinfection by-products:a critical review[J]. Regulatory Toxicology and Pharmacology, 34(2): 103–124.
DOI:10.1006/rtph.2001.1494
|
Jeong C H, Postigo C, Richardson S, et al. 2015. The occurrence and comparative toxicity of haloacetaldehyde disinfection byproducts in drinking water[J]. Environmental Science & Technology, 49(23): 13749–13759.
|
Koudjonou B K, Lebel G L. 2006. Halogenated acetaldehydes:analysis, stability and fate in drinking water[J]. Chemosphere, 64(5): 795–802.
DOI:10.1016/j.chemosphere.2005.10.063
|
Linder K, Lew J, Carter B, et al. 2006. Avoiding chlorite:chlorine and ClO2 together form fewer DBPs[J]. Opflow, 32(8): 24–26.
|
Lykins B W, Griese M H. 1986. Using chlorine dioxide for trihalomethane control[J]. Journal of the American Water Works Association, 78(6): 88–93.
DOI:10.1002/(ISSN)1551-8833
|
Mao Y Q, Wang X M, Guo X F, et al. 2016. Characterization of haloacetaldehyde and trihalomethane formation potentials during drinking water treatment[J]. Chemosphere, 159: 378–384.
DOI:10.1016/j.chemosphere.2016.05.088
|
Matilainen A, Gjessing E T, Lahtinen T, et al. 2011. An overview of the methods used in the characterisation of natural organic matter (NOM) in relation to drinking water treatment[J]. Chemosphere, 83(11): 1431.
DOI:10.1016/j.chemosphere.2011.01.018
|
Postigo C, Jeong C H, Richardson S D, et al. 2015. Analysis, Occurrence, and Toxicity of Haloacetaldehydes in Drinking Waters: Iodoacetaldehyde as an Emerging Disinfection By-product//Karanfil T, Mitch B, Westerhoff P, et al. Recent Advances in Disinfection By-products[M]. New York: Oxford University Press. 25-43
|
Richardson S D, Postigo C. 2011. Drinking Water Disinfection By-products[M]. Heidelberg: Springer: 93–137.
|
Sadiq R, Rodriguez M J, Imran S A, et al. 2007. Communicating human health risks associated with disinfection by-products in drinking water supplies:a fuzzy-based approach[J]. Stochastic Environmental Research and Risk Assessment, 21(4): 341–353.
DOI:10.1007/s00477-006-0069-y
|
王丽坤, 王启山, 刘艳芳, 等. 2009. 二氧化氯预氧化控制饮用水三卤甲烷生成势的研究[J]. 天津大学学报(自然科学与工程技术版), 2009, 42(12): 1118–1122.
|
王丽莎, 胡洪营, 藤江幸一. 2007. 污水氯和二氧化氯消毒过程中溶解性有机物变化的三维荧光光谱解析[J]. 环境科学, 2007, 28(7): 1524–1528.
|
Wei J, Ye B, Wang W, et al. 2010. Spatial and temporal evaluations of disinfection by-products in drinking water distribution systems in Beijing, China[J]. Science of the Total Environment, 408(20): 4600–4606.
DOI:10.1016/j.scitotenv.2010.06.053
|
中华人民共和国卫生部, 中国国家标准化管理委员会. 2006. GB5749-2006生活饮用水卫生标准[S]. 北京: 中国标准出版社
|
Yang X, Guo W, Lee W. 2013. Formation of disinfection byproducts upon chlorine dioxide preoxidation followed by chlorination or chloramination of natural organic matter[J]. Chemosphere, 91(11): 1477–1485.
DOI:10.1016/j.chemosphere.2012.12.014
|
 2018, Vol. 38
2018, Vol. 38


