大气汞因具有持久性、易迁移性和高度的生物富集性而引起全球关注, 氮氧化物是产生光化学烟雾污染、酸雨、臭氧层破坏和城市雾霾天气等一系列环境问题的重要根源, 对人类健康和生态环境都造成了严重危害(Summers, 1978;Vázquez-Rodríguez et al., 2012).我国人为源每年汞排放量约为500~700 t, 超过全球人为排放量的25%~30%, 2010年为538 t(Zhang et al., 2015);2014年我国氮氧化物排放总量为2078万t.目前我国大气污染严重, 将要面对来自国际环境外交谈判和国内经济发展的双重削减汞和氮氧化物排放的压力.烟气汞和氮氧化物的治理迫在眉睫, 已成为目前国际上备受关注的前沿性的研究热点.
烟气中汞的存在形态有3种:元素态Hg0、氧化态汞Hg2+和颗粒态汞Hgp(Senior et al., 2000).Hgp易被除尘器去除, 如袋式除尘器、静电除尘器等, 而Hg2+极易溶于水, 易被湿式脱硫装置去除(Wang et al., 2016);Hg0极不稳定且难溶于水, 这给去除Hg0带来了巨大的困难, 目前, 催化氧化、氧化剂喷射、光催化和低温等离子体等技术被用于氧化Hg0(Huang et al., 2016).对于NOx, 处理技术有选择性催化还原(SCR)和选择性非催化还原(SNCR)等(Yang et al., 2007).但由于这些技术存在能耗大、费用高和催化剂失活等缺点, 因此, 寻找一种具有能耗小、费用低等优势的技术方法是有必要的.
近年来, 生物法由于具有无二次污染、运行费用低等优点, 国内外学者采用传统的生物净化装置, 如生物洗涤器、生物滤池和生物滴滤器处理废气污染物进行了日益广泛的研究与应用(Okuno et al., 2000).蒋文举等(1999)用生物膜填料塔反硝化处理含NOx的模拟烟气, NO去除效率达90%.张华等(2005)用矿物垃圾为填料处理NO, 去除效率为77.1%.膜生物反应器因具有能处理低溶解性气体、提高生物活性和气液可单独进行的优点逐渐成为处理废气研究的热点.Min等(2002)采用中空纤维膜膜生物反应器驯化和富集硝化细菌处理NO, 其去除效率可达70%以上.张新雨等(2013)研究了采用中空纤维膜反硝化去除NO的效果, 实现了9个月的长期运行, NO去除效率最高达100%.魏在山等(2017)采用复合膜生物反应器研究了Hg0对NO的去除影响, 结果显示, NO和Hg0的去除效率最高分别达68.8%和81.7%.研究发现, Hg0→Hg2+的氧化可能是一种非特异性的微生物过氧化氢酶反应(Siciliano et al., 2008).好氧细菌氧化Hg0与过氧化氢酶KatE和KatG有关, 大肠杆菌、革兰氏阳性杆菌(厚壁菌)和链霉菌(放线菌)等微生物能氧化Hg0(Smith et al., 1998).脱硫菌属ND132和硫亚硝酸盐还原菌PCA对Hg0具有生物氧化作用(Colombo et al., 2013);G. fermentans H5是一种专性厌氧菌, 虽缺乏katE和katG基因的同源性, 但仍能以较快的速度使Hg0氧化成Hg2+(Colombo et al., 2014).而Cupriavidus metallidurans和Shewanella oneidensis被证实可以减少Hg2+的含量(Wiatrowski et al., 2006), 以及在厌氧氨氧化中发现其微生物能降解和吸收Hg2+(Yu et al., 2016).目前, 国内外已有膜生物反应器去除NO废气的研究, 但用嗜热膜生物反应器同时去除NO和Hg0的研究尚少.基于此, 本文通过研究嗜热膜生物反应器(TMBR)同时脱硝脱汞, 考察TMBR同时脱硝脱汞的长时间运行稳定性能和循环液喷淋量、pH、COD/TN、DO等因素对去除NO和Hg0的影响, 并通过16S rDNA测序分析微生物群落结构.
2 材料与方法(Materials and methods) 2.1 实验装置嗜热膜生物反应器处理含NO和Hg0烟气的装置流程如图 1所示.汞蒸气采用恒温水浴锅加热法获得, 与混合气(6%氧气和氩气)、NO气体一起进入混合瓶后, 从底部进入膜生物反应器.混合气体在上升的过程中由膜内扩散传质至膜外, 经生物膜降解后从膜生物反应器顶部排出, 尾气用饱和氯化钾和高锰酸钾溶液吸收.同时, 采用对循环槽加热的方式, 使循环液在潜水泵的作用下自上而下流经中空纤维膜.其中, 中空纤维膜组件由天津市蓝十字膜技术有限公司提供, 其材料为聚丙烯(PP).膜组件尺寸:中空纤维膜丝2400根, 纤维内/外径0.38/0.50 mm, 微孔孔径0.1~0.01 μm, 孔隙率60%, 有效膜长300 mm, 膜腔内容积54 mL;整个膜生物反应器的内径40 mm, 总高410 mm.
 |
| 图 1 嗜热膜生物反应器同时处理NO和Hg0废气装置图 Fig. 1 Schematic diagram of TMBR for NO and Hg0 removal simultaneously |
NO采用TESTO Pro-350烟气分析仪(德国)测量, 测量范围为0~1000 ppm;Hg0采用汞测定仪(MVI, 英国)测定, 测定范围为0~2000 μg·m-3;流量采用玻璃转子流量计控制, 量程为0~1.5 L·min-1;液相中溶解氧用溶解氧测定仪测定;循环液pH值用数显酸度计(PHS-3C, 雷兹)测定;COD采用重铬酸钾方法测定, TN采用碱性过硫酸钾方法测定, NO2--N采用N-(1-萘基)-乙二胺光度法测定, NO3--N采用紫外分光光度法测定, NH4+-N采用钠氏试剂光度法测定;采用16S rDNA分析微生物群落.
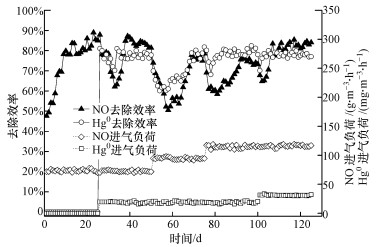
3 结果与分析(Results and analysis) 3.1 嗜热膜生物反应器烟气脱硝脱汞长时间运行稳定性在NO进气负荷为73.0~114.6 g·m-3·h-1, Hg0进气负荷为19.4~31.1 mg·m-3·h-1, 气体停留时间为9.3 s, 循环液喷淋量为60 mL·min-1的条件下, TMBR烟气脱硝脱汞长期稳定运行125 d的效果如图 2所示.实验分为3个阶段, 第Ⅰ阶段(微生物挂膜):第1~25 d, Hg0进气负荷为0 mg·m-3·h-1, NO进气负荷为73.0 g·m-3·h-1;第Ⅱ阶段(微生物驯化):第26~50 d, Hg0和NO进气负荷分别为19.4 mg·m-3·h-1和73.0 g·m-3·h-1, 第51~75 d, Hg0和NO进气负荷分别为19.4 mg·m-3·h-1和93.8 g·m-3·h-1;第Ⅲ阶段(微生物强化):第76~100 d, Hg0和NO进气负荷分别为19.4 mg·m-3·h-1和114.6 g·m-3·h-1, 第101~125 d, Hg0和NO进气负荷分别为31.1 mg·m-3·h-1和114.6 g·m-3·h-1.
 |
| 图 2 嗜热膜生物反应器长时间运行曲线 Fig. 2 Long-term operation curves of the TMBR |
第Ⅰ阶段(第1~25 d):第1 d, NO去除效率为47.6%, 这主要是中空纤维膜分离去除NO的作用;随着时间的推移, 中空纤维膜上负载硝化与反硝化菌, 微生物降解NO作用稳步上升(黎宝仁等, 2016);第11 d, NO去除效率上升至80.1%;第12~25 d, 微生物去除NO趋于稳定, 去除效率可达83%, 此时, 微生物挂膜基本完成.
第Ⅱ阶段(第26~75 d):由于在第26 d通入Hg0, 26~33 d, NO去除效率从87.9%降到62.1%, Hg0去除效率从81.0%降为70.2%, 可能是汞蒸气对微生物具有毒性, 影响了微生物降解NO和Hg0(Wei et al., 2017).第34~39 d, NO去除效率开始上升, 从63.2%上升到87.2%;第40~50 d, NO去除效率有轻微波动, 变化范围为81.4%~86.5%.第34 d, Hg0的去除效率上升至81.0%, 第35~50 d, Hg0去除效率在76.0%~80.0%范围内波动.由于在第51 d时提高NO进气负荷, 第51~58 d, NO去除效率发生强烈波动, 从73.9%下降至50.5%, 第59~69 d NO去除效率开始上升, 从52.4%上升到77.8%, 并在第70~75 d稳定在77%左右.Hg0去除效率在第51~58 d有轻微下降, 从69.9%下降到60.2%;随后的第59~69 d, Hg0去除效率呈现一直上升的趋势, 从61.0%上升到78.8%, 表明在适应了此NO进气负荷后, NO对Hg0的去除有促进作用(李立清等, 2016).第70~75 d, Hg0去除效率在75.0%~81.8%之间波动.通过Hg0的加入和NO进气负荷的逐步提高, 微生物成功驯化, 在膜生物反应器中形成了对NO和Hg0具有较强去除作用的生物膜.
第Ⅲ阶段(第76~125 d):第76 d, 由于提高NO进气负荷到114.6 g·m-3·h-1, NO去除效率下降为69.1%, 第81 d下降至58.5%, 第82~92 d, NO去除效率从60.1%上升到75.6%, 第93~100 d稳定在75%.Hg0去除效率在第76 d开始下降, 第78 d下降至68.1%, 随后去除效率开始上升, 第83 d去除效率为78.4%, 第85~100 d, Hg0去除效率在77.1%~82.4%之间轻微波动.第101 d, 由于提高Hg0进气负荷, NO和Hg0去除效率有轻微的下降, 分别为67.8%和70.1%, 随后NO和Hg0去除效率上升, NO去除效率在第106~125d稳定(81.0%), Hg0去除效率在第102~125 d稳定(77.0%), 表明微生物对NO和Hg0有强抵抗性(Wei et al., 2017), 通过NO和Hg0进气负荷提高, 成功强化微生物, 形成了强抵抗性的生物膜.
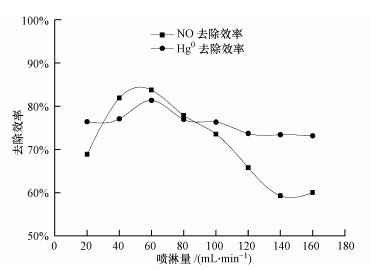
3.2 喷淋量对TMBR同时去除NO和Hg0的影响在NO进气浓度为241.2 mg·m-3, 进气负荷为93.8 g·m-3·h-1, Hg0进气浓度为50 μg·m-3, 进气负荷为19.4 mg·m-3·h-1, 气体停留时间为9.3 s, pH=7.3±0.1条件下, 喷淋量对同时去除NO和Hg0的影响如图 3所示.由图可知, 喷淋量为20~60 mL·min-1时, TMBR对Hg0的去除效率从76.4%增加到81.4%, 对NO的去除效率从68.9%增加到83.8%, 表明增大喷淋量有利于提高反应器对NO和Hg0的处理能力(Debus et al., 1994; Ergas et al., 1999; Essila et al., 2000);喷淋量为60~140 mL·min-1时, TMBR对NO和Hg0的去除效率分别下降至59.3%和73.2%.因此, 本实验最佳喷淋量为60 mL·min-1.
 |
| 图 3 喷淋量对同时去除NO和Hg0的影响 Fig. 3 Influence of spray rate on NO and Hg0 removal |
水不仅是物质代谢的原料, 也是微生物细胞的重要组成部分.喷淋量较小时, 微生物与环境中的渗透压增加及生物膜上的微生物不能补充足够的营养, 影响微生物数量及生物膜更新的速度;随着喷淋量的增加, 营养物质不断补足和生物膜更新速度加快, 微生物降解NO和Hg0的能力加强;但在长时间高喷淋量环境下, 将会使液膜增厚, 传质阻力加大, 生物膜中微生物被不断冲刷下来, 微生物降解NO和Hg0的能力下降.
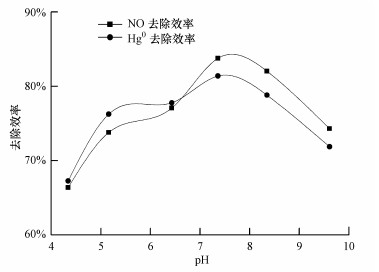
3.3 pH对TMBR同时去除NO和Hg0的影响在NO进气浓度为241.2 mg·m-3, 进气负荷为93.8 g·m-3·h-1, Hg0进气浓度为50 μg·m-3, 进气负荷为19.4 mg·m-3·h-1, 气体停留时间为9.3 s, 喷淋量60 mL·min-1条件下, pH值对同时去除NO和Hg0的影响如图 4所示.由图可知, pH=4.34~7.36时, TMBR对NO的去除效率从66.4%增加至83.8%, 增加17.4%;Hg0去除效率从67.3%增加到81.4%, 增加14.1%.pH=7.36~9.61时, NO去除效率从83.8%降到74.3%, Hg0去除效率则从81.4%降为71.6%.
 |
| 图 4 pH对同时去除NO和Hg0的影响 Fig. 4 Influence of pH on NO and Hg0 removal |
pH值能直接影响离子化合物的跨膜转移、酶活性及某些离子的解离度, 从而影响微生物的活性(Yin et al., 2016).本实验中嗜热膜生物反应器主要是依靠硝化和反硝化菌降解NO和Hg0, 而硝化菌适宜的pH范围为5~8, 反硝化菌适宜的pH范围为7~8(Ghafari et al., 2009; Lee et al., 2003).因此, 为了使反应器能处于最佳处理状态, 本装置pH应控制在6.5~8.0.
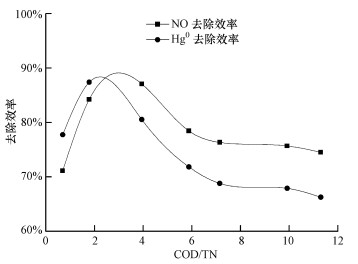
3.4 COD/TN对TMBR同时去除NO和Hg0的影响在NO进气浓度为241.2 mg·m-3, 进气负荷为93.8 g·m-3·h-1, Hg0进气浓度为50 μg·m-3, 负荷为19.4 mg·m-3·h-1, 气体停留时间为9.3 s, pH=7.3±0.1, 喷淋量60 mL·min-1条件下, COD/TN对同时去除NO和Hg0的影响如图 5所示.由图可知, COD/TN为0.69~3.94时, 嗜热膜生物反应器对NO去除效率从71.1%增加到87.1%;COD/TN为3.94~11.30时, NO去除效率从87.1%下降至74.5%;COD/TN为0.69~1.78时, Hg0去除效率从77.1%增加至87.4%;COD/TN为1.78~11.30时, TMBR对Hg0的去除效率从87.4%下降至66.3%.因此, 本实验适宜的COD/TN为2~4.
 |
| 图 5 COD/TN对同时去除NO和Hg0的影响 Fig. 5 Influence of COD/TN on NO and Hg0 removal |
COD/TN直接影响微生物生长与繁殖及代谢物的形成和积累.COD/TN过高或过低时, 嗜热膜生物反应器对NO和Hg0的去除均有所下降, 主要是当COD/TN过高时, 将会造成循环液中的异养菌(反硝化菌)和硝化菌竞争, 从而使硝化菌的增殖受到抑制, 导致硝化菌在循环液中所占比例减少;当COD/TN过低时, 则会造成硝化菌所占比例增大, 造成部分硝化菌脱离污泥絮体, 不易沉淀.当COD/TN为2~4时, 反硝化反应器对脱氮有较好的效果(Chamchoi et al., 2008; Tang et al., 2010).
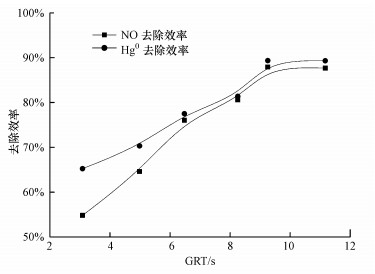
3.5 气体停留时间GRT对TMBR同时去除NO和Hg0的影响在NO进气浓度为241.2 mg·m-3, 进气负荷为93.8 g·m-3·h-1, Hg0进气浓度为50 μg·m-3, 进气负荷为19.4 mg·m-3·h-1, pH=7.3±0.1, 喷淋量60 mL·min-1条件下, 气体停留时间GRT对同时去除NO和Hg0的影响如图 6所示.由图可知, 气体停留时间为3.1~9.3 s时, TMBR对NO的去除效率从53.9%急剧增加至87.9%, Hg0去除效率从65.2%增加到89.4%;气体停留时间为9.3~11.2 s时, TMBR对NO和Hg的去除效率没有出现明显的变化, NO去除效率从87.9%变化至87.9%, Hg0去除效率从89.4%变化到89.3%.
 |
| 图 6 GRT对同时去除NO和Hg0的影响 Fig. 6 Influence of GRT on NO and Hg0 removal |
气体停留时间是影响气体传质和吸附的重要因素(王小军等, 2014).当进气浓度一定时, 气体停留时间越长, NO和Hg与膜生物反应器中的生物膜接触越充分, 大量的气体分子被生物膜捕集和降解, 提高了NO和Hg的去除效率;但气体停留时间过长(≥9.3 s)时, 即需增大膜生物反应器体积或降低气体流量, 这将大大增加运行成本和运行不稳定等问题(黎宝仁等, 2016);生物膜处理废气量将达到饱和, 去除效率将趋于稳定.因此, 本实验最佳气体停留时间为9.3 s.
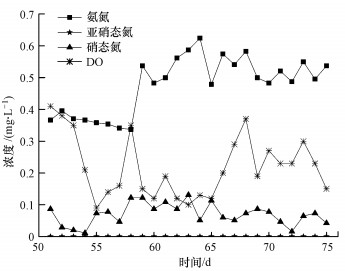
3.6 循环液DO对TMBR产物积累的影响在NO进气负荷为114.6 g·m-3·h-1, Hg0进气负荷为19.4 mg·m-3·h-1, 气体停留时间为9.3 s, pH=7.3±0.1的条件下, 考察了第51~75 d时氮代谢产物随DO的变化情况, 结果如图 7所示.由图可知, 循环液中氮代谢产物波动范围分别为:氨氮0.337~0.624 mg·L-1, 平均0.472 mg·L-1, 硝态氮0.011~0.122 mg·L-1, 平均0.078 mg·L-1, 亚硝态氮0 mg·L-1.氨氮含量变化为先稳定后增加再稳定, 第51~58 d氨氮浓度为0.337~0.395 mg·L-1, 第59 d氨氮浓度急剧增加至0.624 mg·L-1, 在高NO浓度下, 循环液中微生物大量死亡, 产生大量尸体蛋白, 直接导致系统内有机氮的浓度迅速上升, 不断生成氨氮;第51~75 d, 氨氮浓度为0.479~0.587 mg·L-1.
 |
| 图 7 DO对氮代谢产物积累影响 Fig. 7 Influence of DO on nitrogen metabolism products |
DO是影响硝化和反硝化作用的重要因素.溶解氧波动范围为0.09~0.41 mg·L-1, 表明循环液属于厌氧-缺氧交替环境.由图 7可知, 氨氮存在积累和亚硝态氮含量为零的现象.亚硝酸菌是好氧菌, 过低的溶解氧会抑制硝化反应, 影响氨氮降解速率, 导致氨氮有所积累(陈超等, 2009);亚硝态氮是氮循环的中间产物, 此氮化合物极不稳定, 容易氧化成硝酸盐氮和还原成氨氮.
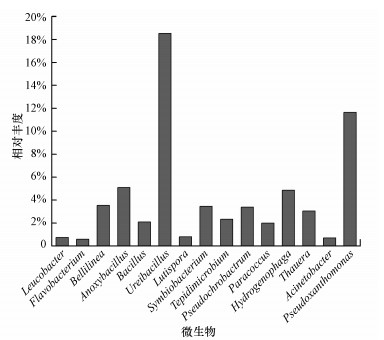
3.7 微生物群落结构分析图 8是TMBR样品在属分类水平上的物种相对丰度图.TMBR样品微生物(丰富度≥0.5%)有Ureibacillus(18.5%)、假黄单胞菌属(Pseudoxanthomonas, 11.7%)、Anoxybacillus(5.1%)、噬氢菌属(Hydrogenophaga, 4.9%)、Bellilinea(3.5%)、Symbiobacterium(3.5%)、Pseudochrobactrum(3.4%)、Thauera(3.1%)、Tepidimicrobium(2.3%)、Bacillus(2.1%)、副球菌属(Paracoccus, 2.0%)、Lutispora(0.8%)、Leucobacter(0.7%)、Acinetobacter(0.7%)、Flavobacterium(0.6%), 其中, 优势菌种为Ureibacillus(18.5%)和假黄单胞菌属(Pseudoxanthomonas, 11.7%).
 |
| 图 8 微生物在属分类上群落结构的变化(≥0.5%) Fig. 8 Convertion of microbial community at genus |
假黄色单胞菌属(Pseudoxanthomonas, 11.7%)属于异养硝化菌, 在有机物存在的条件下能进行异养硝化作用, 降解氨氮(郝明辉等, 2016).噬氢菌属(Hydrogenophaga, 4.9%)是一种反硝化菌, 可利用硝态氮为氮源进行呼吸, 在氨化和氨氧化过程中起到重要作用(黄倩茹等, 2016);Thauera(3.1%)与自养硝酸盐联系密切, 通常在一些硝化类反应器中被发现(Wang et al., 2016).Tepidimicrobium(2.3%)能分解葡萄糖等多糖物质和蛋白质, 对微生物利用碳源和氮源吸收营养有着重要作用(戴晓虎等, 2017);芽孢杆菌属(Bacillus, 2.1%)中部分菌种能利用硝酸盐呼吸, 是一种中度嗜热菌, 在温泉等高温环境下经常被发现;副球菌属(Paracoccus, 2.0%)是与反硝化作用相关的一种菌属(Hee-Sung et al., 2009).Pseudomonas(0.2%)具有好氧反硝化能力, 能将氨直接转化成气态物质(Van et al., 1991; He et al., 2016);还具有抗性质粒, 能还原汞化合物(Filali et al., 2000).丛毛单胞菌属(Comamonas, 0.4%)能降解有机物、氨氮和亚硝态氮(赵燕等, 2012)及使硝酸盐转化为N2(Gumaelius et al, 2001);ComamonasAN3的生长受到重金属抑制, 其中以Hg2+较为严重(Ghane et al., 2013), 表明Hg0可能氧化成Hg2+.Halomonas丰富度较低(0.05%), 在Halomonas菌株中发现汞离子还原酶(Zhou et al., 2015), 表明可以使Hg2+被还原.
与脱硝有关的菌种主要有副球菌属、芽孢杆菌属、苍白杆菌属、亚硝化弧菌属(Nitrosovibrio)、丛毛单胞菌属、噬氢菌属、假单胞菌属(Pseudomonas)、Thauera、假黄色单胞菌属;与汞相关的微生物是丛毛单胞菌属(Comamonas)、Pseudomonas和Halomonas.
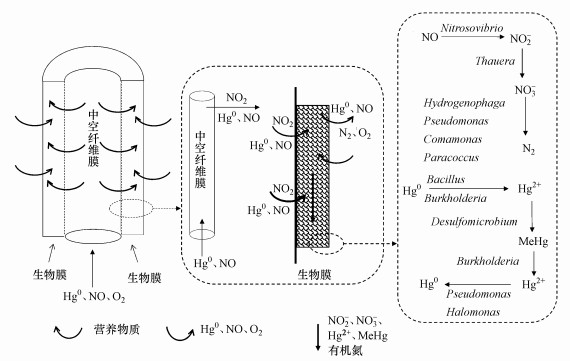
3.8 反应过程机理推测图 9为膜生物反应器中NO和Hg0机理推测过程.NO、O2和Hg0从中空纤维膜底部进入, 在气相界面流动并在膜两侧浓度差作用下经膜孔扩散传质到生物膜, 被生物膜中的微生物所降解.氧气进入膜生物反应器后生物膜会依次形成好氧区、缺氧区和厌氧区.NO在扩散过程中一部分氧化成NO2, 另一部分被生物膜降解.在好氧区, 亚硝化菌将NO氧化成NO2-, 进而被硝化菌氧化成NO3-(陈建孟等, 2005).在缺氧和厌氧区, 同化反硝化将一部分NO3-还原成有机氮化物, 一部分在异化反硝化作用下还原成N2.Hg0在具有过氧化氢酶的微生物作用下氧化成Hg2+(Siciliano et al., 2008;Smith et al., 1998), Bacillus能氧化Hg0(Tracy et al., 1998).汞的甲基化主要由Desulfomicrobium(0.009%)起作用(Tamar et al., 2005).Burkholderia(0.009%)含有AmeiI, 可将MeHg转化成Hg2+(Wei et al., 2017), Hg2+在Halomonas和Pseudomonas的作用下还原成Hg0(Zhou et al., 2015; Filali et al., 2000).
 |
| 图 9 膜生物反应器烟气脱硝脱汞机理推测 Fig. 9 Speculative mechanism of simultaneously denitration and demercuration in membrane bioreactor |
1) 采用嗜热膜生物反应器同时处理NO和Hg0, 实现了100 d的长期稳定运行, NO的去除效率最高可达87.9%, Hg0的去除效率最高可达82.4%.
2) 对嗜热膜生物反应器进行了循环液喷淋量、pH、GRT、COD/TN等因素对NO和Hg0去除效率的影响实验, 结果表明, 最佳优化条件为:喷淋量为60 mL·min-1, pH为6.5~8.0, GRT为9.3 s, COD/TN为2~4.
3) 实时监控循环液DO和氮代谢产物的变化, 发现循环液属于缺氧-厌氧交替环境和氨氮含量积累主要是由低溶解氧导致.
4) 经16S rDNA分析TMBR微生物群落, 结果表明, 在属类别上优势菌种为Ureibacillus(18.5%)和Pseudoxanthomonas(11.7%).与脱氮有关的微生物为:假黄色单胞菌属(11.7%)、噬氢菌属(4.9%)、Thauera(3.1%)、芽孢杆菌属(2.1%)、副球菌属(2.0%)、丛毛单胞菌属(0.4%)、假单胞菌属(0.2%)、亚硝化弧菌属(0.04%)、苍白杆菌属(0.02%);Pseudomonas和Halomonas与Hg0转化有关.
Chamchoi N, Nitisoravut S, Schmidt J E. 2008. Inactivation of ANAMMOX communities under concurrent operation of anaerobic ammonium oxidation (ANAMMOX) and denitrification[J]. Bioresource Technology, 99(9): 3331–3336.
DOI:10.1016/j.biortech.2007.08.029
|
陈超, 徐国勋, 曾林慧, 等. 2009. DO对膜生物反应器中同步硝化反硝化的影响[J]. 上海理工大学学报, 2009, 31(6): 581–584.
|
陈建孟, 马建锋, 王家德, 等. 2005. 生物滤床中一氧化氮的好氧去除过程研究[J]. 环境科学学报, 2005, 25(11): 1436–1442.
|
Colombo M J, Ha J, Reinfelder J R, et al. 2013. Anaerobic oxidation of Hg(0) and methylmercury formation by Desulfovibrio desulfuricans ND132[J]. Geochim et Cosmochim Acta, 112: 166–177.
DOI:10.1016/j.gca.2013.03.001
|
Colombo M J, Ha J, Reinfelder J R, et al. 2014. Oxidation of Hg(0) to Hg(Ⅱ) by diverse anaerobic bacteria[J]. Chemical Geology, 363: 334–340.
DOI:10.1016/j.chemgeo.2013.11.020
|
Debus O, Baumgatl H, Sekoulov I. 1994. Influence of fluid velocities on the degradation of volatile aromatic compounds in membrane bound biofilms[J]. Water Sci Technol, 29(10/11): 253–262.
|
戴晓虎, 何进, 严寒, 等. 2017. 游离氨调控对污泥高含固厌氧消化反应器性能的影响[J]. 环境科学, 2017, 38(2): 678–687.
|
Ergas S J, Shumway L, Fitch M W, et al. 1999. Membrane process for biological treatment of contaminated gas streams[J]. Biotechnol Bioeng, 63: 431–441.
DOI:10.1002/(ISSN)1097-0290
|
Essila N J, Semmens M J, Voller V R. 2000. Modeling biofilms on gas permeable supports:Concentration and activity profiles[J]. Environ Eng ASCE, 126(3): 250–257.
DOI:10.1061/(ASCE)0733-9372(2000)126:3(250)
|
Filali B K, Taoufik J, Zeroual Y, et al. 2000. Waste water bacterial isolates resistant to heavy metals and antibiotics[J]. Curr Microbial, 42(3): 151–156.
|
Ghafari S, Hasan M, Aroua M K. 2009. Improvement of autohydrogenotrophicnitrite reduction rate through optimization of pH and sodium bicarbonate dose inbatch experiments[J]. Journal of Bioscience and Bioengineering, 107(3): 275–280.
DOI:10.1016/j.jbiosc.2008.11.008
|
Ghane M, Tabandeh F, Bandehpour M, et al. 2013. Isolation and characterization of a heavy metal resistant Comamonas sp.from industrial effluents[J]. Iranian Journal of Science & Technology, 37(A2): 173–179.
|
Gumaelius L, Magnusson G, Pettersson B, et al. 2001. Comamonas denitrificans sp.nov., an efficient denitrifying bacterium isolated from activatedsludge[J]. International Journal of Systematic and Evolutionary Microbiology, 51: 999–1006.
DOI:10.1099/00207713-51-3-999
|
郝明辉, 于鲁冀, 李廷梅, 等. 2016. 一株异养硝化菌的筛选及生长特性研究[J]. 生物技术通报, 2016, 32(4): 168–174.
|
黄倩茹, 陈洲洋, 黄振山, 等. 2016. 基于硝化反硝化的膜生物反应器烟气脱硝研究[J]. 华南师范大学学报(自然科学版), 2016, 48(2): 13–18.
|
He T, Li Z, Sun Q, et al. 2016. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 200: 493–499.
DOI:10.1016/j.biortech.2015.10.064
|
Hee S B, Wan T I, Yuichi S, et al. 2009. Characterization of diverse heterocyclic amine-degrading denitrifying bacteria from various environments[J]. Archives of Microbiology, 191(4): 329–340.
DOI:10.1007/s00203-008-0452-9
|
Huang W J, Qu Z, Chen W M, et al. 2016. An enhancement method for the elemental mercury removal fromcoal-fired flue gas based on novel discharge activation reactor[J]. Fuel, 171: 59–74.
DOI:10.1016/j.fuel.2015.12.066
|
Lee K C, Rittmann B E. 2003. Effects of pH and precipitation on autohydrogenotrophic denitrification using the hollow-fiber membrane-biofilmreactor[J]. Water Research, 37(7): 1551–1556.
DOI:10.1016/S0043-1354(02)00519-5
|
黎宝仁, 陈洲洋, 王剑斌. 2016. 复合催化膜生物反应器处理一氧化氮废气研究[J]. 环境科学, 2016, 37(3): 847–854.
|
李立清, 吴绍康, 李海龙, 等. 2016. CeO2-TiO2催化剂低温协同控制燃煤NOx与汞[J]. 中南大学学报(自然科学版), 2016, 47(3): 1049–1057.
|
Min K N, Ergas S J, Harrison J M. 2002. Hollow-fiber membrane bioreactor for nitric oxide removal[J]. Environmental Engineering Science, 19(6): 575–583.
DOI:10.1089/109287502320963517
|
Okuno K, Hiral M, Suglyama M, et al. 2000. Microbial removal of nitrogen monoxide (NO) under aerobic condidons[J]. Biotechnology Letters, 22(1): 79.
|
Senior C L, Helble J J, Sarofim A. 2000. Emissions of mercury, trace elements, and fine particles from stationary combustion sources[J]. Fuel Processing Technology, 65-66: 263–288.
DOI:10.1016/S0378-3820(00)00082-5
|
Siciliano S D, Driscoll N J, Lean D R S. 2002. Microbial reduction and oxidation of mercury in freshwater lakes[J]. Environ Sci Technol, 36(14): 3064–3068.
DOI:10.1021/es010774v
|
Smith T, Pitts K, McGarvey J A, et al. 1998. Bacterial oxidation of mercurymetal vapor, Hg(0)[J]. Appl Environ Microbiol, 64(4): 1328–1332.
|
Summers A O. 1978. Microbial degradation of metals[J]. Annu Rev Microbiol, 32: 637–672.
DOI:10.1146/annurev.mi.32.100178.003225
|
Tamar B, Irene W D. 2005. Microbial transformations of mercury:potentials, challenges, and achievements in controlling mercury toxicity in theenvironment[J]. Advances in Applied Microbiology, 57: 1–52.
DOI:10.1016/S0065-2164(05)57001-1
|
Tang C J, Zheng P, Wang C H, et al. 2010. Suppression of anaerobic ammonium oxidizers under high organic content in high-rate Anammox UASB reactor[J]. Bioresource Technology, 101: 1762–1768.
DOI:10.1016/j.biortech.2009.10.032
|
Tracy S, Keith P, Jeffery A, et al. 1998. Bacterial oxidation of mercury metal vapor, Hg(0)[J]. American Society for Microbiology, 64: 1328–1332.
|
Vázquez-Rodríguez M, Pérez F F, Velo A, et al. 2012. Observed trends of anthropogenic acidification in North Atlantic water masses[J]. Biogeosciences Discussions, 9(3): 3003–3030.
DOI:10.5194/bgd-9-3003-2012
|
Van Nial E W J. 1991. Nitrification by heterotrophic denitrifiers and its relationship to autotrophic nitrification[D]. TU Delft: Delft University of Technology. 78-80
|
Wang B, Peng Y, Guo Y, et al. 2016. Illumina MiSeq sequencing reveals the key microorganisms involved in partial nitritation followed by simultaneous sludge fermentation, denitrification and anammox process[J]. Bioresource Technology, 207: 118–125.
DOI:10.1016/j.biortech.2016.01.072
|
Wang F Y, Wang S X, Meng Y, et al. 2016. Mechanisms and roles of fly ash compositions on the adsorptionand oxidation of mercury in flue gas from coal combustion[J]. Fuel, 163: 232–239.
DOI:10.1016/j.fuel.2015.09.065
|
王小军, 徐校良, 李兵, 等. 2014. 生物滴滤塔净化处理硫化氢的实验研究[J]. 现代化工, 2014, 34(8): 130–133.
|
Wei Z S, Wang J B, Huang Z S, et al. 2017. Effect of gaseous mercury on nitric oxide removal performance andmicrobial community of a hybrid catalytic membrane biofilm reactor[J]. Chemical Engineering Journal, 316: 584–591.
DOI:10.1016/j.cej.2017.01.085
|
Wiatrowski H A, Ward P M, Barkay T, et al. 2006. Novel reduction of mercury(Ⅱ) bymercury-sensitive dissimilatory metal reducing bacteria[J]. Environ Sci Technol, 40(21): 6690–6696.
DOI:10.1021/es061046g
|
Yang W F, Hsing H J, Yang Y C, et al. 2007. The effects of selected parameters on the nitricoxide removal by biofilter[J]. Journal of Hazardous Materials, 148(3): 653–659.
DOI:10.1016/j.jhazmat.2007.03.023
|
Yin Z X, Santos E D D, Li X, et al. 2016. Importance of the combined effects of dissolved oxygen and pH on optimization of nitrogen removal in anammox-enriched granular sludge[J]. Process Biochemistry, 51(9): 1274–1282.
DOI:10.1016/j.procbio.2016.05.025
|
Yu C, Song Y, Chai L, et al. 2016. Comparative evaluation of short-term stress of Cd(Ⅱ), Hg(Ⅱ), Pb(Ⅱ), As(Ⅲ) and Cr(Ⅵ) on anammox granules by batch test[J]. Journal of Bioscience and Bioengineering, 122: 722–729.
DOI:10.1016/j.jbiosc.2016.06.008
|
Zhang L, Wang S, Wang L, et al. 2015. Updated emission inventories for speciated atmospheric mercury form anthropogenic sources in China[J]. Environmental Science & Technology, 49(5): 3185–3194.
|
赵燕, 薛林贵, 李琳, 等. 2012. 丛毛单胞菌在环境污染物降解方面的研究进展[J]. 微生物学通报, 2012, 39(10): 1471–1478.
|
Zhou P, Huo Y Y, Xu L, et al. 2015. Investigation of mercury tolerance in Chromohalobacter israelensis DSM 6768T and Halomonas zincidurans B6T by comparative genomics with Halomonas xinjiangensis TRM 0175T[J]. Marine Genomics, 19: 15–16.
DOI:10.1016/j.margen.2014.11.008
|
 2018, Vol. 38
2018, Vol. 38


