2. 福建师范大学环境科学与工程学院, 福州 350007;
3. 福建师范大学福建省污染控制与资源循环利用重点实验室, 福州 350007;
4. 福建师范大学地理研究所, 湿润亚热带生态地理过程教育部重点实验室, 福州 350007;
5. 福建省金皇环保科技有限公司, 福州 350000
2. College of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007;
3. Key Laboratory of Pollution Control and Resource Recycling of Fujian Province, Fujian Normal University, Fuzhou 350007;
4. Institute of Geography, Key Laboratory of Humid Subtropical Eco-geographical Process(Fujian Normal University), Ministry of Education, Fujian Normal University, Fuzhou 350007;
5. Fujian Jinhuang Environmental Sci-Tech Co., Ltd, Fuzhou 350000
伴随着人们对全球气候变化与人类活动关系认识的深化, 环境中温室效应问题仍然是当今国际外交乃至政治的议论热点(IPCC, 2013).N2O是重要的温室气体之一, 约占全球总增温潜能的6%, 其单分子的全球增温潜能(GWP)为CO2的310倍(万晓红等, 2009a).近年来N2O在大气中所占比例不断升高, 浓度值从人类工业化前的约270 μL·L-1上升至2005年的319 μL·L-1, 并以每年0.2%~0.3%的速率不断增加(IPCC, 2013).随着工业化进程的加快, 特别是土地使用类型的改变、化石燃料的使用、生物遗体的燃烧以及工业废气的排放, 导致活性氮排放的增加(Fan et al., 2017).氮素作为控制及影响土壤生物反应的最重要因子, 外源氮增强能够改变土壤微生物与植被的生理机能(Fan et al., 2017), 加快有机质的分解速率, 提升土壤酶的活性, 是影响温室气体产生与消耗的关键因子, 影响着全球气候的变化.
河口湿地是海陆相互作用的汇集地区, 它是全球变化和人类活动响应敏感的生态系统类型之一, 存在各种耦合多变的物理、化学、生物以及地质过程和演变机制, 生态环境也较为敏感和脆弱(张晓玲等, 2016;李洪波等, 2015).自从欧洲的工业革命以来, 人类活动已经显著改变了全球氮、硫循环.通过大气干湿沉降、陆源输送、与开放海域的海水交换以及沉积物-水界面交换等途径外源物向河口和近海输入了许多氮和硫.河口湿地不仅会受到大气中氮沉降的影响, 而且河流流域内人们的生产、生活活动产生的含氮物质通过河流大量排放到海中, 也会对河口湿地的生态系统产生较为严重的影响(牟晓杰等, 2012).氮素主要通过地表径流、干湿沉降以及农业的灌溉等途径进入到河口湿地中, 被河口湿地中的生物固定以及利用, 随之对生物地球化学过程造成影响, 进而导致湿地N2O的排放也随之发生着变化.研究表明, 河口湿地的N2O排放速率较高(牟晓杰等, 2012), 湿地N2O的排放受到外源氮素有效性的影响, N2O的排放直接与氮素的有效性相关(万晓红等, 2009a).目前, 国内外针对湿地中的N2O排放开展了较多研究, 并取得较为显著的研究成果, 但是对于亚热带河口湿地的相关深入研究成果报道还相对比较罕见.此外, 有关氮沉降对天然河口湿地N2O排放通量的影响研究较少且结果不一(胡敏杰等, 2016a;Galloway et al., 2008).硫作为关键的生源元素之一, 一方面在湿地植物的生长发育中发挥着重要作用, 另一方面对湿地的氧化还原体系起到调节作用.大气中存在的含硫化合物气态SO2以及漂浮的硫酸盐粒子(SO42-), 也能通过干湿沉降进入生态系统并形成硫沉降.研究表明硫化氢(H2S)可用于自养反硝化过程中作为电子供体, 导致N2O排放量的增加(Bartacek et al., 2010);在有氧硝化条件下, 添加硫代硫酸盐也会增加N2O的产生(Fan et al., 2017).Cai等(2012)首次报道了SO2对土壤N2O排放的影响, 认为SO2能抑制氧化亚氮还原酶的活性, 导致N2O排放量增加.其研究结果进一步表明, SO2沉降对N2O排放的影响是由于反硝化作用、异养硝化作用或两者共同作用所致.综上所述, 酸沉降能增加土壤中氮的有效性, 从而进一步影响其中的微生物过程并直接导致N2O排放的增加.目前我国学者在硫沉降对湿地沉积物N2O排放方面较少开展研究, 而针对亚热带河口湿地的相关研究更是很少开展, 其相关机制也尚不清楚.
闽江河口湿地是我国非常重要的河口湿地之一, 位于中亚热带和南亚热带的过渡区, 是福建全省内最大的亚热带河口湿地.因此, 在福建省区域内的氮硫元素沉降呈现上升的趋势下, 开展氮硫负荷增强输入对亚热带河口潮滩湿地N2O排放通量影响的研究, 对于进一步了解全球变暖机制及制定相应减缓措施具有重要意义.
2 材料与方法(Materials and methods) 2.1 研究区域概况本研究以鳝鱼滩湿地(26°00′36″~26°03′42″N, 119°34′12″~119°40′40″E)为研究对象.鳝鱼滩湿地位于福建省闽江河口湿地保护区内, 地处中亚热带和南亚热带过渡区, 气候暖热湿润, 年平均气温约为19.6 ℃, 年平均降水量约为1346 mm.该区内沉积物以滨海盐土和潮土为主, 同时有水稻土等人工土壤.实验研究区的潮汐为正规半日潮.根据现场调查, 短叶茳芏(Cyperus malaccensis)、芦苇(Phragmites australis)和藨草(Scirpus triqueter)是该区域的土著优势植物.本研究在位于中(M)、高潮滩(H)均生长有短叶茳芏群落的前提下, 分别于中、高草滩选择一个较为典型的样地开展实验(图 1), 两个实验样区的直线相距约为130 m, 其中水文条件存在较明显的差异, 两个样地之间的高程差以及样地沉积物基本理化性质如表 1和图 1所示.
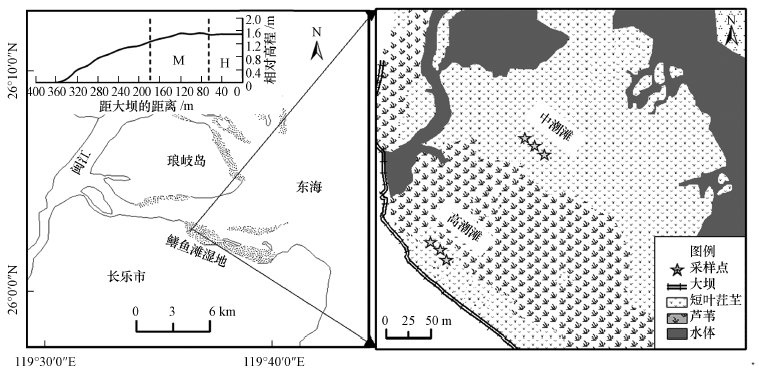 |
| 图 1 闽江口以及采样地点示意图 Fig. 1 Locations of the Min River estuary and the sampling sites in this study |
| 表 1 闽江河口中、高潮滩样地沉积物理化性质 Table 1 Physical and chemical properties of sediments at the middle and high tidal flat wetlands in the Min River estuary |
在与江岸平行的方向上, 于中潮滩和高潮滩分别设置1条30 m×3 m的样带, 平行处理样区根据样带按照相同距离划分, 共划分为3个(3个重复), 样区之间相隔2 m(图 2);在每个平行处理样区内分别设置5个1 m×1 m的平行实验小区, 氮硫增强输入的实验分别在小区内进行, 为避免出现相互干扰的情况, 在小区之间设置实验缓冲区.原位实验根据已有相关研究结果以及中国城市氮硫负荷增强的一般强度(胡敏杰等, 2016a;牟晓杰等, 2012), 并结合闽江河口区实际沉降量, 于2014年7-11月, 在每个月试验日同一时刻施加不同的处理溶液, 按照中等程度偏高的标准, 向各处理样区分别施加氮(NH4+-N)、硫(SO42--S)及氮硫复合溶液.本研究的5个处理分别为NH (24 g·m-2·a-1)、NO(24 g·m-2·a-1)、S(24 g·m-2·a-1)、NS(24 g·m-2·a-1)、对照CK(0 g·m-2·a-1).为保证实验样地可以最大限度的保留施加的处理溶液, 在溶液施加后的24 h的内尽可能将潮水对实验样区的冲刷的影响降到最低, 溶液施加的日期选择在每个月的1个小潮日退潮后地表出露无潮水淹没的时间段, 此操作方式在施加溶液后受到潮水冲刷的影响程度将大大降低(仝川等, 2010).模拟增强实验通过喷壶分别向静态箱底座内沉积物表面喷洒氮、硫及氮硫复合溶液, 其中不同处理组则分别施加NH4Cl、KNO3、K2SO4溶液以及NH4NO3+K2SO4复合溶液, 对照处理则喷洒相同量的水.
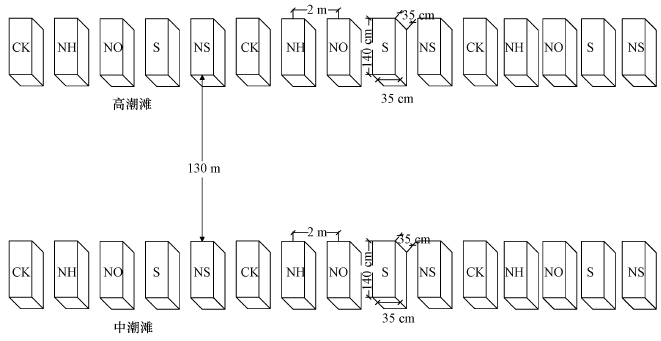 |
| 图 2 实验样区布设示意图 Fig. 2 Locations of the experimental plot |
采用静态暗箱法采集气体, 静态箱材质为PVC板, 由底座和顶箱组成.底座尺寸为35 cm×35 cm×40 cm, 整个静态箱的尺寸按35 cm×35 cm×140 cm设计, 箱内气体的混合通过顶箱的上部安装的1个微型风扇实现, 气体采样口安装在箱体侧面.底座放置于深入沉积物35 cm处, 出露沉积物表面不超过5 cm, 以防止施加溶液的过快流失以及交叉影响, 在整个试验期间底座一直固定于同一位置.气样采集于每月的施加日当天进行.通过带有三通阀的60 mL注射器从静态箱内抽取气样, 分别在盖上箱子后的0~30 min内采集, 每10 min采集1次, 共采集气样4次用于每个通量测定.样品采集完成后马上送回实验室, 用气相色谱仪测定气样中N2O的浓度.根据公式(1)计算排放的N2O通量:
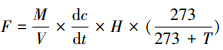
|
(1) |
式中, F表示N2O通量(mg·m-2·h-1);M表示N2O的摩尔质量(g·mol-1);V表示标态下气体的摩尔体积;dc/dt表示N2O的浓度变化率;H表示采样箱高度(m);T表示采样箱内温度(℃).经气相色谱仪测定的N2O浓度数据当R2>0.9时才视为有效并可以用于计算N2O通量.
2.4 环境因子测定不同静态箱内5、10、15 cm的沉积物pH值、电导率、温度、气温以及箱温等指标与气样采集同步测定.采用2265FS便携式电导/温度计(Spectrum Technologies Inc, USA)测定沉积物温度与电导率, IQ150便携式pH/mV仪(IQ Scientific Instruments, USA)测定沉积物pH和氧化还原电位;烘干法测定含水率, 环刀法测定容重;采用Kestrel 3500手持气象站(NK, USA)测定气温;采用碳氮元素分析仪(vario MAX, 德国)测定沉积物背景值中全碳(TC)、全氮(TN), 无机氮则是经过2 mol·L-1 KCL溶液浸提后用流动连续分析仪(Skalar San++, 荷兰)测定.
2.5 数据处理分析采用SPSS 20.0软件中的单因素方差分析(ANOVA)检验不同潮滩之间以及同一潮滩不同处理组之间的N2O排放通量差异性.采用SPSS 20.0软件中Pearson相关系数分析环境因子与N2O排放通量之间的相关关系.采用Origin 8.0进行分析作图.
3 结果与分析(Results and analysis) 3.1 氮硫输入下N2O排放特征在整个实验期间, 闽江河口中、高潮滩的N2O排放通量随时间出现较为明显的波动变化, 同时观察到随温度降低N2O的排放通量减少的趋势.N2O的排放通量的最大峰值出现在夏季最热的7月份(图 3).中潮滩、高潮滩在整个实验观测期间内均表现为N2O的“源”, 排放通量为中潮滩8.54 mg·m-2·h-1, 高潮滩7.16 mg·m-2·h-1, 这说明高潮滩湿地作为N2O“源”的功能低于中潮滩.中、高潮滩湿地的N2O排放通量在对照处理情况下以及氮硫输入增强的处理情况下的差异均达到显著性水平(p < 0.05).此外, 外源氮硫增强输入对中、高潮滩湿地N2O排放通量在不同时间的影响不尽相同, 存在抑制、影响不显著以及促进等3种情况(图 3), 并且高潮滩N2O排放通量对外源氮硫增强输入的响应要强于中潮滩.就N2O排放通量平均值而言, 与对照相比, NH4+-N输入使中、高潮滩N2O排放通量分别提高了157.97%和236.36%, 显然促进了两个潮滩湿地的N2O排放;NO3--N输入使中潮滩提高了60.59%, 而使高潮滩N2O排放通量提高了246.77%, 对N2O排放起了促进作用;SO42--S输入分别使中、高潮滩N2O通量提高50.68%和87.17%, 也促进了N2O的排放;而N-S复合输入则使中、高潮滩N2O通量增加了84.20%和117.79%, 对N2O排放也具有促进作用.中、高潮滩的N2O排放通量对不同的处理组的响应分别表现为:NH > NS > NO >S及NO > NH> NS >S.除高潮滩NH处理组下, 与对照处理组相比N2O排放通量存在显著差异外(p < 0.05), 其他处理组下N2O通量与对照处理组相比均未达到显著差异(p>0.05).
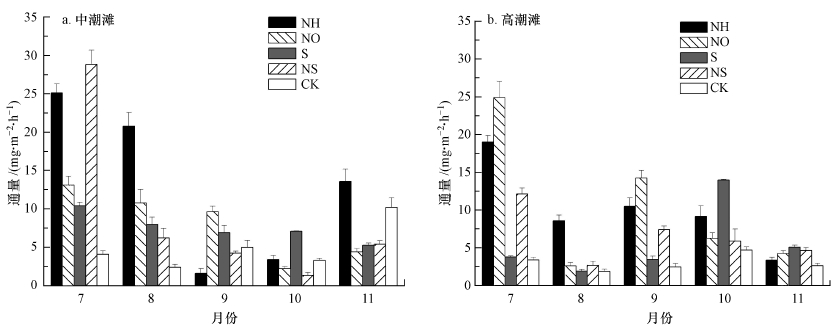 |
| 图 3 闽江河口潮滩湿地N2O排放对氮硫增强输入的响应 (NH表示施氨氮;NO表示施硝态氮;S表示施硫;NS表示施氮硫复合;CK表示对照) Fig. 3 Response of N2O fluxes to nitrogen and sulfate enrichments at the tidal flat wetlands in the Min River estuary |
在不同氮硫增强输入的处理组下, 中、高潮滩湿地的沉积物温度变化趋势较为一致, 总体均表现为温度随沉积物深度增加而递减的趋势(图 4).对照处理以及氮硫增强输入处理组下, 高潮滩沉积物温度均略低于中潮滩, 但这种差异不显著(p>0.05).同一潮滩内, 湿地沉积物温度在增强处理组和对照处理组之间的差异性均不显著(p>0.05).整个研究期间, 闽江河口湿地样区的平均气温为29.19 ℃, 其中样地中潮滩的气温平均值29.40 ℃, 高潮滩气温平均值28.88 ℃.高潮滩沉积物的含水率显著低于中潮滩(p < 0.01), 这种显著的差异性在夏季表现尤其突出.沉积物EC在不同潮滩间差异不显著(p>0.05), 并且两个潮滩湿地间的变化规律性不一致, 中潮滩表现为5 cm < 10 cm < 15 cm, 而高潮滩则为5 cm > 10 cm > 15 cm.相关数据分析表明, 闽江河口中、高潮滩湿地N2O排放通量与表层沉积物温度存在相关关系(表 2).沉积物含水率与N2O排放通量存在显著相关关系(p < 0.05).沉积物EC与N2O的排放通量的相关关系不尽一致, 无论是对照处理还是增强处理均未达到显著差异(p>0.05) (表 2).综上可以得出, 沉积物温度是控制N2O排放通量的关键因子, 并且这种相关性在氮硫增强输入处理的情况下进一步增强.
 |
| 图 4 闽江河口中、高潮滩湿地不同深度沉积物温度 (T5, 10, 15分别表示表层以下5、10、15 cm沉积物温度) Fig. 4 Profiles of sediment temperature at the middle and high tidal flat wetlands of the Min River estuary |
| 表 2 闽江河口中、高潮滩湿地N2O排放通量与沉积物温度、EC之间的相关关系 Table 2 Correlation between N2O fluxes and sediment parameters in the middle and high tidal flat wetlands of the Min River estuary |
土壤中产生的N2O大多来自于微生物的硝化以及反硝化作用过程, 并且与土壤中有效氮的供应水平密切相关(Welsh et al., 2015).土壤中的硝化过程的含义是土壤中的氨(或铵)通过硝化细菌的作用转变成硝酸盐形态(NO2-或NO3-)的过程(刘若萱等, 2015).这一过程必须由亚硝化细菌和硝化细菌共同参与才能完成, 因此硝化作用主要包括以下两个阶段:①在亚硝化细菌的作用下, 铵被氧化成亚硝酸;②在硝化细菌的作用下亚硝酸被氧化成硝酸, 并生成N2O.硝化过程中产生N2O, 其反应过程为:NH3→NH2OH→NO2-;NH3→NH2OH→N2O.土壤的反硝化过程的含义则是通过微生物作用把硝酸盐还原成为气态氮的过程.反硝化过程被认为是大气中N2O的主要来源, 其具体的反应过程为:NH3→NH2OH→NO2-→NO3-→NO→N2O→N2;NH3→NH2OH→NO2-→NO→N2O→N2.在本研究中, 中、高潮滩N2O排放通量在NH4+-N输入后显著增加, 分析其原因可能是因为NH4+-N为硝化作用产生N2O的底物, 增大反应中底物浓度有助于湿地沉积物N2O的生成排放.
湿地沉积物首先在有氧条件下进行硝化作用, 其好氧硝化细菌将有机质分解产生的氨(NH4+)氧化成硝酸盐(NO3-), 然后又通过厌氧反硝化细菌的反硝化作用将硝酸盐(NO3-)还原成气态的N2O和N2重新回到大气中(Khanitchaidecha et al., 2012; Lishawa et al., 2014; Sun et al., 2014).NO3--N输入明显促进了高潮滩N2O排放通量, 可能是因为随着外源硝态氮的输入会引起沉积物中参与硝化作用的底物浓度提高, 从而促进了硝化作用, 进而增强N2O的排放.已有研究表明氮素是N2O产生的最直接来源, 随着氮素加强输入会使N2O的排放通量呈指数上升(史昊先等, 2014;Muñoz-Hincapié et al., 2002).外源氨态氮和硝态氮的输入导致湿地沉积物的N2O排放通量显著增加的原因:一方面根系与微生物间在氮素限制的沉积物环境中对氮素存在激烈的竞争, 能够被硝化细菌和反硝化细菌利用的有效N(NH4+-N和NO3--N)随着外源氮输入的增强而增加, 由于增加氮素的输入明显会提高沉积物中有效氮含量, 使得硝化和反硝化过程必要的反应底物增多, 必将增强沉积物硝化、反硝化作用, 从而促进了湿地沉积物N2O的排放(Muñoz-Hincapié et al., 2002; Asgedom et al., 2014);另一方面外源氮素的输入的增强, 导致沉积物中NO2-的浓度增加, 促进了反硝化作用, 从而增加了湿地沉积物N2O的排放(牟晓杰等, 2012).
结果还显示增加SO42--S输入对河口中、高潮滩湿地沉积物的N2O排放也有促进作用, 主要是由于沉积物中SO42-含量随外源硫输入而显著增加, 硫酸盐的还原作用显著增强, 而硫酸盐还原作用是土壤有机物矿化的重要终端过程(Jørgensen, 1982), 因此, SO42-作为终端电子受体能够影响土壤中有机物的矿化过程(Chambers et al., 2011), 从而对湿地沉积物有机物矿化速率起到促进作用.含氮有机物质在沉积物中微生物的作用下, 通过氨基化作用逐步生成简单的有机态氨基化合物, 然后再经氨化作用转化生成氨和其他较简单的中间产物.氨化作用转化生成的氨大部分与有机或无机酸反应生成铵盐, 其中, 部分铵盐被植物吸收, 部分在微生物作用下氧化生成硝酸盐.由于受盐水入侵的影响, 滨海河口湿地的SO42-含量丰富, 存在强烈的硫酸盐还原作用(胡敏杰等, 2016b), 但是, 湿地沉积物硝化作用和反硝化作用是在中性和弱碱性条件由自养细菌参与的一个过程, 其最适pH范围位于6~8之间, 而在偏酸性条件下沉积物中的硝化作用和反硝化作用均会受到一定程度的抑制(刘义等, 2006).外源硫输入增强了硫酸盐还原作用, 但同时也降低了沉积物中的pH值, 导致硝化作用和反硝化作用受到抑制.本研究中, 外源硫输入通过增加有机物的矿化速率, 提高了湿地沉积物中铵盐或硝酸盐的浓度, 从而导致N2O的排放通量增加, 但是中、高潮滩对外源硫输入的响应比其他增强处理组要低.综合分析本实验数据还可以看出SO42--S输入响应低于NH4+-N输入和NO3--N输入, 说明河口潮滩湿地N2O排放通量对氮元素增强的响应要强于对硫元素增强的响应.此外, 氮硫复合添加对中、高潮滩N2O排放通量的促进作用并不是最强, 说明二者之间的综合作用低于NH4+-N输入和NO3--N输入.一方面在于NH4+-N及NO3--N输入促进了硝化作用, 从而增加N2O的排放;另一方面, 由于SO42--S输入在反应初期增强了还原作用, 而在后期对沉积物的硝化和反硝化起到了抑制作用.氮硫复合添加对中、高潮滩N2O排放通量的促进作用是上述原因综合作用的结果, 因此, N2O排放通量对氮硫复合输入的响应强于SO42--S输入响应, 但是低于NH4+-N输入和NO3--N输入.
此外, 闽江河口潮滩湿地是一个复杂生态系统, 地处于亚热带, 而且湿热多雨, 受潮汐与盐水入侵的共同影响.与高潮滩相比, 中潮滩受潮水入侵频率更频繁, 水淹时间相对更长, 可能在一定程度上削弱了外源氮硫输入的影响, 这可能也是外源氮硫输入对中潮滩N2O排放通量影响不显著的重要原因(胡敏杰等, 2016a).
4.2 环境因子对不同潮滩湿地N2O排放通量的影响沉积物的温度、含水量等理化性质能通过影响微生物生长与改变沉积物的物理性质进而影响的温室气体排放(王立刚等, 2008).在N2O产生的生物学过程中土壤温度是一个非常重要的影响因素, 它主要是通过影响硝化以及反硝化细菌活性而影响N2O的释放.已有研究发现湿地沉积物温度与总硝化速率的变化之间存在显著正相关(r=0.55, p≤0.05)关系(孙志高等, 2008).本研究中, 河口中、高潮滩湿地N2O排放通量均与沉积物温度存在显著的相关关系, 说明沉积物温度是控制N2O排放通量变化的关键环境因子.
湿地沉积物的温度通过影响沉积物中微生物的活动、酶的活性和化学反应速率来影响硝化反硝化作用, 进而影响N2O排放通量(张永勋等, 2011).多数学者研究表明N2O排放与土壤温度相关(孙丽等, 2006;Sommerfeld et al., 1993; Zhu et al., 2008).沉积物的温度升高会使沉积物中有机质分解加速即加速了沉积物中微生物的活动, 同时还会提高生物学过程中酶的活性, 从而提高N2O的排放量.通过调节影响沉积物中温度, 从而影响N2O传输速率的物理化学参数, 进而对排放N2O的生物学过程产生影响.当前大多数学者认为, 硝化作用、反硝化作用较适宜的温度范围分别为25~35 ℃和30~67 ℃, 硝化作用在温度低于5 ℃或者高于50 ℃的情况下将受抑制, 甚至基本停止(孙志高等, 2008).低温可以显著降低沉积物的硝化速率, 但对减弱反硝化速率并不是那么明显, 在低于5 ℃的情况下仍可以发生反硝化作用.因此, 在较低温度下沉积物排放的N2O主要来源于反硝化作用.在适宜的温度范围内, 微生物的活性以及N2O排放速率普遍随沉积物温度升高而上升, 在温度上升的时候硝化、反硝化微生物的活性均会有所增加, 但是与硝化作用相比, 反硝化作用会对温度上升的灵敏度更高(Canion et al., 2014).其主要原因是温度的升高促进了沉积物的呼吸, 从而降低沉积物中氧气的含量, 并促进厌氧条件的形成, 进而增强了沉积物的反硝化能力.因此, 硝化过程N2O排放通量伴随着温度的增加呈现下降趋势, 与之相反, 反硝化过程N2O排放通量则随着温度的增加而上升(Poh et al., 2015).本研究的N2O排放规律与白洋淀湿地(万晓红等, 2009b)、崇明东滩湿地(汪青等, 2010)等的研究结果相似, 其中, N2O排放通量的最大值在8月份或夏季, 并且湿地的植被类型均以芦苇为主.上述结果为研究湿地沉积物温度与N2O排放通量间的关系提供了重要的依据.但是, 与三江平原湿地(王毅勇等, 2006)、若尔盖高原湿地(王德宣等, 2005)等的研究结果存在差异, 其中三江平原湿地在非冰冻期表现为N2O排放, 冰雪覆盖期表现为微弱的吸收, 生长季以毛果苔草沼泽N2O排放通量最小, 灌丛湿地N2O排放通量最大;若尔盖高原湿地N2O排放最低时期为6月, 排放高峰期为5月, 其他月均较低.说明湿地N2O排放除了受温度的控制外, 可能还受到湿地沉积物其他环境因子的影响.
沉积物含水率也是影响N2O排放的重要因素.沉积物含水量影响湿地沉积物的通气状况, 从而进一步控制着土壤的硝化、反硝化过程.硝化过程中, 当沉积物含水量较低时, O2充足, 硝化最终产物是NO3-;当沉积物含水量较高时, O2供应则开始受到限制, 作为替代O2电子受体的中间产物N2O被还原, 硝化作用主要形成N2O.反硝化过程是产生N2O的主要过程, 沉积物含水量增加, 使湿地沉积物中的空气无法扩散到大气中, 形成厌氧环境, 促使反硝化作用占主导地位, 促进N2O的排放.本研究中, 高潮滩沉积物含水率明显低于中潮滩.中潮滩的沉积物由于长期处于水分饱和状态, 因此容易形成厌氧环境.研究发现, 当硝化细菌活性受到淹水土壤中铵态氮的浓度限制时, 随着淹水层O2的增加硝化作用将会显著增强(Long et al., 2017).此外, 由于反硝化作用是一个在厌氧条件下进行的微生物过程, 土壤含水率通过影响土壤的通气状况和O2分压而影响反硝化作用.已有研究表明, 土壤水分含量对反硝化强度的影响通过影响O2含量和N2O/N2比而间接发生作用, 排水不良的土壤具有较高的反硝化率(孙志高等, 2008).同时, 较高的水分条件下, 对湿地沉积物有机质的分解具有促进作用, 为产生N2O提供大量可用的底物, 最终促进N2O的排放.本研究中的沉积物EC与闽江河口中、高潮滩湿地N2O排放通量之间大多数不具有相关关系, 可能是因为研究样地沉积物之间的盐度差异不明显, 同时与本研究时间并不是很长有关.土壤N2O的排放受酸碱度、氧化还原电位、土壤性质、有效碳氮含量、降雨量等多种因素的影响(王立刚等, 2008; Mori et al., 2012; Aguilera et al., 2013), 是生态系统中比较复杂的过程之一(廖千家等, 2010).此外, 土壤微生物、生物量、传输途径等生物和非生物因素也都能影响着N2O的排放, 因此, 我们后续研究的重点会加强多因子相互作用下N2O排放研究.
在全球环境问题日益严重以及全球变暖趋势不可逆转的背景下, 深入研究N2O排放对氮硫增强输入的响应和机制, 是了解全球温室气体排放机制以及制定减排措施的一个重要环节.本研究以河口湿地生态系统为研究对象, 首次探讨了氮硫增强输入对N2O排放通量的影响, 结果表明外源氮硫增强输入在不同时间对中、高潮滩湿地N2O排放通量的影响表现为存在促进、影响不显著以及抑制等3种情况, 就N2O排放通量平均值而言, 总体上表现为明显的促进作用.
5 结论(Conclusions)1) 中潮滩和高潮滩湿地N2O排放通量在对照处理下和氮硫增强输入处理下的差异均达到显著水平(p < 0.05).中、高潮滩湿地N2O排放通量在不同时间对外源氮硫输入响应不尽相同, 总体来看N2O的排放促进作用较为明显.河口潮滩湿地N2O排放通量对氮增强的响应强于对硫增强的响应.
2) 中潮滩与高潮滩湿地N2O的排放通量在氮硫增强输入的处理下具有较为明显的时间变化, 同时具有波动性.7月份N2O的排放通量最大, 整个实验观测期间均表现为N2O排放的“源”.中、高潮滩湿地N2O排放通量的时间变化规律并没有随着氮硫增强输入的处理而改变.
3)不同潮滩湿地沉积物温度、含水率等环境因子与N2O的排放通量具有较好的相关关系, 但沉积物EC与N2O的排放通量相关性不显著.这种相关关系并没有随着氮硫增强输入的处理而改变.
Aguilera E, Lassaletta L, Sanz-Cobena A, et al. 2013. The potential of organic fertilizers and water management to reduce N2O emissions in Mediterranean climate cropping systems. A review[J]. Agriculture, Ecosystems & Environment, 164: 32–52.
|
Asgedom H, Tenuta M, Flaten D N, et al. 2014. Nitrous oxide emissions from a clay soil receiving granular urea formulations and dairy manure[J]. Agronomy Journal, 106(2): 732–744.
DOI:10.2134/agronj2013.0096
|
Bartacek J, Manconi I, Sansone G, et al. 2010. Divalent metal addition restores sulfide-inhibited N2O reduction in Pseudomonas aeruginosa[J]. Nitric Oxide, 23(2): 101–105.
DOI:10.1016/j.niox.2010.04.005
|
Cai Z, Zhang J, Zhu T, et al. 2012. Stimulation of NO and N2O emissions from soils by SO2 deposition[J]. Global Change Biology, 18(7): 2280–2291.
DOI:10.1111/j.1365-2486.2012.02688.x
|
Canion A, Overholt W A, Kostka J E, et al. 2014. Temperature response of denitrification and anaerobic ammonium oxidation rates and microbial community structure in Arctic fjord sediments[J]. Environmental Microbiology, 16(10): 3331–3344.
DOI:10.1111/emi.2014.16.issue-10
|
Chambers L G, Reddy K R, Osborne T Z. 2011. Short-term response of carbon cycling to salinity pulses in a freshwater wetland[J]. Soil Science Society of America Journal, 75(5): 2000–2007.
DOI:10.2136/sssaj2011.0026
|
Fan J L, Xu Y H, Chen Z M, et al. 2017. Sulfur deposition suppressed nitrogen-induced soil N2O emission from a subtropical forestland in southeastern China[J]. Agricultural and Forest Meteorology, 233: 163–170.
DOI:10.1016/j.agrformet.2016.11.017
|
Galloway J N, Townsend A R, Erisman J W, et al. 2008. Transformation of the nitrogen cycle:Recent trends, questions, and potential solutions[J]. Science, 320(5878): 889.
DOI:10.1126/science.1136674
|
胡敏杰, 邹芳芳, 任鹏, 等. 2016a. 河口潮滩湿地CH4、CO2排放通量对氮硫负荷增强的响应[J]. 环境科学学报, 2016a, 36(4): 1359–1368.
|
胡敏杰, 邹芳芳, 仝川, 等. 2016b. 氮、硫输入对河口湿地土壤有机碳矿化的实验研究[J]. 环境科学学报, 2016b, 36(11): 4184–4192.
|
IP CC. 2013. Climate Change 2013:The Physical Science Basis[M]. Cambridge, UK and New York, USA: Cambridge University Press.
|
Jørgensen B B. 1982. Mineralisation of organic matter in the sea bed:The role of sulphate reduction[J]. Nature, 296: 643–645.
DOI:10.1038/296643a0
|
Khanitchaidecha W, Shakya M, Tatsuru K, et al. 2012. NH4-N Removal through nitrification and hydrogenotrophic denitrification in simple attached growth reactors[J]. Water Air & Soil Pollution, 223(7): 3939–3953.
|
李洪波, 韦妮妮. 2015. 城市湿地生态系统服务的空间流转过程研究——以泉州湾河口湿地为例[J]. 湿地科学, 2015, 13(1): 98–102.
|
廖千家, 颜晓元. 2010. 农业土壤氧化亚氮排放模型研究进展[J]. 农业环境科学学报, 2010, 29(5): 817–825.
|
Lishawa S C, Jankowski K J, Geddes P, et al. 2014. Denitrification in a laurentian great lakes coastal wetland invaded by hybrid cattail (Typha×glauca)[J]. Aquatic Sciences, 76(4): 1–13.
|
刘若萱, 张丽梅, 白刃, 等. 2015. 模拟条件下土壤硝化作用及硝化微生物对不同水分梯度的响应[J]. 土壤学报, 2015, 52(2): 415–422.
|
刘义, 陈劲松, 刘庆, 等. 2006. 土壤硝化和反硝化作用及影响因素研究进展[J]. 四川林业科技, 2006, 27(2): 36–41.
|
Long X E, Shen J P, Wang J T, et al. 2017. Contrasting response of two grassland soils to N addition and moisture levels:N2O emission and functional gene abundance[J]. Journal of Soils and Sediments, 17(2): 384–392.
DOI:10.1007/s11368-016-1559-2
|
Mori A, Hojito M. 2012. Effect of combined application of manure and fertilizer on N2O fluxes from a grassland soil in Nasu, Japan[J]. Agriculture, Ecosystems & Environment, 160: 40–50.
|
牟晓杰, 刘兴土, 仝川, 等. 2012. 闽江河口短叶茳芏湿地CH4和N2O排放对氮输入的短期响应[J]. 环境科学, 2012, 33(7): 2482–2489.
|
Muñoz-Hincapié M, Morell J M, Corredor J E. 2002. Increase of nitrous oxide flux to the atmosphere upon nitrogen addition to red mangroves sediments[J]. Marine Pollution Bulletin, 44(10): 992–996.
DOI:10.1016/S0025-326X(02)00132-7
|
Poh L S, Jiang X, Zhang Z, et al. 2015. N2O accumulation from denitrification under different temperatures[J]. Applied microbiology and biotechnology, 99(21): 9215–9226.
DOI:10.1007/s00253-015-6742-7
|
史昊先, 高晓霞, 于景丽, 等. 2014. 外源氮添加对湿地土壤N2O排放量的影响[J]. 农业资源与环境学报, 2014, 31(5): 456–460.
|
Sommerfeld R A, Mosier A R, Musselman R C. 1993. CO2, CH4 and N2O flux through a Wyoming snowpack and implications for global budgets[J]. Nature, 361: 140–142.
DOI:10.1038/361140a0
|
孙丽, 宋长春, 黄耀. 2006. 沼泽湿地N2O通量特征及N2O与CO2排放间的关系[J]. 中国环境科学, 2006, 26(5): 532–536.
|
孙志高, 刘景双. 2008. 湿地土壤的硝化-反硝化作用及影响因素[J]. 土壤通报, 2008, 39(6): 1462–1467.
|
Sun Z G, Wang L L, Mou X J, et al. 2014. Spatial and temporal variations of nitrous oxide flux between coastal marsh and the atmosphere in the Yellow River estuary of China[J]. Environmental Science & Pollution Research, 21(1): 1–15.
|
仝川, 柳铮铮, 曾从盛, 等. 2010. 模拟SO42-沉降对河口潮汐湿地甲烷排放通量的影响[J]. 中国环境科学, 2010, 30(3): 302–308.
|
王立刚, 李虎, 邱建军. 2008. 黄淮海平原典型农田土壤N2O的排放特征[J]. 中国农业科学, 2008, 41(4): 1248–1254.
|
王德宣, 宋长春, 王跃思, 等. 2005. 若尔盖高原沼泽湿地氧化亚氮排放通量研究[J]. 生态科学, 2005, 24(3): 193–196.
|
汪青, 刘敏, 侯立军. 2010. 崇明东滩湿地CO2、CH4和N2O排放的时空差异[J]. 地理研究, 2010, 29(5): 835–946.
|
万晓红, 匡尚富, 周怀东, 等. 2009a. 外源氮素对人工湿地N2O排放通量影响的研究[J]. 中国水利水电科学研究院学报, 2009a, 7(4): 264–269.
|
万晓红, 王雨春, 陆瑾, 等. 2009b. 白洋淀湿地氮素转化和N2O排放特征研究[J]. 水利学报, 2009b, 40(10): 1168–1174.
|
王毅勇, 郑循华, 宋长春, 等. 2006. 三江平原湿地CH4、N2O的地-气交换特征[J]. 地理研究, 2006, 25(3): 457–467.
|
Welsh D T, Nizzoli D, Fano E A, et al. 2015. Direct contribution of clams (Ruditapes philippinarum) to benthic fluxes, nitrification, denitrification and nitrous oxide emission in a farmed sediment[J]. Estuarine, Coastal and Shelf Science, 154: 84–93.
DOI:10.1016/j.ecss.2014.12.021
|
张晓玲, 刘永, 郭怀成. 2016. 湖滨河口湿地中磷的输移转化机制及截留效应研究进展[J]. 环境科学学报, 2016, 36(2): 373–386.
|
张永勋, 曾从盛, 王维奇. 2011. 天然湿地N2O产生机理及排放异质性研究进展[J]. 亚热带水土保持, 2011, 23(4): 50–57.
|
Zhu R B, Liu Y S, Ma J. 2008. Nitrous oxide flux to the atmosphere from two coastal tundra wetlands in eastern Antarctica[J]. Atmospheric Environment, 42(10): 2437–2447.
DOI:10.1016/j.atmosenv.2007.12.016
|
 2018, Vol. 38
2018, Vol. 38


