厌氧干发酵主要是指利用秸秆、畜禽粪便等农业废弃物以及餐厨垃圾等固体有机废弃物,在干物质浓度高达20%~40%情况下进行厌氧消化,高效回收可再生清洁能源的一条途径.但高固形物含量及高有机负荷易导致进出料困难、传质不均匀和局部酸化过度等问题.针对厌氧发酵过程中的过度酸化问题,国内外学者进行了大量研究,并取得了一定进展.凌雪峰等(2004)通过逐步降低反应器内的pH值,获得了耐酸污泥,并实现了反应器在pH值6.0条件下的稳定运行;胡亚东等(2009;2010)用稀盐酸调节逐步降低培养基的pH值,富集培养耐酸产甲烷菌,并分离纯化得到了两株优势菌株RY3和SH4,但它们均是以H2+CO2或甲酸盐为碳源,不能利用乙酸盐;吴桂菊等(2013)采用HCl进行分阶段的污泥驯化培养,结果表明经过驯化,厌氧系统的最低耐受pH值可达4.0;申嫄等(2014)利用驯化至pH值4.5的耐酸污泥处理餐厨垃圾,COD去除率可达到pH值7.2时的65.0%~91.8%;Xin Kong等(2016)研究得出在以食品废弃物为底物的厌氧发酵体系中添加零价铁,可以通过促进酪酸转化和提高产甲烷活性以消除过度酸化;王晓华等(2016)在CSTR反应器中以餐厨垃圾为发酵底物驯化接种污泥,经过45 d稳定运行后,反应器内微生物群落较发酵初始发生明显变化.通过添加化学物质来缓解酸化作用的方式对于厌氧干发酵来说费用较高,而且可能会给发酵残余物的后续处理带来困难;通过耐酸驯化改变接种物的微生物群落结构,是防止酸化的有效途径.
基于厌氧发酵的机理,乙酸是水解和酸化阶段生成的主要有机酸,且2/3的甲烷由乙酸转化而来(Rincón et al., 2008),但是过高的乙酸浓度会抑制产甲烷的活性(Xiao et al., 2015).因此,为了避免发酵过程中乙酸的积累,本研究采用乙酸进行污泥的耐酸驯化,旨在富集得到耐高浓度乙酸,耐低pH值并且可以高效转化乙酸的微生物菌群.对驯化前后污泥中微生物群落结构的变化进行了分析研究,并对两种污泥在高酸浓度和低pH值条件下的发酵产气特性进行了对比.
2 材料和方法(Materials and methods) 2.1 污泥的耐酸驯化原始污泥(YSI)取自于淄博市淄川区杨寨镇秸秆沼气站,为运行良好的液态沼气发酵残余物.发酵原料为牛粪,发酵温度37 ℃.取6 kg左右的原始污泥(pH7.7)置于红泥厌氧发酵袋中,37 ℃下恒温培养2 d后,使用3.6×105 mg·L-1的乙酸调节pH值,对污泥进行4个pH阶段的驯化,pH值分别为7.2、6.7、6.2、6.0,每个阶段驯化10 d.乙酸是产甲烷菌的主要底物,驯化过程中会转化成甲烷而使pH值回升.因此,驯化期间每天测定pH值并用乙酸调节至本阶段目标pH值.驯化最终阶段的产气量稳定,并且甲烷含量在50%以上,所得到的污泥为耐酸污泥(XHI).驯化完成后,分别采集原始污泥和耐酸污泥用于微生物群落结构分析和发酵特性试验研究.
2.2 微生物群落结构分析污泥经充分搅拌混合均匀后,快速取样装入10 mL离心管密封,并立即蓝冰包装寄往上海生工生物工程有限公司进行测序分析.采用OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit提取污泥样品中的DNA,然后利用Qubit2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量.细菌DNA的PCR引物为:341F:CCCTACACGAC GCTCTTCCGATCTG (barcode) CCTACGGGNGGCW GCAG, 805R:GACTGGAGTTCCTTGGCACCCGAGAA TTCCAGACTACHVGGGTATCTA ATCC;古菌引用槽式PCR扩增有3轮,第1轮使用的引物为340F:CCCTAYGGGGYGCASCAG, 1000R:GGCCATGCACY WCYTCTC;第2轮使用第1轮PCR产物进行扩增,所用的引物为349F:CCCTACACGACGCTCTTCCGA TCTN (barcode) GYGCASCAGKCGMGAAW,806R:GACTGGAGTTCCTTGGCACCCGAGAATTCCAGGAC TACVSGGGTATCTAAT;第3轮扩增,引入Illumina桥式PCR兼容引物.利用Qubit2.0 DNA检测试剂盒对回收的DNA精确定量,依托Illumina MiSeq高通量测序平台进行测序.
2.3 厌氧发酵特性试验 2.3.1 VFA浓度耐受性试验参照厌氧污泥的产甲烷活性测定方法(刘士清等, 2013)进行.培养基中的VFA由乙酸、丙酸、丁酸按照COD比值为2:1:1进行配制,浓度分别为4500、5500、6500、7500、8500 mg·L-1(以乙酸计).以2 mol·L-1的NaOH溶液调节pH值至6.8.发酵过程在0.5 L的厌氧瓶中进行,污泥接种量为1.2 g ·L-1.每个VFA浓度做3个平行,以原始污泥为对照.试验装置如图 1所示,37 ℃恒温培养.每天定时排出注射器内液体,并记录体积,以体积值表征甲烷产量.
 |
| 图 1 发酵试验装置图(A.发酵瓶;B.3%NaOH;C.注射器) Fig. 1 Experimental facility (A:.Reactor; B:.3%NaOH; C.Injector) |
试验方法和试验装置同VFA耐受性试验.培养基中VFA浓度为2750 mg·L-1(以乙酸计).以2 mol·L-1的NaOH溶液调节培养基pH值分别为5.5、6.0、6.5、7.0和7.5.发酵过程在0.5 L的厌氧瓶中进行,污泥接种量为1.2 g ·L-1.每个pH梯度做3个平行,以原始污泥为对照.
3 结果与讨论(Results and discussion) 3.1 古菌群落分析通过质量控制,去除样品中非特异性扩增序列及嵌合体后,在相似度97%的水平上聚类得到了操作分类单元(OTU).驯化后耐酸污泥和原始污泥中古菌的有效序列数量分别为23240和22358,聚类后的OTU数目分别为511和584.Chao1指数与Ace指数都是生态学中用来估计物种总数的常用指数.由表 1中Chao1指数和Ace指数可以看出,驯化后厌氧污泥体系中古菌的物种丰富度略高于原始污泥.Shannon与Simpson指数是用来反映局域均匀生境下的物种多样性的指数,前者着重丰富性,后者强调均匀性.Shannon指数值越大,说明群落多样性越高,而Simpson指数越小则说明群落多样性和均匀性越高.如表 1所示,原始污泥样品的Shannon指数高于驯化污泥样品,Simpson指数低于驯化污泥,表明在原始污泥体系中古菌群落的多样性高于驯化后污泥.同时,较低的Simpson指数也表明原始污泥中的OTU分布更均匀.由上述结果可以看出,驯化后污泥中古菌群落结构发生了明显变化,菌群的多样性和分布的均匀度均明显降低.
| 表 1 YSI和XHI污泥样品中古菌的多样性指数 Table 1 Biodiversity indices of archaeal communities in sludge YSI and XHI |
驯化前后污泥样品中古菌群落在属水平上分布结果如图 2所示.驯化前的原始污泥中古菌群落结构分布相对较均匀,其中氢营养型的甲烷囊菌属(Methanoculleus,22.54%)、甲烷螺菌属(Methanospirillum,16.94%)和甲烷短杆菌属(Methanobrevibacter,8.05%)为优势菌群.经过乙酸驯化后污泥中的甲烷八叠球菌属(Methanosarcina)得到了富集,丰度由原始污泥中的4.2%显著提高至58.1%,在古菌群落中占据了绝对的主导地位.甲烷八叠球菌属是乙酸营养型产甲烷菌(Mah et al., 1978),也可以利用H2+CO2、甲醇和甲胺,较高的乙酸浓度有利于其快速生长.有研究指出,随着乙酸浓度的增加,厌氧体系内Methanosarcina的丰度也随之升高(汪婷, 2005),使用富含Methanosarcina的污泥,可有效地解决有机酸积累造成的酸化现象.
 |
| 图 2 驯化前后古菌在属水平上的分布饼状图 Fig. 2 Pie plot of archaea at genus level |
驯化后污泥中氢营养型的产甲烷菌的丰度都有不同程度的下降.Methanoculleus、Methanospirillum、Methanobrevibacter、Mthanothrix和Methanosphaera的丰度分别由原始污泥中的22.54%、16.94%、8.05%、3.99%和3.9%下降至20.09%、9.43%、0.37%、0.58%和0.09%.乙酸转化为甲烷主要通过两种途径:一是乙酸产甲烷途径,通过乙酸营养型产甲烷菌将乙酸转化生成甲烷(Ferry, 1992);二是乙酸互营产甲烷途径,乙酸先被互营菌氧化为H2和CO2,产生的CO2再被氢营养型的产甲烷菌利用H2还原为CH4(麻婷婷, 2015).本研究在驯化过程中只加入了乙酸一种底物,而高浓度乙酸有利于乙酸营养型的甲烷八叠球菌快速生长,大量的底物被乙酸型的产甲烷菌消耗,则供互营菌利用的乙酸就会减少,这就使得发酵过程中释放的H2量减少,底物缺乏,这会在一定程度上抑制氢营养型的产甲烷菌的活性,因而氢营养型的产甲烷菌的活性及丰度都有不同程度的降低.此外,未分类的古菌群在原始污泥中所占比例为34.47%,而在耐酸污泥中只占6.76%,这在一定程度上也表明了通过乙酸驯化后古菌群落多样性降低.由上述分析可知,原始污泥中产甲烷古菌以氢营养型为主导,而驯化后则乙酸营养型的产甲烷菌占优势.
3.2 细菌群落分析同古菌分析方法相一致,细菌群落的多样性指数结果见表 2.耐酸污泥和原始污泥样品分别得到了44800和35778个细菌有效序列,聚类后OTU数目分别为2719和3117.Chao1和Ace指数值的结果均表明耐酸污泥中的物种数量高于原始污泥.Shannon指数和Simpson指数值则表明原始污泥中细菌的多样性略高于驯化后污泥,但驯化后细菌菌群丰度的分布比原始污泥中更加均匀.与古菌相比较,无论耐酸驯化后的污泥还是原始污泥,细菌群落结构的多样性和丰度均明显优于古菌,这与Lee等的研究结果相一致(Lee et al., 2017).
| 表 2 XHI和YSI样品中细菌群落的多样性指数 Table 2 Biodiversity indices of bacterial communities in sludge YSI and XHI |
由于污泥中细菌的种类繁多,根据相对丰度的大小,图 3仅显出了门水平上相对丰度大于1%的细菌种类.在原始污泥中,优势的细菌菌门有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、互养菌门(Synergistetes).其中相对丰度最大的菌门为Firmicutes,占48.79%.该门下多为水解型细菌,主要水解一些高分子聚合物,例如纤维素,木质素(Dridi et al., 2012),广泛分布在下水道污泥中(Ariesyady et al., 2007).添加乙酸驯化后,Firmicutes的丰度提高到61.7%,这可能与驯化过程中污泥中固形物含量(TS)降低有关.有研究指出,污泥厌氧发酵中TS在10%和15%时,Firmicutes的丰度分别可达72.5%和71.5%,而在TS提高到17%和19%时,丰度仅为27.0%和13.7%(Liu et al., 2016).Bacteroidetes常见于厌氧发酵体系中,是厌氧发酵过程中重要产酸菌和发酵菌,功能主要是将各种蛋白质降解为VFAs等(Yi et al., 2013).其相对丰度在原始污泥细菌中为30.06%,而驯化后大幅下降至16.94%,此时发酵体系的TS含量也下降,这与Liu等的研究结果相似(Liu et al., 2016).此外,Proteobacteria和Synergistetes的相对丰度由原始污泥细菌中的10.87%和1.69%经驯化下降至7.25%和1.55%,Chloroflexi和Cloacimonetes的相对丰度则由原始污泥中的1.89%和0.79%经驯化增加至3.71%,2.21%.有研究显示,牛粪厌氧发酵的微生物群落结构中优势菌群为厚壁菌、变形菌、拟杆菌,这与本试验原始污泥的生境相似,群落结构也较为相似(邹艳美, 2012).
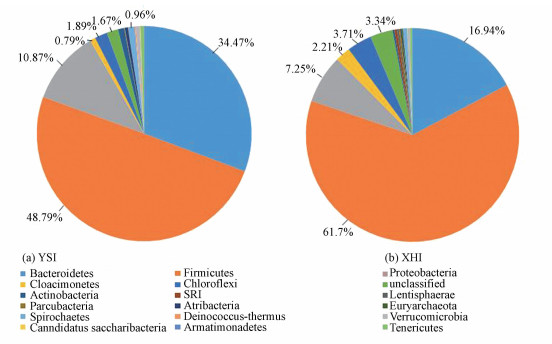 |
| 图 3 驯化前后细菌在门平上的分布饼状图 Fig. 3 Pie plot of bacteria communities at phylum level |
污泥中细菌在纲水平上的系统分类如图 4所示.梭菌纲(Clostridia)和拟杆菌纲(Bacteroidia)在两种污泥中相对丰度均较高.经过驯化,Clostridia纲的相对丰度由原始污泥细菌中的45.51%增加至56.03%,其在原始污泥与耐酸污泥细菌群落中均占主导地位.Clostridia纲下的大部分细菌,主要作用是在厌氧发酵过程中分解一些难降解的纤维素,并为产甲烷菌提供生长繁殖的必需物质(Ziganshin et al., 2013).有文献报道其在中温厌氧发酵中与氢营养型产甲烷菌具有互养关系(Jang et al., 2016),因此其在体系中的优势地位也是厌氧发酵顺利进行的重要保障.经过驯化后Bacteroidia的相对丰度由26.5%降低至10.98%.芽孢杆菌纲(Bacilli)的相对丰度在驯化过程中略有升高,由原始污泥细菌中的1.32%增加至5.08%.Bacilli可以释放出脂肪酶,其下属的菌种可以将一些双糖降解为酸,可以水解淀粉,胶质等,且对pH的耐受性较强,在pH5~11范围内均可以生长繁殖(Shahinyan et al., 2017).而Flavobacteriia则由1.79%升高至2.01%.除此以外,Chloroflexi下的厌氧绳菌纲(Anaerolineae)、Proteobacteria下的β-变形菌(Betaproteobacteria)的相对丰度都在驯化过程中有所上升,Proteobacteria下的δ-变形菌纲(Deltaproteobacteria)、γ-变形菌(Gammaproteobacteria)、的相对丰度都不同程度的有所下降.
 |
| 图 4 驯化前后细菌在纲平上的分布条形图 Fig. 4 Bar plot of bacteria communities at class level |
两种污泥样品中相对丰度前10位的细菌属如表 3所示,驯化前后的菌群结构和相对丰度均发生了明显变化(表 3).驯化后样品中细菌菌群结构更加集中,前10位的相对丰度总量为44.23%,且前5位均属于梭菌纲,而原始污泥中前10位的相对丰度总量仅为31.63%.Saccharofermentans属细菌在pH值为5.0~7.5范围内可发酵己糖、多糖和醇类产生乙酸盐、乳酸盐和延胡索酸盐(Cardinalirezende et al., 2016; Chen et al., 2010);Sedimentibacter的相对丰度与许多有机物质的降解有关,例如甲酚、二甲酚、吲哚等(Huang et al., 2016),同时其能利用乙酸和氢气,添加乙酸诱导了该菌属的生长.而梭菌纲下的Clostridium Ⅲ属相对丰度则显著降低(p < 0.05),由6.09%降至3.78%.Clostridium Ⅲ属可降解纤维素类底物并且转化成乙酸(赵光, 2013),而本研究的污泥驯化过程中仅以乙酸为唯一底物,体系没有添加纤维素,因此驯化后其相对丰度也随之下降.Proteiniphilum属于Bacteroidetes,主要将一些含蛋白质的有机质分解为乙酸,Comamonas与挥发油的降解有关(Huang et al., 2016),二者的相对丰度在驯化后均有一定程度的增加.
| 表 3 XHI与YSI中相对丰度前十的细菌属 Table 3 Relative abundances of the top 10 bacterial genera in XHI and YSI |
分别将耐酸驯化后的污泥和原始污泥接种到不同VFA浓度的培养基中(pH 6.8),发酵产气情况如图 5所示.两种污泥在各VFA浓度梯度下的产气趋势基本相似,接种后有24 h左右的延滞期,然后呈现先增加后降低.接种耐酸污泥时(图 5a),VFA浓度为4500 mg·L-1和5500 mg·L-1的处理在发酵60 h出现了峰值,日产气量为56 mL·L-1和55 mL·L-1,分别比相同VFA浓度下接种原始污泥的处理提高了16%和24%.其余浓度下的甲烷产量都在发酵后的72 h出现峰值,且都比前两个浓度下的产量低.接种原始污泥处理(图 5b)的产气趋势与驯化后的污泥相似,但产气峰值及总产气量均明显降低.VFA浓度为4500 mg·L-1、5500 mg·L-1和6500 mg·L-1的处理都在第60 h时出现产气高峰,而剩下两个浓度则较为滞后.VFA是厌氧发酵过程中的主要中间产物,浓度过高,尤其是丙酸和丁酸浓度过高会抑制产甲烷菌的生长和代谢活性(Wang et al., 2009).本研究中,两种污泥在4500~5500 mg·L-1的低酸浓度下均能快速产气,而较高的VFA浓度的情况下则出现了产气高峰滞后和峰值显著降低的现象.在相同乙酸浓度下,驯化后的污泥产气性能明显优于原始污泥.在VFA浓度为6500 mg·L-1时,产气高峰虽然略有滞后,但产气峰值与低VFA浓度的处理差异不大.当VFA浓度提高至7500 mg·L-1时,产气峰值仍能达到低VFA浓度处理的80%,与原始污泥在低VFA浓度(4500 mg·L-1)下的产气高峰近似相等.而原始污泥在VFA浓度为7500 mg·L-1时的产气峰值比4500 mg·L-1和5500 mg·L-1时则分别降低了29%和32%.以上结果表明,通过乙酸驯化得到的耐酸污泥对高VFA浓度的耐受性有了明显提高.
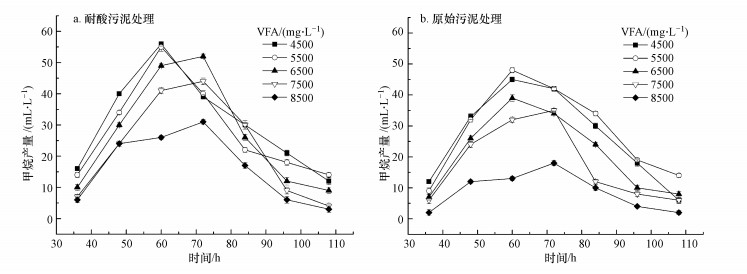 |
| 图 5 不同VFA浓度下的甲烷产量 Fig. 5 Methane yields at different VFAs concentrations |
两种污泥在不同pH条件下的产气情况如图 6所示.接种耐酸污泥的处理组(图 6a),pH值6.5时的产气启动速度最快,在发酵第60 h最先达到产气高峰43 mL·L-1.pH值6.0的处理,产气出峰时间虽稍微滞后,但产气峰值最高,达到67 mL·L-1.随后快速下降,这是由于培养基中底物被转化消耗,浓度降低,则甲烷的转化量也相应下降.该处理组在pH值5.5时依然有气体产生,峰值可达32 mL·L-1;而pH7.5的处理产气最差.接种原始污泥的处理组(图 6b),甲烷产量整体偏低,在pH值7.0时的产气效果最好,该pH值处于多数产甲烷菌的最适生长范围内,因此该处理启动最快,在第60 h率先出现产气高峰.但该处理的峰值仅为pH 6.0条件下接种耐酸污泥的56%,这是因为培养基中的主要底物为乙酸,耐酸驯化后污泥中乙酸营养型产甲烷菌丰度占据了绝对优势,而原始污泥中只有4.2%.该处理组在pH值6.0时的产甲烷菌活性被严重抑制,产气峰值为相同pH下接种耐酸污泥的36%.接种两种污泥的处理组在pH值7.5时的产气效果均较差,说明原始污泥中产甲烷菌群在该pH值条件下的活性较低.以上结果表明,经过驯化的耐酸污泥,耐受低pH的能力明显提高,在pH6.0下仍能够稳定产气.
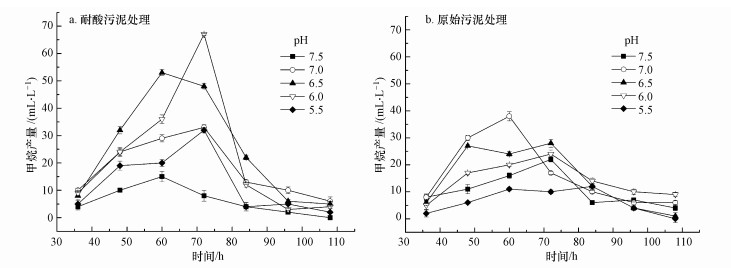 |
| 图 6 不同pH值条件下的甲烷产量 Fig. 6 Methane yields at different pH values |
1) 乙酸驯化后,污泥中产甲烷古菌群落的多样性降低,群落结构发生了显著变化,由原始污泥中以氢营养型产甲烷菌为主导转变为乙酸营养型的产甲烷菌占绝对优势.驯化后污泥中的乙酸营养型产甲烷菌中的甲烷八叠球菌属(Methanosarcina)得到了明显富集,其相对丰度由原始的4.2%提高到58.1%.
2) 驯化前后污泥中细菌的优势菌门均为主要降解纤维素和半纤维素的厚壁菌门(Firmicutes)和降解蛋白质的拟杆菌门(Bacteroidetes),其中驯化后Firmicutes的丰度由48.8%提高到61.7%,而Bacteroidetes的丰度则由30.1%降低至16.9%.
3) 驯化后的污泥对高VFA浓度和低pH值的耐受性均有较大程度的提高,在VFA浓度为7500 mg·L-1及pH 6.0条件下仍可以快速产气.接种耐酸污泥时,VFA浓度为4500 mg·L-1和5500 mg·L-1的日甲烷产量峰值分别比相同VFA浓度下接种原始污泥的处理提高了16%和24%.当VFA浓度提高至7500 mg·L-1时,产气峰值仍能达到低VFA浓度处理的80%.接种耐酸污泥的处理组,pH值6.5时产气启动速度最快,pH值6.0时产气峰值最高.接种原始污泥的处理组,在pH值6.0时的产甲烷菌活性被严重抑制,产气峰值仅为相同pH下接种耐酸污泥的36%.
Ariesyady H D, Ito T, Okabe S. 2007. Functional bacterial and archaeal community structures of major trophic groups in a full-scale anaerobic sludge digester[J]. Water Research, 41(7): 1554–1568.
DOI:10.1016/j.watres.2006.12.036
|
Cardinalirezende J, Rojasojeda P, Nascimento A M, et al. 2016. Proteolytic bacterial dominance in a full-scale municipal solid waste anaerobic reactor assessed by 454 pyrosequencing technology[J]. Chemosphere, 146: 519–525.
DOI:10.1016/j.chemosphere.2015.12.003
|
Chen S, Niu L, Zhang Y. 2010. Saccharofermentans acetigenes gen. nov., sp. nov., ananaerobic bacterium isolated from sludge treating brewery waste water[J]. International Journal of Systematic and Evolutionary Microbiology, 60(12): 2735–2738.
DOI:10.1099/ijs.0.017590-0
|
Dridi B, Fardeau M L, Ollivier B, et al. 2012. Methanomassiliicoccus luminyensis gen. nov. sp. nov. a methanogenic archaeon isolated from human faeces[J]. International Journal of Systematic & Evolutionary Microbiology, 62(8): 1902–1907.
|
Ferry J G. 1992. Biochemistry of Methanogenesis[J]. Critical Reviews in Biochemistry and Molecular Biology, 27(6): 473–503.
DOI:10.3109/10409239209082570
|
Huang Y, Hou X, Liu S, et al. 2016. Correspondence analysis of bio-refractory compounds degradation and microbiological community distribution in anaerobic filter for coking wastewater treatment[J]. Chemical Engineering Journal,, 304: 864–872.
DOI:10.1016/j.cej.2016.05.142
|
胡亚东, 袁月祥, 闫志英, 等. 2010. 一株耐酸碱嗜热产甲烷菌的分离与系统发育分析[J]. 太阳能学报, 2010, 31(10): 1251–1256.
|
胡亚东, 袁月祥, 闫志英, 等. 2009. 一株生长pH较宽的产甲烷菌分离与系统发育分析[J]. 应用与环境生物学报, 2009, 15(4): 554–558.
|
Jang H M, Ha J H, Kim M S, et al. 2016. Effect of increased load of high-strength food wastewater in thermophilic and mesophilic anaerobic co-digestion of waste activated sludge on bacterial community structure[J]. Water Research, 99: 140–148.
DOI:10.1016/j.watres.2016.04.051
|
Kong X, Wei Y, Xu S, et al. 2016. Inhibiting excessive acidification using zero-valent iron in anaerobic digestion of food waste at high organic load rates[J]. Bioresource Technology, 211: 65–71.
DOI:10.1016/j.biortech.2016.03.078
|
Lee J, Kim J R, Jeong S, et al. 2017. Long-term performance of anaerobic digestion for crop residues containing heavy metals and response of microbial communities[J]. Waste Management, 59: 498–507.
DOI:10.1016/j.wasman.2016.10.005
|
凌雪峰, 左剑恶, 顾夏声. 2004. pH6.0酸性条件下产甲烷EGSB反应器的运行研究[J]. 环境科学, 2004, 25(1): 57–61.
|
Liu C, Li H, Zhang Y, et al. 2016. Evolution of microbial community along with increasing solid concentration during high-solids anaerobic digestion of sewage sludge[J]. Bioresource Technology, 216: 87–94.
DOI:10.1016/j.biortech.2016.05.048
|
刘士清, 张无敌, 尹芳, 等. 2013. 沼气发酵实验教程[M]. 北京: 化学工业出版社.
|
麻婷婷, 承磊, 刘来雁, 等. 2015. 不同抑制剂对乙酸降解产甲烷及产甲烷菌群结构的影响[J]. 微生物学报, 2015, 55(5): 587–597.
|
Mah R A, Smith M R, Baresi L. 1978. Studies on an acetate-fermenting strain of Methanosarcina[J]. Applied & Environmental Microbiology, 35(6): 1174–1184.
|
Rincón B, Sánchez E, Raposo F, et al. 2008. Effect of the organic loading rate on the performance of anaerobic acidogenic fermentation of two-phase olive mill solid residue[J]. Water Management, 28(5): 870–877.
|
Shahinyan G, Margaryan A, Panosyan H, et al. 2017. Identification and sequence analyses of novel lipase encoding novel thermophillic bacilli isolated from Armenian geothermal springs[J]. Bmc Microbiology, 17(1): 103–113.
DOI:10.1186/s12866-017-1016-4
|
申嫄, 邸玉翠, 吴桂菊, 等. 2014. 耐酸厌氧消化污泥处理餐厨垃圾[J]. 环境工程学报, 2014, 8(2): 692–696.
|
汪婷. 2005. 沼气发酵过程中产甲烷菌分子多样性研究及产甲烷菌的分离[D]. 南京: 南京农业大学
|
王晓华, 李蕾, 何琴, 等. 2016. 驯化对餐厨垃圾厌氧消化系统微生物群落结构的影响[J]. 环境科学学报, 2016, 36(12): 4421–4427.
|
Wang Y, Zhang Y, Wang J, et al. 2009. Effects of volatile fatty acid concentrations on methane yield and methanogenic bacteria[J]. Biomass and Bioenergy, 33: 848–853.
DOI:10.1016/j.biombioe.2009.01.007
|
吴桂菊, 邸玉翠, 申嫄, 等. 2013. 厌氧消化污泥的耐酸驯化培养[J]. 三峡环境与生态, 2013, 35(2): 45–48.
|
Xiao K, Guo C, Zhou Y, et al. 2015. Acetic acid effects on methanogens in the second stage of a two-stage anaerobic system[J]. Chemosphere, 144: 1498–1504.
|
Yi J, Dong B, Jin J, et al. 2013. Effect of increasing total solids contents on anaerobic digestion of food waste under mesophilic conditions:performance and microbial characteristics analysis[J]. Plos One, 9(7): e102548.
|
赵光. 2013. 两段式厌氧工艺产甲烷发酵特性及微生物生态调控机制研究[D]. 哈尔滨: 哈尔滨工业大学
|
Ziganshin A M, Liebetrau J, Pröter J, et al. 2013. Microbial community structure and dynamics during anaerobic digestion of various agricultural waste materials[J]. Applied Microbiology and Biotechnology, 97(11): 5161–5174.
DOI:10.1007/s00253-013-4867-0
|
邹艳美. 2012. Co2+对牛粪厌氧发酵产气性能和微生物群落结构的影响[D]. 南京: 南京农业大学
|
 2018, Vol. 38
2018, Vol. 38


