2. 长沙经济技术开发区水质净化工程有限公司, 长沙 410100;
3. 长安大学环境科学与工程学院, 西安 710054
2. Changsha Economic and Technical Development Zone Water Purification Engineering Co., Ltd, Changsha 410100;
3. School of Environmental Science and Engineering, Chang'an University, Xi'an 710054
人工湿地不仅可以净化污水、修复水环境, 而且还具有景观效应(Hammer et al., 1989).潮汐流人工湿地具有较好的复氧效果, 系统内处于有氧环境(Sun et al., 1999);潜流人工湿地虽有液面复氧和植物根系复氧的能力, 但系统内仍然属于缺氧环境(Stottmeister et al., 2003).单纯的处理工艺往往导致人工湿地对总氮的处理效果不好, 为了提高人工湿地对总氮的去除效果, 防止处理后的污水排入环境导致水体“富营养化”, 本研究依据总氮在人工湿地中的净化机理, 将潮汐流和潜流人工湿地进行组合, 在去除有机质的前提下达到强化脱氮的目的.
净化污水的过程中, 微生物是去除有机物和含氮化合物的主要承担者(Faulwetter et al., 2009), 对湿地除磷也起到一定促进作用(Oehl et al., 2004).污水中BOD5和CODCr的去除与湿地微生物总数显著相关(项学敏等, 2004), TN和NH4+-N的去除与硝化细菌和反硝化细菌数量显著相关(成水平等, 1998; 卢少勇等, 2006), 而磷元素的去除则与不动杆菌、气单胞菌属、假单胞菌属等的数量存在明显的相关性(Stottmeister et al., 2003).湿地植物芦苇、灯芯草和香蒲根际微生物数量、活性等特性研究发现香蒲、灯心草人工湿地中细菌、放线菌、真菌数量多, 并具有明显的根际效应, 而芦苇根际比香蒲更适合亚硝酸细菌的生长(Ibekwe et al., 2007).不同类型湿地由于构造和水流方式的不同, 湿地中微生物群落结构也存在差异, 潜流湿地中厌氧菌数量相对较多, 表流湿地中好氧细菌相对较多(Liang et al., 2003; 杜刚等, 2013).微生物数量和种类在人工湿地的垂直分布上也呈现一定的规律, 即随着基质层的加深逐渐减少(Tietz et al., 2007).此外, 季节变化引起的环境条件差异会对人工湿地系统中微生物种群和数量产生影响, 从而使人工湿地的净化效果发生改变(梁威等, 2004).目前国内关于潮汐流人工湿地的研究还较少, 运用分子生物学技术对潮汐-潜流组合工艺中微生物群落分布特征更鲜有报道.本文应用PCR-DGGE技术识别潮汐流-潜流组合工艺系统中微生物群落, 对比分析群落活性与功能, 分析微生物群落结构与代谢特征变化(Yu et al., 2001; 朱励之等, 2012), 探讨潮汐流-潜流组合工艺系统中的主要功能菌, 为研究其强化生物脱氮除磷的生物学机制奠定理论基础.
2 材料与方法(Materials and methods) 2.1 实验系统组合人工湿地由潮汐流人工湿地单元和潜流人工湿地单元组成, 每单元进水采用蠕动泵控制, 其中潮汐流人工湿地采用下行流方式进出水, 并用PLC时控器定时调控进出水;潜流人工湿地采用上行流方式进出水.实验装置共两套, 如图 1所示, 分别为:(a)种植植物的潮汐流-潜流人工湿地组合(组合一), 各湿地装置分别种植8株香蒲;(b)未种植植物的潮汐流-潜流人工湿地组合(组合二).每个单元为直径30 cm, 高80 cm的有机玻璃(PMMA)圆柱体, 总体积42 L, 其中填料高度为65 cm, (底部Ф25~50 mm砾石厚15 cm, 中部Ф8~12 mm砾石厚20 cm, 上部Ф3~5 mm砾石厚30 cm).
 |
| 图 1 潮汐流-潜流组合人工湿地工艺示意图(a.种植植物, b.未种植植物) Fig. 1 The diagram of the combined tide flow-subsurface flow constructed wetland (a.with plants, b. without plants) |
潮汐流单元运行方式为:瞬时进水-反应期4 h-瞬时排水-闲置期4 h, 每个周期8 h, 每天3个周期, 每个周期处理水量为20 L(Sun et al., 2005).潜流单元运行方式为连续进水, 进水流量为42 mL·min-1, 8 h进水20 L, 水力停留时间为19.6 h.2014年10月启动反应器, 实验室温度18~25 ℃, 实验用水为人工模拟生活污水, 由葡萄糖、氯化铵、磷酸二氢钾配制, 同时投加CaCl2·2H2O, MgSO4·7H2O和FeSO4·7H2O等补充微量元素.污水pH为6.5~7.7, 其他主要水质指标见表 1.
| 表 1 试验水质 Table 1 The quality of influent water in the reactor |
反应器启动2个月后, 出水水质稳定, 进行样品采集及DNA提取, 采样点位位置和条带编号见表 2.
| 表 2 采样点位置及编号说明 Table 2 The location and serial numbers of the sampling point |
在反应器出水水质稳定后, 通过采样孔, 采集含有砾石、间隙水和沉积物的混合样品, 离心取上清液, 保存于-20 ℃冰箱中, 用于后续检测(田园等, 2015).
2.2.1 DNA提取采用QIAamp® DNA Stool 118 Mini Kit (Qiagen, Germany)进行提取, 提取到的总DNA采用0.8%琼脂糖凝胶电泳进行检查, 通过Genfinder (Invitrogen, USA)染色, 利用凝胶成像系统(Biorad GelDoc XR, USA)观察拍照.电泳条件:琼脂糖凝胶浓度0.8%, 电泳电压120 V, 电泳时间30 min, Genfinder终浓度1 μg·L-1, 电泳所用Marker为Lambda DNA/HindⅢMarkers (Promega, USA).
2.2.2 PCR扩增采用1 μL不同引物的DNA模版.扩增体系为:0.5 μmol引物(TAKARA BIOTECHNOLOGY (DALIAN) CO, LTD.), 800 μmol·L-1 dNTP, 400 ng·μL-1牛血清白蛋白, 2 mmol·L-1 MgCl2, 1.25 UTaq聚合酶, 10 μL的1×PCR缓冲剂, 1 μL DNA样品.扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-TACGG YTACCTGTTCGCTT-3′)、357F-GCa(GCCCTACGGGA GGCAGCAG)和518R(ATTACCGCGGCTGCTGG).扩增后, 采用琼脂糖凝胶电泳检测产物大小, 并利用凝胶成像系统观察拍照.电泳条件:琼脂糖胶浓度1.5%, 电泳电压100 V, 电泳时间30 min, Genfinder终浓度1 μg·L-1, 电泳所用Maker为Pgem DNA Makers(Promega, USA).
2.2.3 DGGE使用D-Code系统(Biorad, USA)对PCR扩增产物进行DGGE分离.条件为:聚丙烯酰胺(37.5:1)浓度为8%, 变性剂浓度梯度为35%~60%(100%的变性剂中还有7.0 mol·L-1的尿素和40%的去离子甲酰胺), 胶厚度0.75 mm, 电泳缓冲液为1×TAE(40 mmol·L-1 Tris, 20 mmol·L-1乙酸, 1 mmol·L-1 EDTA二钠), 电泳电压120 V, 电泳温度60 ℃, 电泳时间12 h.DGGE电泳结果采用Genfinder(Invitrogrn, USA)进行染色, 并利用凝胶成像系统(Biorad GelDoc XR, USA)对染色后的DGGE结果进行观察、拍照.
2.2.4 目的DNA的回收和测序将含目的NDA条带的凝胶块割下转移到200 μL微型离心管中, 加入30 μL ddH2O(Takala, Japan)4 ℃溶解, 以5 μL上清液为模板, 采用总细菌引物357F和518R进行扩增.PCR产物用琼脂糖凝胶电泳检测片段大小, 用QIAquick PCR纯化试剂盒(Qiagen, USA)对PCR产物进行纯化, 并送至上海生工测序中心进行DNA片段序列测定.测序结果与NCBI基因文库中已知序列进行比对.采用MEGA4.1软件对测序结果与Genbank中的相似序列建立系统发育树.
2.2.5 常规水质指标CODCr、NH4+-N、TN、NO3--N、NO2--N、PO43--P采用国标法测定(水和废水监测分析方法, 2002).
2.2.6 统计分析DGGE指纹图谱分析采用GelDoc XR凝胶成像系统进行条带辨别, 迁移率、强度和面积计算, 并绘制泳道间的遗传图谱, 同时应用Quantity One软件计算样品间相似性指数(徐影等, 2013).
采用Dice指数计算各样品间的相似性指数, 在忽略条带强度的条件下把DGGE图片转换为二维数据矩阵, 转换3次以确保结果的一致性, 组间的相似度用Dice指数表示, 计算公式如式(1)所示.

|
(1) |
式中, Cs为Dice指数, j为两个样品间的共有条带数, a、b分别为两个样品各自条带数.
采用Shannon-wiener多样性指数(H′)表示种群多样性, 每一条带视为一个种, 条带强度视为物种丰度, 其计算公式如式(2)所示.

|
(2) |

|
(3) |
式中, ni为第i各条带的强度, N为所有条带强度之和.
采用均匀度指数(E)表示不同操作条件下的物种分布情况.其计算公式如式(4)所示
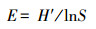
|
(4) |
式中, S为样品中条带的总数, 均匀指数最大值为1.
用种群的丰度指数(R)表示样品的微生物丰富度, 其计算公式如式(5)所示.

|
(5) |
反应器运行稳定后, 连续监测进出水水质3个月, 各项指标浓度及去除率如表 3所示.在平均进水CODCr、NH4+-N、TN、NO3--N、NO2--N、PO43--P浓度分别为214.21、8.83、10.25、0.95、0.47和5.44 mg·L-1时, 有植物组合COD和NH4+-N去除率较高, 分别为62.82%和70.22%, 较无植物组合高4.58%和15.07%;无植物组合TN、NO3--N、NO2--N、PO43--P去除率较高, 分别为68.00%、65.26%、61.70%和46.88%, 较有植物组合高19.41%、36.84%、23.40%和3.50%.
| 表 3 污染物进出水浓度及去除率 Table 3 Effluent water qualities and pollutant removal performance |
潮汐流-潜流组合人工湿地各采样点DGGE指纹图谱如图 2所示.潮汐流人工湿地随着反应期-闲置期交替运行, 装置内优势种群也会发生相应改变.条带强度由强变弱的主要有band13(Acidovorax)、band35(Sphingomonas);由弱变强的主要有band14(Sphingobacteriales)、band46(Proteobacteria)、band43(Alphaproteobacteria).band13(Acidovorax)与band14(Sphingobacteriales)有明显的拮抗关系.潜流人工湿地中种植植物与未种植植物在优势种群中也存在一定的差别, 种植植物的湿地中较明显的优势物种主要有band13(Acidovorax)、band23(Acidobacteria), 而未种植植物中的优势物种主要有band8(Pseudomonas)、band9(Actinomycetales)、band14(Sphingobacteriales).从空间分布来看, 潮汐流人工湿地除band40(Proteobacteria)有较明显的上少下多的空间分布规律外, 其他条带没有明显的规律;潜流人工湿地中, 未种植植物单元明显呈现上多下少的有band8(Pseudomonas)、band9(Actinomycetales)、band17(Massilia)、band19(Bacteroidetes)、band20(Chlorobium)、band40(Proteobacteria), 呈现上少下多的有band7(Epsilonproteobacteria)、band25(Thiothrix)、band27(Dechloromonas), 分布规律非常明显.种植植物单元明显呈现上多下少的有band16 (Acidobacteriaceae)、band17(Massilia)、band18(Massilia)、band19(Bacteroidetes)、band23(Acidobacteria), 呈现下多上少的band9(Actinomycetales)、band26(Lysobacter), 空间分布差异性略低于未种植植物单元.
 |
| 图 2 总细菌的DGGE指纹图谱 Fig. 2 DGGE fingerprint patterns of total bacteria count |
人工湿地微生物总群结构的相似性可以通过Dice指数(Cs)进行定量表征, 各采样点的Cs指数如表 4所示.
| 表 4 总细菌DGGE指纹图谱的相似度矩阵 Table 4 Dice index(Cs) comparing the similarity of DGGE fingerprints |
潮汐流-潜流组合人工湿地各采样点微生物群落聚类分析如图 3所示, 各采样点种群结构相似性在60%分为两大类, 分别是1~6编号的潮汐流人工湿地和7~12编号的潜流人工湿地, 说明潮汐流人工湿地与潜流人工湿地在微生物种群结构方面有明显差异, 这可能跟该组合工艺构型有关.对比不同湿地单元编号, 可以发现潮汐流人工湿地空间分布种群相似性比潜流人工湿地高, 说明潮汐流人工湿地自上而下微生物物种种类差异性较小, 这可能与潮汐流人工湿地特有的处理工艺(反应期-排空-闲置期)有关, 上下层溶解氧水平基本一致.在潜流人工湿地中种植植物的各采样点(7、8、9编号)之间的种群结构相似性比未种植植物的各采样点(10、11、12编号)的种群结构相似性高.表明植物根系能够为底层微生物提供少量的溶解氧, 进而使表层与底层的微生物种群结构差异性降低.
 |
| 图 3 总细菌组成的聚类分析 Fig. 3 Cluster analysis of microbial community structure dynamics |
微生物种群多样性指数是运用数学方法来度量组成种群的个体总数、种类及种群均匀程度等方面的指标, 可表征微生物种群的组织结构水平和生态学特征(Duan et al., 2013; Qiu et al., 2013).潮汐流-潜流组合人工湿地各编号单元微生物种群多样性指数(H′)、均匀度(E)、丰富度(R)计算结果见表 5.
| 表 5 总细菌种群多样性指数 Table 5 Microbial community diversity index |
7~12编号的潜流人工湿地较1~6编号的潮汐流人工湿地种群多样性指数高, 说明潜流人工湿地物种较为丰富;10~12为未种植植物的潜流人工湿地, 由上而下多样性指数呈递减趋势, 说明表层物种多样性大;7~9为种植植物的潜流人工湿地, 可以发现9号的多样性指数与7号和8号相差不大, 这可能是由于植物根系的存在导致中下层物种种类增多;潮汐流人工湿地由上而下多样性指数差别不大, 说明潮汐流空间物种多样性差异小, 间接反映潮汐流具有一定的充氧效果;观察潮汐流反应期, 可以发现1~3编号的丰富度呈递减趋势, 可以说明潮汐流中上层微生物数量多.
3.4 系统发育树分析潮汐流-潜流组合人工湿地细菌系统发育树如图 4所示.研究发现潮汐流-潜流人工湿地系统包含的微生物种类最多的物种是Proteobacteria, 共25种(包括Betaproteobacteria 10种、Gammaproteobacteria 5种、Alphaproteobacteria 5种、Epsilonproteobacteria 2种以及Deltaproteobacteria 2种).其次是Acidobacteria 6种, Bacteroidetes 5种, Firmicutes 3种, Actinobacteria 2种及Nitrospirae 1种.
 |
| 图 4 总细菌的系统发育树 Fig. 4 Phylogenetic relationships among universal bacterial sequences |
系统中可以确定的好氧微生物条带主要有Band41黄杆菌(Flavobacteriaceae), Band4亚硝化螺菌属(Nitrosospira), Band17、21、18、24草酸杆菌科(Oxalobacteraceae), Band35、46鞘氨醇单胞菌属(Sphingomonas), Band6、7、22甲基单胞菌属(Methylomonas), Band47硝化螺旋菌(Nitrospirae).其中Band35、46鞘氨醇单胞菌属(Sphingomonas), 可用于芳香化合物的生物降解.该属菌株具有高代谢能力与多功能的生理特性, 专性需氧且能产生过氧化氢酶, 同时在多环芳烃(PAHs)及六六六(HCH)异构体的降解方面, 该菌种有着独特的优势.结合DGGE指纹图谱可以看出, 好氧微生物在潮汐流人工湿地的空间分布具有一致性, 然而在潜流人工湿地系统中具有上多下少的规律.
专性厌氧的微生物条带及种属主要有Band15拟杆菌(Bacteroides), 该菌种可以发酵分解蛋白胨或葡萄糖, 产生琥珀酸、乙酸、甲酸、乳酸和丙酸等.兼性好氧厌氧的微生物条带及种属主要有Band28、12、27红环菌(Rhodocyclaceae), Band9放线菌目(Actinomycetales), Band11芽孢杆菌目(Bacillales).
可以确定的异养型微生物主要有:Band14、45鞘脂杆菌(Sphingobacteriaceae), Band15拟杆菌(Bacteroides), Band41黄杆菌(Flavobacteriaceae), Band13食酸菌属(Acidovorax), Band17、18、21、24草酸杆菌科(Oxalobacteraceae), Band35、46鞘氨醇单胞菌属(Sphingomonas), Band36、48梭菌属(Clostridiaceae), Band9放线菌目(Actinomycetales), Band6、7、22甲基单胞菌属(Methylomonas).
可以确定的自养型微生物物种主要有:Band4亚硝化螺菌属(Nitrosospira), Band12、27、28红环菌(Rhodocyclaceae), Band25丝硫细菌(Thiothrix), Band47硝化螺旋菌(Nitrospirae), Band20绿硫细菌(Chlorobium).其中丝硫细菌可利用H2S作能源, 将H2S氧化为硫粒, 积累在菌体内, 在缺乏营养时又将硫粒氧化为SO42-.
3.5 微生物群落氮去除作用探讨变形菌门(Proteobacteria)是厌氧消化实验装置中常见的细菌类群(Juretschko et al., 2002; Hiraishi et al., 2000).尤其是β-变形菌纲(Betaproteobacteria), 其在厌氧消化中发挥着重要的代谢功能, 许多种群与葡萄糖、丙酸盐、丁酸盐等小分子化合物的利用有关(Ariesyady et al., 2007);亚硝化单胞菌属(Nitrosomonas)、亚硝化球菌属(Nitrosococcus)则是硝化反硝化反应器中的重要菌群, 具有氨氧化作用(Smith et al., 2006).酸杆菌门(Acidobacteria)对植物残体降解有着重要的作用(王光华等, 2016).拟杆菌门(Bacteroidetes)包括拟杆菌纲、黄杆菌纲、鞘脂杆菌纲三大类, 大多数菌种属于常见的反硝化细菌(Ki et al., 2008).厚壁菌门(Firmicutes)在一些厌氧消化反应器中广泛分布, 包含众多重要的功能微生物, 如梭菌纲、芽孢杆菌纲等(Ariesyady et al., 2007; Chouari et al., 2005; Cheon et al., 2008).梭菌属(Clostridium)是一类严格厌氧的细菌, 在降解碳水化合物的同时会产生乙酸、丁酸等产物(Zhang et al., 2005).放线菌门(Actinobacteria)是一类在厌氧消化反应器中具有重要功能的革兰氏阳性细菌类群, 在很多污水处理活性污泥中广泛分布(Ariesyady et al., 2007; Chouari et al., 2005; Liu et al., 2000).硝化螺旋菌门(Nitrospira)是一类革兰氏阴性细菌, 其中的硝化螺旋菌属(Nitrospira)作为硝化细菌(Nitrifier), 可将亚硝酸盐氧化成硝酸盐(雷旭等, 2015).
| 表 6 总细菌条带测序结果 Table 6 Phylogenetics of dominant bacteria |
比较两组湿地N元素去除效果, 有植物组合NH4+-N去除作用较好, 无植物组合NO3--N和NO2--N去除效果较好, 如图 5所示.在潮汐流中微生物上下分布差异较小, Band4亚硝化螺菌属(Nitrosospira)、Band47硝化螺旋菌(Nitrospirae)以及其他一些异养型硝化微生物数量较多, 硝化作用相对较强, 对NH4+-N转化为NO3--N和NO2--N起到重要作用.潜流湿地下层和中层专性厌氧菌Band15拟杆菌(Bacteroides), 兼性厌氧菌Band28、12、27红环菌(Rhodocyclaceae), Band9放线菌目(Actinomycetales), Band11芽孢杆菌目(Bacillales)分布数量较多, 这些厌氧菌和兼性厌氧菌对反硝化的进行起到了重要作用.在潜流人工湿地上层, Band4亚硝化螺菌属(Nitrosospira), Band47硝化螺旋菌(Nitrospirae), Band17、21、18、24草酸杆菌科(Oxalobacteraceae)等好氧细菌数量逐渐增多, 有植物组合与无植物组合相比, 由于植物根系具有富氧作用, 好氧细菌数量相对更多, 导致NO3--N和NO2--N去除率低于无植物组合.潮汐流潜流这种好氧-厌氧的循环为脱氮提供了良好的环境, 对氮的去除起到了促进作用.
 |
| 图 5 两组人工湿地NH4+-N、NO3--N和NO2--N的去除效果 Fig. 5 The removal performance of NH4+-N, NO3--N, NO2--N in two constructed wetlands |
1) 种植植物对人工湿地组合污染物去除效率有明显影响, 有植物组合CODCr和NH4+-N去除率较高, 分别为62.82%和70.22%;无植物组合TN、NO3--N、NO2--N、PO43--P去除率较高, 分别为68.00%、65.26%、61.70%和46.88%.
2) 人工湿地组合系统内优势菌种包括变形菌门(Proteobacteria)25种、酸杆菌门(Acidobacteria)6种, 拟杆菌门(Bacteroidetes)5种, 厚壁菌门(Firmicutes)3种, 放线菌门(Actinobacteria)2种、硝化螺旋菌门(Nitrospira)1种.潜流人工湿地微生物种群多样性指数高于潮汐流人工湿地.潮汐流人工湿地由上而下多样性指数差别不大, 空间物种多样性差异小, 以好氧菌为主.潜流人工湿地单元微生物空间分布差异较大, 中下层以兼性厌氧和厌氧为主, 上层以好氧菌为主.种植植物能够为系统提供少量的溶解氧, 改变微生物的生活环境.潮汐流提供了好氧环境, 潜流提供了以厌氧和缺氧为主的环境, 在系统内实现了硝化-反硝化组合, 强化了系统的脱氮效果.
3) 潜流人工湿地单元中专性厌氧的微生物较少, 兼性好氧厌氧的微生物较多, 说明该组合工艺中的潜流人工湿地系统底部并不能完全提供厌氧环境, 这可能与模拟装置较小, 水力停留时间较短有关.
Ariesyady H D, Ito T, Okabe S. 2007. Functional bacterial and archaeal community structures of major trophic groups in a full-scale anaerobic sludge digester[J]. Water Research, 41(7): 1554–1568.
DOI:10.1016/j.watres.2006.12.036
|
Chouari R, Le Paslier D, Daegelen P, et al. 2005. Novel predominant archaeal and bacterial groups revealed by molecular analysis of an anaerobic sludge digester[J]. Environmental Microbiology, 7(8): 1104–1115.
DOI:10.1111/emi.2005.7.issue-8
|
Cheon J, Hidaka T, Mori S, et al. 2008. Applicability of random cloning method to analyze microbial community in full-scale anaerobic digesters[J]. Journal of Bioscience and Bioengineering, 106(2): 134–140.
DOI:10.1263/jbb.106.134
|
成水平, 夏宜. 1998. 香蒲、灯心草人工湿地的研究-Ⅱ, 污水的空间[J]. 湖泊科学, 1998, 10(1): 62–66.
DOI:10.18307/1998.0110 |
杜刚, 黄磊, 高旭, 等. 2013. 人工湿地中微生物数量与污染物去除的关系[J]. 湿地科学, 2013, 11(1): 14–20.
|
Duan L, Song Y H, Xia S Q, et al. 2013. Characterization of nitrifying microbial community in a submerged membrane bioreactor at short solids retention times[J]. Bioresource Technology, 149: 200–207.
DOI:10.1016/j.biortech.2013.09.050
|
Faulwetter J L, Gagnon V, Sundberg C, et al. 2009. Microbial processes influencing performance of treatment wetlands: A review Review Article[J]. Ecological Engineering, 35(6): 987–1004.
DOI:10.1016/j.ecoleng.2008.12.030
|
Sun G, Gray K R, Biddlestone A J, et al. 1999. Treatment of agricultural wastewater in a combined tidal flow-downwflow reed bed system[J]. Water Science and Technology, 40(3): 139–146.
DOI:10.2166/wst.1999.0154
|
Qiu G L, Ting Y P. 2013. Osmotic membrane bioreactor for wastewater treatment and the effect of salt accumulation on system performance and microbial community dynamics[J]. Bioresource Technology, 150: 287–297.
DOI:10.1016/j.biortech.2013.09.090
|
国家环境保护总局. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版社.
|
Hammer D A, Bastian R X. 1989. Wetlands ecosystems: Natural water purifiers[A]. In: Hammer, D. A. (ed). Constructed Wetlands for Wastewater Treatment: Municipal, Industrial, and Agri-cultural[C]. Chelsea, MI: Lewis Publishers. 5-19
|
Hiraishi A, Iwasaki M, Shinjo H. 2000. Terminal restriction pattern analysis of 16S rRNA genes for the characterization of bacterial communities of activated sludge[J]. Journal of Bioscience and Bioengineering, 90(2): 148–156.
DOI:10.1016/S1389-1723(00)80102-4
|
Ibekwe A M, Lyon S R, Leddy M, et al. 2007. Impact of plant density and microbial composition on water quality from a free water surface constructed wetland[J]. Journal of Applied Microbiology, 102: 921–936.
|
Juretschko S, Loy A, Lehner A, et al. 2002. The microbial community composition of a nitrifying-denitrifying activated sludge from an industrial sewage treatment plant analyzed by the full -cycle rRNA approach[J]. Systematic and Applied Microbiology, 25(1): 84–99.
DOI:10.1078/0723-2020-00093
|
Ki D, Park J, Lee J, et al. 2008. Microbial diversity and population dynamics of activated sludge microbial communities participating in electricity generation in microbial fuel cells[J]. Water Science and Technology, 58(11): 2195–2201.
DOI:10.2166/wst.2008.577
|
Liang W, Wu Z B, Cheng S P, et al. 2003. Roles of substrate microorganisms and urease activities in wastewater purification in a constructed wetland system[J]. Ecological Engineering, 21(2/3): 191–195.
|
卢少勇, 金相灿, 余刚. 2006. 人工湿地的磷去除机理[J]. 生态环境, 2006, 15(2): 391–396.
|
梁威, 吴振斌, 詹发萃, 等. 2004. 人工湿地植物根区微生物与净化效果的季节变化[J]. 湖泊科学, 2004, 16(4): 312–317.
DOI:10.18307/2004.0404 |
Liu W T, Linning K D, Nakamura K, et al. 2000. Microbial community changes in biological phosphate-removal systems on altering sludge phosphorus content[J]. Microbiology, 146(5): 1099–1107.
DOI:10.1099/00221287-146-5-1099
|
雷旭, 李冰, 李晓, 等. 2015. 复合垂直流人工湿地系统中不同植物根际微生物群落结构[J]. 生态学杂志, 2015, 34(5): 1373–1381.
|
Oehl F, Frossard E, Fliessbach A, et al. 2004. Basal organic phosphorus mineralization in soils under different farming systems[J]. Soil Biology and Biochemistry, 36(4): 667–675.
DOI:10.1016/j.soilbio.2003.12.010
|
Stottmeister U, Wieszner A, Kusehk P, et al. 2003. Effects of Plants and microorganisms in constructed wetlands for waster treatment[J]. Biotechnology Advances, 22(1): 93–117.
|
Sun G, Zhao Y Q, Allen S. 2005. Enhanced removal of organic matter and ammoniacal-nitrogen in a column experiment of tidal flow constructed wetland system[J]. Journal of Biotechnology, 115(2): 189–197.
DOI:10.1016/j.jbiotec.2004.08.009
|
Smith R C, Oerther D B. 2006. Microbial community development in a laboratory-scale nitrifying activated sludge system with input from a side-stream bioreactor treating digester supernatant[J]. Water Science and Technology, 54(1): 209–216.
DOI:10.2166/wst.2006.389
|
Tietz A, Kirschner A, Langergraber G, et al. 2007. Characterisation of microbial biocoenosis in vertical subsurface flow constructed wetlands[J]. Science of the Total Environment, 380: 163–172.
DOI:10.1016/j.scitotenv.2006.11.034
|
田园, 段亮, 宋永会, 等. 2015. 不同污泥龄膜生物反应器内微生物的群落结构特征[J]. 环境科学研究, 2015, 28(3): 453–459.
|
王光华, 刘俊杰, 于镇华, 等. 2016. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14–20.
|
徐影, 仇天雷, 韩梅琳, 等. 2013. PCR-DGGE技术解析固体碳源表面生物膜的微生物群落结构[J]. 环境科学, 2013, 34(8): 3257–3563.
|
项学敏, 宋春霞, 李彦生. 2004. 湿地植物芦苇和香蒲根际微生物特性研究[J]. 环境保护科学, 2004, 8: 35–38.
|
Yu Z, Mohn W W. 2001. Bacterial diversity and community structure in an aerated lagoon revealed by ribosomal intergenic spacer analyses and 16S ribosomal DNA sequencing[J]. Applied and Environmental Microbiology, 67: 1565–1574.
DOI:10.1128/AEM.67.4.1565-1574.2001
|
朱励之, 黄娟, 福大放, 等. 2012. 人工湿地生态系统中的微生物作用及PCR-DGGE技术的应用[J]. 安全与环境工程, 2012, 19(2): 26–30.
|
Zhang Y H P, Lynd L R. 2005. Cellulose utilization by Clostridium thermocellum: bioenergetics and hydrolysis product assimilation[J]. Proceeding of the National Academy of Sciences of the United States of America, 102(20): 7321–7325.
DOI:10.1073/pnas.0408734102
|
 2018, Vol. 38
2018, Vol. 38


