2. 常州大学环境与安全工程学院, 常州 213164
2. School of Environment & Safety Engineering, Changzhou University, Changzhou 213164
沉水植物与水体间的微界面是由颗粒物、碎屑等无机附着物以及真菌、细菌、藻类等附着生物群落共同构成的(陈开宁等, 2006; 王文林等, 2014; Vis et al., 2006).附着藻类是湖泊生态系统的重要初级生产者且与沉水植物间关系影响密切(Vadeboncoeur et al., 2001):附着藻类可以通过增加表面膜脂化程度对沉水植物产生伤害, 反过来, 沉水植物也可通过化感作用对附着藻类产生抑制作用并受营养盐浓度胁迫的增加而增加(宋玉芝等, 2014; Hilt and Gross, 2008; Mulderij et al., 2005).附着细菌在水生态系统中也起到重要功能, 附着细菌多样性指数的高低会对沉水植物生长和生态过程产生有利或有害的影响(Hashidoko, 2005).总言之, 附着生物群落的形成与所附着植物种类及周围水环境关系密切, 不仅受非生物环境因子影响, 还与食草鱼类、浮游植物等水生生物之间也存在复杂的相互作用(黄瑾等, 2010).
以往附着物的研究, 由于从植物本身去除表面附着的效率和测试表征技术精度的限制, 大多集中在陆生植物和大型海洋植物上, 或仅有对湖泊里沉水植物附生植物, 按照季节、区域、营养盐以及沉水植物种类的差异来观察其差异性特征(王丽卿等, 2012; 丁娜等, 2015), 对沉水植物附着细菌的研究也较少(何聃等, 2014), 对影响沉水植物衰退的常见湖泊水环境因素如水位的变化对沉水植物上的附着微生物种群分布和多样性的影响甚少.并且近年来, 我国多地因强降雨导致低洼、河流和湖泊等处水位急涨, 当水位退去后, 多数水生植物会消失且其表面往往会产生较多较厚的附着物.因此在此背景研究沉水植物及其附着生物群落特征之间相互关系, 对水生态修复具有非常重要的意义.
本文通过显微观测和16S rRNA高通量生物测序的方法定性定量沉水植物表面微生物组成和多样性特征, 并结合野外原位湖泊试验的方法, 研究常州滆湖沉水植物现存优势种狐尾藻和马来眼子菜叶上的附着藻类及附着细菌对于水位变化的响应特性, 细化具体环境因素影响沉水植物表面附着微生物群落的研究, 可为研究湖泊生态修复机制、认识与利用沉水植物生态调控功能提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验设计及样品处理2017年7月中旬在滆湖开展试验, 滆湖位于常州市武进区, 是苏南太湖湖群的重要组成部分, 水面面积为164 km2.原位试验区选取滆湖东北部的大洪港, 试验期基本水环境指标见表 1, 该区域拥有常水深稳定、光照条件好和受鱼类牧食作用小等优点.狐尾藻和马来眼子菜就近取自滆湖生态公园, 两种植物择取长势相同、生长情况良好的10 cm左右顶头断枝, 移栽到含有15 cm深、已过筛去除石块和植物残体等杂质后的沉积物基质塑料吊桶中(顶直径×底直径×高=30 cm×20 cm×30 cm), 每盆栽种15株, 定植驯化于生态公园内且生长条件良好的试验驯化池.之后, 再将栽有固定生根且用纯水清除沉水植物表面附着物的塑料吊桶通过尼龙绳分别以0.6 m(T1:桶上端距水面距离——吴淞水位2.2 m)、1.2 m(T2)、1.8 m(T3)和2.4 m(T4)水深条件, 悬挂固定在原位试验区中可漂浮种植框架上(3.0 m×2.5 m, 24盆植物/框架)(图 1), 共8个实验组每个实验组设置3个平行, 同时在框架周围围网以防止鱼类牧食干扰.试验周期为20 d, 实验结束后在原位将吊桶提出水面, 连根采集两种植物装入塑料袋后编号再统一置于含有冰袋的泡沫盒中带回实验室, 用于附着藻类和附着细菌的分离, 采样时注意避免大力搅动造成对植物上附着生物的损失.
| 表 1 试验点基本水环境指标 Table 1 Basic parameters in the water of the test sites |
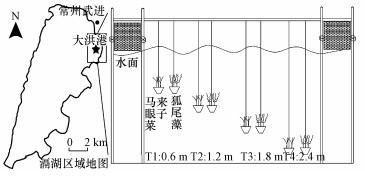 |
| 图 1 原位试验区和设计装置图 Fig. 1 The site and design of experiment in-situ |
每个实验组选取全部完整植株经简单清洗根部泥沙后, 放置于1 L烧杯中, 加入适量清水、pH为7.2冰冷的10 mL PBS缓冲液(10 mmol·L-1)、10 mL表面活性剂焦磷酸钠(0.1 mol·L-1)和小型玻璃珠若干, 经155 r·min-1的摇床震荡10 min, 接着于超声波清洗器中以35 kHz的功率清洗5 min, 最后继续震荡10 min至植株表面呈现翠绿本色时即可(何聃等, 2014), 并得沉水植物表面附着物洗脱液.附着生物现存量可用附着在植物表面有机物的多少来表示(Joph, 2004; 朱广伟等, 2011), 对洗脱液适度稀释, 取一定体积备用液过孔径为1.2 μm Whatman GF/C(φ=45 mm)的滤膜, 用滤膜上残留固体物质(105 ℃烘干至恒重的质量)与经550 ℃灼烧6 h后的质量差(无灰干重, AFDW)表征有机物的含量.
2.2.2 附着藻类现存量取全株植物用于分析附着藻类现存量, 洗脱方法同2.2.1节, 本文用Chl.a含量来快速估计藻类的生物量(Steinman et al., 2017), 取适量洗脱液稀释液, 用孔径为1.2 μm Whatman GF/C(φ=45 mm)滤膜抽滤, 将载有藻类的滤膜在冰箱冷冻24 h后, 加入8 mL左右经80 ℃水浴加热的90%乙醇, 随后将样品放到常温下避光处萃取4~6 h, 萃取结束后用多波长分光光度计在665 nm和750 nm处测定其吸光度值并计算附着藻类现存量.
2.2.3 沉水植物表面附着藻类种群特征测定取2.2.1节所得洗脱液500 mL左右, 加入10 mL鲁哥试剂固定, 在室内静置沉淀48 h后, 将下层浓缩沉淀物定容至30 mL左右, 以进行显微计数.依据《水和废水监测分析方法(第四版)》(魏复盛, 2012), 将定容样品充分摇匀后, 吸取0.1 mL置入0.1 mL的计数框里, 在显微镜下, 横行移动计数框, 逐行计平行线内出现的各种(属)藻类数.视藻类密度大小, 一般计算10行、20行或40行以至全片.
2.2.4 沉水植物表面附着细菌种群特征测定取适量2.2.1节与2.2.2节过膜后的滤液, 过孔径为0.22 μm (φ=45 mm)醋酸纤维混合膜滤膜, 然后用灭过菌的离心管收集滤膜, 置于-20 ℃保存, 一周内进行高通量测序即细菌群落结构分析.根据Illumina hiseq高通量测序要求, 采用蛋白酶K裂解法抽提基因组DNA, 选用16S V4-V5区515F-926R为测序引物, 对目标基因进行PCR扩增和稳定, 回收全部定量且均一化的PCR产物, 微生物细菌基因片段采用上海微基生物科技有限公司的454GS Junior测序仪进行测序.相比传统的生物检测技术, 新一代高通量测序技术可以全面了解细菌群落的多样性结构(丁轶睿等, 2017), 并能够体现丰度较低但生态指示性强的菌群.
2.2.5 水质及沉水植物生长指标原位水样采集后迅速带回实验室, 水质测定参照国标进行测定.通过碱性过硫酸钾氧化紫外分光光度法测定总氮(TN, GB11894—1989);采用钼锑抗分光光度测定总磷(TP, GB1183—1989);水体温度、pH和溶解氧用哈希hq-30d水质便携计测定; 水体透明度SD用塞氏盘测定; 原位采集后的植物与震荡超声后的植物分别称重, 计算附着物的重量.
2.3 数据分析通过空白和平行测定的方法来获得准确数据, 且采用Excel 2007进行数据计算和SPSS 19.0做统计分析处理, 对狐尾藻和马来眼子菜的各指标进行Pearson相关性分析, 图形的绘制则在origin 8.5上完成数据分析及作图.
沉水植物表面附着藻类的多样性采用Shannon-Wienner多样性指数进行分析.Shannon-Wiener多样性指数用来估算群落多样性的大小, 公式为:
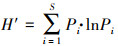
|
式中, S表示总物种数, Pi表示个种占总数的比例(Pielou, 1975).当群落中只有一个居群存在时, Shannon-Wienner指数达最小值0;当群落中有两个以上居群存在, 且每个居群仅有一个成员时, Shannon-Wienner指数达到最大lnk值.
3 结果与讨论(Results and discussion) 3.1 水深对植物附着生物、附着藻类生物量的影响分析由表 2可知, 各水深梯度狐尾藻总附着物占未清洗振荡下植物总质量的比值总是大于马来眼子菜, 对水深胁迫良好适应性使得狐尾藻生物量更大而拥有更多附着面积, 这与宋玉芝等(2016)研究成果相似, 狐尾藻的篦齿羽状叶片结构是湖泊中颗粒物、细屑物质和微生物的良好附着场所.值得注意的是, 狐尾藻附着生物以及附着藻类现存量的值却均显著小于同等水深下马来眼子菜的值(p<0.05), 这说明对于附着生物群落, 马来眼子菜的附着吸引力大于狐尾藻, 据文献报道(张艳娜等, 2015)附着生物的大量繁殖会使植物细胞膜严重损害从而影响抗氧化保护酶系统, 最终导致本试验结果中马来眼子菜比狐尾藻衰败的更显著.同时, 狐尾藻附着生物群落的自养指数AI(附着生物现存量/附着藻类现存量)均大于马来眼子菜的自养指数, AI指数表示附着生物群落中自养和异养生物的比例(宋玉芝等, 2010; 顾泳洁等, 2005).表中T1和T2时同种沉水植物AI指数的差异显著性往往排在各水位梯度前列, 根据边归国(2012)对植物化感作用抑制藻类的研究, 因表层水深处光照适宜, 植物生长占优势会抑制藻类生长导致AI值升高, 随着水深增加, 植物会因有效光照减少而衰亡, 抑制作用减弱, 表面的附着藻类生长则占优势, 使得AI值减小.同时, 因水深增加导致植物上附着生物和附着藻类基数较小, AI值也处于较低水平.因此较小水深0.6~1.2 m的自养指数较高, 较大水深1.8~2.4 m的自养指数则较低, 且同等水深下马来眼子菜的自养指数往往低于狐尾藻.
| 表 2 不同植物附着生物和藻类的存在情况 Table 2 The presence of epiphytic algae and bacteria in different plants |
经显微镜观察各沉水植物试验组表面附着藻类各门类种数组成, 共鉴定出附着藻类7门, 38属, 71种.从图 2中可知, 狐尾藻附着藻类群落中绿藻和硅藻占绝对优势, 分别占总种数的42.3%和18.3%;而马来眼子菜附着藻类各群落组成丰度与狐尾藻上相比均有所减少, 但仍以绿藻和硅藻占群落的绝对优势, 分别占总种数的32.4%和15.5%.其主要原因一方面是因为这两种沉水植物所生长的水域含有较高营养盐浓度, 且狐尾藻和马来眼子菜拥有比表面积大且较光滑的叶片表面结构特点, 绿藻也常附着于这类惰性基质上(刘凯辉等, 2015), 导致狐尾藻和马来眼子菜表面的附着藻类均以绿藻门为最大.两种沉水植物上优势藻都为硅藻和绿藻, 这与宋玉芝等(2014)研究成果相同, 他们认为藻类组成与藻类习性、细胞结构和基质表面粗糙程度有关, 因硅藻自身具有胶质柄或是包被在胶质团等粘性结构, 所以更容易固着在障碍物和突起上.另一方面, 与狐尾藻附着藻类相比, 马来眼子菜的丰度更少, 这可能是由于两种植物的代谢产物不同, 根据Hempel等(2009)对沉水植物生物膜群落组成的研究, 酚类等化感物质会促进或抑制藻类生长, 进而影响其表面附着生物群落特征.值得注意的是, 马来眼子菜在各水深处均未镜检到黄藻, 由于沉水植物表面附着生物群落可能会受到栖息环境和寄主植物影响的特点, 导致马来眼子菜分泌抑制黄藻的物质.随着水深增加, 两种植物附着藻类的藻类组成有显著差异(p<0.05), 但绿藻和硅藻仍占绝对优势, 且占比较小的黄藻和隐藻相对有所变化.8个水深处理组中, 有6种藻类在狐尾藻和马来眼子菜都有检出, 其中比例较高的前5种优势种属分别为:念珠新月藻(Closterium moniliferum)、古氏栅藻(Scenedesmus gutwinskii)、小箍藻属(Trochiscia)、铜绿微囊藻(Microcystis aeruginosa)和环沟藻(Gyrodinium prunus).
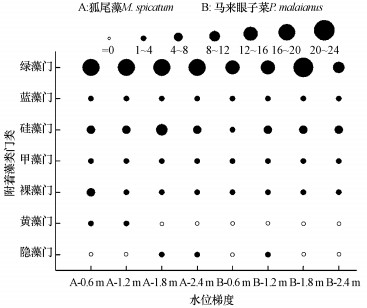 |
| 图 2 沉水植物表面附着藻类群落种类组成 Fig. 2 Species composition of epiphytic algae |
如图 3所示, 试验区中不同种类的沉水植物附着藻类Shannon-Wiener多样性指数H′对于水深的具体特征响应为:狐尾藻, 多样性指数在3.03~3.54之间, 且T3 > T2 > T4 > T1;马来眼子菜, 多样性指数在2.35~3.31之间, 且T3 > T2 > T4 > T1.物种多样性不仅可以作为衡量区域内生物资源丰富度和群落演替动态的指标, 也可以作为水环境评价的具体指标(凌旌瑾等, 2008; 陈清潮等, 1994), 从植物种类上看, 狐尾藻的多样性指数显著大于马来眼子菜(p<0.05), 说明狐尾藻上附着藻类拥有分配均匀度高和群落稳定性好的特点; 从水深梯度上看, 两种植物多样性指数变化差异显著(p<0.05), 且均为T3的多样性指数最大, T1的多样性指数最小, 这与吴晓辉和李其军(2010)关于水动力条件对藻类影响的研究结果相一致, 夏季表层湖水易受雨水冲刷和波浪扰动的影响, 不易于藻类的生长聚集以及在沉水植物表面上的固定附着, 从而一定程度上使得水域中水深较大且水动力扰动较小区域的附着藻类多样性更高.
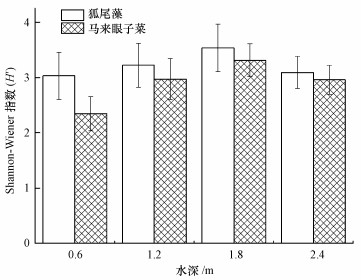 |
| 图 3 沉水植物附着藻类多样性 Fig. 3 Shannon-Wiener′s index(H′) of epiphytic algae |
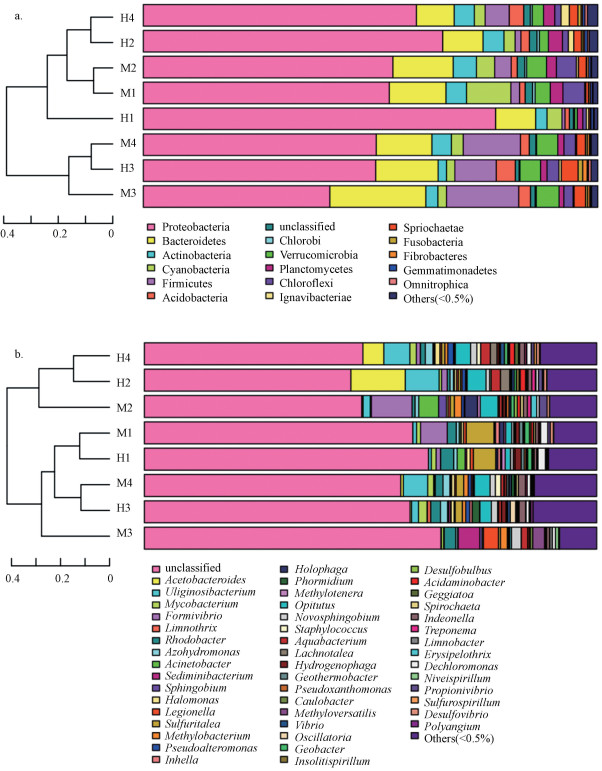
对测得序列进行归类操作, 再将样品优化的序列按97%相似度划分得到各个OTU(Operational Taxonomic Unit)小组进行生物信息统计分析.图 4a和图 4b分别按门和属两种级别, 对样品细菌群落的组成和结构进行聚类树与柱状图组合分析, 图左边是基于bray-curtis算法的层次聚类分析树形图(Oberauner et al., 2013), 根据OTU组成的差异比较样品间的差异, 而图右边是样品的群落结构柱状图, 可得具体附着细菌组成以及各细菌的相对丰度.图中H和M分别代表狐尾藻和马来眼子菜两种植物类型, 1、2、3和4则分别代表从低到高4种水深梯度.
 |
| 图 4 门水平(a)和属水平(b)样品聚类树与柱状图组合分析图 Fig. 4 Bacterial community barplot with cluster tree at the phylum (a) and genus (b) |
结果表明:在门水平上(图 4a), 滆湖大洪港沉水植物附着细菌优势种群包括变形菌门(Proteobacteria, 51.26%)、厚壁菌门(Firmicutes, 12.58%)、拟杆菌门(Bacteroidetes, 12.26%)、疣微菌门(Verrucomicrobia, 4.64%)和放线菌门(Actinobacteria, 4.29%), 这5类细菌群落占总细菌群落的85%以上, 据文献报道(丁轶睿等, 2017; Newton et al., 2011)Proteobacteria拥有广泛分布于浅水湖泊和底泥沉积物中且数量极为丰富的特点, 同时有研究结果表明(Liu et al., 2009), Firmicutes菌群丰度与富营养化指数呈显著正相关并且清水态湖泊是以Bacteroidetes菌种居多(Gucht et al., 2005), 这与滆湖大洪港实际情况相符, 其较高的富营养化程度导致附着在植物上的Firmicutes菌群丰度也较高, 并且滆湖属于草型向藻型退化过渡的湖泊, 因此Bacteroidetes菌群在附着细菌种群中较多但不占主导地位.同时, 本研究发现位于各水深梯度下的两种沉水植物附着细菌种群组成差异显著(p<0.05), 但均以Proteobacteria、Bacteroidetes和Firmicutes为主要优势种群.根据门聚类结果, H2与H4、M1与M2、H3与M4在植物附着细菌组成和丰度相似程度较高, 说明同种沉水植物间或者相似水层深度间的附着细菌组成和丰度的相似性较高, 这与He等(2012)研究成果相一致, 附着细菌群落有较强宿主专一性, 对不同物理和化学结构组成的植物种类, 可以产生结构差异较显著的附着细菌群落特征, 且当水深显著升高后, 水深胁迫对附着细菌群落的影响作用会大于植物种类对其的影响.
在属水平上(图 4b)进行深度的细菌群落结构分析, 是为了更全面了解沉水植物附着细菌的组成.大洪港沉水植物附着细菌经OTUs分类共有404个属, 总细菌组成主要以醋酸杆菌属(Acetobacter, 2.22%)、Uliginosibacterium(2.92%)、Formivibrio(2.27%)、Sulfuritalea(2.09%)和Opitutus(2.56%)为主.Acetobacter是属水平的优势菌群, 在T1、T2、T3和T4水深下马来眼子菜丰度相对较高, 分别占样品个体的0.33%、0.56%、12.02%和4.62%, 狐尾藻丰度则相对较低, 仅占0.01%、0.01%、0.30%和0.02%, 这种专性好氧菌菌群的存在易将植物腐烂发酵分解(王旭昌等, 2015), 这印证了相比于狐尾藻, 马来眼子菜在受到水深胁迫后其生长特性更差.同时本研究发现, 狐尾藻和马来眼子菜的优势附着细菌种属常在位于T2或T3中等水深时的丰度更多, 有研究表明(何尚卫等, 2014)处于深层的沉水植物因水深增加会使光合有效辐射减少, 导致植物衰退以及其内生细菌会通过表面裂口等物理通道迁移到植物表面, 从而影响细菌群落丰富度组成.根据属水平聚类分析显示, M1和M2、M3和M4、H2和H4的细菌主要组成部分更接近, 进一步验证了附着细菌的宿主专一性以及同种沉水植物附着细菌的组成结构更相似.
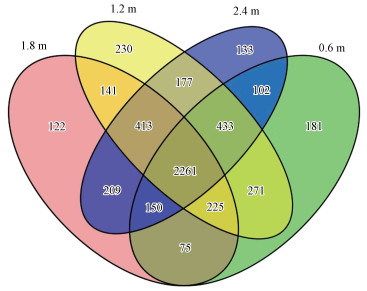
VEEN图通过直观表现样品的OTU数目组成相似性及重叠情况, 来反映样品间所共有和独有的OTU数目(Schloss et al., 2011).图 5中显示整个试验中4种水深梯度共有的OTU总数是3284, 其中0.6、1.2、1.8和2.4 m特有的OTU数目分别是181、230、122和133, 说明两种沉水植物在0.6 m和1.2 m水深时, 拥有较多特有的细菌种类.这与Rimes和Goulder(1985)对沉水植物浮游细菌附着率的研究一致, 处于较大水深时的水动力过程不剧烈, 仅靠水体中浮游细菌自主运动迁移到植物上较为困难且缓慢, 而浅表层因受风力和湖流等作用导致水流动交互性更好, 更多种类的细菌有机会随水流运动附着到植物上并定植形成一个成熟稳定的菌群.
 |
| 图 5 各水深梯度下OTU分布韦恩图 Fig. 5 Venn diagram showing the distribution of OTUs under different water depth gradients |
统计各水深梯度下狐尾藻和马来眼子菜附着细菌的操作单元数目总数, 并利用mothur计算所得Shannon指数和Simpson指数来反映群落的多样性, Shannon指数越大抑或Simpson指数越小, 则认为样品中的物种群落多样性越丰富.从表 3可以看出, 1.2 m水深时狐尾藻和马来眼子菜的Shannon指数均为最大值且Simpson指数均为最小值, 即表示1.2 m水深条件下两种沉水植物附着细菌的多样性最高, 有研究表明(昝帅君等, 2016), 附着细菌群落多样性会随外界环境胁迫的升高而逐渐降低, 本研究中水深大于1.2 m后两种沉水植物附着细菌多样性均显著减低(p=0.037, p=0.021)说明附着细菌多样性对水深变化较为敏感且拥有其适宜生长水深阈值.值得注意的是, 相同水深时, 马来眼子菜附着细菌的种群多样性总是显著大于狐尾藻附着细菌的种群多样性(p<0.05), 这与马杰等(2016)以及肖溪等(2009)研究成果相一致, 马来眼子菜因具有较弱化感活性的特征, 对其他微生物或光养生物产生的次生影响更小, 使得马来眼子菜的多样性更高.
| 表 3 各样品序列和多样性统计 Table 3 The sequence and diversity statistics of each sample |
1) 同等水深下狐尾藻附着生物中异养生物与自养生物的比值大于马来眼子菜, 并且试验组较小水深0.6~1.2 m的附着生物群落AI指数较高, 较大水深1.8~2.4 m的AI指数则较低.
2) 两种沉水植物附着藻类的藻类组成随随水深增加变化显著(p<0.05), 但均以绿藻门和硅藻门占绝对优势, 并以念珠新月藻、古氏栅藻、小箍藻属、铜绿微囊藻和环沟藻为优势种属; 两种沉水植物附着细菌种群特征随水深梯度变化的差异也较显著(p<0.05), 而其优势菌群主要包括有Proteobacteria、Firmicutes和Bacteroidetes等.值得注意的是, 同一沉水植物或者相似水层间的附着细菌组成和丰度的相似性较高, 并且两种沉水植物附着细菌在较小水深0.6~1.2 m时拥有相较于其他水层更多特有的细菌种类.
3) 相同水深下狐尾藻附着藻类的多样性显著大于马来眼子菜(p<0.05), 而两种沉水植物附着细菌的多样性正好与之相反; 同时, 各水深胁迫下两种沉水植物附着藻类和附着细菌的多样性差异显著(p<0.05), 且中等水深1.2~1.8 m时两种沉水植物附着藻类和附着细菌的多样性往往最高.
边归国. 2012. 浮水植物化感作用抑制藻类的机理与应用[J]. 水生生物学报, 2012, 36(5): 978–982.
|
陈开宁, 包先明, 史龙新, 等. 2006. 太湖五里湖生态重建示范工程——大型围隔试验[J]. 湖泊科学, 2006, 18(2): 139–149.
DOI:10.18307/2006.0207 |
陈清潮, 黄良民, 尹建强, 等. 1994. 南沙群岛及其邻近海区海洋生物多样性研究Ⅰ.南沙群岛海区浮游动物多样性研究[M]. 北京: 海洋出版社: 42–50.
|
丁娜, 徐东坡, 刘凯, 等. 2015. 太湖五里湖着生藻类群落结构特征分析[J]. 江西农业大学学报, 2015, 37(2): 346–352.
|
丁轶睿, 李定龙, 张毅敏, 等. 2017. 滆湖底泥细菌群落结构及多样性[J]. 环境科学学报, 2017, 37(5): 1649–1656.
|
顾泳洁, 王秀芝, 廖祖荷. 2005. 利用着生生物群落动态变化检测水质的研究[J]. 华东师范大学学报(自然科学版), 2005(4): 87–94.
|
Gucht K V, Vandekerckhove T, Vloemans N, et al. 2005. Characterization of bacterial communities in four freshwater lakes differing in nutrient load and food web structure[J]. Fems Microbiology Ecology, 53(2): 205–220.
DOI:10.1016/j.femsec.2004.12.006
|
Hashidoko Y. 2005. Ecochemical studies of interrelationships between epiphytic bacteria and host plants via secondary metabolites[J]. Bioscience Biotechnology & Biochemistry, 69(8): 1427–1441.
|
何聃, 任丽娟, 邢鹏, 等. 2014. 沉水植物附着细菌群落结构及其多样性研究进展[J]. 生命科学, 2014, 26(2): 161–168.
|
He D, Ren L J, Wu Q L. 2012. Epiphytic bacterial communities on two common submerged macrophytes in Taihu Lake:diversity and host-specificity[J]. Chinese Journal of Oceanology and Limnology, 30(2): 237–247.
DOI:10.1007/s00343-012-1084-0
|
Hempel M, Grossart H P, Gross E M. 2009. Community composition of bacterial biofilms on two common submerged macrophytes and an artificial substrate in a pre-alpine lake[J]. Aquatic Microbial Ecology, 58(1): 79–94.
|
Hilt S, Gross E M. 2008. Can allelopathically active submerged macrophytes stabilise clear-water states in shallow lakes?[J]. Basic & Applied Ecology, 9(4): 422–432.
|
何尚卫, 李勇, 赵海光, 等. 2014. 滆湖水体光学性质初步研究[J]. 湖泊科学, 2014, 26(5): 707–712.
DOI:10.18307/2014.0508 |
黄瑾, 宋玉芝, 秦伯强. 2010. 不同营养水平下苦草对附着和浮游藻类的影响[J]. 环境科学与技术, 2010, 33(11): 17–21.
|
Joph B. 2004. A comparison of two methods for estimating the organic matter content of sediments[J]. Journal of Paleolimnology, 31(1): 125–127.
DOI:10.1023/B:JOPL.0000013354.67645.df
|
凌旌瑾, 顾咏洁, 许春梅, 等. 2008. 黄浦江和苏州河的着生藻类与水质因子关系的多元分析[J]. 环境科学研究, 2008, 21(5): 184–189.
|
刘凯辉, 张松贺, 吕小央, 等. 2015. 南京花神湖3种沉水植物表面附着微生物群落特征[J]. 湖泊科学, 2015, 27(1): 103–112.
DOI:10.18307/2015.0113 |
Liu Y Q, Yao T D, Zhu L P, et al. 2009. Bacterial diversity of freshwater of freshwater alpine lake Puma Yumco on the Tibetan Plateau[J]. Geomicrobiology Journal, 26(2): 131–145.
DOI:10.1080/01490450802660201
|
马杰, 范婤, 王国祥, 等. 2016. 洪泽湖3种沉水植物附着细菌群落及多样性[J]. 湖泊科学, 2016, 28(4): 852–858.
DOI:10.18307/2016.0419 |
Mulderij G, Mooij W M, Smolders A J P, et al. 2005. Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides[J]. Aquatic Botany, 82(4): 284–296.
DOI:10.1016/j.aquabot.2005.04.001
|
Newton R J, Jones S E, Eiler A, et al. 2011. A guide to the natural history of freshwater lake bacteria[J]. Microbiology and Molecular Biology Reviews:MMBR, 75(1): 14–49.
DOI:10.1128/MMBR.00028-10
|
Oberauner L, Zachow C, Lackner S, et al. 2013. The ignored diversity:complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J]. Scientific Reports, 3(3): 1413–1425.
|
Pielou E C. 1975. Ecological diversity[M]. New York: John Wiley & Sons Inc: 156–182.
|
Rimes C A, Goulder R. 1985. A note on the attachment rate of suspended bacteria to submerged aquatic plants in a calcareous stream[J]. Journal of Applied Microbiology, 59(4): 389–392.
|
Schloss P D, Gevers D, Westcott S L. 2011. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies[J]. Plos One, 6(12): e27310.
DOI:10.1371/journal.pone.0027310
|
Schloss P D, Westcoll S L, Ryabin T, et al. 2009. Introducting mothera: open-source, platform-independent, community-supported software for describing and comparing microbial communitie[J]. Applied and Environmental Microbiology, 75(23): 7537–7541.
DOI:10.1128/AEM.01541-09
|
宋玉芝, 黄瑾, 秦伯强. 2010. 附着生物对太湖常见的两种沉水植物快速光曲线的影响[J]. 湖泊科学, 2010, 22(6): 935–940.
|
宋玉芝, 王宇佳, 王锦旗, 等. 2016. 水体氮磷浓度对两种沉水植物上附着藻类的影响[J]. 环境科学学报, 2016, 36(9): 3208–3212.
|
宋玉芝, 赵淑颖, 杨美玖, 等. 2014. 氨氮浓度及基质对附着藻类群落组成的影响[J]. 环境科学学报, 2014, 34(5): 1173–1177.
|
Steinman A D, Lamberti G A, Leavitt P R, et al. 2017. Biomass and Pigments of Benthic Algae[J]. Methods in Stream Ecology, Volume 1: 357–379.
|
Vadeboncoeur Y, Lodge D M, Carpenter S R. 2001. Whole-lake fertilzation effects on distribution of primary production between benthic and pelagic habitats[J]. Ecology, 82(4): 1065–1077.
DOI:10.1890/0012-9658(2001)082[1065:WLFEOD]2.0.CO;2
|
Vis C, Hudon C, Carignan R. 2006. Influence of the vertical structure of macrophyte stands on epiphyte community metabolism[J]. Canadian Journal of Fisheries and Aquatic Science, 63(5): 1014–1026.
DOI:10.1139/f06-021
|
王丽卿, 张玮, 范志锋, 等. 2012. 淀山湖生态示范区附着藻类季节动态变化研究[J]. 农业环境科学学报, 2012, 31(8): 1596–1602.
|
王文林, 刘波, 韩睿明, 等. 2014. 沉水植物茎叶微界面及其对水体氮循环影响研究进展[J]. 生态学报, 2014, 34(33): 6409–6416.
|
王旭昌, 宗红, 陆信曜, 等. 2015. 醋酸杆菌生物催化丙烯醛合成丙烯酸[J]. 应用与环境生物学报, 2015, 21(4): 652–656.
|
魏复盛. 2012. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社: 703–710.
|
吴晓辉, 李其军. 2010. 水动力条件对藻类影响的研究进展[J]. 生态环境学报, 2010, 19(7): 1732–1738.
|
肖溪, 楼莉萍, 李华, 等. 2009. 沉水植物化感作用控藻能力评述[J]. 应用生态学报, 2009, 20(3): 705–712.
|
昝帅君, 樊景凤, 明红霞, 等. 2016. 辽河口浮游细菌和附着细菌群落结构及多样性分析[J]. 海洋环境科学, 2016, 35(4): 594–599.
|
张艳娜, 宋玉芝, 王敏, 等. 2015. 附植藻类对沉水植物狐尾藻生长及生理的影响[J]. 环境科学学报, 2015, 35(7): 2282–2288.
|
朱广伟, 赵林林, 陈伟民, 等. 2011. 低水位运行对天目湖水库水质与生态的影响[J]. 生态与农村环境学报, 2011, 27(4): 87–94.
|
 2018, Vol. 38
2018, Vol. 38


