2. 江苏省物质循环与污染控制重点实验室, 南京 210000;
3. 南京师范大学地理科学学院, 南京 210000
2. Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, Nanjing 210023;
3. School of Geography Science, Nanjing Normal University, Nanjing 210023
河流、湖泊等湿地常常成为受纳工业污水排放的“汇”.矿山、冶金、电镀、造纸等生产过程产生大量含重金属废水, 是湿地环境的重要威胁(于文金和邹欣庆, 2007; 李丽锋等, 2014).因此对湿地重金属排放进行监测显得十分重要.目前采用的监测方法如原子吸收法、比色法等, 虽然能够准确定性和定量, 但是多依赖人工定期或不定期的采集水样.采样和检测过程往往耗时费力、成本较高.不仅如此, 依赖采样的监测方法不能做到在线连续监测, 容易造成对湿地重金属污染事件的发现滞后, 从而影响对污染的及时处理.
湿地沉积物处于厌氧环境中, 并且含有丰富的有机物, 适合产电细菌生长.许多研究报道了淹水土壤、湖泊、海洋中存在产电细菌.主要分布在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)等(Jiang et al., 2016; Kokko et al., 2016).将阳极埋在湿地底泥中, 阴极固定在上覆水中, 可以构成沉积物-微生物燃料电池(Sediment Microbial Fuel Cells, SMFCs).底泥中的产电细菌将分解有机质产生的电子通过胞外电子传递交给SMFCs的阳极, 电子通过导线到达阴极, 与上覆水中溶解的O2发生还原反应生成H2O(Deng et al., 2012; 邓欢等, 2015).流过导线的电流和导线负载两端的电压能够被数据采集装置在线连续记录.可以设想, 当含有重金属离子的废水进入湿地上覆水后, 会增加水的电导率、降低水体pH, 有利于提高SMFCs电压或电流.换句话说, 排入到湿地上覆水中的重金属可能会刺激电压或电流升高;但另一方面, 上覆水中的重金属离子如果大量进入底泥, 会抑制产电细菌活性, 从而导致电压或电流降低(Deng et al., 2015; Jiang et al., 2015).因此, 重金属废水进入湿地水体后, SMFCs电信号会做出何种方式的响应, 尚不清楚.
已有研究在三电极体系下, 采用交流阻抗法分析阴极和阳极的电荷传递电阻(charge transfer resistance)来揭示阴极和阳极电子传递的难易程度.通常, 阳极表面形成产电菌膜, 电子能顺利地向阳极传递, 则阳极的电荷传递电阻降低;反之, 当产电菌膜受到破坏, 电子难以向阳极传递, 则阳极的电荷传递电阻升高(Baranitharan et al., 2015).因此分析阴极和阳极的电荷传递电阻有助于揭示重金属污染物对阴极电子传递过程是否具有刺激效应, 以及对阳极电子传递过程是否具有抑制效应.另外, 阳极附近沉积物中的产电细菌丰度也是揭示重金属污染物对阳极影响的重要证据.研究表明水稻土中的产电细菌主要为以下5种类群:地杆菌(Geobacter)、脱硫弧菌(Desulfobulbus)、梭菌(Clostridia)、厌氧粘细菌(Anaeromyxobacter)和希瓦氏菌(Shewanella) (De Schamphelaire et al., 2010; Kouzuma et al., 2013; Lin and Lu, 2015; Cabezas et al., 2015; Sun et al., 2015).笔者在前期工作中, 对本研究采用的水稻土中产电细菌16S rRNA基因进行定量分析, 发现地杆菌科(Geobacteraceae)和梭菌属(Clostridiium)是优势的产电细菌类群, 占上述5个细菌类群总量的90%.因此本研究中, 分别采用不同的引物对地杆菌科和梭菌属16S rRNA基因进行定量, 用以表征土壤产电细菌数量.
本研究在实验室中用淹水水稻土模拟湿地环境, 采用一种新型SMFCs装置插入水稻土中进行土壤产电, 并在线记录电压信号(邓欢等, 2017).通过向SMFCs装置阴极附近上覆水中加入CuSO4溶液来模拟重金属污染事件.研究湿地产电信号对水体中重金属污染事件的响应特征, 并且通过产电细菌16S rRNA基因定量、SMFCs装置电荷传递电阻分析以及CuSO4溶液理化性质分析揭示电信号响应Cu2+污染的机理.为发展在线原位监测湿地水体重金属污染的新方法提供理论和实践依据.
2 材料与方法(Materials and methods) 2.1 土壤采集土壤于2017年10月采集于南京市江宁区水稻田(32°05′18″N;118°59′28″E), 土壤含水量56%, 采样深度0~20 cm.采样地为亚热带湿润气候, 年平均降水量1100 mm, 年平均温度15 ℃.土壤过2 mm筛并充分混匀.部分样品自然风干后进行理化性质的测定.土壤总碳(TC)和总氮(TN)通过元素分析仪(Vario EL Ⅲ, Elementar, Germany)测定;土壤pH按土水比1:2.5采用pH计(FE20, Mettler Toledo, Switzerland)测定;土壤电导率(EC)按土水比1:5采用电导率仪(DDSJ-308F, 上海雷磁)测定.土样的理化性质如下:土壤pH 7.21;TC 31.58 mg·g-1;TN 2.84 mg·g-1;EC 167.15 μS·cm-1.
2.2 SMFCs装置构建和运行本研究采用一种新型SMFCs装置(图 1).该装置阳极为不锈钢管, 阴极为铂网, 阳极和阴极分别连接在聚四氟乙烯塑料管两端.阳极和阴极通过导线与负载串联, 负载两端电压作为监测湿地水污染的信号.该装置的优势在于可直接插入湿地底泥中进行原位产电, 产电电压可进行在线记录(邓欢等, 2017).
 |
| 图 1 本实验采用的SMFCs装置示意图(a)以及SMFCs装置运行展示(b) Fig. 1 Diagram of SMFCs device in the present study (a) and an exhibition for operation of the SMFCs device(b) |
向10只2 L玻璃烧杯中分别加入相当于1500 g干重的新鲜水稻土, 之后缓缓地向烧杯中加入去离子水, 保持土壤上覆水深度5 cm以模拟湿地环境.将SMFCs装置阳极不锈钢管插入水稻土中, 阴极铂网位于上覆水水面下方1 cm.阳极和阴极使用钛丝作为导线与外阻(1000 Ω)串联.每个烧杯中插入1个SMFCs.外阻与电压记录设备(7660B, 中泰研创)并联, 每隔15 s记录1次电压数据.为了模拟野外监测的实际状况, SMFCs装置在室温(14.9 ± 0.4)℃下产电.
2.3 CuSO4溶液性质检测和染毒实验用无水CuSO4分别配制Cu2+浓度为50、100、200和400 mg·L-1的溶液.对CuSO4溶液的理化性质进行分析:溶液pH采用pH计(FE20, Mettler Toledo, Switzerland)测定;电导率使用电导率仪(DDSJ-308F, 上海雷磁)测定;氧化还原电位采用微电极分析仪(Unisense Microsensor Multimeter Version 2.01)测定.上述测定结果见表 1.分别从上述4个Cu2+浓度的CuSO4溶液中各取5 mL缓慢加入到两个平行SMFCs装置阴极上方的上覆水中.同时, 向对照组的两个平行SMFCs装置各加5 mL去离子水.连续记录SMFCs装置电压至加铜(对照加水)后180 min.之后抽取阴极附近上覆水采用原子吸收光谱法检测Cu2+浓度, 同时检测阴极和阳极的电荷传递电阻, 并对阳极附近土壤的产电细菌16S rRNA基因进行定量.
| 表 1 CuSO4溶液理化性质 Table 1 Physiochemical properties of CuSO4 solution |
阴极和阳极的电荷传递电阻采用电化学工作站(VersaSTAT4, Princeton, USA)的交流阻抗法, 以三电极体系进行测定.测定阴极电荷传递电阻时, 以阴极作为工作电极, 阳极作为对电极, 同时靠近阴极设置Ag/AgCl参比电极;测定阳极电荷传递电阻时, 以阳极作为工作电极, 阴极作为对电极, 同时靠近阳极设置Ag/AgCl参比电极.扰动电压设为5 mV, 频率范围设置10-2到105 Hz.阻抗数据采用ZSimDemo3.30软件进行分析.
2.5 产电细菌16S rRNA基因定量加铜3 h后采集所有处理及平行SMFCs装置阳极附近土样, 使用土壤DNA快速提取试剂盒(Fast DNA® SPIN Kit for Soil, MP)按照制造商说明书分别提取土壤DNA.地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因丰度采用实时荧光定量PCR法测定, 在CFX96 Real-Time System(BIO-RAD, Laboratories Inc, USA)仪器上运行检测.这两个类群细菌的qPCR反应体系都为20 μL, 包括10 μL 2×SYBR Premix Ex Taq (Takara, Japan), 20 μmol·L-1上下游引物各0.4 μL, 2 μL模板DNA及7.2 μL ddH2O.引物序列和反应程序见表 2.采用溶解曲线分析扩增产物的特异性, 反应程序为65~ 95 ℃, 每间隔0.5 ℃升温测定荧光信号.采用10倍稀释含有标靶基因的重组质粒制作标准曲线.地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因标准曲线模板的浓度分别为1.37×109~ 1.37×103 copies·μL-1和2.13×109~ 2.13×103 copies·μL-1.扩增效率分别为90.1%(R2 = 0.991)和102.1%(R2= 0.996).设置3个无模板样品为阴性对照.
| 表 2 产电细菌定量PCR的引物和反应条件 Table 2 Primers and reaction conditions for quantitative real-time PCR of exoelectrogenic bacteria |
土壤产电电压、阴极和阳极的电荷传递电阻、产电细菌16S rRNA基因定量的数据与加入的Cu2+浓度之间关系, 采用origin 8.0软件进行线性回归分析.
3 结果(Results) 3.1 SMFCs装置产电电压对Cu2+污染的响应向上覆水加入Cu2+污染之前30 min开始在线连续记录电压数据.运行结果显示, 加入Cu2+污染之前电压运行十分平稳(图 2).大多数SMFCs装置的产电电压稳定在12 ~ 14 mV附近, 只有对照的1个平行产电在18 mV附近, 以及200 mg·L-1和400 mg·L-1各有1个平行稳定在6 mV附近.向对照加入去离子水之后, 电压仅出现了微弱的升高, 升高幅度不超过1 mV.这可能是去离子水的加入过程中对阴极附近的环境产生了扰动, 引入了少量O2, 以及促进了阴极表面反应产物的扩散, 这些都有利于提高产电.但本研究在操作过程中尽量做到平缓, 因此没有引起大的扰动.向上覆水中加入CuSO4溶液之后, 土壤产电电压立刻升高, 并且在30 s内录得电压峰值.随着加入的Cu2+浓度增加, 电压峰值呈现升高趋势, 其中, 加入400 mg·L-1 Cu2+浓度处理的电压峰值超过了100 mV.所有加铜处理的电压在峰值之后缓慢降低, 20 min后电压逐渐平稳.但200和400 mg·L-1 Cu2+处理的电压稳定后一直高于加入Cu2+污染前的水平.
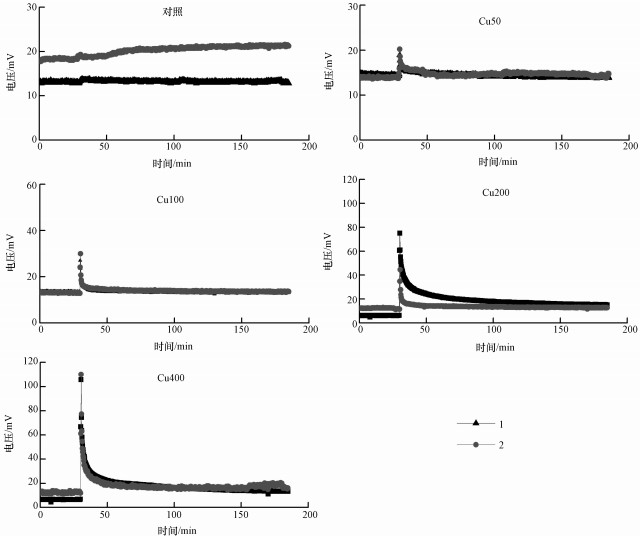 |
| 图 2 加入CuSO4溶液(对照加入去离子水)前后的土壤产电电压曲线(1和2分别代表两个平行) Fig. 2 The voltage curves generated by soil before and after the addition of CuSO4 solution or deionized water for control treatment (Number 1 and 2 denotes two replicates) |
由于加入Cu2+污染之前, 不同SMFCs装置的产电电压不同, 因此将峰电压值作为监测Cu2+污染水平的电压信号是不合适的.例如, 加入Cu2+污染之前, 对照-2的基准电压为18.3 mV, 而Cu50-1仅为14.5 mV(表 3);加入50 mg·L-1 Cu2+之后Cu50-1的峰电压为18.9 mV.单从峰电压判断, 与对照-2(19.3 mV)接近, 容易被误认为电压信号对50 mg·L-1 Cu2+污染没有响应.为了解决这个问题, 本文采用电压增量△U作为监测Cu2+污染水平的电压信号:

|
| 表 3 不同Cu2+浓度处理的电压信号 Table 3 The voltage signals of treatments with different Cu2+ concentrations |
其中, 基准电压为加铜前30 min电压平均值.电压增量消除了不同SMFCs装置基准电压的差异, 凸显了电压信号对Cu2+污染的响应.从表 3可以看出, 电压增量随着Cu2+浓度增加呈现不断上升的趋势.回归分析显示, 加入的Cu2+浓度与电压增量存在极显著的线性关系(图 3).需要注意的是, 本课题组之前的研究表明土壤产电电压随着气温会产生明显的波动(Deng et al., 2014).因此基准电压的时间范围内应避免有气温的变化.本试验中, 加入Cu2+污染之前30 min内气温基本维持在(15.2±0.1) ℃, 保证了基准电压的稳定.
 |
| 图 3 电压增量与加入Cu2+浓度之间的线性回归曲线 Fig. 3 The linear regression curve of voltage increment against Cu2+ concentrations |
分别对阳极和阴极内阻数据进行等效电路拟合.阴极阻抗的等效电路为阴极电荷传递电阻(Rctc)和电容元件(C)的并联电路与欧姆阻抗(RΩ)串联(图 4a);阳极阻抗的等效电路为阳极电荷传递电阻(Rcta)和电容元件(C)的并联电路与欧姆阻抗(RΩ)和Warburg阻抗(Zw)串联(图 4b).对照组的均高于600 Ω, 而且Rctc随加入Cu2+浓度的增加而降低, 其中400 mg·L-1 Cu2+处理的Rctc最低, 为400 Ω左右(表 4).回归分析表明, Rctc与Cu2+浓度呈现显著的负相关关系(图 5).与阴极电荷传递电阻不同的是, 阳极电荷传递电阻Rcta与加入的Cu2+浓度之间没有显著的线性关系.但200和400 mg·L-1 Cu2+处理的阳极电荷传递电阻与对照相比有明显的上升.
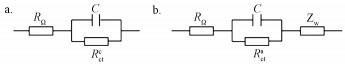 |
| 图 4 阴极(a)和阳极(b)阻抗等效电路图 Fig. 4 Equivalent circuit for the impedance spectra data of cathode (a) and anode (b) |
| 表 4 不同Cu2+浓度处理的阴极电荷传递电阻(Rctc)和阳极电荷传递电阻(Rcta) Table 4 The polarization resistance of cathode (Rcta) and anode(Rcta) |
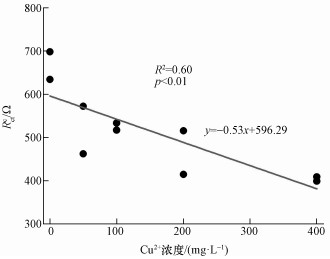 |
| 图 5 阴极电荷传递电阻与加入的Cu2+浓度之间的线性回归曲线 Fig. 5 The linear regression curve of against added Cu2+ concentrations |
加入Cu2+污染3 h后, 对阳极附近土壤中(以干土重计)的梭菌属(Clostridium)和地杆菌科(Geobacteraceae)细菌16S rRNA基因进行定量分析, 结果显示, 不同Cu2+浓度处理下, 梭菌属16S rRNA基因拷贝数变化范围3.17×108 ~ 4.62×108 g-1(图 6).和对照相比, 梭菌属16S rRNA基因拷贝数未出现随Cu2+浓度增加而降低的趋势;地杆菌科16S rRNA基因拷贝数变化范围4.93×108 ~ 7.37×108 copies·g-1.和对照相比, 加入400 mg·L-1 Cu2+处理的地杆菌科16S rRNA基因拷贝数降低了22%.
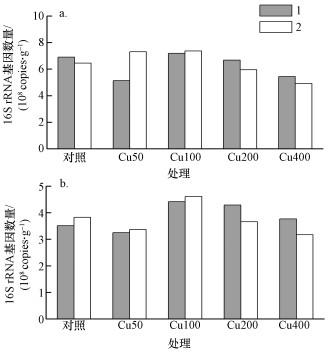 |
| 图 6 地杆菌科(Geobacteraceae)(a)和梭菌属(Clostridium)(b)细菌16S rRNA基因定量结果 Fig. 6 The quantification of Geobacteraceae (a) and Clostridium (b) 16S rRNA genes |
本研究采用一种新型的SMFCs装置, 对模拟的湿地水体Cu2+污染事件进行原位、在线监测.产电电压对Cu2+污染的响应迅速, 向阴极附近的上覆水中加入CuSO4溶液后, 电压立即上升, 达到峰值后回落.本文将加铜后电压峰值与加铜前基准电压的差值, 即电压增量作为监测Cu2+污染的电信号.采用电压增量作为监测信号的优点在于消除了基准电压差异的影响.而基准电压受土壤或底泥理化性质、温度和产电细菌活性等因素影响(Deng et al., 2014;Jiang et al., 2016).消除基准电压之后, 电压增量只与Cu2+浓度相关, 因此采用电压增量指标有利于提高不同地区、不同季节检测结果的可比性.
Cu2+污染加入阴极附近的上覆水中, 引起了电压的迅速上升, 而且电压增量与加入的Cu2+浓度具有显著的线性关系.推测Cu2+能够促进阴极反应.为了验证这一推测, 检测了CuSO4溶液的一系列化学性质(表 1).结果显示, 随着Cu2+浓度的增加, 溶液的电导率和氧化还原电位增加, 溶液pH降低.由于阴极进行以下反应(Wu et al., 2017):
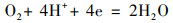
|
(1) |
因此, 与阴极表面接触的Cu2+浓度越高, H+浓度就越大, 越有利于反应向右侧进行.另外, CuSO4溶液的加入能够提高上覆水的电导率, 提高阴极电势.而且随着Cu2+浓度的增加, 阴极电荷传递电阻有降低的趋势, 表明Cu2+促进阴极反应的进行.这些因素都有利于增加SMFCs装置的电流, 从而提高1000 Ω负载两端的电压.而电压达到峰值之后回落, 这可能是由于阴极附近Cu2+的扩散以及被淹水土壤大量吸附有关(Deng et al., 2009).本研究在CuSO4溶液加入3 h后检测阴极附近上覆水的Cu2+浓度, 发现400 mg·L-1 Cu2+处理中Cu2+浓度最高仅为0.81 mg·L-1.随着阴极附近Cu2+浓度的减少, 铜对阴极反应的刺激效应随之减弱, 导致电压在达到峰值之后逐渐降低.
本研究的结果显示, 高浓度Cu2+污染对底泥产电细菌产生了不利的影响.基因定量结果显示, 400 mg·L-1 Cu2+处理的地杆菌科16S rRNA基因拷贝数比对照降低了22%, 但高浓度Cu2+污染未对梭菌属16S rRNA基因拷贝数产生明显的抑制.在之前的研究中, 我们对从土壤中分离的一株梭菌属产电细菌进行抗铜能力测试, 发现在10 mg·L-1 Cu2+浓度下其产电能力仍然没有显著降低(Deng et al., 2017).梭菌属的细菌为革兰氏阳性, 抗铜能力可能与细胞壁对Cu2+的吸附有关.另外, 阻抗检测也显示, 200和400 mg·L-1 Cu2+处理的阳极电荷传递电阻也比对照有明显上升.电荷传递电阻升高表明电极反应速度变慢, 对于阳极而言, 表明产电细菌的活性降低(Islam et al., 2017).
在以往的研究中, 我们分别采用了重金属(Cu2+、Cd2+)和有机污染物(芘)与土壤混合, 并将阳极埋设在污染土壤中进行产电(姜允斌等, 2014;Deng et al., 2015;Jiang et al., 2015).由于污染物直接抑制阳极表面土壤产电细菌活性, 从而造成土壤产电电压降低.本研究中污染物是加入到上覆水而非土壤中, 产电信号主要反映的是阴极对Cu2+的响应, 而且阳极附近产电细菌受到底泥的保护, 不易受到水体重金属污染的影响.因此产电电压在污染后迅速上升而不是降低, 并且从峰值回落并达到稳定之后, 电压仍然高于加铜前的水平, 这些都表明Cu2+污染对于阴极反应的刺激作用是主要的, 对阳极产电细菌的抑制作用是次要的.也正因为监测湿地水污染时, 底泥中的产电细菌不易受到重金属抑制, 从而完成对一次污染事件的监测之后, 电压能够重新回到稳定状态, 以便进行下一次监测, 所以本研究结果有助于实现对湿地水体重金属污染进行长期的原位在线监测.
5 结论(Conclusions)1) 本研究采用的新型沉积物-微生物燃料电池装置能够插入湿地底泥, 产生稳定的电压信号.当水体发生Cu2+污染事件时, 电压迅速升高, 且电压增量与加入的Cu2+浓度存在显著的正相关关系.
2) Cu2+污染对阴极反应具有促进作用, 是引起电压升高的主要原因.而产电细菌受到底泥的保护不易受到水体重金属污染的影响, 保证了产电信号在Cu2+污染事件结束后仍然稳定运行, 从而该装置可长期原位在线监测湿地水体Cu2+污染.
Baranitharan E, Khan M R, Prasad D, et al. 2015. Effect of biofilm formation on the performance of microbial fuel cell for the treatment of palm oil mill effluent[J]. Bioprocess and Biosystems Engineering, 38: 15–24.
DOI:10.1007/s00449-014-1239-9
|
Cabezas A, Pommerenke B, Boon N. 2015. Geobacter, Anaeromyxobacter and Anaerolineae populations are enriched on anodes of root exudate-driven microbial fuel cells in rice field soil[J]. Environmental Microbiology Reports, 7(3): 489–497.
DOI:10.1111/emi4.2015.7.issue-3
|
Cummings D E, Lovley D R. 2003. Diversity of geobacteraceae species inhabiting metal-polluted freshwater lake sediments ascertained by 16S rDNA analyses[J]. Microbial Ecology, 46(2): 257–269.
DOI:10.1007/s00248-005-8002-3
|
De Schamphelaire L, Cabezas A, Marzorati M, et al. 2010. Microbial community analysis of anodes from sediment microbial fuel cells powered by rhizo deposits of living rice plants[J]. Applied and Environmental Microbiology, 76: 2002–2008.
DOI:10.1128/AEM.02432-09
|
Deng H, Li X F, Cheng W D, et al. 2009. Resistance and resilience of Cu-polluted soil after Cu perturbation, tested by a wide range of soil microbial parameters[J]. FEMS Microbiology Ecology, 70(2): 293–304.
DOI:10.1111/fem.2009.70.issue-2
|
Deng H, Chen Z, Zhao F. 2012. Energy from plants and microorganisms: progress in plant-microbial fuel cells[J]. Chemsuschem, 5(6): 1006–1011.
DOI:10.1002/cssc.v5.6
|
Deng H, Wu Y C, Zhang F, et al. 2014. Factors affecting the performance of single-chamber soil microbial fuel cells for power generation[J]. Pedosphere, 24: 330–338.
DOI:10.1016/S1002-0160(14)60019-9
|
Deng H, Jiang Y B, Zhou Y W, et al. 2015. Using electrical signals of microbial fuel cells to detect copper stress on soil microorganisms[J]. European Journal of Soil Science, 66: 369–377.
DOI:10.1111/ejss.2015.66.issue-2
|
邓欢, 薛洪婧, 姜允斌, 等. 2015. 土壤微生物产电技术及其潜在应用研究进展[J]. 环境科学, 2015, 36(10): 3925–3934.
|
邓欢, 许静, 郭颖颖, 等2017. 一种快速响应水体污染的监测系统[P]. 专利授权号: ZL201720575719. 7
|
Deng H, Xue H J, Zhong W H. 2017. A novel exoelectrogenic bacterium phylogenetically related to clostridium sporogenes isolated from copper contaminated soil[J]. Electroanalysis, 29: 1294–1300.
DOI:10.1002/elan.v29.5
|
Islam M A, Ethiraj B, Cheng C K, et al. 2017. Electrogenic and antimethanogenic properties of Bacillus cereus for enhanced power generation in anaerobic sludge-driven microbial fuel cells[J]. Energy and Fuels, 31: 6132–6139.
DOI:10.1021/acs.energyfuels.7b00434
|
姜允斌, 薛洪婧, 钟文辉, 等. 2014. 土壤微生物产电信号评价芘污染毒性研究[J]. 土壤学报, 2014, 51: 1332–1341.
|
Jiang Y B, Deng H, Sun D M, et al. 2015. Electrical signals generated by soil microorganisms in microbial fuel cells respond linearly to soil Cd2+ pollution[J]. Geoderma, 255-256: 35–41.
|
Jiang Y B, Zhong W H, Han C, et al. 2016. Characterization of electricity generated by soil in microbial fuel cells and the isolation of soil source exoelectrogenic bacteria[J]. Frontiers in Microbiology, 7: 1776.
|
Kokko M E, Mäkinen A E, Puhakka J A. 2016. Anaerobes in Bioelectrochemical Systems. In: Hatti-Kaul R, Mamo G, Mattiasson B (eds). Anaerobes in Biotechnology[M]. Berlin: Springer, 263-292
|
Kouzuma A, Kasai T, Nakagawa G, et al. 2013. Comparative metagenomics of anode-associated microbiomes developed in rice paddy-field microbial fuel cells[J]. PLoS one, 8(11): e77443.
DOI:10.1371/journal.pone.0077443
|
李丽锋, 苏芳莉, 关驰, 等. 2014. 造纸废水灌溉对湿地土壤重金属累积影响及趋势评价[J]. 环境科学学报, 2014, 35(9): 2964–2970.
|
Lin B, Lu Y H. 2015. Bacterial and archaeal guilds associated with electrogenesis and methanogenesis in paddy field soil[J]. Geoderma, 259-260: 362–369.
DOI:10.1016/j.geoderma.2015.03.001
|
Sun M, Xiao T, Ning Z, et al. 2015. Microbial community analysis in rice paddy soils irrigated by acid mine drainage contaminated water[J]. Applied Microbiology and Biotechnology, 99: 2911–2922.
DOI:10.1007/s00253-014-6194-5
|
Wang Y Y, Ni Z H, Yu T, et al. 2008. Raman Studies of Monolayer Graphene: The Substrate Effect[J]. Journal of Physical Chemistry C, 112(29): 10637–10640.
DOI:10.1021/jp8008404
|
Wu J, Chen W, Yan Y, et al. 2017. Enhanced oxygen reducing biocathode electroactivity by using sediment extract as inoculums[J]. Bioelectrochemistry, 117: 9–14.
DOI:10.1016/j.bioelechem.2017.04.004
|
于文金, 邹欣庆. 2007. 江苏新洋港潮滩湿地重金属元素Pb、Cu、Zn、Cr分布特征及污染评价[J]. 环境科学学报, 2007, 27(12): 2088–2094.
DOI:10.3321/j.issn:0253-2468.2007.12.025 |
 2018, Vol. 38
2018, Vol. 38


