2. 农业部西北植物营养与农业环境重点实验室, 杨凌 712100;
3. 陕西省土地工程建设集团有限责任公司, 西安 710075
2. Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100;
3. Shaanxi Province Land Engineering Construction Group, Xi'an 710075
土壤碳库是陆地碳库最重要的组成部分, 在全球碳素收支平衡中占主导地位, 它由有机碳库和无机碳库两部分构成, 其中, 有机碳库主要包括动植物残体、微生物残骸及土壤腐殖质, 是湿润、半湿润地区土壤碳库的主要形式, 无机碳库主要由碳酸盐构成, 是干旱、半干旱地区土壤碳库的主要形式(Post et al., 1990).据估计, 全球土壤0~1 m范围内汇集了约1500 Pg有机碳及1200 Pg无机碳(Kirschbaum, 2000; Eswaran et al., 2000).由于土壤碳库巨大, 即使其微小的变化都会对大气中温室气体浓度及陆地生态系统产生巨大影响(Smith, 2008).例如, 土壤有机碳库减小10%相当于人为活动30年所排放的CO2量(Kirschbaum, 2000);0~2 m土层土壤有机碳含量增加5%~15%将会使大气中CO2浓度降低16%~30%(Baldock, 2007).
土壤有机碳矿化是一个重要的生物化学过程, 它与土壤养分的释放与供应、温室气体的形成与排放及土壤质量等密切相关, 揭示土壤有机碳矿化规律对科学管理土壤养分及有效控制温室效应具有重要意义(Celik et al., 2004; Schlesinger et al., 2000).目前已有大量研究表明, 土壤有机碳矿化会受到有机碳含量、质量、温度、水分、土壤pH、通气状况及粘粒含量等诸多因素的影响(Bertrand et al., 2007; Six et al., 2002; Chow et al., 2006).除此之外, 碳酸盐决定了土壤中的CO2分压, 也会影响土壤中有机碳的矿化.在干旱半干旱地区, 土壤无机碳库是有机碳库的2~5倍(Eswaran et al., 2000).然而, 土壤有机碳矿化与土壤无机碳的形成与分解的关系并不清楚.因此, 近年来碳酸盐对土壤有机碳矿化与累积的影响逐渐成为研究热点(Bertrand et al., 2007; Gocke et al., 2012).潘根兴等(1999a)认为在旱地土壤中土壤有机碳可作为碳酸盐溶解的驱动力, 但土壤无机碳也能够影响有机碳的转化.葛云辉等(2012)的研究表明, 向土壤中添加碳酸钙能够刺激土壤微生物活性、增加土壤活性有机碳的数量进而促进土壤有机碳的矿化(Feng et al., 2016).然而, Hamer等(2005)和Fang等(2015)的研究表明, 添加碳酸钙对土壤有机碳矿化不仅没有促进作用甚至会产生负效应.
中国有47%的面积属于干旱、半干旱区域, 这些区域无机碳库约为60 Pg, 相当于全球无机碳库的1/20(潘根兴, 1999b).黄土高原地区特殊的气候环境和成土条件导致该区土壤有机碳缺乏、无机碳充足, 这种特殊的土壤性质并不利于保持良好的土壤生产力.施用有机肥通常被认为是提高该地区土壤质量的一种有效途径.目前, 施用有机肥对土壤有机碳组分的影响及控制有机碳矿化的因素(如温度、水分、有机-无机配施等)已被广泛研究(陈涛等, 2008;Yang et al., 2011), 但无机碳与有机碳的关系也会直接影响土壤碳素循环(Finlay et al., 2003), 然而当前关于施用有机肥对土壤无机碳的影响及土壤中的碳酸盐对土壤有机碳矿化与腐殖化影响的研究较少.
在南方的酸性土壤中常常通过施用碳酸钙来调节土壤pH、降低土壤中重金属元素的活性等.然而, 北方土壤中的碳酸钙往往是过饱和的, 不需要施用碳酸钙来调节pH或其他指标, 但该区土壤中的碳酸钙含量变异较大, 因此, 碳酸钙含量的不同可能会引起土壤有机碳周转的不同.鉴于黄土高原地区土壤丰富的碳酸盐含量及有机肥被广泛施用, 研究该区土壤有机碳矿化对有机肥和碳酸钙的响应具有重要意义.本研究通过一个105 d的室内培养试验拟探明在相同质地、不同碳酸盐含量的黄绵土中土壤有机碳的周转状况, 包括不同水平碳酸钙和施用有机肥对土壤有机碳组分和CO2排放的影响.这将进一步补充影响黄土高原地区土壤有机碳矿化的因素, 对阐明该区土壤碳素固定及土壤碳库对大气碳库的影响具有重要意义.
2 材料与方法(Materials and methods) 2.1 试验材料试验土壤采自陕西省铜川市演池乡(35°07′N, 109°00′E), 该区位于关中平原与渭北高原接壤地带, 属暖温带大陆性气候, 四季分明, 年均气温8.9~12.3 ℃, 平均日照2345.7~2412.5 h, 年均降水量555.8~709.3 mm.供试土壤类型为黄绵土, 有机肥来源于由鸡粪和菌糠发酵腐熟的商品有机肥, 两者基本性质见表 1.有机肥经低温(50 ℃)烘干后粉碎并过1 mm筛, 备用;黄绵土去除动、植物残体后风干研磨并过1 mm筛, 备用.
| 表 1 供试土壤与有机肥基本性质 Table 1 The basic properties of tested soil and composted manure |
为了研究黄绵土中有机碳矿化和CO2排放对CaCO3含量和有机肥添加的响应, 同时避免不同的土壤性质, 如土壤质地、C/N、微生物体系等对土壤有机碳矿化造成的差异, 本研究通过向一种黄绵土中添加0、30和50 g · kg-1 CaCO3粉末模拟陕西省境内具有不同CaCO3含量(9%~15%)的黄绵土, 并添加0和20 g · kg-1有机肥(M)用于相关研究.本试验为室内培养试验, 共设6个处理(表 2).首先向风干、过筛的黄绵土中添加0、30和50 g · kg-1 CaCO3粉末、混匀, 用微型喷雾器均匀喷水至田间持水量的60%, 在温度为(25±2) ℃、空气相对饱和湿度为95%的培养箱中预先培养30 d, 形成具10.2%、13.2%和15.1% 3个CaCO3水平的黄绵土进行后续研究.培养结束后, 将土样风干并过1 mm筛, 随后根据表 2处理将土样与有机肥混匀, 称取260 g混合土样装入容积为250 mL的塑料瓶内(每个处理21瓶), 加入蒸馏水使土壤含水量达到田间持水量的60%, 其中3瓶内置一盛有20 mL 0.4 mol · L-1 NaOH的小广口瓶吸收培养过程中释放出的CO2, 最后加盖密闭后将塑料瓶置于(25±2) ℃的恒温恒湿培养箱内进行培养, 保持培养箱空气相对饱和湿度为95%.培养过程中, 每5 d采用称重法补充水分, 并于第2、4、7、11、18、28、38、54、70、85和105 d取出NaOH吸收液测定土壤CO2释放量, 同时放置新的NaOH吸收瓶后重新密封培养.在第1、7、21、42、70和105 d采集未放置NaOH吸收瓶的土壤样品, 每次3个重复, 取80 g鲜土储藏在4 ℃冰箱内备用, 其余的土样风干、研磨后过2、1及0.149 mm筛备用.
| 表 2 不同处理中外源添加物种类及用量 Table 2 Types and amount of exogenous substances in different treatments |
土壤pH以1 : 2.5的土水比用PHS-3C型pH计测定;土壤碳酸盐(主要为CaCO3)含量采用气量法测定(鲍士旦, 2000);土壤有机碳采用K2Cr2O7-H2SO4外加热法测定(Nelson et al., 1982);微生物量碳(MBC)采用氯仿熏蒸-0.5 mol · L-1 K2SO4提取、TOC-VCPH仪测定(Brookes et al., 1985);土壤水溶性有机碳(DOC)参照Ghani等(2003)方法测定;土壤颗粒碳(POC)采用Cambardella等(1992)的方法进行分离, 随后用K2Cr2O7-H2SO4外加热法测定有机碳含量;土壤易氧化有机碳(ROC)采用333 mmol · L-1 KMnO4氧化, 随后在波长565 nm处用比色法测定(Blair et al., 1995; Lefroy et al., 1993);NaOH吸收的CO2采用0.2 mol · L-1 HCl中和滴定法测定.
2.4 计算方法及数据处理土壤有机碳氧化稳定系数(Kos)根据公式(1)计算.
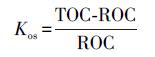
|
(1) |
式中, TOC为土壤总有机碳含量(g · kg-1);ROC为易氧化有机碳含量(g · kg-1).
有机肥矿化率(Rc)根据公式(2)计算(柳敏等, 2007).

|
(2) |
式中, C1为土壤与有机肥混合培养后有机碳含量(g · kg-1);C2为对照土壤培养后有机碳含量(g · kg-1);C为最初加入的有机肥的有机碳含量(g · kg-1).由于培养过程中供试土壤的有机碳也发生了分解, 添加的物料质量也因矿化分解而下降, 因此, 在计算中进行了校正(减去了对照土壤).
碳酸钙和有机肥对土壤CO2表观累积净增加量根据公式(3)计算.
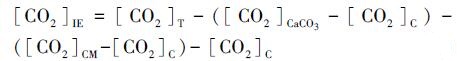
|
(3) |
式中, [CO2]IE为土壤表观累积CO2净增加量(mg · kg-1);[CO2]T为L30-M或L50-M处理表观累积CO2释放量(mg · kg-1);[CO2]CaCO3为L30或L50处理土壤表观累积CO2释放量(mg · kg-1);[CO2]CM为L0-M处理土壤表观累积CO2释放量(mg · kg-1);[CO2]C为L0处理土壤表观累积CO2释放量(mg · kg-1).
数据采用Microsoft Office Excel 2007进行整理计算, 利用SAS8.0(SAS Institute Inc., Cary, NC, USA)软件对数据进行方差分析和差异显著性检验(LSD法).
3 结果与分析(Results and analysis) 3.1 CaCO3含量和施用有机肥对土壤pH的影响由图 1可知, 培养初期施用有机肥对土壤pH无显著影响, 第7~105 d施用有机肥显著降低了土壤pH, 但培养0~105 d, 土壤pH随CaCO3含量的增加显著升高(p < 0.05).在L0、L30和L50处理中土壤pH先增加并在第7 d达到峰值, 随后逐渐降低, 于第70 d趋于平稳.然而, 在L0-M、L30-M和L50-M处理中土壤pH在培养初期迅速降低, 随后逐渐趋于平稳.在整个培养过程中, 与L0相比, 施用有机肥使土壤pH降低了0.01~0.04;与L0-M相比, L30-M和L50-M分别使土壤pH增加0.02~0.05和0.04~0.07.
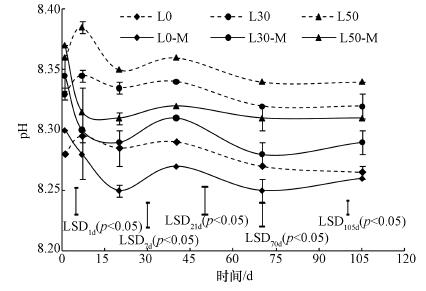 |
| 图 1 培养过程中土壤pH变化 Fig. 1 Changes of soil pH during the incubation |
施用有机肥可以显著增加土壤MBC、DOC、POC和ROC含量, 但土壤CaCO3含量仅对MBC含量产生显著影响(p < 0.05)(表 3).本研究中, 土壤微生物活性与CaCO3含量呈正相关关系.与L0相比, L30和L50分别使土壤MBC含量显著增加11.2%和30.3%;与L0-M相比, L30-M和L50-M分别使土壤MBC含量显著增加5.6%和20.0%(p < 0.05).当未施用有机肥时, 随着CaCO3含量增加土壤DOC含量降低, POC和ROC含量增加, 但差异均未达到显著水平(p>0.05).当施用有机肥时, 土壤DOC、POC和ROC含量均与CaCO3含量呈正相关关系.与L0-M相比, L30-M对土壤DOC、POC和ROC含量的影响不显著, 但L50-M分别使DOC和ROC含量增加了21.2%和7.8%, 差异均达到显著水平(p < 0.05).
| 表 3 黄绵土中CaCO3含量和施用有机肥对土壤有机碳组分的影响 Table 3 Effect of CaCO3 content and composted manure application on soil organic C fractions in loessial soil |
土壤有机碳的抗氧化能力用氧化稳定系数(KOS)衡量, Kos值越大, 氧化稳定性越强, 反之则越弱.如图 2所示, 添加有机肥对Kos无显著影响, 但无论添加有机肥与否, 黄绵土中有机碳抗氧化能力随CaCO3含量的增加而减小.与L0相比, L30和L50分别使Kos降低了5.6%和7.2%, 差异不显著, 但与L0-M相比, L30-M和L50-M分别使Kos降低了10.2%和15.1%, 差异达到显著水平(p < 0.05).
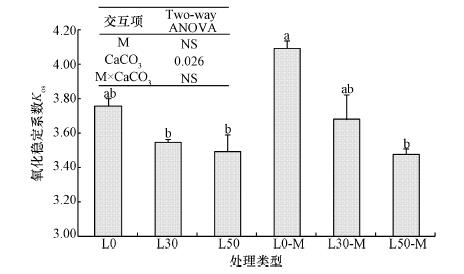 |
| 图 2 CaCO3含量和施用有机肥对土壤有机碳氧化稳定性的影响 (不同小写字母表示不同处理间土壤有机碳氧化稳定性差异达到显著水平(p < 0.05), 下同) Fig. 2 Effect of CaCO3 content and composted manure application on soil organic C oxidation stability |
本研究中, 培养105 d时, L0-M、L30-M和L50-M处理中有机肥矿化率分别为10.7%、20.3%和19.3%(图 3).与L0-M相比, L30-M和L50-M处理中有机肥矿化率分别增加了95.9%和81.2%, 差异达到显著水平;与L30-M相比, L50-M处理中有机肥矿化率减少了4.9%, 差异未达到显著水平(p>0.05).由此可见, 在一定范围内有机肥的矿化量随土壤CaCO3含量增加而增加, 但当土壤中CaCO3含量超过阈值时反而不利于有机肥的矿化.这可能是因为虽然增加CaCO3含量会激发土壤微生物活性, 但当土壤CaCO3含量过高时, 它反而会对有机碳形成保护, 阻碍其分解.
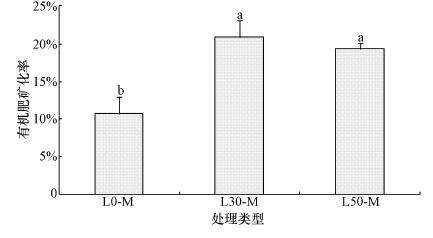 |
| 图 3 黄绵土中CaCO3含量对有机肥(M)矿化率的影响 Fig. 3 Effects of CaCO3 content in the loessial soil on the mineralization rate of composted manure |
随着培养时间延长, 各处理土壤CO2表观累积释放量不断增加, 添加有机肥的处理土壤CO2表观累积释放量显著高于未添加有机肥的处理(p < 0.05)(图 4a).各处理CO2释放速率均在培养第2 d时达到最高, 其中, 未添加有机肥的处理为71.4~86.2 mg · kg-1 · d-1, 添加有机肥的处理为112.7~128.4 mg · kg-1 · d-1;培养38 d后, 各处理CO2释放速率趋于稳定, 105 d时各处理CO2释放速率仅为5.1~8.5 mg · kg-1 · d-1(图 4b).
 |
| 图 4 CaCO3含量和施用有机肥对黄绵土中CO2累积释放量 (a)、释放速率(b)及净增加量(c)的影响 Fig. 4 Effects of CaCO3 content and composted manure application on soil total CO2 accumulation (a), CO2 release rate (b) and net CO2 accumulation (c) in loessal soil |
在黄绵土中, 施用有机肥能显著增加土壤CO2排放量(p < 0.05).培养105 d时, 与L0相比, 施用有机肥使CO2表观累积排放量平均增加46.5%.未施用有机肥时, 土壤CaCO3含量对CO2排放无显著影响, 但施用有机肥后CaCO3和有机肥会对土壤CO2排放产生显著的交互效应(p < 0.05), 进而影响土壤CO2排放, 其效果与土壤中CaCO3含量密切相关(图 4a).具体来讲, 在L30-M处理中CaCO3和有机肥会对土壤CO2排放产生负的交互效应, 且随着培养时间的延长这种交互效应逐渐消失.105 d时, L30-M处理中土壤表观累积CO2净增加量为-31.5 mg · kg-1, 这会使土壤CO2表观累积排放量减少.然而, 在L50-M处理中CaCO3和有机肥会对土壤CO2排放产生正的交互效应, 且这种效果持续于整个培养周期. 105 d时, L50-M处理中土壤累积CO2净增加量为238.2 mg · kg-1, 这会使土壤CO2表观累积排放量显著增加(p < 0.05)(图 4c).
4 讨论(Discussion)土壤中有机碳的矿化会受土壤pH影响(Bertrand et al., 2007; Rousk et al., 2009), 一方面土壤pH的变化会改变土壤有机碳的溶解性和有效性(Andersson et al., 2001), 另一方面土壤pH亦会通过改变微生物细胞中生物大分子的电荷及微生物细胞对营养物质的吸收性能(陈燕飞, 2009)来影响土壤微生物群落的多样性和活性(Rousk et al., 2009), 进而影响土壤有机碳矿化.在本研究中, 土壤pH随CaCO3含量的增加而升高, 同时较高的CaCO3含量亦会抵消施用有机肥造成的土壤pH下降(图 1), 这有利于增加土壤微生物量、提高土壤微生物活性(表 3), 这与葛云辉等(2012)报道的添加CaCO3对土壤微生物活性有激发作用的研究结果相同.Edmeades等(1981)和Grover等(2017)研究认为, 施用CaCO3在一定程度上有利于为土壤微生物的生长提供最适宜的pH环境, 这有助于土壤有机碳的矿化.然而, 施用CaCO3也会改善土壤结构, 提高团聚体稳定性, 增加对土壤团聚体内有机碳的物理保护效应, 减少有机碳被微生物分解的敏感性(Bronick et al., 2005).由此可见, 土壤有机碳矿化与土壤中CaCO3含量的关系是复杂的, 而且它们之间相互影响、过程并不完全独立.
众所周知, 导致土壤有机质分解的直接原因是微生物参与的矿化过程.研究表明, 土壤微生物活性与土壤基质有效性是密不可分的, 因此, 添加外源有机物质可以影响土壤微生物活性(Ocio et al., 2007; Witter et al. 1993).究其原因, 一方面施用有机物料可为微生物活动提供充足的碳源, 能够激发土壤微生物活性(Yang et al., 2017);另一方面施用有机物料可以增加土壤MBC、DOC、POC和ROC等活性组分的含量, 进而增加土壤有机碳的有效性(Diacono et al., 2010).在本研究中, 与对照相比, 施用有机肥后显著增加了土壤MBC、DOC、POC和ROC的含量(表 3)(p < 0.05), 该结果与Yang等(2017)和Diacono等(2010)的研究结果相同.因此, 上述结果表明施用有机肥亦会对土壤有机碳的矿化产生显著的影响.综上所述, 土壤中不同的CaCO3含量、pH及外源有机添加物会对土壤有机碳矿化造成或正或负的激发效应, 从而引起土壤CO2排放的差异.
目前, 已有大量研究表明, 土壤CO2排放与环境条件和外源添加物有关.Motavalli等(1995)通过270 d的培养试验发现, 土壤CO2排放量与土壤pH存在正相关关系.Bertrand等(2007)的研究表明, 向碱性土壤中添加石灰会使土壤排放更多的CO2, 而且添加作物秸秆也会增加土壤中CO2的产量.在本研究中, 黄绵土中有机碳的矿化及CO2的排放与有机肥的施用和CaCO3含量密切相关, 这与Bertrand等(2007)的研究结果类似.与对照相比, 施用有机肥显著增加了土壤CO2的排放量(图 4a)(p < 0.05), 它是由外源有机物料对土壤微生物活性和有机碳有效性的激发作用所致(Yang et al., 2017;Diacono et al., 2010), 这有利于土壤有机碳的矿化分解.然而, 土壤CaCO3含量对土壤CO2排放的影响却更加复杂, 与是否施用有机肥密切相关.
未施用有机肥时, 随着土壤CaCO3含量的增加土壤CO2排放量无显著变化(p < 0.05), 这可能是因为CaCO3的增加虽然会激发土壤微生物活性, 但它也对土壤有机碳形成了一定的物理保护作用, 减少了微生物对有机碳的分解(Bronick et al., 2005).此外, 就土壤有机碳有效性而言, 土壤DOC含量随CaCO3含量增加而减少, 这不利于有机碳矿化;虽然POC和ROC含量随CaCO3含量增加而增加(表 3), 有机碳氧化稳定性(Kos)也随之降低(图 2), 但由于CaCO3含量和培养时间的影响, 其差异并未达到显著效果.因此, 当不施用有机肥时, 在多方面因素的综合影响下黄绵土中CaCO3含量的差异不会对土壤CO2排放产生显著影响(p < 0.05).当施用有机肥时, 土壤CO2的排放与土壤CaCO3含量有关.与L0-M相比, L30-M虽然提高了土壤微生物活性和土壤有机碳的易氧化性, 但差异未达到显著水平(表 3), 因此, 它对表观CO2排放无显著影响(p < 0.05)(图 4a);然而, L50-M相比L0-M显著增加了土壤MBC、DOC、POC和ROC等活性有机碳的含量(表 3), 同时显著降低了土壤有机碳氧化稳定性(Kos)(p < 0.05)(图 2), 这有利于激发土壤中有机碳的矿化分解, 进而显著增加了土壤CO2的排放(图 4a), 该结果与Ahmad等(2014)的研究结果类似.除此之外, 土壤中的CaCO3促进了有机肥的矿化, 使其矿化率提高了90%左右(图 3), 而且CaCO3对土壤有机碳的矿化具有促进和保护的双重效果, 会对土壤CO2的释放产生方向不同的激发效应.具体来讲, 在较低CaCO3水平的黄绵土中(L30-M), CaCO3和有机肥在培养初期会对土壤CO2排放产生负的表观激发效应, 且随着培养时间延长激发效应逐渐消失;但在较高CaCO3水平的黄绵土中(L50-M), CaCO3和有机肥则会对土壤CO2排放产生持续的、正的表观激发效应(图 4c).其原因可能是因为L30-M与L0-M相比, 土壤pH变化较小, CaCO3对有机碳矿化的激发效应小于保护效应, 但当土壤CaCO3含量较高时(L50-M)则呈现相反的效果.最终, 在L30-M处理中CaCO3与有机肥产生的负激发效应抵消掉部分CaCO3对有机肥矿化的促进效果, 导致L30-M与L0-M相比并未对CO2表观累积排放量产生显著影响;但在L50-M处理中CaCO3与有机肥产生的正激发效应与CaCO3对有机肥矿化的促进效果相叠加, 进一步增加了CO2表观累积排放量, 使差异达到显著水平(p < 0.05)(图 4a, 4c).
总之, 在黄绵土中, 随着土壤CaCO3含量的增加可以通过提高土壤微生物活性、增加土壤活性有机碳含量及降低土壤有机碳氧化稳定性来促进有机肥和土壤有机碳的矿化, 而且土壤表观CO2排放量将会受到土壤CaCO3含量和外源有机物料添加的影响.然而, 在石灰性土壤中CO2排放可来源于有机碳矿化和无机碳分解, 因此, 当前研究仅能说明有机肥和CaCO3对土壤表观累积CO2排放的影响, CO2来源及内在机理有待进一步研究.
5 结论(Conclusions)1) 施用有机肥后, 随着土壤CaCO3含量的增加, 土壤pH上升、活性有机碳(MBC、DOC、POC和ROC)含量增加、有机碳氧化稳定性(Kos)降低, 有利于土壤有机碳的矿化分解.
2) CaCO3不仅能促进有机肥的矿化, 而且会和有机肥对土壤CO2释放产生显著的交互效应, 其效果与土壤中CaCO3水平有关.
3) 土壤CO2排放与土壤CaCO3含量和有机肥的施用密切相关, 根据土壤CaCO3含量合理施用有机肥对土壤碳素循环和温室气体(CO2)排放具有重要意义.
Ahmad W, Singh B, Dijkstra F A, et al. 2014. Temperature sensitivity and carbon release in an acidic soil amended with lime and mulch[J]. Geoderma, 214-215: 168–176.
DOI:10.1016/j.geoderma.2013.09.014
|
Andersson S, Nilsson S I. 2001. Influence of pH and temperature on microbial activity, substrate availability of soil-solution bacteria and leaching of dissolved organic carbon in a mor humus[J]. Soil Biology & Biochemistry, 33: 1181–1191.
|
Baldock J A. 2007. Composition and Cycling of Organic Carbon in Soil, Nutrient Cycling in Terrestrial Ecosystems[M]. Berlin: Springer.
|
鲍士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社.
|
Bertrand I, Delfosse O, Mary B. 2007. Carbon and nitrogen mineralization in acidic, limed and calcareous agricultural soils: Apparent and actual effects[J]. Soil Biology & Biochemistry, 39(1): 276–288.
|
Blair G J. 1995. Soil carbon fractions based on their degree of oxidation, and the development of acarbon management index for agricultural systems[J]. Australian Journal of Agricultural Research, 46(7): 393–406.
|
Brookes P C, Landman A, Pruden G, et al. 1985. Chloroform fumigation and the release of soil N:A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology & Biochemistry, 17(6): 837–842.
|
Bronick C J, Lal R. 2005. Soil structure and management:a review[J]. Geoderma, 124: 3–22.
DOI:10.1016/j.geoderma.2004.03.005
|
Cambardella C A, Elliott E T. 1992. Particulate soil organic-matter changes across a grasslandcultivation sequence[J]. Soil Science Society of America Journal, 56: 777–783.
DOI:10.2136/sssaj1992.03615995005600030017x
|
Celik I, Ortas I, Kilic S. 2004. Effects of compost, mycorrhiza, manure and fertilizer on some physical properties of a Chromoxerert soil[J]. Soil & Tillage Research, 78(1): 59–67.
|
陈涛, 郝晓辉, 杜丽君, 等. 2008. 长期施肥对水稻土土壤有机碳矿化的影响[J]. 应用生态学报, 2008, 19(7): 1494–1500.
|
Chow A T, Tanji K K, Gao S, et al. 2006. Temperature, water content and wet-dry cycle effects on DOC production and carbon mineralization in agricultural peat soils[J]. Soil Biology & Biochemistry, 38(3): 477–488.
|
陈燕飞. 2009. pH对微生物的影响[J]. 太原师范学院学报, 2009, 8(3): 121–131.
|
Edmeades D C, Judd M, Sarathchandra S U. 1981. The effect of lime on nitrogen mineralization as measured by grass growth[J]. Plant and Soil, 60: 177–186.
DOI:10.1007/BF02374102
|
Eswaran H, Reich P F, Kimble J M, et al. 2000. Global Carbon Stocks//Lal R, Kimble J M, Eswaran H, et al. Global Climatechange and Pedogenic Carbonates[M]. BocaRaton: Lewis Publishers
|
Fang Y Y, Singh B, Singh B P. 2015. Effect of temperature on biochar priming effects and its stability in soils[J]. Soil Biology & Biochemistry, 80: 136–145.
|
Feng S, Huang Y, Ge Y, et al. 2016. Variations in the patterns of soil organic carbon mineralization and microbial communities in response to exogenous application of rice straw and calcium carbonate[J]. The Science of the Total Environment, 571: 615–623.
DOI:10.1016/j.scitotenv.2016.07.029
|
Finlay J C. 2003. Controls of streamwater dissolved inorganic carbon dynamics in a forested watershed[J]. Biogeochemistry, 62(3): 231–252.
DOI:10.1023/A:1021183023963
|
葛云辉, 苏以荣, 邹东生, 等. 2012. 桂西北石灰土土壤有机碳矿化对外源有机物质和碳酸钙的响应[J]. 生态学杂志, 2012, 31(11): 2748–2754.
|
Ghani A, Dexter M, Perrott K W. 2003. Hot-water extractable carbon in soils:a sensitive measurement for determining impacts of fertilisation, grazing and cultivation[J]. Soil Biology & Biochemistry, 35(9): 1231–1243.
|
Gocke M, Pustovoytov K, Kuzyakov Y. 2012. Pedogenic carbonate formation:Recrystallization versus migration-Process rates and periods assessed by 14C labeling[J]. Global Biogeochemical Cycles, 26(1): 1018–1029.
|
Grover1 S P, Butterly C R, Wang X, et al. 2017. The short-term effects of liming on organic carbon mineralisation in two acidic soils as affected by different rates and application depths of lime[J]. Biology and Fertility of Soils, 53: 431–443.
DOI:10.1007/s00374-017-1196-y
|
Hamer U, Marschner B. 2005. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions[J]. Soil Biology & Biochemistry, 37(3): 445–454.
|
Kirschbaum M U F. 2000. Will changes in soil organic carbon act as a positive or negative feedback on global warming[J]. Biogeochemistry, 48(1): 21–51.
DOI:10.1023/A:1006238902976
|
Lefroy R D B, Blair G J, Strong W M. 1993. Changes in soil organic matter with cropping asmeasured by organic carbon fractions and 13C natural isotope abundance[J]. Plant and Soil, 155-156(1): 399–402.
DOI:10.1007/BF00025067
|
柳敏, 张璐, 宇万太, 等. 2007. 有机物料中有机碳和有机氮的分解进程及分解残留率[J]. 应用生态学报, 2007, 18(11): 2503–2506.
|
Motavalli P P, Palm C A, Parton W J, et al. 1995. Soil pH and organic C dynamics in tropical forest soils:evidence from laboratory and simulation studies[J]. Soil Biology & Biochemistry, 27(12): 1589–1599.
|
Nelson D W, Sommers L E. 1982. Total Carbon, Organic Carbon and Organic matter[M]. Madison: ASA and SSSA Publishing.
|
Post W M, Peng T H, Emanuel W R, et al. 1990. The global carbon cycle[J]. American Scientist, 78: 310–326.
|
潘根兴, 曹建华, 何师意, 等. 1999a. 土壤碳作为湿润亚热带表层岩溶作用的动力机制:系统碳库及碳转移特征[J]. 南京农业大学学报, 1999a, 22(3): 49–52.
|
潘根兴. 1999b. 中国干旱性地区土壤发生性碳酸盐及其在陆地系统碳转移上的意义[J]. 南京农业大学学报, 1999b, 22(2): 51–57.
|
Rousk J, Brookes P C, Baath E. 2009. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization[J]. Applied and Environmental Microbiology, 75(6): 1589–1596.
DOI:10.1128/AEM.02775-08
|
Schlesinger W H, Andrews J A. 2000. Soil respiration and the global carbon cycle[J]. Biogeochemistry, 48(1): 7–20.
DOI:10.1023/A:1006247623877
|
Six J, Conant R T, Paul E A, et al. 2002. Stabilization mechanisms of soil organic matter:Implications for C-saturation of soils[J]. Plant and Soil, 241(2): 155–176.
DOI:10.1023/A:1016125726789
|
Smith P. 2008. Land use change and soil organic carbon dynamics[J]. Nutrient Cycling in Agroecosystems, 81(2): 169–78.
DOI:10.1007/s10705-007-9138-y
|
Yang X, Meng J, Lan Y, et al. 2017. Effects of maize stover and its biochar on soil CO2 emissions and labile organic carbon fractions in Northeast China[J]. Agriculture, Ecosystems & Environment, 240: 24–31.
|
Yang X Y, Li P R, Zhang S L, et al. 2011. Long-term-fertiliz ation effects on soil organic carbon, physical properties, and wheat yield of a loess soil[J]. Journal of Plant Nutrition and Soil Science, 174(5): 775–784.
DOI:10.1002/jpln.v174.5
|
 2018, Vol. 38
2018, Vol. 38


