2. 桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心, 桂林 541004;
3. 湖南大学环境科学与工程学院, 长沙 410082
2. Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004;
3. College of Environmental Science and Engineering, Hunan University, Changsha 410082
近20年来, 我国大气环境得到了很大改善, 但冬季出现的雾霾污染以及夏季出现的臭氧污染, 对人们生活及健康产生了极大危害.挥发性有机污染物(VOCs)是雾霾和臭氧产生的前体物之一(王铁宇等, 2013), 因此, 要控制雾霾和臭氧污染, 归根结底要减少前体物VOCs的排放, 加强VOCs的治理.在众多VOCs控制技术中, 生物法是利用微生物吸收并降解VOCs, 将其转化为小分子的CO2、H2O和微生物菌体, 具有处理效果好、投资运行成本低、二次污染小等突出优点.目前生物法已被广泛用于多个不同行业的VOCs处理(Amin et al., 2017; Rene et al., 2017; Chheda et al., 2017).其中, 生物滴滤器作为新兴的生物处理技术之一, 在VOCs的处理中发挥了很大的潜力, 其对VOCs的去除性能受VOCs在水中的溶解度及其亨利常数的影响较大(Muñoz et al., 2012).疏水性VOCs具有较低的水溶性, 从气相到液相以及从液相到生物膜相的传质速率较低, 限制了VOCs的生物降解速率以及微生物的生长速率, 因此, 生物反应器对疏水性VOCs如正己烷和苯乙烯的处理性能降低(Lebrero et al., 2014;Kim et al., 2005).基于这些原因, 增加疏水性VOCs在液相中的传质性能, 将有助于增强它们在生物膜中的生物可利用性, 从而促进它们的生物可降解性(Cheng et al., 2016; Zehraoui et al., 2012).
表面活性剂是能显著降低界面张力, 具有一定结构、亲水亲油特性和特殊吸附性质的物质(Zhou and Zhu, 2007).它可以增加化合物在液相中的溶解性, 降低其与液相之间的传质阻力, 使污染物更易与微生物直接接触, 从而促进疏水性有机污染物的生物降解.表面活性剂在生物膜上的吸附可能会改变难降解有机物在生物膜上的穿透作用, 增大生物膜对疏水性基质的吸收和中间介质向生物膜中渗滤的可能(姜霞等, 2003).除此之外, 表面活性剂还能抑制絮凝作用, 增加微生物的运输, 影响微生物的流动(Mihelcic et al., 1993).目前, 表面活性剂在难降解有机物如多氯联苯土壤修复、重金属污染治理等领域备受人们的青睐(Zhou and Zhu, 2007).虽然表面活性剂在有机废气生物净化领域有一定研究, 但阴离子表面活性剂对反应器内生物膜组成的影响方面研究较少.
本实验采用阴离子表面活性剂对生物滴滤器去除正己烷废气及生物膜相特性研究, 考察正己烷在表面活性剂中的分配系数, 阴离子表面活性剂浓度对反应器性能和生物膜分泌物组成的影响.这些研究结果将进一步扩展BTFs在处理疏水性VOCs方面的应用.
2 材料与方法(Materials and methods) 2.1 实验装置实验装置由柱1和柱2两个相同实验室规模的生物滴滤器(BTF1和BTF2)并联组成, 如图 1所示.生物滴滤器由高780 mm, 内径为100 mm的有机玻璃管制成, 分4层, 每层由密布均匀小孔的筛板作为承托层, 支撑内径和高度分别为100 mm的圆柱形网状聚氨酯海绵填料(孔径10 PPI, 孔隙率95.3%, 表观密度28 kg·m-3).实验采用气液同向流模式的方式操作.空气经空气压缩机后分成两股气流, 均由转子流量计控制进入增湿瓶和正己烷气体发生器, 增湿后的空气与正己烷气体一起进入混合瓶充分混合均匀, 经流量计调节后由生物滴滤器顶部通过整个床层.含有正己烷的废气在下降的过程中, 正己烷与填料上的生物膜接触, 然后被吸附、降解, 从而得到净化.净化后的气体从底部排出.微生物所需要的营养液从低位槽中经潜水泵提升至生物滴滤器顶部, 喷淋量(4.5 L·d-1)由定时器定时定量控制, 通过喷淋头均匀淋洒至填料上.营养液组成见先前的文献报道(Cheng et al., 2015).生物滴滤器一侧安装水位U型压力计, 以实时监控柱内的压力, 观察反应器内填料上生物膜的生长状况.系统运行温度维持在25 ℃.实验所用微生物取自湖南省长沙市国祯污水处理厂氧化沟内活性污泥中的混合菌群.
 |
| 图 1 生物滴滤器实验流程图 Fig. 1 Schematic diagram of experimental set-up for biofiltration of hexane vapors |
运行周期详见表 1.在BTFs运行期间, 为确保BTFs在各个运行阶段的可重复性和可靠性以及在不同操作条件下所获得的实验结果之间的可比性, 本实验设定了一组参考条件, 即每改变操作条件之前或者操作完成之后, 将BTFs在参考条件下进行5~6 d的恢复实验.本研究阶段参考条件设定为正己烷进口有机负荷为24 g·m-3·h-1.
| 表 1 BTFs运行周期 Table 1 Experimental scheme for continuous n-hexane degradation experiments using BTFs |
(1) 正己烷浓度的测定:气态正己烷浓度采用美国Agilent-6890型气相色谱仪进行分析, 气相色谱仪配有HP-VOC、19091R-316型毛细色谱柱(60 m×320 μm ID×1.8 μm)和氢火焰离子化检测器(FID).汽化室、检测器和柱子的温度分别为120、200、120 ℃, 载气(高纯氮气)、燃气(H2)和助燃气(空气)的气体流速分别为30、30、350 mL·min-1.样品采用1.0 mL气密型进样器, 分流进样.为了减小实验误差, 每次取样后及时对样品进行分析, 且在实验中, 每个样品重复测定3次, 以所得平行样数据的平均值为最终结果.
(2) 分配系数的测定:取7个135 mL的玻璃瓶, 加入1.0 mL浓度为79.3 mg·L-1的表面活性剂溶液(SDS、Tween20、Triton X-100)和体积分别为5、10、20、50、100、200、300 μL的正己烷, 将玻璃瓶密封后在30 ℃条件下恒温72 h, 然后测定顶空部分正己烷的浓度.液相中的浓度根据总的正己烷质量减去气相中正己烷的质量后再除以液相的体积得到, 正己烷在表面活性剂中的分配系数通过公式(1)计算(Galindo et al., 2011; Woertz and Kinney, 2015):
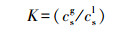
|
(1) |
式中, K为分配系数;csg为正己烷在气相中的浓度(g·m-3);csl为正己烷在表面活性剂中的浓度(g·m-3).
(3) 胞外聚合物(EPS)的提取与分析:本实验采用加热法提取生物滴滤器生物膜表面的EPS, 具体操作过程已在先前的研究中报道过(Cheng et al., 2015).
(4) 多糖(PS)和蛋白质(PN)含量的测定:多糖采用苯酚-硫酸法进行测定, 蛋白质采用Folin-酚法测定(Cheng et al., 2015).
3 结果与讨论(Results and discussion) 3.1 正己烷在不同表面活性剂中的分配系数在恒温平衡状态下, 挥发性有机物在气液两相中的浓度之比称为分配系数(K)(Galindo et al., 2011).根据公式(1)可知, K值大小与挥发性有机物在气液两相中的浓度有关.K越小, 挥发性组分在气相中的浓度就越小, 换言之, 在液相中的浓度就越大, 生物降解过程中微生物与挥发性有机物接触的几率就会越大.表 2是正己烷在非离子表面活性剂(Triton X-100)和阴离子表面活性剂(SDS)中的分配系数.可以看出, 正己烷在SDS中的K值最低, 在Triton X-100中的值最大, 说明SDS相比Triton X-100更能促进正己烷在液相中的溶解度.值得注意的是, 正己烷在3种表面活性剂中的分配系数远远低于其在水溶液中的分配系数, 表明在含有表面活性剂的溶液中, 正己烷的溶解度远大于水相中的溶解度, 这进一步说明了表面活性剂对挥发性有机物具有增溶的作用.Nguyen等(2010)研究证明, 表面活性剂能在水溶液表面形成表面活性膜, 使气体在含有表面活性剂溶液中的溶解度远大于在水中的溶解度, 且扩散系数也比在纯水中的大3个数量级以上.Daiguji等(1997)在研究表面活性剂强化吸收VOCs的机理时也发现, 表面活性剂不仅对VOCs具有增溶作用, 而且用作气体或者是挥发性有机物吸收剂时, 对VOC的吸收容量大且还可提高挥发性有机物在液相中的传质系数、增强扩散能力.
| 表 2 正己烷在表面活性剂中的分配系数 Table 2 Hexane partition coefficients in surfactants |
实验采用气液同向流的方式对填料上的生物膜进行驯化.驯化期, 正己烷进口有机负荷保持在24 g·m-3·h-1(进口浓度为200 mg·m-3, 空床停留时间为30 s), 整个启动期BTFs的运行时间为20 d.BTFs启动阶段实验结果如图 2所示.反应器启动初期, 由于填料上的生物膜对正己烷需要一段时间的适应过程, 因此, 在反应器运行的第1天, BTF1和BTF2对正己烷的去除率不到20%, 但在第2天, 正己烷的去除率上升速度较快, 且在两个反应器中的去除率都达到了50%左右, 说明在低浓度正己烷条件下, 填料上的微生物已开始适应正己烷的环境并逐渐生长繁殖.到第12天, BTF 1和BTF 2中正己烷的去除率均能达到85%左右, 并且随着时间的延长, 在随后几天内正己烷的去除率一直稳定在85%~90%之间.此时, 可以观察到BTFs填料上附着有一层黄褐色的微生物膜如图 3所示, 即成功完成了反应器的启动过程, 整个启动过程持续了20 d.Yang等(2011)认为, 生物过滤器处理挥发性有机化合物的启动过程中, 在进口浓度和停留时间一定的情况下, 去除率稳定并维持在较高水平, 则系统启动成功.Cox等(2000)认为在停留时间不变, 进口有机物浓度较低的条件下, 生物过滤器的启动阶段可能需要几周甚至几个月的时间, 这可能与反应器处理的对象或者反应器本身有关.不同的目标污染物由于其分子结构、在水中的溶解性及亨利常数不同, 微生物对它的适应能力和降解效果不同.因此, 反应器达到稳定运行的时间也不相同.Vergara-Fernande等(2011)在考察不同碳源对真菌反应器去除正己烷的启动周期发现, 当以正己烷作为碳源时, 反应器的启动周期为35 d, 然而, 当反应器分别添加甘油、正己醇或麦麸等有机物作为真菌的碳源时, 反应器的启动周期被大大缩短, 从35 d分别缩短到24 d、14 d和8 d, 且反应器对正己烷还能保持较高的去除率.当基于聚氨酯海绵填料的生物过滤器处理乙苯废气时, 反应器装置的启动时间为25 d(Wang et al., 2014).Yang等(2011)也报道了采用含有同样填料的生物滴滤器处理甲苯废气时, 反应器的启动时间为32 d.
 |
| 图 2 BTFs启动阶段性能 Fig. 2 The star-up performance of BTF |
 |
| 图 3 BTFs启动阶段填料上附着的生物膜 Fig. 3 Biofilms on packing materials during start-up of BTFs |
SDS是一种阴离子表面活性剂, 含有易被微生物降解的磺酸基团.一些研究者也发现, SDS具有可生物降解性, 对微生物没有毒性(Zeng et al., 2007; Cheng et al., 2016b), 这就意味着, 可直接将SDS加入营养液中引入到生物滴滤器中, 通过这种方式既能保证表面活性剂的添加量也能保证其喷淋的均匀性.在BTF2的营养液中逐步添加浓度为79.3、158.6、475.8、793.0 mg·L-1的阴离子表面活性剂SDS, BTF1作为对照组.图 4是进口正己烷有机负荷为72 g·m-3·h-1时, SDS浓度对生物滴滤器去除正己烷废气性能影响的变化曲线.图 4a中BTF2喷淋的营养液中含有不同浓度的SDS, BTF1作为对照组营养液中不添加SDS.图 4b表示的是不同运行时间对生物滴滤器去除正己烷能力的变化曲线.
 |
| 图 4 SDS浓度对BTFs性能的影响 Fig. 4 Effect of SDS concentration on the performance of both BTFs with time for degrading n-hexane |
从图可以看出, 当SDS浓度从79.3 mg·L-1增加到158.6 mg·L-1时, BTF2对正己烷的去除率增加了6%, 相应的去除能力也增加了4.32 g·m-3·h-1.当SDS浓度进一步增加到475.8 mg·L-1和793.0 mg·L-1时, BTF2对正己烷的去除效率从70%降低到40%左右, 相应的去除能力也随之下降, 从50.4 g·m-3·h-1降低到了33.01 g·m-3·h-1以下.由此可见, SDS浓度在158.6 mg·L-1以下时, 生物滴滤器对正己烷的去除效率明显得到提高, 这一结果与Kim等(1998)在对比研究添加剂对生物反应器处理CAH的增效作用时的结论相似.此外, Wang等(2013)也发现, 当引入的非离子表面活性剂Tween 20在其临界胶束浓度以下(11.79 mg·L-1)时, 生物滴滤器可以最大程度的去除废气中的乙苯.因此, 适当浓度的表面活性剂的添加有利于生物反应器对挥发性有机物的去除.
在图b中还值得注意的是, 对照组BTF1对正己烷的去除效率一直保持在50%~55%左右, 相应的去除能力不到40 g·m-3·h-1, 而BTF2在SDS浓度为79.3 mg·L-1及158.6 mg·L-1条件下对正己烷的去除率均高于BTF1.但是SDS浓度为475.8 mg·L-1和793.0 mg·L-1时, BTF2对正己烷的去除效果反而要低于BTF1.产生这种现象的原因可能与不同浓度的SDS所扮演的角色有关.低浓度的SDS主要发挥其表面活性剂的增溶作用, 增大正己烷在液相中的溶解度进而增加正己烷与微生物接触的几率, 从而提高去除效率.而SDS作为碳源还具有一定的生物降解性, 因此高浓度的SDS与正己烷之间存在一定的竞争作用.与气态的正己烷相比, 高浓度的SDS被微生物降解的机会更多, 因此阻碍了气态正己烷的有效降解, 从而导致BTF2对正己烷的去除效率下降(Zeng et al., 2007; Cheng et al., 2016b).Tu等(2015)在对生物表面活性剂皂角苷强化BTFs去除正己烷的研究中也发现了类似的现象, 作为碳源, 皂角苷与正己烷之间存在一定的竞争作用.然而, 有些研究者对这种现象解释为表面活性剂浓度的增加导致溶液的粘性增加, 因而限制了氧气和正己烷从气相到液相的传质速率(Galindo et al., 2011), 致使反应器的去除性能降低.由此可见, 表面活性剂的浓度并不是越高越好, 表面活性剂强化疏水性VOCs生物降解取决于表面活性剂的浓度, 如浓度为50.0 mg·L-1 (1.25 CMC(临界胶束浓度, Critical micelle concentration))皂角苷能使进口负荷为120 g·m-3·h-1的正己烷的去除率从56.8%增加到83.3%, 而浓度为60 mg·L-1皂角苷却使正己烷的去除率降到82.5%.相似的研究也在Wang等研究Tween20强化乙苯生物过滤一文中发现过(Wang et al., 2014).本研究中SDS浓度在158.6 mg·L-1(1/10 CMC)以下能够使反应器对正己烷的去除率在进口负荷为72 g·m-3·h-1的操作条件下达到64%~70%, 而Hassan和Sorial等(2010)在处理正己烷的过程中发现, 在进口负荷为13.40 g·m-3·h-1, 营养液中加入150 mg·L-1 Triton X-100时, 正己烷的去除效率只有59%, 这和前面研究正己烷在SDS和Triton X-100中的浓度分配相一致, 说明SDS更能促进正己烷的生物降解.
3.4 SDS对BTF中生物膜分泌物组成的影响为研究SDS对填料上生物膜相组成的影响, 在不同反应器运行期包括启动结束阶段和添加不同浓度表面活性剂阶段, 从BTF2第2层填料上及BTF1前3层填料上刮取一定量的生物膜, 考察不同运行期反应器内生物膜分泌物组成的变化情况以及比较填料上生物膜的生长状况, 结果如图 5a和5b所示.
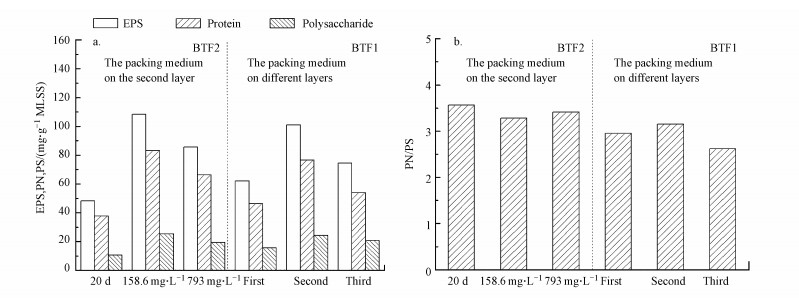 |
| 图 5 BTFs运行过程中生物膜相组成变化 Fig. 5 Composition change of of biofilms during the operation of BTFs |
从图 5中可以看出, BTF2的第2层填料上生物膜分泌的蛋白质在EPS中占的比例最大, 含量是多糖的3倍多(见图 5b), 这一结果与先前的研究结论相似(Cheng et al., 2015).当BTF2在不同浓度的SDS条件下运行时, 可以发现SDS浓度为158.6 mg·L-1的情况下, 生物膜分泌的蛋白质和多糖均比浓度为793.0 mg·L-1条件下生物膜分泌的蛋白质和多糖要高, 且都高于启动期.这些实验结果表明, SDS的加入促进了反应器内微生物产蛋白质和EPS的含量, 而蛋白质和EPS含量的增加可能又促进了反应器运行初期填料床层生物膜的形成, 说明生物膜的形成与蛋白质的含量有关.前人的研究也表明, 蛋白质在生物膜形成和保持结构稳定性中可能发挥重要的作用(Sheng et al., 2010; Tourney and Ngwenya, 2014).从图中还可以发现, BTF1中第2层填料床层上生物膜分泌的蛋白质和多糖含量要高于其它两个填料上的, 且3个填料上的均高于启动期, 其原因可能是由于营养液喷淋装置在第1层填料上部, 间歇性的喷淋冲刷作用导致第1层填料上生物膜比第2、3层填料上相对较少, 而第2层填料床层上的生物膜因其距离进气口处相比于第3层填料而言较近, 生物膜与正己烷的接触几率更多, 生长速度较快, 因此, 床层上的生物膜分泌的蛋白质和多糖相对较多, 然而BTF1中第2层填料上生物膜EPS和蛋白质含量相较于BTF2而言要少, 这可能与SDS的促溶作用和自身可作为碳源被微生物降解有关.微生物利用的碳源越多, 相比之下, 其生长速度就越快, 因而分泌的蛋白质也就越多.
4 结论(Conclusions)1) 正己烷在SDS中的K值最低, 其次是在Tween 20中, 而在Triton X-100中的值最大, 且正己烷在3种表面活性剂中的分配系数远远低于其在水溶液中的分配系数.
2) 当正己烷进口负荷为72 g·m-3·h-1、停留时间为30 s时, 添加浓度为79.3~158.6 mg·L-1的SDS能强化生物滴滤器对正己烷的去除, 其去除效率可以从50%左右提高到70%, 相应的去除容量从36 g·m-3·h-1增加到56 g·m-3·h-1.
3) 在生物滴滤器去除正己烷过程中, 生物膜分泌的胞外蛋白质占胞外聚合物比例最大, 比较BTF1中3层填料上的微生物膜分泌的胞外蛋白质和多糖含量, 蛋白质和多糖含量最多的是第2层填料上微生物膜, 其次是第1层填料, 最少的是第3层填料.添加SDS的BTF2中第2层填料上生物膜分泌的胞外蛋白质含量高于BTF1中第2层填料上的.
Amin M M, Rahimi A, Bina B, et al. 2017. Biodegradation of n-hexane as single pollutant and in a mixture with BTEX in a scoria/compost-based biofilter[J]. Process Safety and Environmental Protection, 107: 508–517.
DOI:10.1016/j.psep.2017.03.019
|
Cheng Y, He H J, Yang C P, et al. 2015. Performance and biofilm characteristics of gas biofilter for n-hexane removal at various operational conditions[J]. Rsc Advances, 5(60): 48954–48960.
DOI:10.1039/C5RA06879G
|
Cheng Y, He H J, Yang C P, et al. 2016a. Challenges and solutions for biofiltration of hydrophobic volatile organic compounds[J]. Biotechnology Advances, 34: 1091–110.
DOI:10.1016/j.biotechadv.2016.06.007
|
Cheng Y, He H, Yang C, et al. 2016b. Effects of anionic surfactant on n-hexane removal in biofilters[J]. Chemosphere, 150: 248–253.
DOI:10.1016/j.chemosphere.2016.02.027
|
Chheda D, Sorial A G. 2017. Evaluation of co-metabolic removal of trichloroethylene in a biotrickling filter under acidic conditions[J]. Journal of Environmental Sciences, 57: 54–61.
DOI:10.1016/j.jes.2016.12.008
|
Cox H H J, Nguyen T T, Deshusses M A. 2000. Toluene degradation in the recycle liquid of biotrickling filters for air pollution control[J]. Applied Microbiology & Biotechnology, 54(1): 133–137.
|
Daiguji H, Hihara E, Saito T. 1997. Mechanism of absorption enhancement by surfactant[J]. International Journal of Heat & Mass Transfer, 40(40): 1743–1752.
|
Galindo H, Revah S, Cervantes F J, et al. 2011. Effect of surfactant and oil additions in the biodegradation of hexane and toluene vapours in batch tests[J]. Environmental Technology, 32(2): 167–173.
DOI:10.1080/09593330.2010.491132
|
Hassan A A, Sorial G A. 2010. A comparative study for destruction of n-hexane in Trickle Bed Air Biofilters[J]. Chemical Engineering Journal, 162(1): 227–233.
DOI:10.1016/j.cej.2010.05.034
|
姜霞, 高学晟, 应佩峰, 等. 2003. 表面活性剂的增溶作用及在土壤中的行为[J]. 应用生态学报, 2003, 14(11): 2072–2076.
DOI:10.3321/j.issn:1001-9332.2003.11.058 |
Kim D, Cai Z, Sorial G A. 2005. Evaluation of trickle-bed air biofilter performance under periodic stressed operating conditions as a function of styrene loading[J]. Journal of the Air & Waste Management Association, 55(2): 200–209.
|
Kim J O, Terkonda P K, Lee S D. 1998. Gaseous CAH removal by biofiltration in presence and absence of a nonionic surfactant[J]. Bioprocess Engineering, 19(4): 253–259.
DOI:10.1007/s004490050516
|
Lebrero R, Hernández M, Quijano G, et al. 2014. Hexane biodegradation in two-liquid phase biofilters operated with hydrophobic biomass:Effect of the organic phase-packing media ratio and the irrigation rate[J]. Chemical Engineering Journal, 237(1): 162–168.
|
Mihelcic J R, Lueking D R, Mitzell R J, et al. 1993. Bioavailability of sorbed-and separate-phase chemicals[J]. Biodegradation, 4(3): 141–153.
DOI:10.1007/BF00695116
|
Muñoz R, Daugulis A J, Hernández M, et al. 2012. Recent advances in two-phase partitioning bioreactors for the treatment of volatile organic compounds[J]. Biotechnology Advances, 30(6): 1707–1720.
DOI:10.1016/j.biotechadv.2012.08.009
|
Nguyen L L A, Carbonell R G, Coy B J M. 2010. Diffusion of gases through surfactant films:Interfacial resistance to mass transfer[J]. Aiche Journal, 25(6): 1015–1024.
|
Rene E R, Sergienko N, Goswami T, et al. 2017. Effects of concentration and gas flow rate on the removal of gas-phase toluene and xylene mixture in a compost biofilter[J]. DOI: 10.1016/j.biortech.2017.08.029
|
Sheng G P, Yu H Q, Li X Y. 2010. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances, 28(6): 882–894.
DOI:10.1016/j.biotechadv.2010.08.001
|
Tourney J, Ngwenya B T. 2014. The role of bacterial extracellular polymeric substances in geomicrobiology[J]. Chemical Geology, 386: 115–132.
DOI:10.1016/j.chemgeo.2014.08.011
|
Tu Y, Yang C, Cheng Y, et al. 2015. Effect of saponins on n-hexane removal in biotrickling filters[J]. Bioresource Technology, 175: 231–238.
DOI:10.1016/j.biortech.2014.10.039
|
Vergara-Fernández A, Hernández S, Revah S. 2011. Elimination of hydrophobic volatile organic compounds in fungal biofilters:Reducing start-up time using different carbon sources[J]. Biotechnology & Bioengineering, 108(4): 758–765.
|
Wang L, Yang C, Cheng Y, et al. 2013. Effects of surfactant and Zn (Ⅱ) at various concentrations on microbial activity and ethylbenzene removal in biotricking filter[J]. Chemosphere, 93(11): 2909–2913.
DOI:10.1016/j.chemosphere.2013.09.109
|
Wang L, Yang C, Cheng Y, et al. 2014. Enhanced removal of ethylbenzene from gas streams in biotrickling filters by Tween-20 and Zn(Ⅱ)[J]. Journal of Environmental Sciences, 26(12): 2500–2507.
DOI:10.1016/j.jes.2014.04.011
|
王铁宇, 李奇锋, 吕永龙. 2013. 我国VOCs的排放特征及控制对策研究[J]. 环境科学, 2013, 34(12): 4756–4763.
|
Woertz J R, Kinney K A. 2015. Influence of Sodium Dodecyl Sulfate and Tween 20 on Fungal Growth and Toluene Degradation in a Vapor-Phase Bioreactor[J]. Journal of Environmental Engineering, 130(3): 292–299.
|
Yang C P, Yu G L, Zeng G M, et al. 2011. Performance of biotrickling filters packed with structured or cubic polyurethane sponges for VOC removal[J]. Journal of Environmental Sciences, 23(8): 1325–1333.
DOI:10.1016/S1001-0742(10)60565-7
|
Zehraoui A, Hassan A A, Sorial G A. 2012. Effect of methanol on the biofiltration of n-hexane[J]. Journal of Hazardous Materials, 219-220(6): 176–182.
|
Zeng G M, Fu H, Zhong H, et al. 2007. Co-degradation with glucose of four surfactants, CTAB, Triton X-100, SDS and Rhamnolipid, in liquid culture media and compost matrix[J]. Biodegradation, 18(3): 303–310.
DOI:10.1007/s10532-006-9064-8
|
Zhou W, Zhu L. 2007. Enhanced desorption of phenanthrene from contaminated soil using anionic/nonionic mixed surfactant[J]. Environmental Pollution, 147(2): 350–357.
DOI:10.1016/j.envpol.2006.05.025
|
 2018, Vol. 38
2018, Vol. 38


