2. 大连海事大学环境科学与工程学院, 大连 116026
2. College of Environmental Sciences and Engineering, Dalian Maritime University, Dalian 116026
在自然水体, 光化学过程是产生卤代有机物的重要过程之一(Méndez-díaz et al., 2014).卤代有机物多数具有溶解度低、持久性高、致癌等特性, 部分甚至是环境荷尔蒙物质, 易于在生物体内积累(金梨娟等, 2017; Yu et al., 2013; Dorneles et al., 2015), 会对生物体造成长期的慢性毒性效应(Khalil et al., 1999; 刘慧, 2011).因此, 有关卤代有机化合物的自然来源及环境行为的探究, 正逐渐成为国际环境科学及相关领域的研究热点之一, 但我国相关研究报道仍然少见.海洋等自然水体中的卤代物大部分都是氯代或溴代, 含碘化合物则比较少.虽然海洋等自然水体中氯离子的含量大大超过溴离子含量, 但与氯离子相比, 溴离子更容易与有机物结合形成卤代物(Sim et al., 2009; 阴永光等, 2011).
氨基酸作为水中含氮有机物的重要组成部分, 在水中广泛、大量的存在(孙岩, 2012; 姚昕等, 2010), 且其作为典型的含氮有机物, 在卤代光化学过程中会有不同的表现(Remucal et al., 2011; How et al., 2017; Gannamani et al., 2016; Pająk et al., 2016), 具有非常重要的研究价值.酪氨酪(Tyrosine, Tyr)属于芳香族氨基酸(结构如图 1所示), 能够吸收250~320 nm的紫外线,被吸收的紫外线的能量可直接使其发生光降解等光致反应.Weyl等(1966)对酪氨酸水溶液进行光照实验,发现在紫外光的照射下,酪氨酸会发生光致转化反应,生成产物3, 4-二羟基苯丙氨酸.
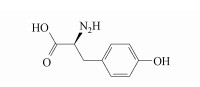 |
| 图 1 酪氨酸结构图 Fig. 1 Structures of Tyr |
目前对天然卤代有机物进行分析时, 人们常用GC-MS或HPLC-MS联用来同时进行定性与定量分析(Dufour et al., 2016; Hauler et al., 2015; Wang et al., 2013).本研究通过建立及优化固相萃取-高效液相色谱-三重串联四级杆质谱(SPE-HPLC-MS/MS)的分析方法, 对Tyr及溴代产物进行定性和定量分析, 研究Tyr在含盐水体中的光化学行为及环境因子对其光致溴代反应的影响, 这可对部分有机卤代物的天然来源研究提供重要的科学参考价值.
2 材料与方法(Material and methods) 2.1 仪器与试剂仪器:光化学反应仪(XPA-7, 南京胥江机电厂, 配300 W汞灯, 2.4 A);液相色谱-三重串联四级杆质谱仪(液相色谱:Agilent 2100 SL, 安捷伦科技有限公司;质谱:Agilent 6410B三重串联四级杆质谱仪, 安捷伦科技有限公司);12管防交叉污染型真空固相萃取装置(Supelco公司);氮吹仪(WD-12, 杭州奥盛仪器有限公司);精密pH计(PHS-3E, 上海仪电科学仪器股份有限公司);石英光解管(2.1 cm×16 cm).
试剂:酪氨酸(Tyrosine, Tyr)、色氨酸(Tryptophan, Trp)纯度均 > 99%, 购自上海阿拉丁生化科技股份有限公司;3-溴-酪氨酸(3-Bromo-L-tyrosine, 3-BrTyr)、3, 5-二溴-L-酪氨酸(3, 5-Dibromo-L-tyrosine, 3, 5-diBrTyr)纯度均 > 96%, 购自北京百灵威科技有限公司;乙腈(色谱纯)购自Sigma-Aldrich公司;甲醇(色谱纯)购自天津市科密欧化学试剂有限公司;盐酸(北京化工厂)、氢氧化钠(沈阳试剂三厂)、三氯化铁(天津市大茂化学试剂厂)、溴化钠(汕头市西陇化工厂)、氨水(天津市科密欧化学试剂有限公司)均为分析纯;超纯水(18.2 MΩ·cm, Milli-Q公司).
2.2 光化学实验用0.1% HCl配制Tyr的储备液(1.00 mg·L-1), 置于-4 ℃冰箱内避光保存.试验中的铁盐为氯化铁(Fe(Ⅲ)), 用超纯水配制成55.85 g·L-1的储备液, 并将pH值调整到1.0~2.0, 防止沉淀生成.
光源采用300 W汞灯, 使用滤光片得到λ > 290 nm的光, 用德国TriOS水下光谱仪测得溶液中心处的平均光强为204 W·m-2.光解反应前在一定浓度(0.61 g·L-1)的溴化钠水溶液中加入一定量的Fe(Ⅲ), 加入Tyr储备液至需要的浓度(CTyr=0.40 mg·L-1), 并用NaOH或HCI调节反应液的pH值, 搅拌使溶液达到溶解平衡.将25 mL反应溶液转移至石英光解管中, 在室温下进行3组光化学平行试验.分别在光照时间为0、0.5、1、2、4、7.5 h时取出样品进行分析.使用的装置如图 2所示.
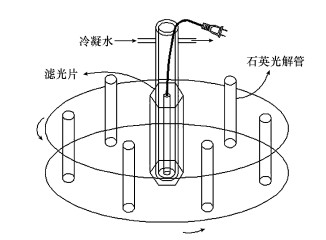 |
| 图 2 光化学反应装置示意图 Fig. 2 Schematic diagram of the photoreactor |
酪氨酸溴代产物的定性和定量分析均采用固相萃取(SPE)浓缩, 液质联机分析.以离子扫描模式(SIM)定性分析产物, 多反应监测模式(MRM)定量分析产物的浓度.
色谱条件:C18(Waters Xterra MS C18(3.5 μm, 2.1 mm×100 mm))色谱柱;进样量10 μL;柱温40 ℃;流动相为0.1%甲酸(A)、乙腈(B), 流动相比例为90%A.
质谱条件:ESI离子源, 正离子扫描模式, 干燥气温度为350 ℃, 干燥气流速为8 L·min-1, 毛细管电压为4000 V, 电喷雾压力为25 psi.
SPE操作如下(使用Cleanert-SCX小柱(60 mg, 3 mL)):①固相萃取小柱活化:依次用6 mL甲醇、6 mL超纯水和6 mL pH=2.4的超纯水通过SPE小柱;②上样:光照后的反应溶液中加入内标物(Trp), 用HCl调节反应液至pH=2.4, 然后以2 mL·min-1的流速通过小柱, 之后用3 mL超纯水淋洗萃取小柱, 使用真空抽滤泵抽干;③洗脱:洗脱液为8 mL 5%氨水甲醇, 分4次洗脱, 收集洗脱液, 氮气吹至近干, 用500 μL 0.1%甲酸水溶液进行复溶, 然后进行HPLC-MS/MS分析.
2.4 质量控制和质量保证 2.4.1 回收率实验和精密度实验采用超纯水作为水样, 进行精密度实验和回收率实验.具体操作步骤如下:取3份超纯水(每份25 mL), 加入Tyr及溴代产物的单标及内标物(Trp), 使浓度均为8.00 μg·L-1, 按上述分析方法进行分析检测.每次光照实验过程分别做3次平行实验, 进行实验中的精密度实验, 此外, 每9个样品为一个批次, 另外再取一份超纯水只加入内标物进行加标空白实验, 用于指示目标化合物的回收率.
2.4.2 仪器的稳定性每次在对每一批次样品进行仪器分析之前, 使用空白溶剂和已知浓度的标准样品分别连续测定20针平行针, 使相对标准偏差在10%以下, 验证仪器稳定性及确保实验结果的准确性.
2.4.3 玻璃仪器的洗涤实验用玻璃仪器依次使用自来水、去离子水进行超声清洗3次, 烘干后再使用马弗炉进行高温处理(400 ℃, 4 h), 以便去除污染.
3 结果与讨论(Results and discussion) 3.1 溴离子溶液中Tyr的光致溴代反应如图 3所示, 汞灯照射下(λ > 290 nm), 在含有18.48 mg·L-1 Fe(Ⅲ)和0.61 g·L-1溴化钠的水溶液中, Tyr发生显著的光转化反应.HPLC-MS/MS定性分析Tyr的光溴代产物的出峰色谱图如图 3a所示.通过Br的同位素峰的比例, 可确认分子中所含Br的个数(图 3b).Br的两个同位素分别为79Br和80Br, 其丰度比为1:1, 在3.7、8.5 min时出现小峰, 苯环上的Br数目分别1和2时, 产物峰面积的比例分别为1:1(m/z=260:262)、1:2:1(m/z=338:340:342), 结合图 3a和3b可以确定光转化过程中形成了3-BrTyr和3, 5-diBrTyr.
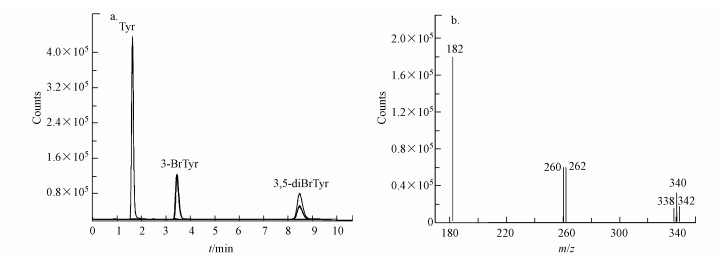 |
| 图 3 Tyr光转化产物的色谱图(a)和主要产物的质谱图(b) Fig. 3 The chromatography (a) and mass spectrum(b) for the Tyr photo-transformation product |
用Tyr、3-BrTyr、3, 5-diBrTyr及内标Trp(IS)的标准溶液进行质谱条件优化, 结果见表 1.
| 表 1 各物质的质谱检测条件 Table 1 Transitions for the selected compounds |
以0.1%甲酸甲酸铵水溶液、0.1%甲酸水溶液分别为A相, 乙腈为B相进行洗脱.如图 4所示, A:B=9:1, A相为0.1%甲酸甲酸铵时, 两种溴代产物没有出峰;A相为0.1%甲酸时, 各组分分离度较好、响应值较大.
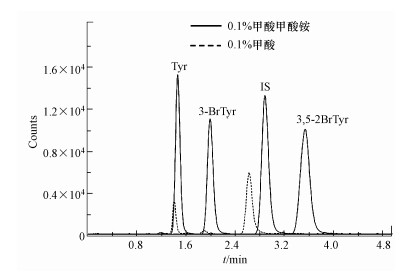 |
| 图 4 氨基酸及溴代产物出峰示意图 Fig. 4 The chromatography for the Tyr and brominated products |
为提高3-BrTyr、3, 5-diBrTyr两种产物的回收率, 本实验考察了富基氨基酸常用的Sep-Pak C18和Cleanert-SCX固相萃取小柱.结果显示, 在进行3次平行试验后, Sep-Pak C18对两种产物的回收率分别为12.6%±3.21%、11.1%±4.43%;Cleanert-SCX对两种产物的回收率分别为87.30%±2.16%、76.60%±4.72%, 因此, 本实验选用Cleanert-SCX固相萃取小柱.
3.2.4 方法的检出限、回收率及相对标准偏差使用0.1%甲酸水溶液配制Tyr、3-BrTyr、3, 5-diBrTyr的混合标准品溶液做标准曲线, 浓度分别为20、50、100、200、400及800 μg·L-1, 并在标准曲线中加入相同浓度(400 μg·L-1)的Trp(IS).以进样量为10 μL时的3倍色谱峰信噪比(S/N)来确定仪器的检出限(IDL).检出限如表 2所示, 结果表明, 目标化合物的浓度在20~800 μg·L-1范围内可以满足定量要求.为评价本方法的准确性和重复性, 采用25 mL 8 μg·L-1的目标物, 按照优化后的分析方法进行3组平行试验.加标回收率在75%~90%之间, 相对标准偏差均小于5%, 显示出良好的回收率和重复性(表 2).
| 表 2 酪氨酸及溴代产物的线性相关系数、仪器检出限、加标回收率和相对标准偏差 Table 2 Instrumental detection limits, recovery and relative standard deviation of Tyr and brominated products |
Fe(Ⅲ)在不同水体中的浓度变化很大, 在天然含盐水体中其浓度范围是 < 0.056 μg·L-1~12.89 mg·L-1(Koshikawa et al., 2007).文献报道在大气水中, 特别是在一些由于含大量硫酸或者硝酸而呈现强酸性的气溶胶中, 溶解态铁对物质的光转化起到重要作用(刘慧, 2011; Vione et al., 2005).尽管高pH对于了解环境水体的真实情况更有现实意义, 但由于Fe(Ⅲ)的溶解和沉淀平衡是受到多种因素影响(欧晓霞, 2008);此外, 在pH=3.0时, 大部分的Fe(Ⅲ)以溶解态存在, 表现出很大的光活性.因此, 本文选择在pH=3.0的条件下, 来研究3种不同浓度的Fe(Ⅲ)对Tyr光化学反应过程的影响, 结果如图 5所示.
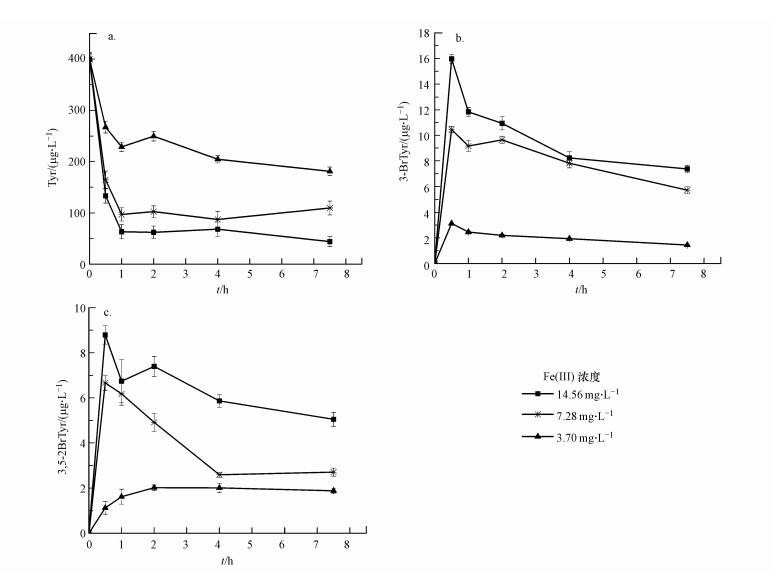 |
| 图 5 Fe(Ⅲ)浓度对Tyr光降解(a)及形成3-BrTyr (b)、3, 5-diBrTyr (c)的影响 ([Br-]=0.61 g·L-1, pH=3.0) Fig. 5 Variations of of Tyr(a), 3-BrTyr (b) and 3, 5-diBrTyr(c) under different Fe(Ⅲ) concentration in the presence of 0.61 g·L-1 Br- at pH 3.0 |
图 5a中, Tyr在含Fe(Ⅲ)体系溶液中较易发生光降解反应, 在1 h内迅速降解, 这是由于在光的作用下, Fe(Ⅲ)浓度升高时, ·OH的产量增多, ·OH也会参与污染物的降解(Zhao et al., 2015), 导致Tyr其他转化途径的发生或增强;之后Tyr基本趋于缓慢衰减状态, 这可能是由于随着光降解反应的进行, Tyr浓度降低, 光降解中间产物增多且成分复杂, 而这些中间产物优先吸光子能量, 并将其进行能量转化, 相应降低了每摩尔氨基酸分子的吸光效率, 延缓了氨基酸分子的光降解反应(Remucal et al., 2011).图 5b和5c结果显示, 光照7.5 h过程中, 3-BrTyr和3, 5-diBrTyr的浓度随着Fe(Ⅲ)浓度的增加而增大, 当Fe(Ⅲ)浓度分别为3.70、7.28、14.56 mg·L-1时, 3-BrTyr的最大浓度分别为15.97、10.45、和3.13 μg·L-1.当Fe(Ⅲ)浓度分别为14.56、7.28 mg·L-1时, 3-BrTyr和3, 5-diBrTyr迅速生成, 光照0.5 h即有显著的形成量, 之后经过一个快速衰减过程过渡到慢速衰减过程, 光反应7.5 h时, 浓度分别降低为7.38、5.72 μg·L-1.这是由于高浓度的Fe(Ⅲ)使3-BrTyr快速地发生光化学降解, 因此, 在溶液中的累积量减少.当Fe(Ⅲ)浓度为3.70 mg·L-1时, 光反应1 h, 3-BrTyr的浓度达到最大值, 之后维持稳定, 未见明显衰减.3, 5-diBrTyr的变化趋势与3-BrTyr类似, 3, 5-diBrTyr的最大值范围是1.12~8.79 μg·L-1.
3.3.2 pH对Tyr光转化的影响含Fe(Ⅲ)体系中, pH是光化学反应的重要影响因素.一般而言, 地表水的pH的范围为5~9, 而某些大气水, 如气溶胶和雨水, 可能由于含有硫酸和硝酸而呈现出更强的酸性(刘慧, 2011; 钟明洁等, 2009).为了考察溶液pH对Tyr光化学反应过程的影响, 保持其它反应条件不变, 分别调溶液pH在3.0~8.0之间进行6组光化学实验, 结果如图 6所示.从图 6可见, pH对Tyr光化学反应的影响很大, 随着pH的升高, Tyr迅速降解之后处于缓慢衰减过程, 而两种溴代产物3-BrTyr和3, 5-diBrTyr的形成量也减少.3, 5-diBrTyr在高pH条件下的形成量低于仪器的检出限(2.23 ng), 因此, 图 6c没有给出它的浓度.这可能是由于pH可以影响Fe(Ⅲ)溶液中Fe(Ⅲ)物种, 从而影响溶液中·OH含量(Zhao et al., 2015), 而溶液中·OH是Tyr光化学转化的重要因素, 当pH升高时, Fe(Ⅲ)溶解度下降且·OH产量显著降低, 从而造成低的吸光效率, Tyr向3-BrTyr和3, 5-diBrTyr转化减慢;同时, 由于Tyr光降解中间产物吸收光子能量的原因(Remucal et al., 2011), Tyr在高pH条件下缓慢降解, 所以高的pH不利于Tyr的光降解及溴代反应(Remucal et al., 2011).虽然溴代产物在高pH条件下的形成量显著低于低pH条件下的形成量, 但不可否认Tyr的光致溴代反应在地表水pH条件下可以发生.
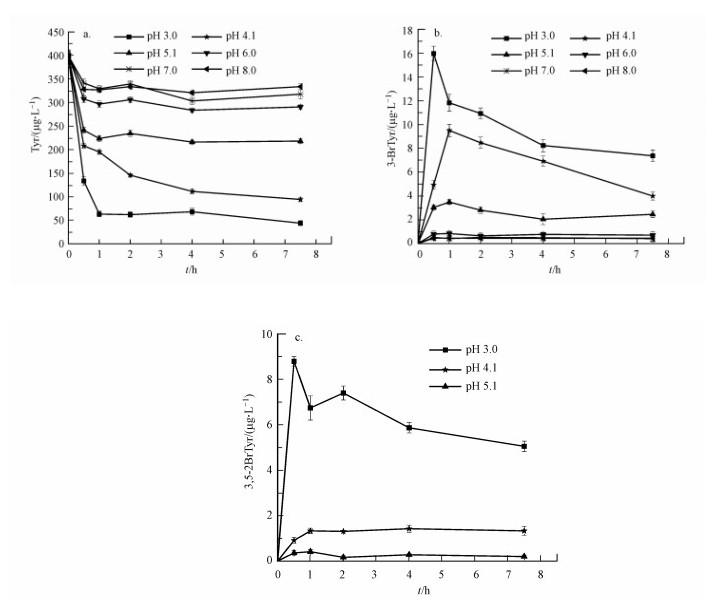 |
| 图 6 pH对Tyr光降解(a)及形成3-BrTyr (b)、3, 5-diBrTy (c)的影响 ([Br-]=0.61 g·L-1, [Fe(Ⅲ)]=14.56 mg·L-1) Fig. 6 The variation of Tyr(a), 3-BrTyr (b) and 3, 5-diBrTyr (c) under different pH in the presence of 14.56 mg·L-1 Fe(Ⅲ) and 0.61 g·L-1 Br- |
本文主要研究了在模拟自然光照射下发生的光致溴代反应及其影响因素, 结果表明, 汞灯(λ > 290 nm)照射下, 0.40 mg·L-1的Tyr在含0.61 g·L-1 Br-和14.56 mg·L-1 Fe(Ⅲ)的溶液中发生光致溴代反应, 形成Tyr的溴代产物3-BrTyr和3, 5-diBrTyr.随着Fe(Ⅲ)浓度增加, 溴代产物的形成量逐渐增加.在pH=3.0的条件下, Fe(Ⅲ)浓度分别为3.70、7.28和14.56 mg·L-1的溶液中, 形成的3, 5-diBrTyr最大浓度分别为15.97、10.45和3.13 μg·L-1, 而3, 5-2BrTy的最大浓度分别为8.79、6.67和1.12 μg·L-1. Fe(Ⅲ)浓度为14.56 mg·L-1时, pH对Tyr光化学反应的影响很大.3-BrTyr和3, 5-diBrTyr的形成量随着pH升高而减少, 而Tyr的光降解速率也随着pH升高而减慢.这说明在自然环境中, 尤其是海洋环境, Tyr能通过光转化形成溴代有机污染物, 本研究对于部分有机卤代物的天然来源研究具有重要的科学参考价值.
Dorneles P R, Lailson-Brito J, Secchi E R, et al. 2015. Levels and profiles of chlorinated and brominated contaminants in Southern Hemisphere humpback whales, Megaptera novaeangliae[J]. Environmental Research, 138: 49–57.
DOI:10.1016/j.envres.2015.02.007
|
Gannamani B, Shin J. 2016. Kinetic method analysis of the effect of halogenation on relative proton affinity of tyrosine[J]. Helvetica Chimica Acta, 99(3): 181–186.
DOI:10.1002/hlca.201500208
|
Hauler C, Vetter W. 2015. A non-targeted gas chromatography/electron capture negative ionization mass spectrometry selected ion monitoring screening method for polyhalogenated compounds in environmental samples[J]. Rapid Communications in Mass Spectrometry, 29(7): 619–628.
DOI:10.1002/rcm.7143
|
How Z T, Linge K L, Busetti F, et al. 2017. Chlorination of amino acids:Reaction pathways and reaction rates[J]. Environmental Science & Technology, 51(9): 4870–4876.
|
金梨娟, 陈宝梁. 2017. 环境中卤代有机污染物的自然来源、背景浓度及形成机理[J]. 化学进展, 2017(9): 1093–1114.
|
Khalil M A K, Rasmussen R A. 1999. Atmospheric methyl chloride[J]. Atmospheric Environment, 33(8): 1305–1321.
DOI:10.1016/S1352-2310(98)00234-9
|
Koshikawa M K, Takamatsu T, Takada J, et al. 2007. Distributions of dissolved and particulate elements in the Yangtze estuary in 1997-2002:Background data before the closure of the Three Gorges Dam[J]. Estuarine, Coastal and Shelf Science, 71(1/2): 26–36.
|
刘慧. 2011. 水环境中卤代酚类有机污染物的光化学形成过程[D]. 大连: 大连理工大学. 43-60
http://cdmd.cnki.com.cn/Article/CDMD-10141-1011109307.htm |
Méndez-Díaz J D, Shimabuku K K, Ma J, et al. 2014. Sunlight-driven photochemical halogenation of dissolved organic matter in seawater:a natural abiotic source of organobromine and organoiodine[J]. Environmental Science & Technology, 48(13): 7418–7427.
|
Murphy C. 2003. A Review New frontiers in biological halogenation[J]. Journal of Applied Microbiology, 94(4): 539–548.
DOI:10.1046/j.1365-2672.2003.01900.x
|
Pająk M, Pałka K, Winnicka E, et al. 2016. Syntheses of halogen derivatives of L-tryptophan, L-tyrosine and L-phenylalanine labeled with hydrogen isotopes[J]. Journal of Labelled Compounds and Radiopharmaceuticals, 59(1): 4–8.
DOI:10.1002/jlcr.v59.1
|
欧晓霞. 2008. 腐殖酸及其不同级分和铁的络合物对阿特拉津光降解的影响[D]. 大连: 大连理工大学. 57-83
http://cdmd.cnki.com.cn/Article/CDMD-10141-2009041174.htm |
Remucal C K, Mcneill K. 2011. Photosensitized amino acid degradation in the presence of riboflavin and its derivatives[J]. Environmental Science & Technology, 45(12): 5230–5237.
|
Sim W, Lee S, Lee I, et al. 2009. Distribution and formation of chlorophenols and bromophenols in marine and riverine environments[J]. Chemosphere, 77(4): 552–558.
DOI:10.1016/j.chemosphere.2009.07.006
|
孙岩. 2012. 南黄海和胶州湾海水中溶解氨基酸的分布与组成研究[D]. 青岛: 中国海洋大学. 16-31
http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505180.htm |
Vione D, Maurino V, Minero C, et al. 2005. Phenol chlorination and photochlorination in the presence of chloride ions in homogeneous aqueous solution[J]. Environmental Science & Technology, 39(13): 5066–5075.
|
Wang T, Rabe P, Citron C A, et al. 2013. Halogenated volatiles from the fungus Geniculosporium and the actinomycete Streptomyces chartreusis[J]. Beilstein Journal of Organic Chemistry(1): 2767–2777.
|
Weyl D A, Murfin D. 1966. Fluorescence of Photo-degraded Tyrosine Solutions[J]. Nature, 212(5065): 921–922.
DOI:10.1038/212921a0
|
姚昕, 朱广伟, 秦伯强. 2010. 太湖北部水体溶解性氨基酸分布特征及其环境意义[J]. 中国环境科学, 2010, 30(10): 1402–1407.
|
Yu L, Luo X, Zheng X, et al. 2013. Occurrence and biomagnification of organohalogen pollutants in two terrestrial predatory food chains[J]. Chemosphere, 93(3): 506–511.
DOI:10.1016/j.chemosphere.2013.06.023
|
阴永光, 刘景富, 江桂斌. 2011. 海洋环境中的天然溴代有机物[J]. 化学进展, 2011, 23(1): 254–260.
|
Zhao Q, Zhao H, Quan X, et al. 2015. Photochemical formation of hydroxylated polybrominated diphenyl ethers (OH-PBDEs) from polybrominated diphenyl ethers (PBDEs) in aqueous solution under simulated solar light irradiation[J]. Environmental Science & Technology, 49(15): 9092–9099.
|
钟明洁, 陈勇, 胡春. 2009. 水溶液中嗪草酮的光化学行为研究[J]. 环境科学学报, 2009, 29(7): 1470–1474.
|
 2018, Vol. 38
2018, Vol. 38


