木质纤维素是一种丰富的可再生资源,占全球光合作用产物总量的一半以上,在我国具有种类多、分布广、数量大等特点(刘艺,2015;李红亚等,2015).如何充分利用这些资源而又不污染环境,是当代农业面临的难题.植物纤维质原料结构坚硬、难以降解(El-Mastry,1983),如果对其的处理方法不妥当,就会造成资源浪费,严重时则会污染环境.采用物理或化学手段处理木质纤维素普遍存在着投入成本高、利用不充分、有害副产物多等问题(张木明等,2006;黄根树等,2015),因此, 高效、环保的微生物法被日益采用.以往人们通过微生物法预处理木质纤维素只注重单菌的纯培养(王士强等,2010),而复合菌系相较于纯种菌处理纤维素具有更多的优势(涂漩等,2004;张宁等,2011),复合菌系中微生物协作共生的关系大大提高了它们对纤维素的降解能力(Zhang et al., 2011),利用复合菌系降解木质纤维素已受到广泛关注,如崔宗均等(2002)以高温堆肥为原料构建了一组纤维素降解复合菌系MC1,并对该菌系中微生物的协同降解过程进行了研究.
目前关于复合菌系中微生物多样性的研究均通过变性梯度凝胶电泳等非培养技术(田敏,2013;付琳琳等,2004),具有一定的局限性.高通量测序技术研究微生物群落占有明显的优势,高通量测序技术又称第二代测序技术,它能够对几百万至十亿条DNA分子一次性地进行测序,具备高通量、准确定量、速度快等优点(陈泽斌等,2016),该特性有利于对物种的转录组或基因组进行细致、深入的分析,与非培养法及传统的纯培养方法相比,它能够产生更大深度的数据量(陈泽斌等,2015).因此也有人把它称为深度测序(Schuster,2008;骋飞等,2010).已在分子生物学领域有广泛应用(Maccallum et al., 2009),如水中微生物、人体微生物及土壤微生物等领域(王林等,2016;Andersson et al., 2008).梯度稀释法,即通过对菌群逐步稀释,人为的创造适宜生长条件,使其大量繁殖,随着稀释的进行可能造成一些菌的流失(陈艳琼等,2015).
近几年迅速发展的高通量测序技术能检测到许多低丰度内生细菌种类(陈娜等,2014),目前该技术应用于纤维素复合菌系的研究鲜有报道,本研究首次采用梯度稀释法结合高通量测序技术对富集构建的可对农业废弃物猪粪和稻秆高效降解的复合菌系进行微生物多样性及关键功能菌分析,运用高通量测序技术探索复合菌系中微生物多样性及关键功能菌,为木质纤维素类废弃物资源化利用奠定了理论基础.
2 材料及方法(Materials and methods) 2.1 培养基与主要试剂富集(PCS)培养基(g·L-1):碳酸钙3.0、蛋白胨5.0、酵母膏1.0、氯化钠5.0、猪粪6.0、稻秆4.0、pH 7.6.
发酵培养基的组成(g·L-1):碳酸钙3.0、蛋白胨5.0、酵母膏1.0、氯化钠5.0、猪粪6.0、稻秆4.0、滤纸2.0、pH 7.6.
基本培养基:蛋白胨5.0 g·L-1、酵母膏1.0 g·L-1、氯化钠5.0 g·L-1、pH 7.6, 灭菌备用.
2.2 纤维素降解复合菌系的构建从秸秆地、稻田地等采集了12个土样,每个土样分别称取10 g,加入含90 mL PCS培养基的锥形瓶中,55 ℃静置培养,以滤纸作为分解的外观指标,待滤纸完全降解,按10%接种量进行传代培养,在传代培养过程中,舍弃不能降解的培养液,选取滤纸降解的比较完全的培养液,并按照一定的方式进行混合,将混合液接入到新的PCS培养基中培养,保留降解效果最好的的培养液,经连续传代培养后,得到一组高效稳定的可分解猪粪和稻秆的纤维素降解复合菌系(即原始复合菌系).
2.3 复合菌系降解稀释临界点的确定将原始复合菌系进行活化,置55 ℃培养箱培养40 h,滤纸完全降解,即获得活化液.取10 mL活化液加入到含90 mL基本培养基的锥形瓶中,即得到梯度为10-1的稀释液;在此基础上依次可得到10-3、10-5、10-7、10-9稀释梯度的稀释液(张全国等,2011).将原始菌液、10-1、10-3、10-5、10-7、10-9稀释液,按10%的接种量(v/v)分别接种于发酵培养基中,每个梯度3个重复,另设未加种子液的培养基为空白对照,在55 ℃培养箱静置培养,通过肉眼观察在不同稀释梯度下滤纸的降解情况,并测定不同稀释梯度下的培养液中滤纸酶(FPA)、羧甲基纤维素酶(CMC)酶活,酶活测定方法见参考文献(赵玉萍等,2006),最终通过滤纸的降解情况和酶活的变化情况确定复合菌系的降解稀释临界点.
2.4 基因组提取每个稀释梯度的培养液各取1.5 mL,离心收集菌体,采用溶菌酶进行细胞破壁,使用DNA提取试剂盒(TaKaRa, 大连)分别对每个样品进行基因组提取,并用0.8%琼脂糖凝胶电泳检查DNA的纯度和浓度.
2.5 16S rDNA-V4区的PCR扩增以基因组DNA为模板,使用16S rDNA-V4区特异引物515F(5′-GTTTCGGTGCCAGCMGCC GCGGTAA-3′)和806R(5′-GCCAATGGACTACH VGGGTWTCTAAT-3′)进行PCR扩增,反应条件:98 ℃ 2 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min.PCR产物用2%琼脂糖凝胶电泳检测,目的条带用DNA切胶回收试剂盒(TaKaRa, 大连)回收.
2.6 16S rDNA基因测序及分析DNA样品回收后,对样品进行检测;用检测合格的样品构建文库,使用融合引物进行PCR扩增,筛选片段;最后,用合格的文库进行cluster制备和测序,测序委托华大基因有限公司完成.
2.7 生物信息分析利用FLASH软件将序列拼接成Tags,将拼接好的Tags利用软件USEARCH(Edgar,2013)进行OTU聚类,对代表序列进行分类学分析,并在各个水平分析样品的群落组成;利用Mothur软件做稀释曲线分析样品复杂度;对Alpha多样性指数分析;利用R语言中的gplots制作热图;聚类分析利用QIIME软件进行.
3 结果与分析(Results and analysis) 3.1 复合菌系降解临界点的确定通过梯度稀释法对复合菌系进行10-1~10-9梯度稀释,可明显观察不同稀释梯度下的滤纸降解情况存在显著差异.实验表明,当接种原始菌液时,滤纸在40 h完全降解,而接种了稀释菌液的培养液中,滤纸降解所需时间延长,且稀释倍数越大,滤纸降解所需时间越长.稀释梯度为100~10-5的培养液中滤纸在一定时间内都可完全降解,而稀释梯度为10-7和10-9的培养液中的滤纸在第6 d未降解如图 1所示,即使进一步延长培养时间滤纸仍不能降解.由此推测复合菌系在稀释过程中,一些关键功能菌随着稀释倍数增大而流失.进一步对样品进行酶活测定(图 2),所测酶活是不同稀释水平下的培养液中滤纸完全降解时的酶活,在不同稀释梯度下,滤纸完全降解的时间不同,稀释倍数越高的情况下,滤纸降解所需的时间越长.从图 2可明显看出不同稀释梯度下发酵过程中滤纸酶酶活变化情况与CMC酶酶活变化情况基本一致,100~10-5的培养液中滤纸酶、CMC酶酶活较高,而稀释梯度为10-7、10-9的培养液(滤纸不能降解)中滤纸酶、CMC酶酶活基本为0.上述结果表明,复合菌系降解临界点为10-5,即稀释度小于10-5的培养液滤纸能够降解,当稀释度大于10-5的培养液滤纸不能降解.
 |
| 图 1 不同稀释梯度下培养液中滤纸降解情况 Fig. 1 Degradation of filter paper by the original or diluted consortiums (100~10-9) |
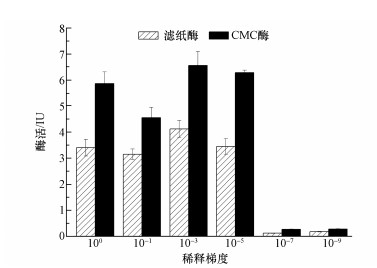 |
| 图 2 不同稀释梯度下培养液中滤纸酶、CMC酶酶活变化情况 Fig. 2 Changes of Fpase and CMCase activity by the original or diluted consortiums(100~10-9) |
通过对细菌的16S rDNA-V4区测序,总计测得原始序列条数为387813条,除掉低质量的序列后,共计有效条数为323053条,在97%相似度下将其聚类为OTU,共产生130个,经分析发现,OTU在各样品间丰度差异显著,其中Petrobacter属的OTUs约占50%,OTU数量最多可达到90,最少为36,表明复合菌系中微生物丰度很高,并且样品之间微生物丰度差异较大,各样品测序结果如表 1所示.基于OTU统计结果绘制稀释曲线,如图 3所示,随着测序数量的增加,各样品稀释曲线均基本趋于平缓,表明取样基本合理,置信度高,能够比较真实的反映样品的细菌群落.
| 表 1 各样品的OTU数量及Alpha多样性指数 Table 1 The number of OTUs and the Alpha diversity indexs of bacteria in each sample |
 |
| 图 3 稀释曲线 注A为原始菌液,B为稀释梯度为10-1,C为稀释梯度10-3,D为稀释梯度10-5,E为稀释梯度10-7,F为稀释梯度10-9,每个梯度有3个平行样,下同. Fig. 3 The rarafaction curve of the cellulose-degrading consortium |
OTU的丰度初步说明了样品的物种丰富程度,从表 1可知,随着稀释倍数的升高,OTU有显著下降趋势,A~D组的OTU处于77~90,E和F组的OTU处于36~57,表明A~D组(稀释梯度≤10-5)的物种丰度明显高于E和F组(稀释梯度 > 10-5),证实复合菌系在稀释过程中微生物组成发生了变化.各个样品Alpha多样性指数如表 1所示,Shannon指数、chao指数、ace指数越大,simpson越小,表明物种越丰富.A~D组(滤纸能够降解)的Shannon指数、chao指数、ace指数均高于E和F组(滤纸完全不能降解),A~D组的simpson指数均小于E和F组,进一步说明降解临界点10-5前的样品中微生物丰度高于临界点后的样品.
3.4 主成分分析图 4是基于OTU丰度的PCA分析,分析表明主成分1(PC1)和主成分2 (PC2)分别在样品差异性贡献率上达到57.63%和22.27%,合计达到80%,是差异的主要来源.不同颜色代表不同的样品,样品间距离代表其相似性,样品1、2、3、4(滤纸能够降解)均位于PC1的负值区域,位于PC2坐标轴正负两侧,较为靠近的位置,说明能够降解滤纸的样品间主成分差异不显著;而5和6(滤纸完全不能降解)分布比较分散,说明在降解临界点10-5前后的复合菌系中微生物组成存在显著差异.
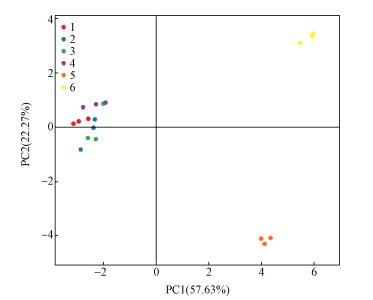 |
| 图 4 PCA分析图 Fig. 4 The analysis chart of PCA |
从图 5进化树可知,A、B、C、D(滤纸能够降解)物种组成发生聚类,E、F(滤纸完全不能降解)物种产生聚类,与上述PCA分析结果一致,即能够降解滤纸(稀释梯度≤10-5)的样品与不能降解滤纸(稀释梯度 > 10-5)的样品间物种组成不同.进一步说明在降解临界点10-5前后的复合菌系中微生物组成存在显著差异.
 |
| 图 5 样品在门水平的热图 Fig. 5 Heatmap of samples at phylum level |
图 5为门水平上的热图,不同颜色表示各门在样品中的丰度,进化树表明样品间的相似程度.从颜色分布可看出18个样品中细菌共分布在7个门,所占比例如图 5热图所示.厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为各样品中的优势菌门,而Firmicutes主要分支为起水解作用的梭菌属Clostridium,Thermotogae在A~C间的含量高,而该菌门在D~E含量逐渐减少,该菌门是嗜热细菌,可以利用碳水化合物产气(曹新垲等,2012);其他的门丰度较低,均小于0.5%,相对丰度由高到低依次为Cyanobacteria、Synergistetes、Bacteroidetes、Tenericutes、Cyanobacteria,它们协同发挥作用进而高效降解纤维素.进一步在属水平上分析,如图 6所示,平均丰度大于1%的有Petrobacter、Clostridium、Aneurinibacillus、S1等6个属,未知菌属(Unclassified)约占20%.Petrobacter是优势菌,在所有样品中约占50%,与OTUs分布结果一致.Clostridium(梭状芽孢杆菌属)在A~D组样品中约占15%~25%, 而E和F组中几乎不存在;很多菌属如Tepidimicrobium、Lutispora、Coprococcus及Defluviitalea在临界点10-5前都存在,而在临界点后样品中不存在,由此可推测,它们在复合菌系降解滤纸过程中起着重要的作用.其中Petrobacter为优势菌属,可以有效利用降解过程产生的中间产物,促进木质纤维素的降解(田敏,2013);据文献(Mbadinga et al. 2012)可知Defluviitalea sp.的发酵产物主要是醋酸酯、甲酸酯等,在降解过程中起辅助作用;Clostridium属在稀释梯度为10-7和10-9的培养液中消失的同时,复合菌系也失去了滤纸降解能力,如Tepidimicrobium、Lutispora均属于梭菌属菌群,为嗜热产酸菌(Shiratori et al., 2008;Niu et al., 2009),说明梭菌属Clostridium在降解过程发挥关键作用,这与很多研究的结论是类似的,如刘甲锋等(2010)发现厌氧梭菌Clostridium sp.可以通过分泌大量纤维素酶(滤纸酶、纤维素酶、木聚糖酶)来实现纤维素的有效降解.Jauris等(1990)发现Clostridium stercorarium是一种有效降解微晶纤维素的纤维素酶;刘爽(2009)在研究复合菌系木质纤维素降解特性时发现厌氧菌Clostridium islandicum strain AK1是功能微生物,且可以分解多糖类物质;已有报道称Clostridium thermosuccinogenes为厌氧嗜热细菌,发酵产物以琥珀酸和醋酸盐为初级代谢产物,以甲酸酯、乳酸和乙醇为次级代谢产物(Sridhar et al., 2001),由此证实梭菌属Clostridium是构建的复合菌系中关键降解菌属,在降解纤维素过程中起着重要作用.梭菌属Clostridium与Petrobacter、Defluviitalea协同发挥作用,值的注意的是其大量未确定分类的微生物(Unclassified),说明还有相当一部分未知分类和功能的微生物有待研究.本研究充分展示了纤维素降解复合菌系的微生物组成,并找到其关键功能菌属,为今后纤维素降解复合菌系的研究奠定基础.
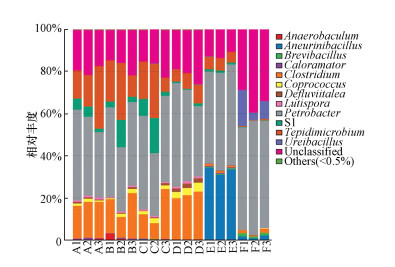 |
| 图 6 样品在属水平上细菌类群比较 Fig. 6 Comparison of bacteria groups in each sample at genus level |
1) 根据不同梯度下的滤纸降解情况及酶活变化情况,确定复合菌系的降解临界点为10-5.
2) 由高通量测序结果可知,Firmicutes和Proteobacteria为复合菌系的优势菌门,且降解临界点前后的样品中微生物组成显著不同.其中梭菌属Clostridium是复合菌系的关键功能属,它们与Petrobacter、Defluviitalea等菌属协同发挥降解作用.
Andersson A F, Lindberg M, Jakobsson H, et al. 2008. Comparative analysis of human gut microbiota bybarcoded pyrosequencing[J]. PLos One, 3(7): e2836.
DOI:10.1371/journal.pone.0002836
|
曹新垲, 杨琦, 郝春博. 2012. 厌氧污泥降解萘动力学与生物多样性研究[J]. 环境科学, 2012, 33(10): 3535–3541.
|
陈娜, 杨毅, 张澜, 等. 2014. Illumina高通量测序技术分析早产儿出生后肠道菌群变化的初步研究[J]. 中国循证儿科杂志, 2014, 9(5): 359–364.
|
陈艳琼, 阮灵伟. 2015. 深海热液区超嗜热古菌Thermococcus sp.TVG2的培养分离与鉴定[J]. 微生物学通报, 2015, 42(3): 467–477.
|
陈泽斌, 李冰, 王定康, 等. 2015. Illumina MiSeq高通量测序分析核桃内生细菌多样性[J]. 江苏农业学报, 2015, 31(5): 1129–1133.
|
陈泽斌, 李冰, 王定康, 等. 2016. 应用Illumina MiSeq高通量测序分析玉米内生细菌多样性[J]. 现代食品科技, 2016, 32(2): 113–120.
|
骋飞, 王英, 葛芹玉. 2010. 高通量DNA测序技术及其应用进展[J]. 南京晓庄学院学报, 2010, 26(3): 1–5.
|
崔宗均, 李美丹, 朴哲, 等. 2002. 一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J]. 环境科学, 2002, 23(3): 36–39.
|
Edgar R C. 2013. UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 10(10): 996.
DOI:10.1038/nmeth.2604
|
El-Masry H G. 1983. Utilization of Egyptian rice straw in production of cellulases and microbial protein:Effect of various pretreatments on yields of protein and enzyme activity[J]. Journal of the Science of Food and Agriculture, 34(7): 725–732.
DOI:10.1002/(ISSN)1097-0010
|
付琳琳, 李海星, 曹郁生, 等. 2004. 利用变性梯度凝胶电泳分析微生物的多样性[J]. 生物技术通报, 2004(2): 38–40.
|
黄根树, 孔令保, 王刚, 等. 2015. 纤维素降解复合菌系中纤维结合蛋白的分离及鉴定[J]. 环境科学学报, 2015, 35(4): 1026–1031.
|
Jauris S, Rücknagel K P, Schwarz W H, et al. 1990. Sequence analysis of the Clostridium stercorarium celZ gene encoding a thermoactive cellulase (Avicelase l):identification of catalytic and cellulose-binding domains[J]. MGG-Molecular and General Genetics, 223(2): 258–267.
|
李红亚, 李术娜, 王树香, 等. 2015. 解淀粉芽孢杆菌MN-8对玉米秸秆木质纤维素的降解[J]. 应用生态学报, 2015, 26(5): 1404–1410.
|
刘甲锋. 2010. 水稻秸秆腐解复合菌系的筛选构建[D]. 北京: 中国农业科学院
http://cdmd.cnki.com.cn/Article/CDMD-82101-2010171247.htm |
刘爽. 2009. 复合菌系降解木质纤维素特性及其菌群动态[D]. 哈尔滨: 东北农业大学
http://cdmd.cnki.com.cn/Article/CDMD-10224-2009219481.htm |
刘艺. 2015. 降解木质纤维素的嗜热霉菌和放线菌的筛选及其培养基的优化[D]. 太原: 山西大学
http://cdmd.cnki.com.cn/Article/CDMD-10108-1016001726.htm |
Maccallum I, Przybylski D, Gnerre S, et al. 2009. ALLPATHS 2:small genomes assembled accurately and with high continuity from short paired reads[J]. Genome Biology, 10(10): R103.
DOI:10.1186/gb-2009-10-10-r103
|
Mbadinga S M, Li K P, Zhou L, et al. 2012. Analysis of Alkane-dependent methanogenic community derived from production water of a high-temperature petroleum reservoir[J]. Applied and Environmental Biotechnology, 96(2): 531–542.
DOI:10.1007/s00253-011-3828-8
|
Niu L L, Song L, Liu X L, et al. 2009. Tepidimicrobium xylanilyticum sp. nov., an anaerobic xylanolytic bacterium, and emended description of the genus Tepidimicrobium[J]. International Journal of Systematic and Evolutionary Microbiology, 59(Pt 11): 2698–2701.
|
Schuster S C. 2008. Next-generation sequencing transforms today's biology[J]. Nature Methods, 5(1): 16.
DOI:10.1038/nmeth1156
|
Shiratori H, Ohiwa H, Ikeno H, et al. 2008. Lutispora thermophila gen. nov., sp. nov., a thermophilic, spore-forming bacterium isolated from a thermophilic methanogenic bioreactor digesting municipal solid wastes[J]. International Journal of Systematic and Evolutionary Microbiology, 58(Pt 4): 964–969.
|
Sridhar J, Eiteman M A. 2001. Metabolic flux analysis of clostridium thermosuccinogenes:effects of pH and culture redox potential[J]. Applied Biochemistry and Biotechnology, 94(1): 51–69.
DOI:10.1385/ABAB:94:1
|
田敏. 2013. 高效纤维素降解复合菌系RXS的微生物多样性及关键功能菌初探[D]. 无锡: 江南大学
http://cdmd.cnki.com.cn/Article/CDMD-10295-1013309968.htm |
王林, 李冰, 朱健. 2016. 高通量测序技术在人工湿地微生物多样性研究中的研究进展[J]. 中国农学通报, 2016, 32(5): 10–15.
DOI:10.11924/j.issn.1000-6850.casb15090065 |
王士强, 顾春梅, 赵海红, 等. 2010. 木质纤维素生物降解机理及其降解菌筛选方法研究进展[J]. 华北农学报, 2010, 25(b08): 313–317.
|
涂漩, 薛泉宏, 司美茹, 等. 2004. 多元混菌发酵对纤维素酶活性的影响[J]. 工业微生物, 2004, 34(1): 30–34.
|
张木明, 徐振林, 张兴秀, 等. 2006. 预处理对稻草秸秆纤维素酶解产糖及纤维素木质素含量的影响[J]. 农产品加工·学刊, 2006, 58(3): 4–6.
|
张宁. 2011. 高效厌氧纤维素降解菌复合菌系的构建及应用研究[D]. 石家庄: 河北师范大学
http://cdmd.cnki.com.cn/Article/CDMD-10094-1011147900.htm |
张全国, 张志萍, 赵民善, 等. 2011. 秸秆制氢过程中纤维素酶酶活测定方法研究[J]. 热科学与技术, 2011, 10(1): 35–40.
|
Zhang Q H, He J, Tian M, et al. 2011. Enhancement of methane production from cassava residues by biological pretreatment using a constructed microbial consortium[J]. Bioresource Technology, 102: 8899–8906.
DOI:10.1016/j.biortech.2011.06.061
|
赵玉萍, 杨娟. 2006. 四种纤维素酶酶活测定方法的比较[J]. 食品研究与开发, 2006(3): 116–118.
|
 2018, Vol. 38
2018, Vol. 38


