四氯化碳(CCl4)是一种有微甜味的无色液体, 易挥发, 不溶于水, 化学性质稳定, 常作为重要的工业原料和溶剂, 被广泛应用于制药、化工、清洁、皮革等行业.CCl4通过挥发、泄漏和排放废水等途径进入环境后, 因其生物毒性和在自然环境中的稳定性, 会对生态环境造成持续的危害.因此, CCl4已被美国环境保护局(EPA)列为优先控制污染物(Hua et al., 1996;刘永娟等, 2005).
对含CCl4废水的修复研究目前已受到人们的普遍关注(陈静等, 2017), 物理方法(如蒸汽汽提和活性炭吸附(Tan et al., 2009;Choe et al., 2001))、生物学方法(如单一的微生物处理(王震等, 2017)和联合生化处理)、化学方法(包括氧化和还原(Bas et al., 2010))均已被成功地应用于CCl4废水的处理中.但物理化学氧化和生物方法都存在一定的局限性(高乃云等, 2003).CCl4易于化学还原, 且还原转化后的产物对后续的微生物的毒性和抑制性都会大大降低, 进而提高了生物可降解性.
1994年Gillham首次用零价铁还原降解水中的氯代脂肪族化合物(Gillham et al., 1994).零价铁作为渗透反应墙的活性成分, 可用于固定和去除污染物(Lv et al., 2014).纳米零价铁(nZVI)具有比表面积大、粒度小的特点, 已被成功地应用于氯代有机化合物的还原脱氯(和婧等, 2015;张永祥等, 2017), 具体过程如下:

|
(1) |
但nZVI仍存在易于氧化钝化、颗粒易团聚等问题(Yu et al., 2012; Wu et al., 2009), 这在很大程度上限制了nZVI的应用规模.为了解决nZVI容易聚积和钝化的问题, 本研究拟用Fe3O4纳米颗粒作为载体, Fe3O4纳米颗粒的磁性可以使nZVI紧贴在其表面上, 提高nZVI的分散性, 优化纳米材料的分离问题, 稳定Fe0@Fe3O4和CCl4水溶液的反应体系(Zhang et al., 2009; Xing et al., 2011).目前已有将nZVI/Fe3O4用于PBDEs的脱溴(Tan et al., 2014)和重金属铬(Ⅲ)去除(Lv et al., 2014)的相关研究, 但将Fe0@Fe3O4应用于氯代有机化合物的修复研究较少见.此外, 超声空化可产生瞬间高温高压, 能够加快化学反应的发生, 已成为辅助化学反应的有效方法, 近年来受到人们的普遍关注(张军等, 2015;李承轩等, 2014).然而, 目前对超声协同Fe0@Fe3O4降解CCl4的研究在国内外尚不多见.
基于此, 本研究通过共沉淀法制备Fe0@Fe3O4, 探究不同反应条件如Fe0@Fe3O4投加量、超声功率、初始pH值、温度和初始CCl4浓度对CCl4去除率的影响.同时, 对Fe0@Fe3O4降解CCl4反应进行伪一级动力学拟合, 比较nZVI、Fe3O4和Fe0@Fe3O4纳米粒子在最优条件下对CCl4的去除能力, 并对反应机理进行分析.
2 材料与方法(Materials and methods) 2.1 试剂与仪器试剂:CCl4、FeSO4 · 7H2O、Fe2(SO4)3、NaOH、NaBH4等均为分析纯.
仪器:LGJ-10D冷冻干燥机、D40-2F型电动搅拌机、HH-S数显恒温油浴锅、SHA-B恒温水浴振荡器、BT100-1J蠕动泵驱动器、pH计(Thermo, star-A211pH计)、KQ-500VDE型超声波清洗器、Aquelix5去离子水制水机、TDL-5离心机、FA1004分析天平、GC-2014气相色谱仪(日本岛津公司)、扫描电子显微镜(SEM)(Carl-Zeiss, Oberkochen, Germany)、自动吸附仪(BET)(Micromertics Tri Star 3000, America).
2.2 纳米Fe0@Fe3O4的制备Fe3O4颗粒采用共沉淀法中的Massart水解法制备(Huang et al., 2012).具体操作为:将油浴锅温度调至80 ℃; 配制含5 g NaOH的溶液(250 mL)置于四口圆底烧瓶反应器中, 搅拌并连续通入氮气使反应器处于无氧状态; 配制含5 g Fe2(SO4)3和6.95 g FeSO4 · 7H2O的溶液250 mL, 将此混合液通过蠕动泵以1 mL · min-1的速度滴入反应器, 与反应器中的NaOH溶液反应后生成Fe3O4颗粒, 反应机理如式(2)所示.加液装置中的溶液持续滴加反应1.5 h后, 为保证反应充分继续搅拌0.5 h.之后将反应器移出油浴锅, 使Fe3O4颗粒冷却沉淀, 用去离子水洗涤2遍后, 离心分离, 最后真空干燥备用.
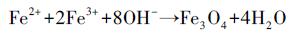
|
(2) |
在恒温并连续通氮气(0.1 L · min-1)的条件下, 将含0.17 g NaBH4的溶液(250 mL)逐滴加入装有0.5 g Fe3O4颗粒和等体积含0.62 g FeSO4 · 7H2O水溶液的1000 mL四口烧瓶中, 同时以400 r · min-1的速度搅拌, 即制得Fe0@Fe3O4 (Xu et al., 2013).具体反应机理如式(3)所示.通过磁力分离收集Fe0@Fe3O4, 并用曝气除氧的超纯水洗涤至pH值呈中性.最后, 真空冷冻干燥并在氮气保护下备用.
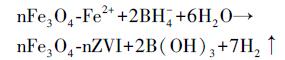
|
(3) |
用气相色谱(GC-2014, Shimadzu, Japan)检测样品中CCl4的浓度.测试条件为:Rtx-1毛细管色谱柱(Restek, 30 m×0.25 μm×0.25 mm, USA), 电子捕获检测器(ECD), 以高纯氮气(99.99%)为载气, 柱箱升温程序为:初始40 ℃保持5 min后, 以8.0 ℃ · min-1升温至100 ℃, 然后以6.0 ℃ · min-1的速率升温至200 ℃, 保持10 min, 进样口和检测器的温度分别为220 ℃和320 ℃.取样量为1 mL, 用CCl4标准溶液绘制校准曲线进行校准.
通过批实验研究不同因素对Fe0@Fe3O4去除CCl4反应的影响.将一定量的CCl4储备溶液(400 mg · L-1)和Fe0@Fe3O4颗粒加入到120 mL的血清瓶中, 然后用Teflon丁基塞与铝盖双重密封.空白样品(不添加纳米颗粒)与上述处理相同.为了便于取样并减少误差, 每个实验设置3个平行样.定时取样, 并用0.22 μm的滤膜过滤(何小娟等, 2003).
扫描电镜的参数为:分辨率为1.0 nm(15 kV)、1.3 nm(1 kV), 倍率为80~2000000.
BET表征方法:吸附前先在200 ℃下真空脱附3 h, 然后于-196 ℃下吸附液氮饱和, 利用BET方法计算比表面积, 采用BJH方法计算孔分布曲线.
3 结果分析(Results and discussion) 3.1 Fe0@Fe3O4的表征 3.1.1 SEM表征图 1为经过液相还原法制得的nZVI和壳核型Fe0@Fe3O4的SEM图.由图 1a可知, nZVI的单个粒径约为200~400 nm, 呈不均匀球状, 表面粗糙, 颗粒间聚合现象严重, 紧密相连, 团聚成块状.以Fe3O4为载体, nZVI附着在其表面上合成Fe0@Fe3O4复合颗粒(图 1b), 主要粒径为100~300 nm, 比表面积增大, 聚集和钝化效应减轻, 因而其颗粒在水中的分散性更好(Zhu et al., 2009; Lv et al., 2011), Fe0@Fe3O4与四氯化碳水溶液反应体系的稳定性也有所增强.
 |
| 图 1 nZVI (a)及Fe0@Fe3O4复合材料(b)的SEM图像 Fig. 1 SEM images of nZVI(a) and Fe0@Fe3O4 composite(b) |
nZVI和Fe0@Fe3O4的氮吸附-解吸等温线和孔径分布曲线如图 2所示, 其BET表面积和平均孔径如表 1所示.根据BET分析可知, Fe0@Fe3O4的比表面积为66.788 m2 · g-1, 比nZVI(14.560 m2 · g-1)高出近4.6倍, 表明Fe3O4纳米颗粒作为载体可以增加比表面积.复合材料表面的变化增加了反应面积并提供更多的活性点位, 从而提高了Fe0@Fe3O4对CCl4的还原脱氯性能.
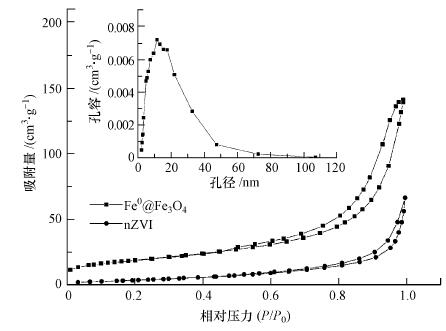 |
| 图 2 nZVI和Fe0@Fe3O4复合材料的氮吸附-解吸等温线和Fe0@Fe3O4复合材料的孔径分布曲线 Fig. 2 Nitrogen adsorption-desorption isotherms for nZVI and Fe0@Fe3O4 composite and pore size distribution curve of for Fe0@Fe3O4 composite |
| 表 1 nZVI和Fe0@Fe3O4纳米颗粒的BET表面积和平均孔径 Table 1 BET surface area and average pore diameter of nZVI and Fe0@Fe3O4 nanoparticles |
根据Brunauer-Deming-Deming-Teller(BDDT)分类方法, 对比图 2可以看出, Fe0@Fe3O4的氮吸附-解吸等温线为Ⅳ型, 且在P/P0=0.5处出现H3型滞后环.由孔径分布曲线可知, Fe0@Fe3O4平均孔隙宽度为12.786 nm, 孔体积为0.237 cm3 · g-1, 孔径分布范围窄.根据IUPAC的分类方法(Duarte et al., 2009), 中孔材料的孔隙宽度在2~50 nm范围内.因此, Fe0@Fe3O4具有典型性中孔结构(And et al., 2001).
3.2 批实验 3.2.1 Fe0@Fe3O4投加量的影响在CCl4初始浓度为2.0 mg · L-1, 超声功率为300 W, 反应温度为30 ℃, 溶液初始pH为7.0的条件下, 向每100 mL CCl4溶液中分别加入不同量(0.4、0.5、0.6、0.7和0.8 g · L-1)的Fe0@Fe3O4, 考察CCl4去除率随时间的变化关系, 结果见图 3.由图 3可知, 在相同的降解时间内, Fe0@Fe3O4投加量不同, CCl4降解去除率也不相同, 但总的趋势是随Fe0@Fe3O4投加量的增多, CCl4去除率也相应增大.当降解反应达到60 min时, 5种Fe0@Fe3O4投加量条件下CCl4的去除率分别达到67.6%、88.5%、90.6%、92.7%和94.5%.这是因为随着Fe0@Fe3O4投加量的增加, 参与反应的nZVI总量和总表面积增加, 为CCl4的还原脱氯提供了更多的自由电子, 使CCl4的降解更加彻底(胡劲召等, 2005).
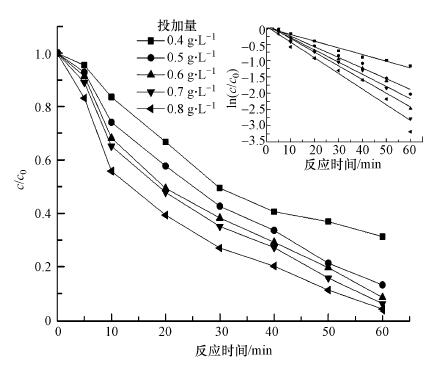 |
| 图 3 Fe0@Fe3O4投加量对CCl4降解的影响及不同投加量下CCl4降解的动力学拟合 Fig. 3 Effect of Fe0@Fe3O4 dosage on CCl4 degradation and kinetic fitting of CCl4 degradation under different dosages |
表 2为不同Fe0@Fe3O4投加量下CCl4降解的伪一级动力学拟合结果.当Fe0@Fe3O4投加量为0.4 g · L-1时, 由于缺乏反应点位, 反应速率相对较慢, 伪一级动力学常数k值较低为0.0201 min-1.当Fe0@Fe3O4投加量为0.5 g · L-1时, k值为0.0329 min-1, 提高了0.0128 min-1.当Fe0@Fe3O4投加量继续增加时, 过量的催化剂会与水反应, 产生大量的氢气.产生的氢气会附着在Fe0@Fe3O4颗粒的表面上, 阻遏CCl4与催化剂活性点位的接触, 不利于CCl4的还原脱氯.因此, 本研究催化剂的投加量选为0.5 g · L-1.
| 表 2 Fe0@Fe3O4投加量对CCl4降解的伪一级动力学参数 Table 2 Pseudo first order kinetics parameter of CCl4 degradation under different Fe0@Fe3O4 dosages |
在保持反应温度为30 ℃, pH为7.0, CCl4初始浓度为2.0 mg · L-1的条件下, 控制Fe0@Fe3O4的投加量为0.5 g · L-1, 将超声功率进行调变, 考察超声功率的变化对CCl4降解率的影响, 结果见图 4.由图可知, 反应5 min内, 4种超声功率(200、250、300、350 W)所对应的CCl4去除率分别为8.4%、9.7%、15.4%、11.4%. 200和250 W两种功率下的去除率差别不大, 超声功率为300和350 W时, 相同降解时间内CCl4的去除率明显高于200和250 W时.反应30 min时, 随着超声功率的增加, CCl4的去除率逐渐增加, 分别达到43.2%、50.3%、71.7%、69.8%.300和350 W的功率条件对CCl4降解的促进效果变得更为显著.降解反应60 min时, 200、250、300、350 W 4种功率下的去除率依次升至56.3%、68.9%、89.7%、91.3%.总体来说, 随着超声功率的增加, CCl4的去除率也逐步增加.同样地, 随着反应的进行, CCl4浓度逐渐降低, 去除率的增长明显变缓.
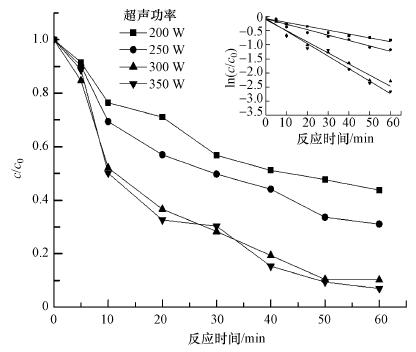 |
| 图 4 超声功率对CCl4降解的影响及不同超声功率下CCl4降解的动力学拟合 Fig. 4 Influence of ultrasound power on CCl4 degradation rate and kinetic fitting of CCl4 degradation under different ultrasound powers |
表 3所示为不同超声功率下CCl4降解的伪一级动力学拟合结果.4种超声功率下线性拟合结果的R2值均大于0.9.200和250 W时的k值较小, 说明反应速率较慢, 半衰期较长; 300 W时的k值为0.0394 min-1, 半衰期为17.59 min, 比200 W时的k值增加了0.0256 min-1, 半衰期减少了32.63 min.当超声功率为300和350 W时, 反应速率和半衰期差距较小.因此, 从技术、经济的角度来看, 本研究选择超声功率为300 W.
| 表 3 不同超声功率下CCl4降解的伪一级动力学拟合 Table 3 Pseudo first order kinetic fitting of CCl4 degradation under different ultrasound powers |
控制Fe0@Fe3O4投加量为0.5 g · L-1, 超声功率为300 W, 应温度为30 ℃, CCl4初始浓度为2.0 mg · L-1, 而将pH分别设置为3.5、5.0、7.0、8.5和10.0, 所得CCl4去除率随时间的变化关系见图 5.分析图 5可知, 在降解反应起始后的10 min内, pH为3.5、5.5、7.0、8.5和10.0条件下的CCl4去除率依次为50.5%、43.4%、30.5%、24.5%和16.7%, 在pH=3.5的酸性条件下CCl4去除率最高.降解时间进行至60 min时, 上述5个pH条件下CCl4去除率分别为93.7%、92.4%、88.7%、80.4%和68.2%, 即呈现出CCl4去除率随着pH值增加而降低的趋势.初始pH为3.5时的去除率为93.7%, 去除效果最好.而在碱性条件下, pH从7.0至8.5, 去除率降低8.3%, 在初始pH为10.0时最终降至68.2%, 与pH为3.5时相比下降了25.5%.但除pH值为10.0以外, 去除率都大于80.0%, 表明Fe0@Fe3O4颗粒可以适应的pH值范围较宽.
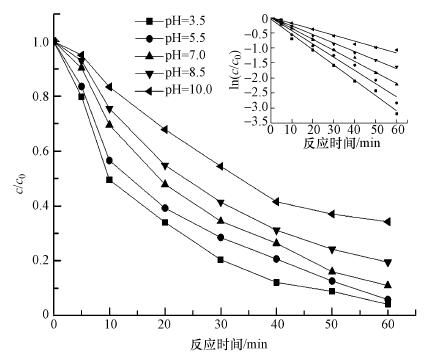 |
| 图 5 pH对CCl4降解的影响及不同pH下CCl4降解的动力学拟合 Fig. 5 Effect of pH on CCl4 degradation and kinetic fitting of CCl4 degradation under different pH values |
表 4为不同pH下CCl4降解的伪一级动力学拟合结果.5种pH下的线性拟合结果的R2值均大于0.9.当初始pH为3.5~10.0时, k为0.0501~0.0188 min-1, 反应速率随着pH的增加而减慢.这是因为在溶液pH高的条件下, 产生的氢氧化铁会附着在Fe0@Fe3O4表面, 阻碍反应的进行.当pH=3.5时, 平衡时间最短, 最终去除率最高(93.7%).在Fe0@Fe3O4的表面形成的氧化铁会在酸性条件下溶解, 促进还原脱氯.
| 表 4 不同pH下CCl4降解的伪一级动力学参数 Table 4 Pseudo first order kinetics parameter of CCl4 degradation under different pH values |
保持Fe0@Fe3O4投加量为0.5 g · L-1, 超声功率为300 W, pH为7.0, 且CCl4浓度为2.0 mg · L-1的条件下, 将反应温度分别设定为10、20、30、35和40 ℃, 所得CCl4的降解效果如图 6所示.由图可知, 温度越高对CCl4的降解效果越显著.温度为40 ℃时, 降解反应10 min, CCl4的去除率即可达到49.4%, 明显高于其他4个较低温度下的去除率(35、30、20、10 ℃对应的去除率分别为31.0%、22.6%、10.9%、8.1%).随着溶液中CCl4含量的减少去除率变化趋缓.降解60 min时, 40 ℃条件下的去除率可达94.2%, 已接近完全降解.可见, 温度对CCl4的降解影响比较显著.
 |
| 图 6 温度对CCl4降解的影响及不同温度下CCl4降解的动力学拟合 Fig. 6 Effect of temperature on CCl4 degradation and kinetic fitting of CCl4 degradation under different temperatures |
由表 5可知, Fe0@Fe3O4在不同温度下对CCl4的降解符合伪一级动力学方程, k值和半衰期随温度的变化波动较大.10 ℃时k值最小为0.0114 min-1, 半衰期最大为60.80 min.40 ℃时k值最大为0.0437 min-1, 半衰期最小为15.86 min.温度越高, Fe0@Fe3O4对CCl4的降解速率越快.因为温度升高会加快反应体系中CCl4分子的运动, 从而提高CCl4分子与Fe0@Fe3O4之间的相互作用和发生还原脱氯反应的几率, 进而使反应速率得到提高.周红艺等(2004)用Pd/Fe双金属降解间二氯苯时也发现了类似的规律, 因此, 增加温度可以促进Fe0@Fe3O4对CCl4的还原脱氯.
| 表 5 不同温度对CCl4降解的伪一级动力学参数 Table 5 Pseudo first order kinetics parameter of CCl4 degradation under different temperatures |
在Fe0@Fe3O4投加量为0.5 g · L-1, 超声功率为300 W, 温度为30 ℃, 溶液pH为7.0, CCl4初始浓度分别为1、2、3、4 mg · L-1的条件下, 研究初始CCl4浓度对去除率的影响, 结果如图 7所示.由图可知, Fe0@Fe3O4对CCl4的去除率随初始浓度的增大而减小.反应开始60 min后, 已基本达到平衡, CCl4的初始浓度为1、2、3 mg · L-1时, 去除率分别为95.8%、88.9%、81.9%, 均达到80%以上; 初始浓度为4 mg · L-1时, 去除率为74.8%.随着CCl4初始浓度的不断增大, 去除率逐渐降低.这可能是由于随着CCl4溶液初始浓度的升高, Fe0@Fe3O4的活性点位不足而引起的.
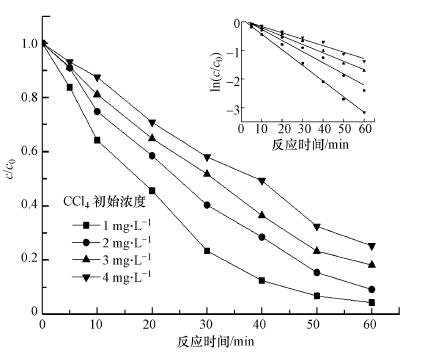 |
| 图 7 CCl4初始浓度的影响及不同CCl4初始浓度下降解的动力学拟合 Fig. 7 Effect of initial CCl4 concentrations and kinetic fitting of CCl4 degradation under different initial concentrations |
由表 6可知, 当CCl4初始浓度为1~4 mg · L-1时, 对应的降解速率常数k为0.0560~0.0238 min-1, 反应速率随着初始浓度的增加而下降.Fe0@Fe3O4的投加量一定, 反应活性点位的量保持恒定.随着CCl4初始浓度的增加, 会对活性点位产生竞争, 表明活性点位的不足可能阻碍还原脱氯的进一步进行, 使反应速率逐渐降低.
| 表 6 不同CCl4初始浓度下降解的伪一级动力学参数 Table 6 Pseudo first order kinetics parameter of CCl4 degradation under different concentrations |
将Fe3O4颗粒、nZVI和Fe0@Fe3O4的投加量分别定为0.5 g · L-1, 控制超声功率为300 W, pH=7.0, 温度为30 ℃, 且CCl4初始浓度为2 mg · L-1, 所得CCl4降解结果如图 8a所示.由图可知, 前10 min内, Fe0@Fe3O4催化体系的降解率可达30.5%, 而加入Fe3O4颗粒和nZVI的催化体系降解率分别为14.8%和6.8%.降解60 min时, nZVI、Fe3O4颗粒和Fe0@Fe3O4对CCl4的降解率分别为60.9%、13.2%和88.5%.当反应时间较短(60 min)时, Fe3O4颗粒对CCl4的去除主要取决于Fe3O4颗粒的吸附; 随着反应时间的延长, CCl4会逐渐解吸使浓度有所增加, 因此, Fe3O4对CCl4的降解效果不理想.由于nZVI存在团聚现象, 比表面积较小, 在反应体系中不易分散, 随着反应的进行nZVI表面有一定的钝化, 使得nZVI对CCl4的去除反应变缓.Fe3O4的加入大大提高了nZVI对CCl4的去除效率, 比单独nZVI体系提高了27.6%.主要是因为在Fe0@Fe3O4中, nZVI和Fe3+之间转换的过程中产生的Fe2+有还原能力, 从而使反应得以高效进行下去.
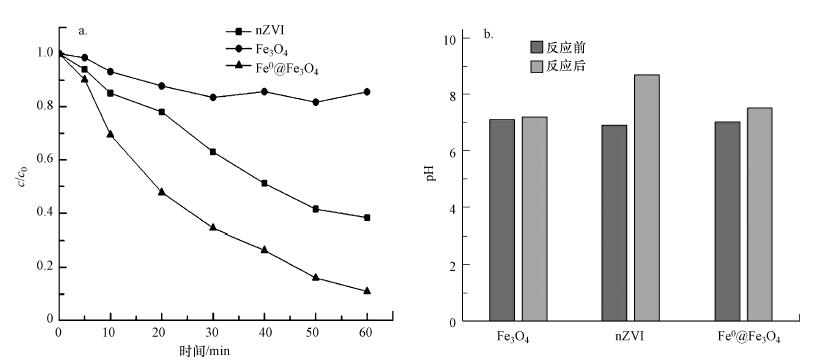 |
| 图 8 Fe3O4颗粒、nZVI和Fe0@Fe3O4对CCl4降解率的比较(a)及反应前后pH值的比较(b) Fig. 8 Comparison between Fe3O4, nZVI and Fe0@Fe3O4 on degradation of CCl4(a) and comparison on pH value before and after reaction(b) |
Fe3O4颗粒、nZVI和Fe0@Fe3O4对CCl4降解反应前后pH值的比较如图 8b所示.反应前溶液的pH值都是7.0±0.1.Fe3O4颗粒、nZVI和Fe0@Fe3O4反应后溶液的pH值分别为7.1、8.9和7.6.结合图 8a的CCl4降解结果可以看出, 在Fe3O4降解CCl4的反应体系中, 反应前后的pH值没有发生明显的变化.在nZVI降解CCl4的反应体系中, 降解60 min后的pH值变化较大为1.9.在Fe0@Fe3O4降解CCl4的反应体系中, 降解60 min后的pH值略有升高, 升高了0.6.
4 机理(Mechanism)Fe0@Fe3O4纳米颗粒的结构如图 9a所示.基于3种纳米颗粒的对比实验和以上的其他分析可知, nZVI在Fe0@Fe3O4对CCl4还原脱氯的过程中起主要作用.
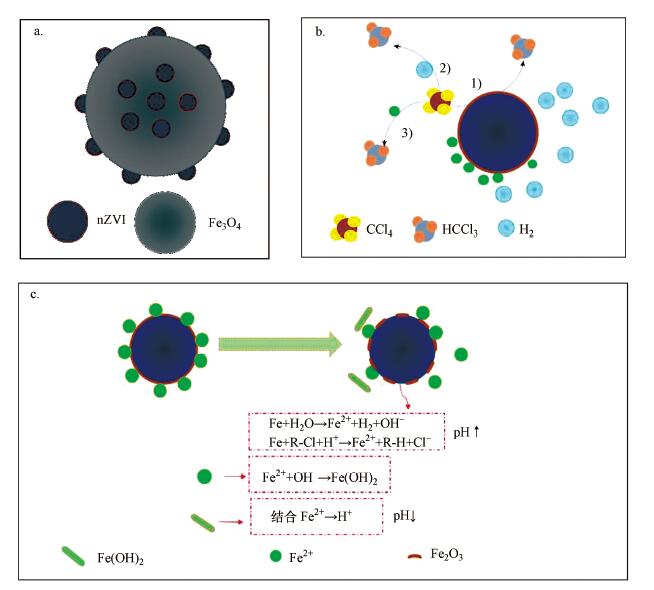 |
| 图 9 Fe0@Fe3O4纳米颗粒的结构示意图(a)、CCl4催化脱氯的概念模型(b)及溶液pH值的自缓冲(c) Fig. 9 The schematic structure of Fe0@Fe3O4 nanoparticles (a), conceptual models for the catalytic dechlorination of CCl4(b) and self-buffering of solution pH in the nZVI and water reducing system(c) |
图 9b为CCl4催化脱氯的概念模型.在Fe0@Fe3O4和水的还原体系中存在3种还原剂(nZVI、亚铁离子和氢气), Fe0@Fe3O4降解CCl4有3种反应路径:①氢解:nZVI表面直接与CCl4发生反应, 铁表面电子转移给CCl4使其发生脱氯反应(式(4)) (Matheson et al., 2009).②还原消除:nZVI腐蚀产生Fe2+的还原脱氯(式(5))(Liu et al., 2006).③加氢还原:厌氧状态下, H2O作为电子受体与nZVI反应产生H2, H2与CCl4反应使其还原脱氯(式(6)、(7)) (Lookman et al., 2009).体系中以上所有路径共存, 并由前两种主导.
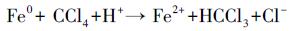
|
(4) |

|
(5) |
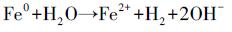
|
(6) |
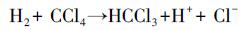
|
(7) |
由图 9c可知, Fe0@Fe3O4和水还原体系中存在溶液pH值的自缓冲(Li et al., 2015).随着nZVI腐蚀和CCl4还原脱氯, 产生Fe2+, 使溶液的pH值升高.同时, Fe2+与溶液中的OH-结合产生了氢氧化物, 以及Fe2+与氢氧化物的结合将会消耗碱度释放出H+, 使溶液的pH降低.
此外, Fe3O4具有磁性, 作为良好的载体吸引nZVI颗粒附着在其表面上, 克服聚集和表面钝化问题.Fe0@Fe3O4颗粒的介孔结构在特定位置形成不同的活性点位和反应物结合位点, 因此, 可以吸附更多污染物并被限制在特定的位置, 从而提高催化剂性能和降解效果.引入Fe3O4, 还可使Fe0@Fe3O4与nZVI、Fe3O4颗粒相比具有较高的Zeta电势, 且提高Fe0@Fe3O4复合材料的稳定性(Wu et al., 2009; Yoshioka et al., 1997).
综上所述, 以上因素共同维持体系的pH值稳定, 使CCl4脱氯过程持续进行.在这个系统中, nZVI起主要还原作用; Fe3O4颗粒作为载体, 加快了电子传递速率, 从而提高了nZVI的还原脱氯效果.
5 结论(Conclusions)1) 使用共沉淀法成功制备了Fe0@Fe3O4颗粒, 采用SEM和BET方法对其进行表征, 发现颗粒的主要粒径为100~300 nm, 比表面积为67.127 m2 · g-1.
2) 通过批实验确定最佳反应条件为:催化剂投加量0.5 g · L-1, 超声功率300 W, 初始pH值7.0, 温度30 ℃, CCl4初始浓度2 mg · L-1, 此时, 体系对CCl4的去除率为88.5%.
3) Fe0@Fe3O4、nZVI和Fe3O4颗粒对CCl4降解的对比试验表明, Fe0@Fe3O4的降解效果最佳.
And M K, Jaroniec M. 2001. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials[J]. Chemistry of Materials, 13(10): 3169–3183.
DOI:10.1021/cm0101069
|
Bae S, Lee W. 2010. Inhibition of nZVI reactivity by magnetite during the reductive degradation of 1, 1, 1-TCA in nZVI/magnetite suspension[J]. Applied Catalysis B Environmental, 96(1/2): 10–17.
|
陈静, 陈海, 金歆, 等. 2017. 纳米零价铁降解水中四氯化碳的试验研究[J]. 环境科学学报, 2017, 37(2): 610–616.
|
Choe S, Lee S H, Chang Y Y, et al. 2001. Rapid reductive destruction of hazardous organic compounds by nanoscale Fe0[J]. Chemosphere, 42(4): 367.
DOI:10.1016/S0045-6535(00)00147-8
|
Duarte F, Maldonado-Hódar F J, Pérez-Cadenas A F, et al. 2009. Fenton-like degradation of azo-dye Orange Ⅱ catalyzed by transition metals on carbon aerogels[J]. Applied Catalysis B Environmental, 85(3/4): 139–147.
|
高乃云, 李富生, 汤浅晶, 等. 2003. 水中三氯乙烯的去除研究进展[J]. 工业水处理, 2003, 23(9): 14–17.
DOI:10.11894/1005-829x.2003.23(9).14 |
Gillham R W, Blowes D W, OHannesin S F, et al. 1994. Use of Zero-Valent Metals in in-situ Remediation of Contaminated Ground Water[M]. Columbus, OH: Battelle Press: 1–5.
|
何小娟, 刘菲, 黄园英, 等. 2003. 利用零价铁去除挥发性氯代脂肪烃的试验[J]. 环境科学, 2003, 24(1): 139–142.
|
和婧, 王向宇, 王培, 等. 2015. PAA改性纳米铁强化还原降解水中亚甲基蓝[J]. 环境科学, 2015, 36(3): 980–988.
|
胡劲召, 陈少瑾, 吴双桃, 等. 2005. 零价铁对土壤中4-氯苯酚还原脱氯研究[J]. 生态环境, 2005, 14(3): 349–352.
|
Hua I, Hoffmann M R. 1996. Kinetics and mechanism of the sonolytic degradation of CCl4:intermediates and byproducts[J]. Environmental Science & Technology, 30(3): 864–871.
|
Huang R, Fang Z, Yan X, et al. 2012. Heterogeneous sono-Fenton catalytic degradation of bisphenol A by Fe3O4, magnetic nanoparticles under neutral condition[J]. Chemical Engineering Journal, 197(14): 242–249.
|
李承轩, 靳朝喜, 张军, 等. 2014. 超声协同下零价铁还原降解水溶液中的四氯化碳[J]. 河南科技大学学报(自然科学版), 2014, 35(2): 95–99.
|
Li W W, Huo Y C, Min D, et al. 2015. Zero-valent iron nanoparticle with sustained high reductive activity for carbon tetrachloride dechlorination[J]. Rsc Advances, 5(67): 54497–54504.
DOI:10.1039/C5RA07052J
|
刘永娟, 韩宝平, 王小英. 2005. 地下水四氯化碳污染现状与治理技术研究进展[J]. 水资源保护, 2005, 21(2): 5–8.
|
Liu C C, Tseng D H, Wang C Y. 2006. Effects of ferrous ions on the reductive dechlorination of trichloroethylene by zero-valent iron[J]. Journal of Hazardous Materials, 136(3): 706–713.
DOI:10.1016/j.jhazmat.2005.12.045
|
Lookman R, Bastiaens L, Borremans B, et al. 2004. Batch-test study on the dechlorination of 1, 1, 1-trichloroethane in contaminated aquifer material by zero-valent iron[J]. Journal of Contaminant Hydrology, 74(1/4): 133–144.
|
Lv X, Xu J, Jiang G, et al. 2011. Removal of chromium(Ⅵ) from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes[J]. Chemosphere, 85(7): 1204–1209.
DOI:10.1016/j.chemosphere.2011.09.005
|
Lv X, Xue X, Jiang G, et al. 2014. Nanoscale zero-valent Iron (nZVI) assembled on magnetic Fe3O4/graphene for Chromium (Ⅵ) removal from aqueous solution[J]. Journal of Colloid & Interface Science, 417: 51–59.
|
Matheson L J, Tratnyek P G. 1994. Reductive dehalogenation of chlorinated methanes by iron metal[J]. Environmental Science & Technology, 28(12): 2045.
|
Tan I A W, Ahmad A L, Hameed B H. 2009. Adsorption isotherms, kinetics, thermodynamics and desorption studies of 2, 4, 6-trichlorophenol on oil palm empty fruit bunch-based activated carbon[J]. Journal of Hazardous Materials, 164(2): 473–482.
|
Tan L, Lu S, Fang Z, et al. 2017. Enhanced reductive debromination and subsequent oxidative ring-opening of decabromodiphenyl ether by integrated catalyst of nZVI supported on magnetic Fe3O4, nanoparticles[J]. Applied Catalysis B Environmental,, 200: 200–210.
DOI:10.1016/j.apcatb.2016.07.005
|
王震, 李群, 王帆, 等. 2017. 白腐真菌对四氯化碳的降解及吸附性能研究[J]. 环境科学与技术, 2017, 40(2): 150–157.
|
Wu Y J, Zhang J H, Tong Y F, et al. 2009. Chromium (Ⅵ) reduction in aqueous solutions by Fe3O4-stabilized Fe0 nanoparticles[J]. Journal of Hazardous Materials, 172(2/3): 1640–1645.
|
Xing S, Zhou Z, Ma Z, et al. 2011. Characterization and reactivity of Fe3O4/FeMnOx, core/shell nanoparticles for methylene blue discoloration with H2O2[J]. Applied Catalysis B Environmental, 107(3/4): 386–392.
|
Xu J, Tan L, Baig S A, et al. 2013. Dechlorination of 2, 4-dichlorophenol by nanoscale magnetic Pd/Fe particles:Effects of pH, temperature, common dissolved ions and humic acid[J]. Chemical Engineering Journal, 231(17): 26–35.
|
Yoshioka K, Sakai E, Daimon M, et al. 1997. Role of steric hindrance in the performance of superplasticizers for concrete[J]. Journal of the American Ceramic Society, 80(10): 2667–2671.
|
Yu K, Gu C, Boyd S A, et al. 2012. Rapid and extensive debromination of decabromodiphenyl ether by smectite clay-templated subnanoscale zero-valent iron[J]. Environmental Science & Technology, 46(16): 8969–8975.
|
张军, 白孝康, 李晶晶, 等. 2015. 超声协同下镍铁双金属化合物催化降解水溶液中的四氯化碳[J]. 环境工程学报, 2015, 9(4): 1693–1697.
DOI:10.12030/j.cjee.20150428 |
Zhang L, Wu J, Liao H, et al. 2009. Octahedral Fe3O4 nanoparticles and their assembled structures[J]. Chemical Communications, 29: 4378–4380.
|
Zhu H, Jia Y, Wu X, et al. 2009. Removal of arsenic from water by supported nano zero-valent iron on activated carbon[J]. Journal of Hazardous Materials, 172(2/3): 1591–1596.
|
周红艺, 徐新华, 汪大翬. 2004. Pd/Fe双金属对水中m-二氯苯的催化脱氯[J]. 化工学报, 2004, 55(21): 1912–1915.
|
 2018, Vol. 38
2018, Vol. 38


