水是人类赖以生存的自然资源, 也是人类生态环境的重要组成部分, 水质的优劣直接影响到人类的生活质量、生产及身体健康, 但随着经济的高速发展, 水体污染日益严重.造成水体污染的主要物质有重金属离子、农药、过量的N、P和致病微生物等.重金属是具有潜在危害的重要污染物质, 水中重金属污染主要来自采矿业、冶金、机械加工、重工业及农药和化肥中重金属的残留.因为重金属在自然界中不容易被生物降解, 且可通过食物链在生物体内富集, 从而对生物体构成严重威胁(支田田等, 2011).因此, 重金属污染水体的修复技术一直是全球水处理领域的研究热门.
目前比较受关注的废水中有毒重金属主要为铅、镉、铬、锌、镍(Ahn et al., 2009;Rajfur et al., 2010).例如, 人们熟知的“水俣病”、“痛痛病”均是由重金属引起的.传统的工业重金属废水处理方法包括化学沉淀、电解法、离子交换、反渗透、活性炭吸附等(孟祥和, 2000).其弊端是在处理低浓度废水时, 效率较低而能耗较高, 使用后的材料需要经填埋或燃烧处理, 可能产生二次污染.生物吸附技术因具有吸附剂价廉易得、吸附量大、选择性好、操作条件范围宽、金属可回收再利用等特点而受到广泛关注.常见的生物吸附材料主要包括藻类、细菌与真菌.藻类对许多重金属具有较强的富集能力, 尤其是对于含量较低或传统方法不易于去除的重金属具有很好的处理效果, 是一种具有经济价值及发展前途的工业重金属污水净化材料.另一方面, 藻类具有光合作用的能力, 藻类在培养收获时对二氧化碳的减排也具有重要意义, 这使其相较于其它类型的生物吸附剂具有一定的优势.
目前, 国内外针对淡水微藻与大型海洋藻类应用于重金属废水处理方面展开了大量研究.Tsezos等(1981)通过对比死亡海藻细胞和活体海藻细胞对重金属的吸附能力, 证实死亡海藻细胞具有更佳的吸附性能, 更适用于吸附和处理含有重金属的实际污水.死亡的海藻细胞是通过物理-化学途径富集重金属, 其中, 细胞中的蛋白质与多糖起到重要作用(Trujillo, 1991;Sar et al., 1999;Ting et al., 1989).死亡海藻细胞壁受到破坏后, 可暴露出更多的内部官能团, 从而使生物吸附的能力得到显著提高(张永亮等, 2009).在对藻类吸附重金属离子的机理研究中, 藻多糖被认为是主要的活性吸附物质.邓莉萍等(2008)通过对马尾藻(Sargassum sp.)藻酸盐多聚糖的提取、纯化, 发现影响重金属吸附的主要因素是藻酸盐的含量和组成, 糖醛酸残基起主要作用(邓莉萍, 2008).Chojnacka等(2005)通过对不同藻类的吸附研究发现, 当把细胞壁中的羧基脂化后或细胞表面的主要官能团被修饰后, 该藻即失去了对重金属的吸附能力.李建宏等(1998)在对极大螺旋藻富集重金属的机理研究中发现, 多糖的吸附量为藻体的8倍左右, 认为藻细胞中多糖对重金属离子的吸附起主要作用.赵玲等(2001)研究发现, 从海洋原甲藻(Prarocentrum micans)分离出的多糖对金属的吸附量是藻体的5倍, 其中, —OH和—CONH2是吸附的活性中心.藻类对重金属离子的生物吸附是一个复杂的物化与生化过程, 是多种机理协同作用的结果.前期研究结果显示, 海洋硅藻是一类对重金属离子具有高吸附性能的生物吸附剂, 优于其他类型藻类(褐藻、绿藻), 而其中的有效吸附组分尚未见相关报道.因此, 从海洋硅藻提取粗多糖并考察其对重金属的吸附性能, 对于揭示其吸附机理和开发新型高效吸附剂具有重要意义.前期研究显示, 碱法提取的粗多糖得率明显高于其他物理化学法(酸法、超声法、热水法)(陈利华等, 2018);陈晓清等(2005)、王长海等(1999)采用40 mg·mL-1 NaOH为提取溶液(不同碱浓度会影响溶液pH值, 从而影响多糖得率), 从小球藻及紫球藻中获得了较多的粗多糖样品.基于此, 本文利用浓碱法(40 mg·mL-1 NaOH)辅助冻融、加热方法对混合海洋硅藻的粗多糖得率、粗多糖总糖、蛋白质及硫酸基含量进行比较, 筛选出最优的提取方法, 以此方法提取的粗多糖为生物吸附剂, 对Pb2+吸附特性和吸附动力学进行分析.
2 材料与方法(Materials and methods) 2.1 试剂与仪器实验试剂:无水乙醇、氢氧化钠(粒)、无水葡萄糖、苯酚、硫酸钾、氯化钡、明胶、三氯乙酸、浓盐酸、浓硫酸均为分析纯;Pb2+储备液溶液(1 mg·mL-1)是将其硝酸盐溶于去离子水中配得, 其它浓度则由储备液稀释配得.其他需要配制试剂包括:1 mol·L-1 HCl、0.5%明胶、1%氯化钡-明胶、3%三氯乙酸.
实验用到的混合海洋硅藻藻粉是从深圳大鹏新区海洋微藻培养基地露天培养获得, 其中, 约80%(细胞数比例)为角毛藻, 其余20%由舟形藻、菱形藻、海链藻及茧形藻组成.
实验仪器:电热鼓风干燥箱(DHG-9140A)、电子分析天平(AL104/01)、离心机(Centrifuge5810R)、智能恒温水浴锅(SCG-4)、超声波细胞粉碎机、紫外可见分光光度计、pH计(Startorius PB-10)、台式冷冻干燥机、红外消化炉、电感偶合等离子体发射光谱仪(ICP).
2.2 试验方法 2.2.1 样品预处理将海洋硅藻粉研磨过325目筛, 得到均匀粉末, 作为后续实验的藻类来源.
2.2.2 粗多糖提取利用40 mg·mL-1 NaOH作为提取液, 辅助冻融或加热法从硅藻干粉中提取粗多糖.具体处理分为:①浓碱处理:将硅藻干粉置于40 mg·mL-1 NaOH溶液中, 充分反应后, 离心得到上清液;②浓碱-冻融处理:将硅藻干粉置于40 mg·mL-1 NaOH溶液中, 充分反应后反复冻融3次, 离心取上清液;③浓碱-冻融-90 ℃处理:将硅藻干粉置于40 mg·mL-1 NaOH溶液中, 反复冻融3次, 离心, 分别收集上清液与沉淀, 然后将沉淀置于沸水浴中加热3 h, 离心, 将两次得到的上清液混合.
每种方法的料液比均为1:30 (g:mL)、反应4 h(Davis et al., 2003;Yun et al., 2003;Raize et al., 2004), 在4000 r·min-1下离心20 min, 得到的上清液加热浓缩至原体积的1/4, 去除溶液中的蛋白质, 采用乙醇分级沉淀提纯法, 考察其在3种提取过程中对粗多糖得率的影响.以此前的上清液加热浓缩后的液体体积为基准, 设定乙醇体积为0.4、1、2、3、4和5倍.沉淀后的物质冷冻干燥得到粗多糖干粉为淡绿色粉末(含有大量的色素和小分子杂质).
2.2.3 粗多糖组成成分分析蒽酮-硫酸显色反应:糖类物质遇到浓硫酸脱水生成糠醛或其衍生物, 可与蒽酮试剂缩合产生蓝绿色物质(Sheng et al., 2004), 将蒽酮-硫酸试剂加入到粗多糖溶液中, 溶液呈蓝绿色, 证明提取到的为多糖类物质.
总糖含量测定:采用硫酸-苯酚法测定样品的总糖含量, 分别在480、490 nm两个波长测定吸光度, 以葡萄糖质量为横坐标, 吸光度为纵坐标, 绘制标准曲线, 根据标准曲线及换算因子计算样品总糖含量(Chojnacka et al., 2005).
蛋白质含量测定:采用凯氏定氮法测蛋白质含量, 粗多糖样品与浓硫酸和催化剂(K2SO4、CuSO4·5H2O)一同加入消解管内加热消化, 使蛋白质分解, 样品中的有机氮转化为氨与硫酸结合成硫酸铵.将消化液转入凯氏定氮反应器内, 0.1 mol·L-1盐酸吸收后用已经标定过的氢氧化钠溶液进行滴定.
硫酸基含量测定:采用硫酸钡比浊法测定硅藻多糖中硫酸基含量(宫春宇等, 2009), 以硫酸基质量(mg)为横坐标, 纵坐标为吸光度(A1-A2, 在360 nm处测定吸光度), 根据标准曲线及换算因子计算硫酸基含量.
2.2.4 吸附试验配制一系列不同浓度的Pb2+溶液, 25 ℃恒温下振荡(180 r·min-1), 使体系达到平衡, 取样时将反应液在4000 r·min-1条件下离心5 min, 用0.22 μm滤膜过滤, 稀释到指定浓度后, 用ICP测定其金属离子浓度.
pH对吸附的影响:配制一系列1 mg·mL-1的Pb2+溶液, 各取10 mL加入到装有0.005 g粗多糖的10 mL离心管中.试验过程中保持pH恒定及吸附稳定, 用0.1 mol·L-1 HNO3或0.1 mol·L-1 NaOH调节溶液pH使其在2.0~10.0之间, 吸附条件为:温度25 ℃, 转速180 r·min-1, 吸附时间24 h.
温度对吸附的影响:配制一系列1 mg·mL-1的Pb2+溶液, 各取10 mL加入到装有0.01 g粗多糖的10 mL离心管中.吸附条件为:转速180 r·min-1, 吸附pH为原溶液初始值, 调节温度为15、25、35 ℃, 吸附24 h后测定Pb2+浓度.
转速对吸附的影响:配制一系列1 mg·mL-1的Pb2+溶液, 各取10 mL加入到装有0.01 g粗多糖的10 mL离心管中.吸附条件为:温度25 ℃, 吸附pH为原溶液初始值, 调节转速为50、100、150、180 r·min-1, 吸附24 h后测定Pb2+浓度.
共存离子的影响:配制一系列0.6 mg·mL-1的Cd2+、Pb2+、Cu2+、Ni2+溶液, 各取10 mL加入到装有0.01 g粗多糖的10 mL离心管中.吸附条件为:温度25 ℃, 吸附pH为原溶液初始值, 调节转速为180 r·min-1, 吸附24 h后测定其值.
2.2.5 等温吸附试验分别配置一系列一定浓度梯度的Pb2+溶液, 各取50 mL加入到装有0.01 g粗多糖的50 mL离心管中.吸附条件为:温度25 ℃, 转速180 r·min-1, 吸附时间24 h, 吸附pH为原溶液初始值.吸附完毕后, 离心静置, 吸取一定体积的上清液透过0.22 μm膜, ICP检测吸附前后溶液浓度.
2.2.6 粗多糖有效吸附组分对吸附影响提取粗多糖过程中, 在3倍无水乙醇沉淀之前, 向藻水混合液中添加三氯乙酸或透过截留分子量为6 kD的半透膜, 去除混合液中残留的蛋白质等杂质或小分子杂质, 再进行浓缩、沉淀后获得粗多糖样品, 进行Pb2+吸附试验.
2.2.7 数据分析与处理本研究中样品提取及测定均设置2个平行样, 采用SPSS 11.5和Excel 2010进行数据分析和统计分析, 以p < 0.05为差异显著, p < 0.01为差异极显著, 用Origin 8.6软件绘图.
吸附t时间后, 吸附剂对Pb2+的吸附量(qt, mg·g-1)、达到吸附平衡时的吸附量(qe, mg·g-1)的计算公式如下所示:
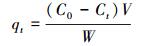
|
(1) |
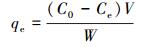
|
(2) |
式中, C0、Ct、Ce分别为初始时刻、吸附时间为t、吸附平衡时的吸附量(mg·g-1), V为溶液体积(L), W为吸附剂的质量(g).
金属离子去除率(RE)是指吸附前后目标金属离子浓度差与初始浓度的比值, 其计算公式如下所示:
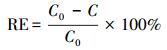
|
(3) |
式中, C0为金属溶液的初始浓度(mg·L-1), C为吸附后金属溶液的浓度(mg·L-1).
3 结果与讨论(Results and discussion) 3.1 不同提取方法的粗多糖得率粗多糖得率η为提取得到的粗多糖干粉质量(m粗多糖)相对硅藻干粉质量(m硅藻)的百分比, 即:

|
(4) |
利用浓碱法(40 mg·mL-1 NaOH)进行提取, 随乙醇体积的增加粗多糖得率变化趋势显著(p < 0.05), 尤其以浓碱-冻融-90 ℃提取方法的粗多糖得率变化趋势极显著(p < 0.01).在3倍无水乙醇体积沉淀下得到的粗多糖得率最高, 浓碱法、浓碱-冻融、浓碱-冻融-90 ℃处理下的粗多糖得率分别为28.44%、33.14%、44.40%.结果表明, 浓碱辅助冻融法可提高粗多糖得率.这是由于冻融、热提法可进一步破坏硅藻细胞壁的纳米硅质结构, 从而提高硅藻粗多糖得率(张新宇等, 2000;徐锡莲等, 2007).提取的样品为粗多糖, 其中含有核酸、蛋白质、色素、低聚寡糖等小分子和无机盐等杂质.
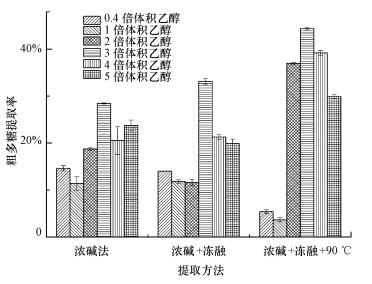 |
| 图 1 不同方法的粗多糖得率比较 Fig. 1 The comparison of polysaccharide extraction rate with different methods |
采用硫酸-苯酚法测定粗多糖样品中总糖含量(Haysahi et al., 1996), 粗多糖样品分别配制成0.1 mg·mL-1溶液, 其中, 己糖在490 nm、戊糖及糖醛酸在480 nm处有最大吸收(刘艳等, 2007).测定结果如图 2a所示, 待测样品中戊糖及糖醛酸含量要高于己糖含量.总糖含量大小顺序为:浓碱-冻融>浓碱-冻融-90 ℃>浓碱法, 其中, 浓碱-冻融法得到的粗多糖总糖含量分别为31.65%(480 nm)和27.27%(490 nm).结果表明, 添加额外的化学试剂在一定程度上会降低粗多糖的纯度.浓碱-冻融方法下粗多糖却保持了较高的多糖含量, 这有可能是由于冻融促进了硅藻胞内多糖的溶出, 间接提高了粗多糖的多糖含量.
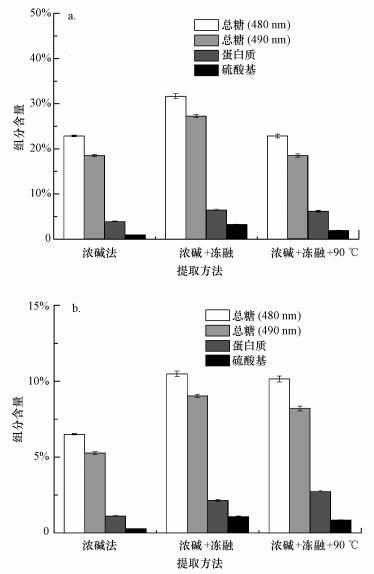 |
| 图 2 不同方法提取的粗多糖成分比较 (a.粗多糖组分, b.单位质量生物质(藻粉)的粗多糖组分) Fig. 2 The comparison of polysaccharide components from different marine diatom species (a. the components of crude polysaccharide, b. the components of per unit diatom biomass (dry powder)) |
采用凯氏定氮法测定硅藻干粉的蛋白质含量为14.40%, 说明硅藻干粉中含有一定量的蛋白质.如图 2a所示, 所有粗多糖样品均检测到蛋白质, 含量依次为3.89%、6.44%、6.14%, 与总糖含量的变化趋势相似, 即浓碱-冻融>浓碱-冻融-90 ℃>浓碱法.表明样品中除含有糖类以外, 还含有像蛋白质或肽类等其他物质.
硫酸多糖(Sulfated polysaccharide)为多糖的硫酸化衍生物, 是一类多功能活性物质(Groth et al., 2001;邓成华等, 2000;Mei et al., 2002).如图 2a所示, 浓碱法、浓碱-冻融、浓碱-冻融-90 ℃处理的粗多糖硫酸基含量分别为0.97%、3.23%、1.90%.这是由于在碱性条件下硫酸基容易生成3, 6-内醚衍生物或发生Walden转化, 导致硫酸基脱落(Groth et al., 2001;高亚辉, 2001;Armbrust, 2009).
综合粗多糖得率与单位质量粗多糖的成分结果计算出单位质量藻粉提取出的物质组成成分, 结果如图 2b所示.结果表明, 浓碱-冻融法的单位质量硅藻干粉中提取的总糖含量和硫酸基多糖含量较高, 相比于其它方法具有优势.
3.3 吸附特性研究 3.3.1 不同提取方法不同提取方法得到的粗多糖含有的官能团有差异, 提供孤对电子与金属离子络合或离子交换的可能性不同, 而且粗多糖中杂质亦可能不同.本研究比较了浓碱-冻融、浓碱法及浓碱-冻融-90 ℃ 3种方法对Pb2+的吸附性能, 结果如图 3所示.由图可知, 浓碱-冻融、浓碱法两种提取方法得到的粗多糖样品对Pb2+的吸附量明显高于浓碱-冻融-90℃方法, 在初始Pb2+溶液浓度为1 mg·mL-1时, 浓碱-冻融法对Pb2+的去除率达到98.34%, 接近100%, 其吸附量为983.35 mg·g-1.这表明加热反应可能破坏了多糖表面的某些官能团, 降低了对Pb2+的吸附.同时, 冻融与否对于粗多糖吸附Pb2+无明显影响.因此, 综合考虑粗多糖得率及对Pb2+的吸附效果, 利用浓碱-冻融法提取得到的粗多糖样品进行Pb2+吸附试验.
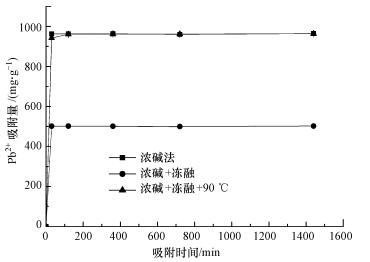 |
| 图 3 不同方法提取的粗多糖对Pb2+吸附量随时间的变化 Fig. 3 The change of adsorption capacity for Pb2+ over time by extracted crude polysaccharide using different methods |
在同一种提取方法下, 不同的乙醇体积沉淀所获得的粗多糖不同.图 4显示了浓碱-冻融法在不同倍体积无水乙醇沉淀下获得的粗多糖对Pb2+的吸附结果.由图可知, 反应迅速达到吸附平衡, 在初始Pb2+浓度为0.6 mg·mL-1时, 3倍乙醇沉淀后对Pb2+的吸附量达到最大, 为591.36 mg·g-1, 去除率为98.56%, 接近100%.因此, 利用浓碱法-冻融法3倍乙醇沉淀后得到的粗多糖样品进行后续的吸附试验.
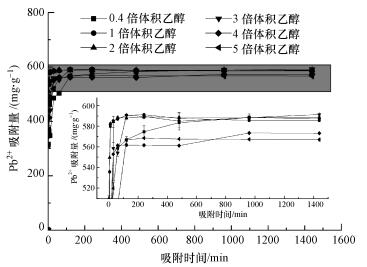 |
| 图 4 浓碱-冻融法提取的粗多糖对Pb2+吸附量随乙醇体积变化 Fig. 4 The change of adsorption capacity for Pb2+ by extracted crude polysaccharide using 40 mg·mL-1NaOH-freeze-thaw method with different ethanol volumes |
共存离子:工业废水通常是多种离子共存的复杂体系, 溶液中存在的阳离子会与目标重金属离子竞争吸附点位, 对吸附产生干扰, 影响生物吸附剂对重金属的吸附能力.本文利用粗多糖样品对Cd2+、Pb2+、Cu2+、Ni2+4种重金属进行吸附实验, 6 mg·mL-1 Cd2+、Pb2+ Cu2+和Ni2+混合溶液中Pb2+吸附量随时间的变化如图 5a所示.当以质量浓度为单位反映吸附量时, 其吸附顺序为:Cd2+>Cu2+>Pb2+>Ni2+.因为分子量不同, 仅以质量浓度难以反映出分子结合的相对能力.以物质的量浓度为单位对吸附率进行评价, 粗多糖对这4种重金属离子的吸附能力顺序为:Ni2+> Cu2+>Cd2+ >Pb2+.这说明同时存在几种金属离子的情况下, 粗多糖对Pb2+仍具备一定的吸附性能, 且对不同重金属离子的吸附能力不同.不同重金属离子之间吸附容量存在差异主要是由重金属离子的不同性质(电负性、共价指数、原子质量、原子数、有效核电荷等)所导致.
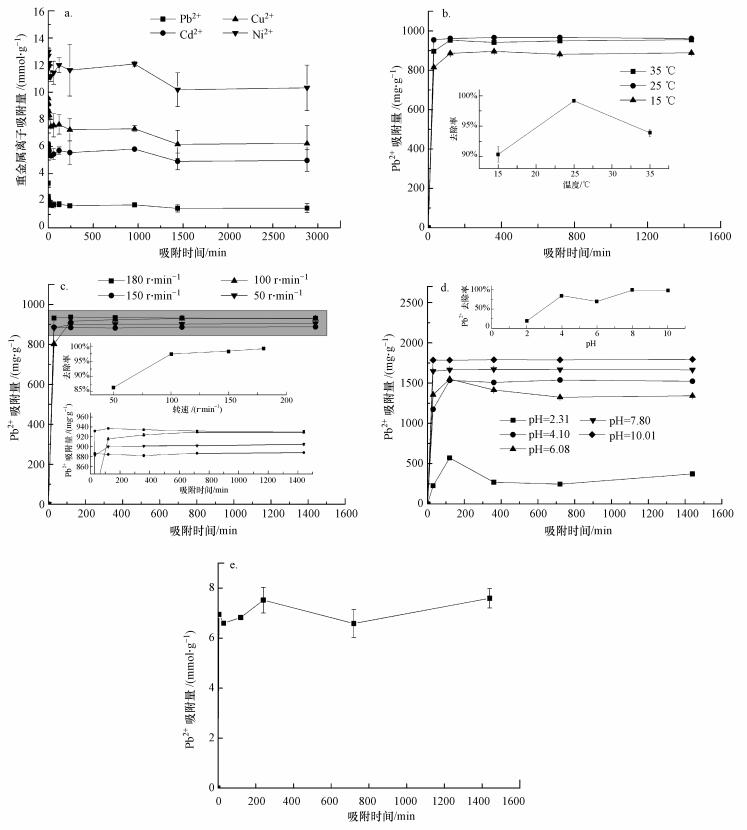 |
| 图 5 不同因子对粗多糖的Pb2+吸附性能影响 (a.共存Cd2+、Pb2+、Cu2+和Ni2+, b.温度, c.转速, d.pH, e.吸附时间) Fig. 5 The impact of different factors on Pb2+ adsorption by crude polysaccharide |
另外, 在Pb2+和Cd2+分别单独存在于溶液中时, Pb2+的吸附效果要高于Cd2+(邓莉萍, 2008), 当多种离子共存时, Cd2+的吸附效果要高于Pb2+, 这可能是由于粗多糖细胞壁表面的吸附官能团更容易与Cd2+结合, 在一定程度上也阻碍了其与Pb2+结合.
| 表 1 各金属离子(Pb2+、Cu2+、Cd2+、Ni2+)的物化特性 Table 1 Comparison of physicochemical properties of Pb2+、Cu2+、Cd2+、Ni2+ |
温度:温度主要通过影响吸附剂细胞表面的化学结构和溶液的物理化学状态对吸附容量产生影响.对不同的生物吸附剂, 温度对金属离子吸附量的影响有所不同.粗多糖样品对Pb2+的吸附量随温度变化曲线如图 5b所示.随着温度的升高, 粗多糖对Pb2+的吸附量变化显著, Pb2+在25 ℃时吸附效率最高, 但随着温度的进一步升高, 其对Pb2+的去除率无明显上升且发生轻微下降.
转速:摇床转速对Pb2+吸附速率的影响如图 5c所示.随着转速加快, 金属离子在吸附剂中的扩散加快, 增大了与吸附剂表面积的接触吸附基团, 有利于吸附反应的进行, 达到吸附平衡的时间越短.
pH:溶液pH值是影响生物吸附的重要因素, 它不仅会影响重金属离子的水化学性质、金属的水解、与有机/无机基团络合、氧化还原电位、沉淀等, 还会影响吸附剂表面的质子化程度, 从而影响吸附剂对重金属的吸附(Esposito et al., 2002;Huang et al., 1990;Matheickal et al., 1999;Sánchez et al., 1999).粗多糖样品对Pb2+吸附量随pH的变化如图 5d所示.pH≈2时, 粗多糖对Pb2+的吸附量较低;随pH的增加, 吸附量逐渐增大;pH=4时, 粗多糖对Pb2+的吸附量最大, 对Pb2+的去除率达到86.15%.pH太高又会导致重金属离子部分水解沉淀, 当pH=8时, Pb2+的反应溶液开始出现白色絮状沉淀, 反应溶液浑浊.因此, 高pH条件下, Pb2+大量被吸附是由粗多糖及溶液中大量的氢氧根两者共同作用导致的.
当pH较低时, 硅藻细胞壁中的杂多糖中的一些氨基、羧基硫酸基团被质子化(Andrade et al., 2005), 阻碍了Pb2+向细胞壁的靠近, pH值越低其阻力越大, 因此, 对Pb2+的吸附量越低.随着pH值升高, 溶液中出现更多的吸附基团, 吸附剂表面带负电, 有利于Pb2+的接近并吸附在细胞表面上(Dönmez et al., 1999;Aksu, 2001).pH对吸附的影响可进一步解释为H3O+与重金属离子之间的竞争吸附作用, 在pH较低时, H3O+占据了细胞表面的吸附位点, 随pH的升高, H3O+吸附位点的能力降低, 带正电荷的重金属会占据细胞表面的吸附位点, 因此, 吸附重金属的能力增加.当pH值过高, 金属离子在水中被各种阴离子包围, 形成负电基团, 不易被吸附.当溶液pH值超过金属离子微沉淀的上限时, 在溶液中的大量金属离子会以氢氧化物微粒的形式存在, 从而吸附过程无法进行.微藻类粗多糖吸附重金属的最佳pH范围通常在4~5之间(Feng et al., 2004).
吸附时间:吸附时间是影响重金属吸附效率的重要因素.很多研究表明, 生物吸附在最初的30 min内速率很快(Singh et al., 2010;秦捷等, 2011), 可达到总吸附量的90%以上, 30 min后速率减慢.通常情况下, 生物吸附需要2~4 h或更长的时间才能达到理想的效果(Armbrust, 2009).图 5e给出了粗多糖在初始浓度为400 mg·L-1时对Pb2+的吸附量随吸附时间的变化曲线.从图中可以看出, 吸附过程经历了快吸附和慢吸附两个阶段.Pb2+在被吸附的前30 min内, 吸附量迅速增大, 说明吸附进行得很快;随后吸附速率在2 h之后趋于平缓.由此可见, 粗多糖对Pb2+的吸附是一个动态过程.快速吸附阶段主要是离子交换和表面络合作用, 如粗多糖含有的氨基和羧基与金属发生配位络合作用;慢速吸附阶段主要是由于传输和沉淀作用.为保证吸附体系充分达到平衡, 本研究将吸附振荡时间设置为24 h.
3.3.3 吸附动力学分析伪一级动力模型(式(5))与伪二级动力模型(式(6))是两种常用的吸附动力学模型(Singh et al., 2010).伪一级动力模型假设吸附位点的占据速率与未被占据的吸附位点的数量成正比, 伪二级动力模型假设吸附位点的占据速率与未被占据的吸附位点的数量的平方成正比.
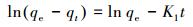
|
(5) |
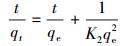
|
(6) |
式中, qe、qt分别为吸附平衡及t时刻的吸附量(mg·g-1);t为吸附时间(min);K1为伪一级吸附速率常数(min-1);K2为伪二级吸附速率常数(g·mg-1·min-1).
将ln (qe-qt)对t和t/qt对t数据点分别采用伪一级吸附模型和伪二级吸附模型进行线性拟合, 结果见图 6和表 2.根据伪二级动力学模型计算的Pb2+平衡吸附容量更接近实验值, 说明伪二级动力模型更适于描述本研究中硅藻粗多糖对Pb2+的吸附动力学过程.
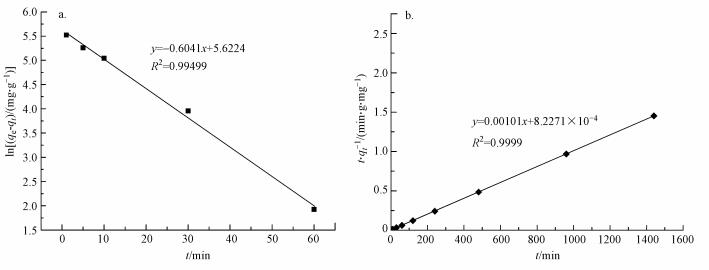 |
| 图 6 粗多糖吸附Pb2+的伪一级(a)、二级(b)动力学模型拟合 Fig. 6 The model fitting diagram of pseudo first (a) and two (b) order for Pb2+ adsorption |
| 表 2 混合藻硅藻粗多糖对Pb2+吸附的动力学模型系数 Table 2 The kinetic model coefficients of Pb2+ adsorption by rude polysaccharides from mixed algal diatoms |
初始浓度可以提供金属离子克服水溶液与固体物质传质阻力的动力, 因此, 初始浓度对吸附具有一定的影响.实验中分别设置Pb2+初始浓度为100、200、400、800、1000 mg·L-1, 考察不同的反应初始浓度对溶液中Pb2+吸附的影响, 结果如图 7所示.在相同反应条件下, 随Pb2+初始浓度的增大, 粗多糖对Pb2+的吸附量逐渐增大, 当初始浓度为400 mg·L-1时达到最大值, 但去除率逐渐降低(Ofer et al., 2003).由于投加相同量的粗多糖, Pb2+初始浓度越大, 与吸附剂接触的机率越大, 吸附剂对Pb2+的吸附量就越大.当初始浓度升高至一定浓度时, 吸附量不再发生明显变化, 这是由于吸附剂表面已接近吸附饱和状态.
 |
| 图 7 不同初始浓度下粗多糖对Pb2+吸附量的影响 Fig. 7 The impact on adsorption capacity for Pb2+ under different initial concentrations |
常见的吸附等温模型为Langmuir等温式和Freundlich等温式, 其线性表达式分别为:
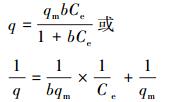
|
(7) |
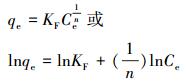
|
(8) |
式中, qm为最大吸附容量(mg·g-1);b为Langmuir的吸附平衡常数, 可用于判别吸附过程的难易程度;Ce为达到吸附平衡时溶液中的吸附质浓度(mg·L-1);qe为对应于平衡浓度Ce时的吸附量(mg·g-1);KF为Freundlich常数;n为经验常数, 一般来说, n值大于1, 当n值介于2~10之间时表示吸附反应容易进行.
由2个方程的拟合结果可以看出, 2个方程拟合的效果均不理想, 但Langmuir等温吸附模型比Freundlich等温吸附模型拟合的可决系数高, 即用Langmuir方程模拟的效果较好, 表明粗多糖对Pb2+吸附为单层吸附.
本研究对采用浓碱-冻融方法从混合海洋硅藻中提取的粗多糖对Pb2+的吸附能力与其他藻类吸附剂对Pb2+的吸附能力进行了比较, 结果如表 4所示.
 |
| 图 8 粗多糖吸附Pb2+的Langmuir(a)、Freundlich (b)吸附等温线 Fig. 8 The adsorption isotherms of Langmuir(a) and Freundlich(b) for Pb2+ adsorption |
| 表 3 混合藻硅藻粗多糖对Pb2+吸附的Langmuir、Freundlich等温吸附模型系数 Table 3 The adsorption isotherms of Langmuir and Freundlich of Pb2+ adsorption by rude polysaccharides from mixed algal diatoms |
| 表 4 各类吸附剂对Pb2+吸附容量对比 Table 4 The comparison of Pb2+ adsorption capacity with different adsorbent |
结果表明, 海洋硅藻相比于其它生物吸附剂和海洋大型藻类具更高效的Pb2+吸附性能, 从混合海洋硅藻中提取的粗多糖是关键的吸附活性物质, 其糖表面有活性基团, 有较强的电负性, 与Pb2+发生表面络合、离子交换、静电吸附等作用.因此, 浓碱-冻融法提取的粗多糖样品具备作为一种优质Pb2+吸附剂的潜力.
3.3.5 粗多糖中有效吸附组分分析三氯乙酸可去除混合液中绝大部分的蛋白质杂质, 本文考察了去除蛋白质和小分子杂质前后粗多糖对Pb2+的吸附性能, 结果如图 9所示.结果表明, 蛋白质杂质去除与否对该粗多糖吸附Pb2+不产生明显影响(图 9a);而透析后得到的藻水混合液的颜色变淡, 去除绝大部分小分子杂质(如植物色素、无机离子及糖类)后, 得到的粗多糖样品对Pb2+的吸附明显下降(图 9b), 对Pb2+去除率由95.08%下降到21.62%, 但吸附容量仍保持在200 mg·g-1的水平.这说明粗多糖中小分子多糖对Pb2+的吸附具有一定贡献, 但起主要贡献的是粗多糖样品中的低聚寡糖等小分子或无机盐杂质.
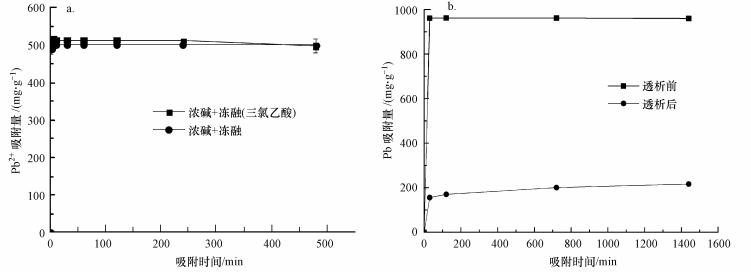 |
| 图 9 蛋白质杂质(a)及小分子杂质(b)对Pb2+吸附的影响 Fig. 9 The analysis of effective adsorption components on Pb2+ adsorption with crude polysaccharides |
1) 浓碱(40 mg·mL-1 NaOH)辅助冻融、加热等提取方法中, 浓碱-冻融法的粗多糖得率为33.14%, 粗多糖含糖量最高, 为31.65%(480 nm)和27.27%(490 nm), 蛋白质含量为6.44%, 硫酸基含量为3.23%.
2) 以浓碱-冻融法提取的粗多糖为生物吸附剂对Pb2+的吸附效果最好, 吸附容效果为983.35 mg·g-1, 大大高于海洋硅藻原藻的吸附容量, 这说明粗多糖为海洋硅藻中主要的吸附物质.
3) 浓碱-冻融法提取的硅藻粗多糖对Pb2+的吸附动力学更符合伪二级动力模型, 且用Langmuir方程模拟的效果较好, 说明粗多糖对Pb2+吸附为单层吸附.
4) 粗多糖的有效吸附成分分析结果显示, 蛋白质杂质对Pb2+无明显影响, 大分子多糖对Pb2+吸附有一定贡献, 而起主要作用的是粗多糖中的小分子糖类及无机盐等物质.
5) 浓碱-冻融提取操作简单, 且得到的粗多糖样品对Pb2+的吸附性能要高于其他的生物吸附剂, 这为后续的海洋硅藻活性产物的提取、开发及利用提供了一定的理论基础.
Ahn C K, Donghee P, Woo S H, et al. 2009. Removal of cationic heavy metal from aqueous solution by activated carbon impregnated with anionic surfactants[J]. Journal of Hazardous Materials, 164(2/3): 1130–1136.
|
Aksu Z. 2001. Equilibrium and kinetic modelling of cadmium (Ⅱ) biosorption by C.vulgaris in a batch system:effect of temperature[J]. Separation and Purification Technology, 21(3): 285–294.
DOI:10.1016/S1383-5866(00)00212-4
|
Andrade A D, Rollemberg M C E, Nóbrega J A. 2005. Proton and metal binding capacity of the green freshwater alga Chaetophora elegans[J]. Process Biochemistry, 40(5): 1931–1936.
DOI:10.1016/j.procbio.2004.07.007
|
Armbrust E V. 2009. The life of diatoms in the world's oceans[J]. Nature, 459: 185–192.
DOI:10.1038/nature08057
|
陈利华, 王欣, 成家杨. 2018. 不同方法提取的海洋硅藻粗多糖比较[J]. 浙江农业学报, 2018, 30(2): 280–289.
|
陈晓清, 郑怡, 林雄平. 2005. 二种微藻多糖与蛋白质提取物的抗菌活性[J]. 福建师大学报(自然科学版), 2005, 21(2): 76–79.
|
程东祥, 李绪谦, 李红艳, 等. 2008. 淡水中丝状绿藻对重金属Pb2+的吸附[J]. 吉林大学学报(地), 2008, 38(2): 305–308.
|
邓成华, 杨祥良, 王雁, 等. 2000. 取代度对硫酸酯化虎奶多糖抗氧化活性的影响[J]. 华中科技大学学报(自然科学版), 2000, 28(5): 104–107.
|
邓莉萍. 2008. 藻体对水环境中N、P及重金属Cu2+、Pb2+、Cd2+、Cr6+的吸附特征研究[D]. 青岛: 中国科学院海洋研究所. 30-42
http://www.irgrid.ac.cn/handle/1471x/167652?mode=full&submit_simple=Show+full+item+record |
Dönmez G Ç, Aksu Z, Öztürk A, et al. 1999. A comparative study on heavy metal biosorption characteristics of some algae[J]. Process Biochemistry, 34(9): 885–892.
DOI:10.1016/S0032-9592(99)00005-9
|
Esposito A, Pagnanelli F, Vegliò F. 2002. pH-related equilibria models for biosorption in single metal systems[J]. Chemical Engineering Science, 57(3): 307–313.
DOI:10.1016/S0009-2509(01)00399-2
|
Feng DAldrich C. 2004. Adsorption of heavy metals by biomaterials derived from the marine alga Ecklonia maxima[J]. Hydrometallurgy, 73(1/2): 1–10.
|
高亚辉. 2001. 海洋微藻分类生态及生物活性物质研究[J]. 厦门大学学报(自然版), 2001, 40(2): 566–573.
|
Gardeatorresdey J L, Beckerhapak M K, Hosea J M, et al. 1990. Effect of chemical modification of algal carboxyl groups on metal ion binding[J]. Environmental Science & Technology, 24(9): 1372–1378.
|
宫春宇, 潘迎捷. 2009. 硫酸钡比浊法对龙须菜多糖中硫酸基含量的测定[J]. 天然产物研究与开发, 2009, 21(b10): 402–405.
|
Groth T, Wagenkneeht W. 2001. Anticoagulant potential of rcgioseselective Dedvatked cellulose[J]. Biomaterials, 22: 2719–2729.
DOI:10.1016/S0142-9612(01)00013-8
|
Haysahi K, Haysahi T, Kojima I. 1996. A natural sulfated polysaccharide, calium spirulan, isolation from Spirulina platensis:in vitro and in vivo evaluation of anti-herps simp lex virus and anti-human immunodeficiency virus activities[J]. AIDS Research and Human Retroviruses, 12(15): 1463–1471.
DOI:10.1089/aid.1996.12.1463
|
Hellebust J A. 1974. Extracellular Products//Steward N D. Algal Physiology and Biochemistry[M]. Berkeley: University of California Press. 838-863
|
Huang C P, Huang C P, Morehart A L. 1990. The removal of Cu(Ⅱ) from dilute aqueous solutions by Saccharomyces cerevisiae[J]. Water Research, 24(4): 433–439.
DOI:10.1016/0043-1354(90)90225-U
|
李建宏, 曾昭琪, 薛宇鸣, 等. 1998. 极大螺旋藻富积重金属机理的研究[J]. 海洋与湖沼, 1998, 29(3): 274–279.
|
李英敏, 杨海波, 刘艳, 等. 2002. 小球藻吸附水中Pb~(2+)影响因素的初步研究[J]. 生物技术, 2002, 12(1): 12–13.
|
廖经慧. 2012. 硅藻土吸附剂的制备及其对重金属离子吸附性能的研究[D]. 北京: 中国地质大学(北京). 35-47
http://cdmd.cnki.com.cn/Article/CDMD-11415-1012364592.htm |
刘筱潇, 孙颖颖, 管习超, 等. 2010. 3种海洋微藻多糖提取工艺的研究[J]. 海洋通报, 2010, 29(5): 534–539.
|
刘艳, 杨海波, 赵莲华, 等. 2007. 四爿藻多糖的分离分析及其生物活性的初步研究[J]. 生物技术, 2007, 7(2): 53–56.
|
雒和敏, 曹国璞. 2010. 活性炭对含铅废水吸附特性研究[J]. 环境工程学报, 2010, 4(2): 373–376.
|
Matheickal J T, Yu Q. 1999. Biosorption of lead(Ⅱ) and copper(Ⅱ) from aqueous solutions by pre-treated biomass of Australian marine algae[J]. Bioresource Technology, 69(3): 223–229.
DOI:10.1016/S0960-8524(98)00196-5
|
Mei W Z, Lin L I, Yuan G S, et al. 2002. Review on structure-activity relationship of active polysaccharides[J]. Modern Chemical Industry, 22(8): 18–21.
|
孟祥和. 2000. 重金属废水处理[M]. 北京: 环境科学与工程出版中心: 17–51.
|
Ofer R, Yerachmiel A, Shmuel Y. 2003. Marine macroalgae as biosorbents for cadmium and nickel in water[J]. Water Environment Research, 75(3): 246–253.
DOI:10.2175/106143003X141033
|
Poulet S A, Martin-Jézéquel V. 1983. Relationships between dissolved free amino acids, chemical composition and growth of the marine diatom Chaetoceros debile[J]. Marine Biology, 77(1): 93–100.
DOI:10.1007/BF00393214
|
漆亚瑢. 2016. 海洋硅藻纳米藻壳对水中Pb2+的吸附研究[D]. 北京: 北京大学. 27-37
|
秦捷, 赵文, 张鹏. 2011. 环境汞污染对藻类的毒性效应及其影响因素[J]. 生物学杂志, 2011, 28(3): 74–76.
|
Raize O, Argaman Y, Yannai S. 2004. Mechanisms of biosorption of different heavy metals by brown marine macroalgae[J]. Biotechnology & Bioengineering, 87(4): 451–458.
|
Rajfur M, Kłos A, Wacławek M. 2010. Sorption properties of algae Spirogyra sp.and their use for determination of heavy metal ions concentrations in surface water[J]. Bioelectrochemistry, 80(1): 81–86.
|
Sánchez A, Ballester A, Blázquez M L, et al. 1999. Biosorption of copper and zinc by Cymodocea nodosa[J]. Fems Microbiology Reviews, 23(5): 527–536.
DOI:10.1111/j.1574-6976.1999.tb00411.x
|
Sar P, Kazy S K, Asthana R K, et al. 1999. Metal adsorption and desorption by lyophilized Pseudomonas aeruginosa[J]. International Biodeterioration & Biodegradation, 44(2/3): 101–110.
|
Sheng P X, Ting Y P, Chen J P, et al. 2004. Sorption of lead, copper, cadmium, zinc, and nickel by marine algal biomass:characterization of biosorptive capacity and investigation of mechanisms[J]. Journal of Colloid & Interface Science, 275(1): 131–141.
|
Singh V K, Tiwari P N. 2010. Removal and recovery of chromium(Ⅵ) from industrial waste water[J]. Journal of Chemical Technology & Biotechnology Biotechnology, 69(3): 376–382.
|
Ting Y P, Lawson F, Prince I G. 1989. Uptake of cadmium and zinc by the alga Chlorella vulgaris:part 1.Individual ion species[J]. Biotechnology & Bioengineering, 34(7): 990–999.
|
Trujillo E M, Jeffers T H, Ferguson C, et al. 1991. Mathematically modeling the removal of heavy metals from a wastewater using immobilized biomass[J]. EnvironmentalScienceand Technology, 25(9): 1559–1565.
|
Tsezos M, Volesky B. 1981. Biosorption of uranium and thorium[J]. Biotechnology and Bioengineering, 23(3): 583–604.
DOI:10.1002/(ISSN)1097-0290
|
王长海, 温少红, 鞠宝. 1999. 紫球藻多糖的提取和测定[J]. 中国海洋药物, 1999, 18(1): 22–25.
|
王桂仙, 张启伟. 2008. 改性竹炭对含铅废水吸附处理的效果研究[J]. 广东微量元素科学, 2008, 15(3): 31–34.
|
徐锡莲, 童微星, 雷引林, 等. 2007. 盐藻胞外多糖分离纯化方法研究[J]. 食品与生物技术学报, 2007, 26(4): 28–33.
|
尹珊珊. 2015. 玉米生物质吸附剂对水溶液中Pb(Ⅱ)的吸附研究[D]. 上海: 东华大学. 14-17
http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D631393 |
Yun Y S, Volesky B. 2003. Modeling of lithium interference in cadmium biosorption[J]. Environmental Science & Technology, 37(16): 3601–3608.
|
张新宇, 王雷, 李光友, 等. 2000. 绿色巴夫藻硒多糖的提取、分离与纯化[J]. 海洋与湖沼, 2000, 31(6): 643–646.
DOI:10.11693/hyhz200006009009 |
张永亮, 张浩江, 谢水波, 等. 2009. 藻类吸附重金属的研究进展[J]. 铀矿冶, 2009, 28(1): 31–37.
|
赵玲, 尹平河, QimingYU, 等. 2001. 海洋赤潮生物原甲藻对重金属的富集机理[J]. 环境科学, 2001, 22(4): 42–45.
|
支田田, 程丽华, 徐新华, 等. 2011. 藻类去除水体中重金属的机理及应用[J]. 化学进展, 2011, 23(8): 1782–1794.
|
周洪英, 王学松, 李娜, 等. 2010. 3种大型海藻对含铅废水的生物吸附研究[J]. 环境工程学报, 2010, 4(2): 331–336.
|
 2018, Vol. 38
2018, Vol. 38


