伴随人类工业的发展, 氯氟烃化合物(CFCs)和氮氧化物的大量排放使臭氧层不断变薄, 而大气臭氧的损耗导致地球表面具有生物学效应的UV-B辐射增强(訾先能等, 2006).研究发现, UV-B辐射增强对地球生命系统的影响是多方面的, 作为生态系统生命物质缔造者的植物, 由于自身不能移动的特性, 承受紫外辐射增强所带来的生存胁迫程度加倍于动物, 对UV-B辐射增强的响应最为明显(李良博等, 2015).目前, 植物对UV-B辐射的响应已成为众多学者研究的热点问题.
叶绿素荧光与光合作用中各个反应过程紧密相关, 任何逆境对光合作用过程产生的影响都可通过植物体内叶绿素荧光诱导动力学变化反映出来, 这也是植物环境适应机制的内在表征(姚晓蕊等, 2006).目前, 在众多的研究报道中, UV-B辐射增加对植物叶绿素荧光特性的影响并没有显示出完全一致的结果, 这可能由于使用的方法、材料和试验条件不同所致。而且多数试验是在实验室和温室中进行, 缺少野外观测数据, 由于植物对UV-B的响应会随着光、温度、水分和营养等环境因子的变化而改变, 因此, 国际上对自然条件下植被对UV-B辐射增强的响应研究越来越重视。作为湿地生态系统核心组分的植物, UV-B辐射对其叶绿素荧光性能的改变必将影响湿地生态系统的功能.基于此, 本试验在露天条件下, 研究不同U-VB辐射强度下芦苇(Phragmites australis)叶绿素荧光特性的变化规律, 以期为芦苇光合生理对UV-B辐射胁迫的响应机制提供科学依据, 同时丰富有关湿地植物逆境生理生化领域的研究.
2 材料与方法(Material and methods) 2.1 试验地概况试验于2017年5—7月在甘肃农业大学(36°3′N, 103°40′E)进行, 该区属温带大陆性气候, 日照多, 年日照时数达2600 h, 昼夜温差大, 干燥少雨, 年均降水量250~350 mm, 集中分布在6—9月, 年均温10.3 ℃, 无霜期180 d.
2.2 试验设计 2.2.1 湿地模拟系统建造垂直潜流型湿地9个, 每块湿地大小为1 m×1 m×1 m, 底部和四周为砖结构砌筑, 并进行防渗处理.湿地内部填充不同级配基质, 基质选用卵石、粗砂及当地表层土壤, 基质层总高95 cm, 从下至上依次为大粒径(3~5 cm)卵石20 cm、小粒径(1~2 cm)卵石20 cm、粗砂25 cm、表层土壤30 cm.每块湿地均匀栽种芦苇, 栽种密度为30株·m-2.
2.2.2 UV-B辐射处理设置3个辐照处理:①CK为自然光照, 辐射强度为168 μW·cm-2;②R1组UV-B辐射强度为210 μW·cm-2, 相当于兰州地区夏季晴天UV-B辐射增强25%;③R2组UV-B辐射强度为252 μW·cm-2, 相当于兰州地区夏季晴天UV-B辐射增强50%.每个辐照处理3个重复.用紫外灯(吉日牌, 功率40 W, 波长峰值为310 nm, 南京华强电子有限公司)平行悬挂于植株上方, 模拟UV-B辐射增强处理, R1组共使用紫外灯管6支, R2组共使用紫外灯管12支.灯管用乙酸纤维素膜包裹以滤去波长小于290 nm的UV-C辐射, 植株位于灯管正下方.灯管与植株距离随着植株高度增长进行调节, 距离范围为20~40 cm.
试验期间根据植物生长情况随时调节灯管与植株的距离, 用UV-B辐照计测定紫外辐射强度.试验开始时间为2017年5月19日, 结束时间为2017年7月17日, UV-B辐射处理时间为每天9:00—17:00, 连续辐照60 d, 阴雨及多云天气不照射.试验期间, 晴天共计47 d, 多云天气共计7 d(5月21、25、31日, 6月2、19、28日, 7月2日), 雨天共计6天(5月22日, 6月3、4、14、29日, 7月5日).
2.3 测定指标和方法叶片表观指标测定采用观察法, 每天观察植株叶片表观特征, 并记录初始出现变化的辐射日期.色素含量测定采用80%丙酮浸提法(高俊凤, 2006), 选取植株第3位叶分别于辐射处理第3、7、14、28、56 d测定叶绿素a、叶绿素b、叶绿素a+b、类胡萝卜素含量.
叶绿素荧光参数采用CF Imager叶绿素荧光成像系统(英国Technologica公司)测定.测定指标包括初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)、PSⅡ实际光化学效率(ФPSⅡ)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ), 测定时间与色素含量相同.
2.4 数据处理试验结果用3次试验平均值±标准误差表示, 采用Excel 2007软件对试验数据进行统计分析和作图, 采用SPSS 17.0软件对数据进行单因素方差分析(One-way ANOVA), 利用Duncan法进行多重比较(α=0.05).
3 结果(Results) 3.1 UV-B辐射增强对芦苇叶片表观的影响由图 1可以看出, 芦苇在自然光照下生长正常, 整个试验周期未观察到有明显变化.R1辐处理下于第20 d叶缘开始褪绿, 随辐照时间推移, 第35 d叶片整体萎蔫, 第50 d部分枯萎并有死斑. R2辐照梯度下受损程度更加严重, 于第15 d出现叶缘褪绿现象, 25 d叶片开始萎蔫, 35 d叶片部分枯萎伴有死斑, 第45 d叶片卷曲枯萎(表 1).
 |
| 图 1 UV-B辐射增强对芦苇叶片表观的影响 Fig. 1 Effect of enhanced UV-B radiation on the apparent appearance of leaves |
| 表 1 UV-B辐射增强对芦苇叶片表观的影响 Table 1 Effect of enhanced UV-B radiation on the apparent appearance of leaves |
由图 2可以看出, R1辐射梯度下, 试验第3、14 d, 芦苇叶绿素a含量(以鲜重计)显著高于对照(p<0.05), 升幅分别为6.72%、15.19%, 随辐射时间延长, 试验结束时R1与CK之间无显著差异(p>0.05).R2辐射梯度下, 整个试验周期内芦苇叶绿素a含量显著低于对照, 降幅为11.63%~28.72%, R2与R1、CK之间均差异显著(p<0.05).
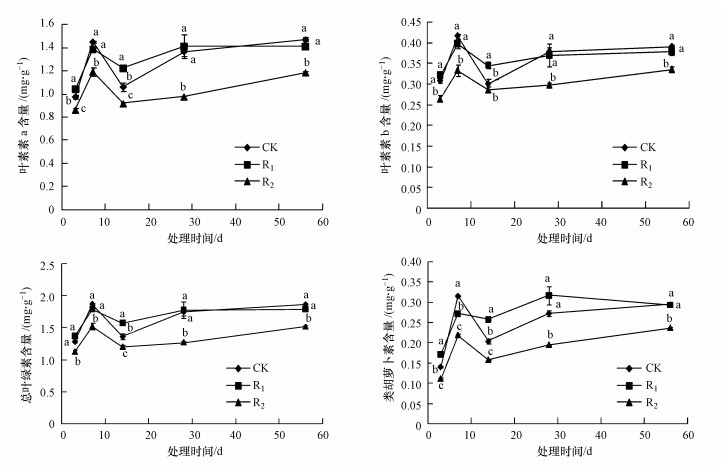 |
| 图 2 UV-B辐射增强对芦苇色素含量的影响(不同小写字母表示差异显著(p<0.05), 下同) Fig. 2 Effects of enhanced UV-B radiation on photosynthetic pigment contents of Phragmites australis |
叶绿素b含量(以鲜重计)的变化趋势与叶绿素a相似, 但含量较低.R1辐射梯度下, 试验第3、14 d, 芦苇叶绿素b含量高于对照, 升幅分别为4.11%、14.81%, 试验结束时R1与CK之间无显著差异(p>0.05).R2辐射梯度下, 整个试验周期内芦苇叶绿素b含量均显著低于对照(第14 d除外), 降幅为4.73%~21.17%, 除第14 d, R2与R1、CK之间均差异显著(p<0.05).
R1辐射梯度下, 试验第3、14、28 d, 芦苇总叶绿素含量(以鲜重计)高于对照, 升幅分别为6.10%、15.11%、2.01%, 随辐射时间延长, 试验结束时总叶绿素含量低于对照, 除第14 d之外, R1与CK之间无显著差异(p>0.05).R2辐射梯度下, 整个试验周期内芦苇总叶绿素含量均显著低于对照, 降幅为11.72%~27.09%, R2与R1、CK之间均差异显著(p<0.05).
除第7 d外, 类胡萝卜素含量总体变化趋势表现为:R1>CK>R2.与CK相比, 试验第3、14、28 d, R1升幅分别为22.03%、26.14%、16.21%.与CK相比, R2降幅为19.77%~30.60%.试验第3、7、14 d, CK、R1、R2之间的差异显著(p<0.05), 试验第28、56 d, R2与R1、CK之间均差异显著(p<0.05).
3.3 UV-B辐射增强对叶绿素荧光参数的影响由图 3可以看出, UV-B辐射处理下, 芦苇叶片初始荧光(Fo)均高于对照组, 变化趋势表现为R2>R1>CK.与CK相比, R1、R2升幅分别为0~14.78%、9.13%~36.0%.试验第3、7 d, R1、R2、CK三者之间差异不显著(p>0.05).随处理时间延长, R2与CK之间差异显著(p<0.05), R1与CK、R2之间均无显著差异(p>0.05).
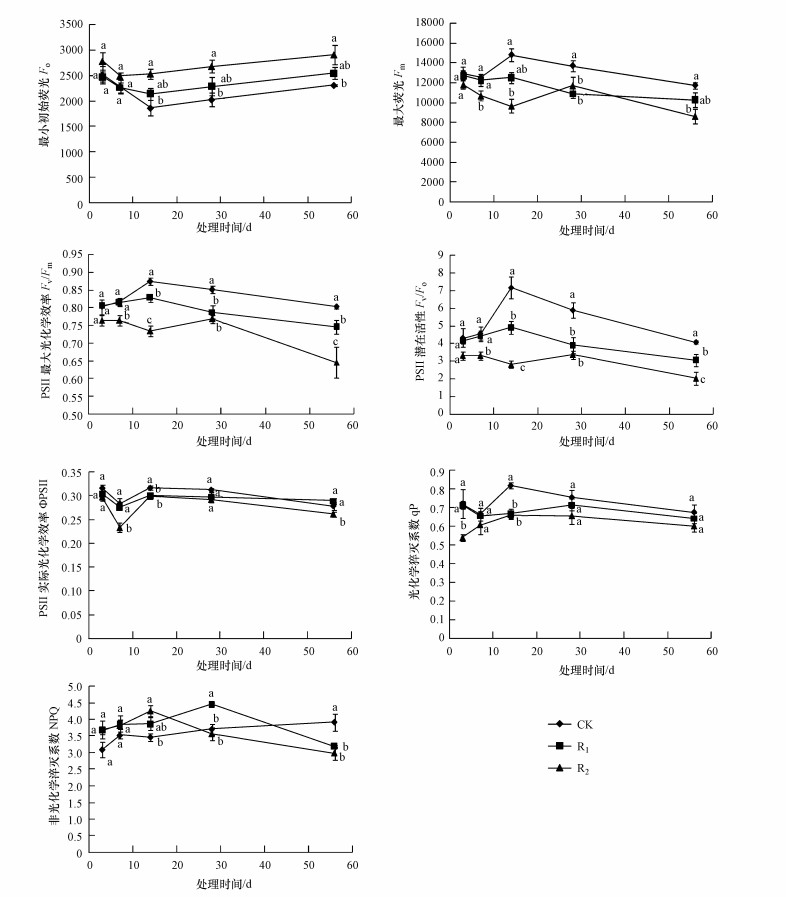 |
| 图 3 UV-B辐射增强对芦苇叶绿素荧光特性的影响 Fig. 3 Effects of enhanced UV-B radiation on chlorophyll fluorescence characteristics |
UV-B辐射处理下, 芦苇叶片最大荧光(Fm)均低于对照组, 变化趋势大体表现为CK>R1>R2.与CK相比, R1、R2降幅分别为2.07%~20.75%、9.01%~34.76%.试验第3 d, R1、R2、CK三者之间差异不显著(p>0.05).试验第28 d, R1、R2均与CK之间差异显著(p<0.05), 但R1、R2之间无显著差异(p>0.05), 除此之外, R2与CK之间差异显著(p<0.05).
UV-B辐射处理下, 芦苇叶片PSⅡ最大光化学效率(Fv/Fm)均低于对照组, 且随辐射梯度增大, 下降幅度加剧, 变化趋势表现为CK>R1>R2.与CK相比, R1、R2降幅分别为0.48%~7.42%、4.80%~19.53%.试验第3 d, R1、R2、CK三者之间差异不显著(p>0.05), 辐射第14、56 d, CK、R1、R2三者之间差异显著(p<0.05).
UV-B辐射处理下, 芦苇叶片PSⅡ潜在活性(Fv/Fo)均低于对照组, 且随辐射梯度增大, 下降幅度加剧, 变化趋势表现为CK>R1>R2.与CK相比, R1、R2降幅分别为3.24%~33.66%、23.43%~60.78%.试验第3 d, R1、R2、CK三者之间差异不显著(p>0.05), 辐射第14 d至试验结束, R1与CK之间差异显著(p<0.05), 辐射第7 d至试验结束, R2与CK之间差异显著(p<0.05).试验第14、56 d, CK、R1、R2三者之间差异显著(p<0.05).
UV-B辐射处理下, 芦苇叶片PSⅡ实际光化学效率(ФPSⅡ)均低于对照组, 且随辐射梯度增大, 下降幅度加剧, 变化趋势表现为CK>R1>R2.与CK相比, R1、R2降幅分别为2.75%~5.08%、5.70%~17.58%.试验第14 d, R1与CK之间差异显著(p<0.05), 但R1与R2之间差异不显著(p>0.05).试验除第7、14、56 d, R2与CK之间差异显著(p<0.05).
UV-B辐射处理下, 芦苇叶片光化学淬灭系数(qP)均低于对照组, 且随辐射梯度增大, 下降幅度加剧, 变化趋势表现为CK>R1>R2.与CK相比, R1、R2降幅分别为1.00%~18.55%、8.69%~25.22%.试验第14 d, R1与CK之间差异显著(p<0.05), 但R1与R2之间差异不显著(p>0.05).试验第3、14 d, R2与CK之间差异显著(p<0.05).
UV-B辐射处理下, 芦苇叶片非光化学淬灭系数(NPQ)在试验前14 d均高于对照组, 且随辐射梯度增大, 上升幅度加剧, 变化趋势表现为R2>R1>CK.与CK相比, R1、R2升幅分别为9.51%~18.44%、8.34%~22.76%.试验第28 d, R1处理下NPQ高于对照组, 但R2处理下NPQ低于对照组.试验第56 d, R1、R2处理下, NPQ均低于对照组, 且随辐射梯度增大, 下降幅度加剧.试验第14 d, R2与CK之间差异显著(p<0.05).试验第28 d, R1与CK和R2之间均差异显著(p<0.05), 但CK与R2之间无显著差异(p>0.05).试验第56 d, R1、R2均与CK之间差异显著(p<0.05), 但R1、R2之间无显著差异(p>0.05).
4 讨论(Discussion) 4.1 UV-B辐射增强对芦苇叶片表观的影响叶片是植物与外界环境接触最广泛的部分, 也是植物与外界进行能量、气体和水分交换的器官, 其对环境变化较为敏感且可塑性大, 最容易受到辐射的影响, 在表征生态系统功能方面具有一定的生态指示作用.逆境条件对植物的伤害, 往往首先在叶片上表现出来.本试验结果表明, 正常生长的芦苇叶片呈现翠绿色, UV-B辐照增强条件下, 植物会出现叶缘褪绿、萎蔫、死斑、卷曲、枯萎的现象, 且随辐照梯度增大, 叶片损伤程度加剧, 这与李元等(1998)在大田试验下对春小麦的研究结果一致.
4.2 UV-B辐射增强对芦苇色素含量的影响叶绿素是植物进行光合作用的物质基础(赵天宏等, 2013), 其含量与光合作用紧密相关, 是光能捕捉(吸收)、传递和转换的重要结构, 植物体内叶绿素含量的多少, 在很大程度上决定着光合作用的强弱, 并与植物生长和生理状况紧密相关(王锦旗等, 2015), 因此, 叶绿素含量被看作是衡量增强UV-B辐射对植物造成伤害的一个重要指标.
大量研究表明, 增强UV-B辐射能降低植物叶绿素含量(Azizpour et al., 2010;Liang et al., 2011).但本研究中, 低强度UV-B辐射下, 试验前28 d, 芦苇叶片叶绿素a、叶绿素b、总叶绿含量及类胡萝卜素含量高于对照组, 且均于辐射第14 d差异达显著水平.随辐射时间延长, 叶绿素a、叶绿素b、总叶绿含量及类胡萝卜素含量均有所下降, 至试验结束, 各色素含量均低于对照组, 与刘敏等(2007)对烟草的研究结果一致.这表明不同植物对UV-B辐射的敏感性不同, 芦苇对低强度UV-B辐射具有较强的适应性, 低强度UV-B辐射作为一种弱胁迫, 刺激了光合结构的功能发挥(刘晓等, 2011), 故在短期辐射下促进光合色素的提高, 这与本试验中叶绿素荧光参数的变化一致.此外, 低剂量UV-B辐射诱导芦苇叶片中类胡萝卜素含量增多, 类胡萝卜素是一种重要的抗氧化剂, 其分子具有共轭双键, 通过与生物膜结合, 吸收紫外光(周党卫等, 2002), 减少UV-B辐射对植物体的伤害, 同时还吸收过多的光能, 在电子的吸收和传递过程中起重要作用, 保护着细胞、叶绿体和叶绿素免受伤害(Tracewell et al., 2001).但低辐照梯度下, UV-B辐射对色素的破坏依然具有时间上的累积性, 随辐射时间延长, 辐射对色素含量显现出抑制作用.高辐射梯度下, 整个试验周期芦苇叶片叶绿素a、叶绿素b、总叶绿含量及类胡萝卜素含量均显著低于对照组, 这与祁虹等(2017)对棉花的研究结果相一致, 高辐照梯度超出了芦苇自身的调节极限, 导致各色素含量受到显著的抑制.叶绿素含量的降低可能是UV-B辐射加剧了植物脂质过氧化作用, 破坏了叶绿体膜相, 导致叶绿素的分解(杨景宏等, 2000).此外, 在大豆(Mirecki et al., 1984)、水稻(Teramura et al., 1991)和北美枫香(Sullivan et al., 1994)上的研究发现, UV-B辐射能破坏敏感植物的叶绿素结构和它们的前体, 或者使叶绿素的合成受到阻碍, 从而降低叶绿素含量.
4.3 UV-B辐射增强对芦苇叶绿素荧光特性的影响叶绿素荧光参数是植物光合作用的内在探针, 通过分析叶绿素荧光动力学参数可以揭示植物光能吸收、转化、传递过程的生理状态(耿东梅等, 2014), 进而真实准确地揭示UV-B辐射增强对芦苇光合生理的影响机制.
初始荧光Fo是PSII反应中心全部开放时的荧光水平, 反映PSII天线色素受激发后的电子密度, 与叶绿素浓度有关(张阿宏等, 2008).本研究中, 除低剂量的UV-B辐射在处理前7天Fo与对照组相比没有明显变化外, UV-B辐射增强均导致芦苇叶片Fo增加, 这与张美萍等(2014)对水稻的研究结果一致.说明低剂量的UV-B辐射在试验前期对叶绿素初始荧光没有明显影响, 但其对Fo的影响具有时间上的累积性, 而高剂量辐射下, 芦苇叶片PSⅡ反应中心受损害程度较严重, 处理对天线色素造成损伤, 降低了PSII天线色素受激发后的电子密度, 导致Fo升高. Fo的变化受多种因素的影响, UV-B辐射可导致PSⅡ反应中心D1蛋白受到损坏(徐军田等, 2007), 引起PSII反应中心的可逆失活或出现不易逆转的破坏使其升高(Rintamki et al., 1996), 也可能是类囊体膜受到损伤, 类囊体膜受损程度越严重, Fo增加量越多.因此, 随着UV-B辐射剂量的增加, 芦苇受到伤害程度加剧, Fo随辐射剂量增加而增大, 且随辐射时间延长伤害更加严重.
叶绿素最大荧光Fm是PSⅡ反应中心处于完全关闭时的荧光产量, 反映通过PSⅡ的电子传递情况(张守仁, 1999).本研究结果表明, 除低剂量的UV-B辐射在处理前7天Fm与对照组相比没有显著变化外, UV-B辐射增强均导致芦苇叶片最大荧光显著降低, 这与马晓丽等(2016)对白菜的研究结果相一致, 说明UV-B辐射会严重抑制芦苇叶片PSⅡ电子传递, 且随辐射强度增大, 抑制程度加剧.
Fv/Fm是PSⅡ最大光化学量子产量, 它反映了PSⅡ反应中心的光能转化效率, 一般比较恒定(Demmig et al., 1987), 当植物受环境胁迫时, 其值会出现显著变化. Fv/Fo代表PSⅡ的潜在活性.本研究中, 低剂量UV-B辐射前7 d, Fv/Fm与Fv/Fo较对照组没有显著变化, 除此之外, 增强UV-B辐射均可导致芦苇叶片Fv/Fm与Fv/Fo显著降低, 且随辐射梯度增大, 降低程度加剧.这与李良博等(2016)对紫茎泽兰和艾草及Tevini等(1994)的研究结果一致, 表明UV-B辐射降低了PSⅡ的光能转化效率和PSⅡ的潜在活性.这可能是由于UV-B辐射对芦苇叶绿素结构造成不可修复的破坏, PSⅡ反应中心受到损, 捕获用于电子传递的光能显著降低所造成, 电子从PSⅡ反应中心到QA、QB和PQ的运输受到抑制.
ΦPSII值反映了PSⅡ反应中心在环境胁迫中有部分关闭情况下的实际原初光能捕获效率, 是PSⅡ功能的重要指标之一(余小龙等, 2011).本研究结果表明, UV-B辐射对芦苇叶片ΦPSII值具有抑制作用, 且随辐射强度增大, 抑制作用加剧, 这与左园园等(2005)对青榨槭的研究结果一致, UV-B辐射处理下, 光合电子传递受阻.
光化学淬灭系数qP是PSⅡ天线色素吸收的光能用于光化学电子传递的份额, 它与电子传递、光合反应的过程相关(曹昀等, 2008).本研究中, 整个试验期内, 处理组芦苇叶片qP均低于对照组, 且随辐射强度增大, 下降幅度增大, 这与韩雯等(2015)对拟南芥幼苗的研究结果一致.说明从PSⅡ氧化侧向PSⅡ反应中心的电子流动受到抑制, 这可能是由于逆境条件下光合速率降低, 植物光合机构接受的光能超过了其所能利用的数量, 光合作用受到抑制.
非光化学淬灭系数NPQ反映天线色素吸收的光能不能用于电子传递而以热的形式耗散的光能及光合机构的损伤程度(张雷明等, 2003).试验结果表明, 辐照前14 d, 芦苇叶片NQP均高于对照水平, 说明芦苇在UV-B辐射下, 以热的形式耗散掉的光能部分增加, 非光化学淬灭NPQ的上升是芦苇保护PSII的重要机制.试验第14 d之后, 低辐射剂量下, NPQ依然有上升的趋势, 但至试验结束时NPQ低于对照组.高辐射剂量下, 试验14 d后, NPQ均低于对照组, 说明辐射对芦苇叶片的损伤具有累积性, 随辐射时间延续, 芦苇叶片不能将过剩的光能以热的形式耗散, PSⅡ彻底受损.
5 结论(Conclusions)1) UV-B辐射可对芦苇叶片表观造成一定的损伤, 且随辐射梯度增大, 损伤加剧.
2) 低辐射梯度下, 辐射初期可促进芦苇叶片叶绿素a、叶绿素b、总叶绿含量及类胡萝卜素含量增长, 但UV-B辐射对色素含量的影响具有累积效应, 随处理时间延续, 辐射对色素含量显现出抑制作用.高辐射梯度下, 芦苇叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量表现出相同规律, 均受到显著的抑制作用.
3) 低辐射梯度下, 辐射前7 d, 叶绿素荧光各参数均无显著变化, 随辐照时间延续, 芦苇叶片Fo增高, 叶片Fm、Fv/Fm与Fv/Fo显著降低, 叶片ΦPSII值、qP降低, UV-B辐射对荧光参数的影响具有累计效应.高辐射梯度下, 芦苇叶片Fo显著升高, Fm、Fv/Fm、Fv/Fo、ΦPSII值显著降低, qP降低.整个试验期, 增强UV-B辐射, NPQ表现出增高的趋势, 但在试验结束时NPQ低于对照, 其对PSII的保护作用随辐射时间的延长逐渐消失.综上所述, UV-B辐射对PSII的破坏作用随辐射强度增大而增大.
Azizpour K, Shakiba M R, Sima K K, et al. 2010. Physiological response of spring durum wheat genotypes to salinity[J]. Journal of Plant Nutrition, 33(6): 859–873.
DOI:10.1080/01904161003654097
|
曹昀, 王国祥, 张聃. 2008. 干旱对芦苇幼苗生长和叶绿素荧光的影响[J]. 干旱区地理, 2008, 31(6): 862–869.
|
Demmig B, Bjorkman O. 1987. Comparison of the effect of excessive light on chlorophyll fluorescence(77K) and photon yield of O2 evolution in leaves of higher plants[J]. Planta, 171: 171–184.
DOI:10.1007/BF00391092
|
耿东梅, 单立山, 李毅. 2014. 土壤水分胁迫对红砂幼苗叶绿素荧光和抗氧化酶活性的影响[J]. 植物学报, 2014, 49(3): 282–291.
|
韩雯, 韩榕. 2015. 不同时间的UV-B辐射对拟南芥幼苗生长的影响[J]. 植物学报, 2015, 50(1): 40–46.
|
李良博, 唐天向, 海梅荣, 等. 2015. 植物对UV-B辐射增强的响应及其分子机制[J]. 中国农学通报, 2015, 31(13): 159–163.
DOI:10.11924/j.issn.1000-6850.2014-1871 |
李良博, 张连根, 唐天向, 等. 2016. UV-B辐射增强对紫茎泽兰和艾草抗性生理特性的影响[J]. 西北植物学报, 2016, 36(2): 343–352.
|
李元, 王勋陵. 1998. 紫外辐射增加对春小麦生理、产量和品质的影响[J]. 环境科学学报, 1998, 18(5): 504–509.
|
Liang C J, Zhang G S, Zhou Q. 2011. Effect of cerium on photosynthetic pigments and photochemical reaction activity in soybean seedling under ultraviolet-B radiation stress[J]. Biological Trace Element Research, 142(3): 796–806.
DOI:10.1007/s12011-010-8786-y
|
刘敏, 李荣贵, 范海, 等. 2007. UV-B辐射对烟草光合色素和几种酶的影响[J]. 西北植物学报, 2007, 27(2): 291–296.
|
刘晓, 贺俊芳, 岳明. 2011. 荧光动力学方法研究光系统Ⅱ原初传能过程对低剂量UV-B辐射的响应[J]. 生物物理学报, 2011, 27(10): 839–848.
|
马晓丽, 冀瑞萍, 李亚莉. 2016. 一氧化氮对增强UV-B辐射后白菜叶绿素荧光特性和Rubisco活化酶的影响[J]. 核农学报, 2016, 30(7): 1440–1445.
DOI:10.11869/j.issn.100-8551.2016.07.1440 |
Mirecki R M, Teramura A H. 1984. Effects of ultraviolet-B irradiance on soybean.V.The dependence of plant sensitivity on the photosynthetic photon flux density during and after leaf expansion[J]. Plant Physiology, 74: 475–480.
DOI:10.1104/pp.74.3.475
|
祁虹, 段留生, 王树林, 等. 2017. 全生育期UV-B辐射增强对棉花生长及光合作用的影响[J]. 中国生态农业学报, 2017, 25(5): 708–719.
|
Rintamki E, Salo R, Aro E M. 1994. Rapid turnover of the D1reaction-center protein of photosystem Ⅱ as a protectionmechanism against photoinhibition in a moss, Ceratodon purpureus(Hedw) Brid[J]. Planta, 193: 520–529.
DOI:10.1007/BF02411557
|
Sullivan J H, Teramura A H, Dillenburg L R. 1994. Growth and photo synthetic responses of field-grown sweetgum (Liquidambar styraciflua Hamamelidaceae) seedlings to UV -B radiation[J]. Am J Bot, 81: 826–832.
DOI:10.1002/ajb2.1994.81.issue-7
|
Teramura A H, Ziska L H, Sztein A E. 1991. Changes in growth and photosynthetic capacity of rice with increased UV-B radiation[J]. Physiologia Plantarum, 83: 373–380.
DOI:10.1111/ppl.1991.83.issue-3
|
Tevini M. 1994. UV-B effects on terrestrial plants and aquatic organisms[J]. Prog Bot, 55: 174–190.
|
Tracewell C A, Vrettos J S, Bautista J A. 2001. Carotenoid photo-oxidation in photosystemⅡ[J]. Archives of Bioche-mistry and Biophysics, 385: 61–69.
DOI:10.1006/abbi.2000.2150
|
王锦旗, 郑有飞, 薛艳. 2015. 紫外辐射对菹草成株生理特性的影响[J]. 生态学报, 2015, 35(18): 5975–5983.
|
徐军田, 高坤山. 2007. 阳光紫外辐射对绿藻石莼光化学效率的影响[J]. 海洋学报, 2007, 29(1): 127–132.
|
杨景宏, 陈拓, 王勋陵. 2000. 增强紫外线B辐射对小麦叶素膜组分和膜流动性的影响[J]. 植物生态学报, 2000, 24(1): 102–105.
|
姚晓蕊, 潘存德, 李冬梅, 等. 2009. 11种人工栽培树木叶绿素荧光特征比较[J]. 干旱区研究, 2009, 26(4): 555–560.
|
余小龙, 余树全, 伊力塔, 等. 2011. UV-B辐射胁迫对细叶青冈幼苗叶绿素荧光特性的影响幼苗叶绿素荧光特性的影响[J]. 东北农业大学学报, 2011, 42(10): 114–119.
DOI:10.3969/j.issn.1005-9369.2011.10.024 |
张阿宏, 齐孟文, 张晔晖. 2008. 调制叶绿素荧光动力学参数及其计量关系的意义和公理化讨论[J]. 核农学报, 2008, 22(6): 909–912.
|
张雷明, 上官周平, 毛明策, 等. 2003. 长期施氮对旱地小麦灌浆期叶绿素荧光参数的影响[J]. 应用生态学报, 2003, 14(5): 695–698.
|
张美萍, 王勇, 韩榕, 等. 2014. 增强UV-B辐射对水稻叶绿素荧光参数的影响[J]. 山西师范大学学报, 2014, 28(1): 66–70.
|
张守仁. 1999. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报, 1999, 16(4): 444–448.
|
赵天宏, 刘轶鸥, 王岩, 等. 2013. 浓度升高和UV-B辐射增强对大豆叶片叶绿素含量和活性氧代谢的影响[J]. 应用生态学报, 2013, 24(5): 1277–1283.
|
周党卫, 韩发, 滕中华, 等. 2002. UV-B辐射增强对植物光合作用的影响及植物的相关适应性研究[J]. 西北植物学报, 2002(4): 280–286.
|
訾先能, 陈宗瑜, 郭世昌, 等. 2006. UV-B辐射的增强对作物形态及生理功能的影响[J]. 中国农业气象, 2006, 27(2): 102–106.
|
邹琦. 1995. 植物生理生化实验指导[M]. 北京: 中国农业出版社: 36–38.
|
左园园, 刘庆, 林波, 等. 2005. 短期增强UV-B辐射对青榨槭幼苗生理特性的影响[J]. 应用生态学报, 2005, 16(9): 1682–1686.
|
 2018, Vol. 38
2018, Vol. 38


